Fecha de recepción: 01/03/2018 – Fecha de aceptación: 04/06/2018
Nieves-Sedano M, Caro-Teller JM, Ferrari-Piquero JM
Servicio de Farmacia. Hospital Universitario 12 de Octubre. Madrid (España)
____
Correspondencia:
Marcos Nieves-Sedano w Hospital Universitario 12 de Octubre (Servicio de Farmacia) w Avenida de Córdoba, s/n w 28045 Madrid (España)
marcos.nieves@salud.madrid.org
____
Resumen
Objetivo: Identificar y describir las interacciones farmacológicas entre riociguat y los medicamentos domiciliarios de pacientes con hipertensión pulmonar tromboembólica crónica, y evaluar su seguridad en la práctica clínica.
Método: Estudio observacional retrospectivo. Se incluyeron todos los pacientes que iniciaron tratamiento con riociguat hasta octubre de 2017. Se recogieron variables demográficas, diagnósticas y terapéuticas. Para evaluar la seguridad se registraron las reacciones adversas secundarias al tratamiento, se analizaron las interacciones detectadas y el motivo de suspensión, interrupción o reducción de dosis.
Resultados: Cincuenta y cinco pacientes recibieron tratamiento con riociguat y la mediana de edad fue de 67 años (23-86). El 47,27% presentó algún tipo de reacción adversa asociada al fármaco, destacando: sistema digestivo (34,55%), nervioso (32,73%) y vascular (18,18%). Cinco pacientes tuvieron que reducir la dosis y dos que interrumpir el tratamiento por efectos secundarios, destacando una descompensación de la insuficiencia cardiaca que requirió ingreso en urgencias. Un paciente presentó un síncope que obligó a suspender definitivamente el tratamiento.
La mayoría de los pacientes presentó al menos una interacción potencial con riociguat, registrándose hasta un total de 30 interacciones diferentes. La mayoría (n=27, 90%) de estas interacciones fueron de carácter moderado y la principal repercusión clínica de dicha interacción implicaba un aumento del riesgo de hipotensión (n=23, 76,67%).
Conclusiones: El 47,27% de los pacientes experimentaron efectos adversos durante la terapia con riociguat siendo leves en su mayoría. El 5,45% tuvo que interrumpir o suspender el tratamiento, a pesar del alto número de interacciones potenciales encontradas en pacientes polimedicados.
Palabras clave: Riociguat, guanilato ciclasa soluble, interacciones farmacológicas, seguridad, polifarmacia.
____
INTRODUCCIÓN
La hipertensión pulmonar (HP) es un trastorno hemodinámico definido por el aumento anómalo de la presión arterial pulmonar media (≥25 mmHg), que puede presentarse en numerosas enfermedades y situaciones clínicas. Las causas de HP se clasifican en 5 grandes grupos: arterial, debida a cardiopatía izquierda, debida a enfermedad pulmonar y/o hipoxemia, tromboembólica crónica y de mecanismo no establecido y/o multifactorial1.
La hipertensión pulmonar tromboembólica crónica (HPTC) se caracteriza por la formación de trombos que se adhieren a las arterias pulmonares, pudiendo llegar a reducir por completo la luz o a producir diferentes grados de estenosis, con el consiguiente aumento de las resistencias vasculares pulmonares, que conduce en última instancia, a una insuficiencia cardíaca derecha2.
Se trata de una enfermedad rara, con una prevalencia estimada en España de 3,2 pacientes por millón de habitantes y una incidencia de 0,89 pacientes por millón de habitantes/año. Se calcula que el número de pacientes con HPTC en nuestro país es de 162, según datos procedentes del Registro Español de Hipertensión Arterial Pulmonar –REHAP–, que incluyó los casos registrados voluntariamente por 31 hospitales durante el periodo comprendido entre julio de 2007 y junio de 2008. La supervivencia a los 5 años tras el diagnóstico publicada en nuestro medio es del 65%3.
Los pacientes con HPTC deben recibir anticoagulación de por vida para prevenir acontecimientos recurrentes tromboembólicos. Hasta hace poco no había ningún tratamiento autorizado para la HPTC, por lo que en la práctica clínica se han venido utilizando, fuera de indicación, algunos fármacos para el tratamiento de la hipertensión arterial pulmonar (sildenafilo, análogos de la prostaciclina, bosentán). Sin embargo, sus datos de eficacia en la HPTC son limitados (nivel de evidencia IIb)2,4.
El tratamiento de elección para los pacientes con HPTC es la tromboendarterectomía pulmonar (EAP) ya que es una opción potencialmente curativa. Sin embargo, una cantidad considerable de pacientes con HPTC (entre el 20% y el 40%) no son operables5,6.
Riociguat es un estimulador de la enzima guanilato ciclasa soluble (GCs) que ha sido autorizado para el tratamiento de la HPTC en pacientes adultos en clase funcional II a III de la OMS, para mejorar la capacidad de ejercicio en HPTC inoperable y HPTC persistente o recurrente después del tratamiento quirúrgico7. Fue designado medicamento huérfano para el tratamiento de la HPTC en el año 20078.
La enzima GCs es una enzima presente en el sistema cardiopulmonar que actúa como receptor para el óxido nítrico (NO). El riociguat tiene un doble mecanismo de acción: sensibiliza la GCs al NO endógeno mediante la estabilización de la unión NO-GCs y también estimula directamente la GCs independientemente del NO.
La dosis inicial recomendada es de 1 mg tres veces al día durante 2 semanas. Posteriormente, esta dosis debe incrementarse en 0,5 mg más tres veces al día en intervalos de dos semanas hasta alcanzar la dosis máxima recomendada de 2,5 mg tres veces al día, salvo en aquellos pacientes que la presión arterial sistólica (PAS) sea inferior a 95 mm Hg y aparezcan signos o síntomas de hipotensión, en cuyo caso debe reducirse la dosis en 0,5 mg tres veces al día7.
La larga supervivencia junto con el envejecimiento de la población, lleva a un escenario en el que la mayoría de los pacientes subsidiarios de recibir tratamiento con riociguat, son personas de edad media o avanzada y generalmente con tratamientos concomitantes para sus patologías crónicas de base.
La polimedicación aumenta la probabilidad de que aparezca una interacción farmacológica (IF). Se estima que el riesgo potencial de sufrir una IF es del 70% en pacientes que toman cinco fármacos al mismo tiempo y asciende a un 100% si se toman siete9. Dichas IF pueden ser meramente teóricas sin consecuencias clínicas para el paciente o llegar a desencadenar procesos graves10. Unas IF muy relevantes son las que varían los niveles plasmáticos del fármaco: un aumento de los niveles plasmáticos puede generar una toxicidad excesiva y una disminución muy probablemente conllevará una respuesta terapéutica insuficiente11.
Riociguat está sujeto a interacciones farmacocinéticas ya que se metaboliza a través del citocromo P450, principalmente CYP1A1, CYP3A4 / 5, CYP2C8 y CYP2J2. Además, se comporta como sustrato de la glicoproteína P y la proteína de resistencia al cáncer de mama (BCRP), por lo que la administración concomitante con cualquier otro fármaco que se metabolice a través de estas vías puede producir una interacción que debe ser tenida en cuenta7.
A pesar de todo ello riociguat ha demostrado beneficios clínicos significativos y un perfil de seguridad similar al de otros fármacos vasodilatadores que aumentan los niveles de GMPc (cefalea, hipotensión, trastornos gastrointestinales) en los ensayos clínicos aleatorizados (ECA) en pacientes con HPTC, incluyendo también los estudios en el tratamiento a largo plazo12-16. Sin embargo la evaluación de seguridad de los medicamentos es compleja y requiere de una visión más real, ya que los ECA cuantifican los eventos adversos de una manera estandarizada en poblaciones muy seleccionadas.
El presente estudio, realizado en condiciones de práctica clínica habitual en un hospital de tercer nivel, tiene como objetivo identificar, describir y establecer recomendaciones terapéuticas para las interacciones farmacológicas entre riociguat y los medicamentos domiciliarios de pacientes con HPTC, así como evaluar su seguridad y tolerabilidad.
MATERIAL Y MéTODOS
Estudio observacional retrospectivo en el que se incluyeron todos los pacientes diagnosticados de HPTC en tratamiento con riociguat en nuestro hospital desde su inicio de comercialización en septiembre de 2015 hasta octubre de 2017. El tiempo de seguimiento de los pacientes se definió como el tiempo transcurrido desde el inicio del tratamiento hasta la finalización del mismo o el fin de seguimiento.
Para la identificación de los pacientes se utilizó la aplicación de dispensación a pacientes externos Farhos®. Las variables clínicas se obtuvieron del programa de prescripción-historia clínica electrónica del hospital (HP-HCIS®) y la medicación domiciliaria a través del visor de la historia clínica de atención primaria.
Se recogieron las siguientes variables: demográficas (edad de inicio del tratamiento, sexo), diagnósticas (tipo de hipertensión pulmonar), terapéuticas (EAP previa, fecha de inicio con riociguat, reducción de dosis, motivo de reducción, interrupción del tratamiento, motivo de la interrupción, medicación domiciliaria concomitante al tratamiento con riociguat, presencia de interacciones farmacológicas, categoría de la interacción, fecha de fin de tratamiento y motivo de finalización).
Para evaluar la duración del tratamiento, ésta se calculó en función de si el paciente había sido intervenido quirúrgicamente mediante EAP.
Se analizaron las interacciones detectadas entre riociguat y la medicación domiciliaria concomitante utilizando la herramienta Lexi-InteractTM y se clasificaron en función de la gravedad de la interacción en tres categorías (C, D y X). Se analizó el mecanismo de acción, la repercusión clínica, se establecieron unas recomendaciones generales en función de la trascendencia de las interacciones detectadas: monitorizar el tratamiento (categoría C), considerar la sustitución terapéutica (categoría D) o evitar la asociación (categoría X) y se determinaron los fármacos más frecuentemente implicados.
La evaluación de la seguridad se llevó a cabo a través del registro de los efectos adversos de todos los pacientes incluidos en el estudio, categorizados según los estándares del Sistema de Clasificación de órganos MedDRA (Medical Dictionary for Regulatory Activities). Se consideró a riociguat agente causal de las reacciones adveras (RA) cuando el médico responsable lo especificó en la historia clínica tras entrevistar al paciente una vez iniciado el tratamiento.
Se definió uso concomitante con riociguat cuando las fechas de prescripción se solapaban 20% o más con la duración de tratamiento del otro fármaco prescrito.
RESULTADOS
Durante el periodo de estudio, un total de 62 pacientes recibieron tratamiento con riociguat, 60 fueron diagnosticados de HPTC y de los cuales 55 presentaban datos suficientes para su posterior análisis. La edad media de los pacientes fue de 67 años (rango 23-66 años), y el 67,27% (n=37) eran mujeres.
El 60% (n=33) de los pacientes del estudio no eran candidatos a beneficiarse de la EAP por lo que solamente habían recibido tratamiento con riociguat, por su parte el 40% restante (n=22) además de recibir tratamiento con riociguat habían sido operados mediante EAP en algún momento de su enfermedad (EAP + riociguat). En la figura 1 se muestra la evolución de los pacientes durante el periodo de seguimiento en función de si habían sido operados o no mediante EAP. La mediana de duración de tratamiento con riociguat fue de 13,47 (0,53-37,23) meses en el grupo EAP + riociguat versus 19,23 (2,83-54,27) meses en el grupo que solo recibió tratamiento con riociguat.
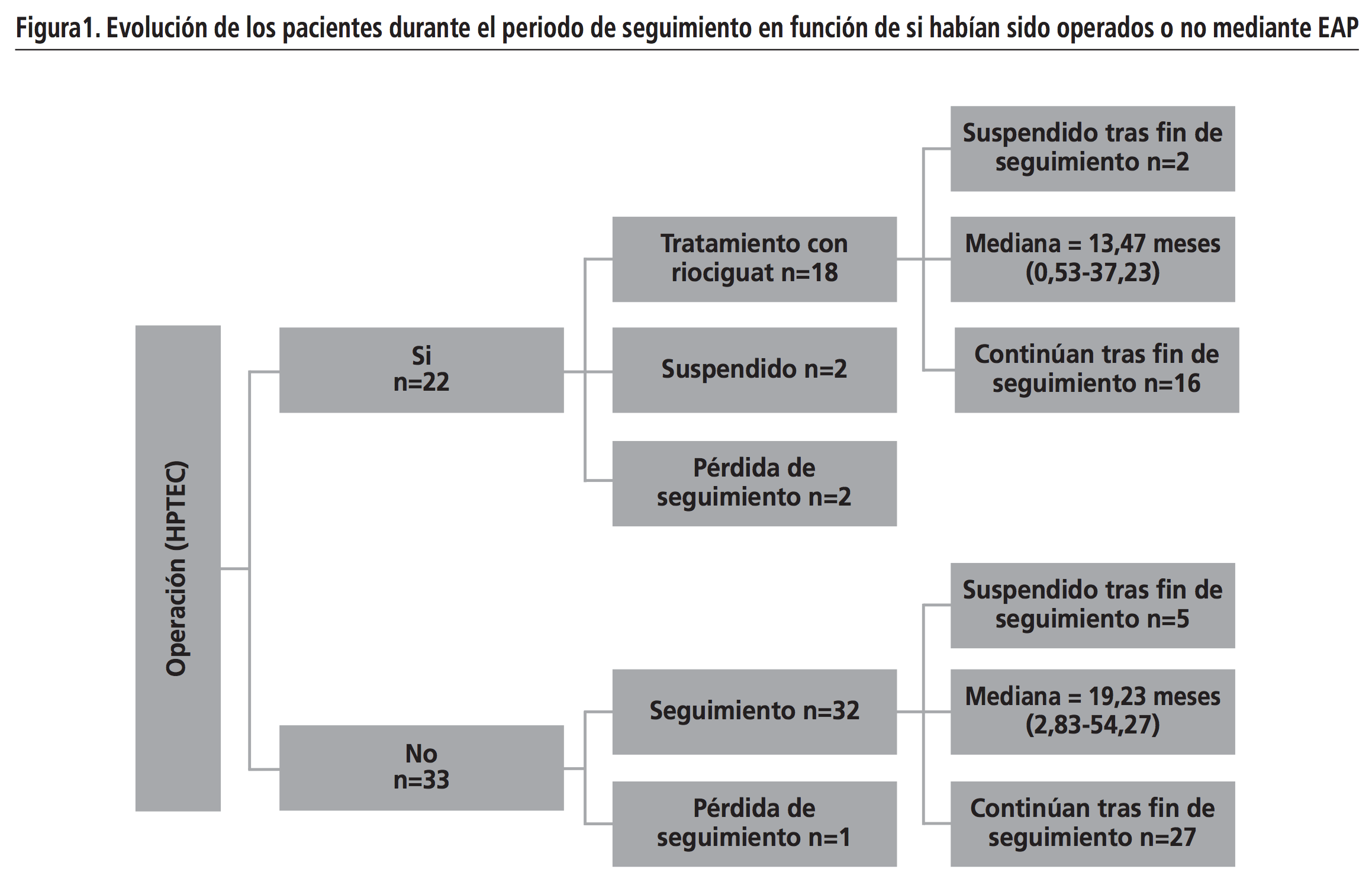
Cuando finalizó el seguimiento en octubre de 2017 continuaba en tratamiento el 78,18% (n= 43) de los pacientes. Con respecto a los pacientes que finalizaron tratamiento (n=9, 16,36%), los principales motivos que llevaron a la suspensión del mismo fueron: ineficacia del tratamiento (n=2; 3,64%) y mejoría de la enfermedad tras EAP (n=2; 3,64%); seguidos de intolerancia al tratamiento (n=1; 1,82%), mejoría de la enfermedad sin EAP previa (n=1; 1,82%), cáncer gástrico (n=1; 1,82%) y exitus (n=1; 1,82%). Cabe destacar que el paciente que tuvo que suspender el tratamiento por intolerancia a riociguat fue debido a que presentó un episodio de síncope asociado al mismo. Por su parte, el fallecimiento registrado durante el periodo de estudio parece que vino motivado por su patología de base y no por el tratamiento con riociguat.
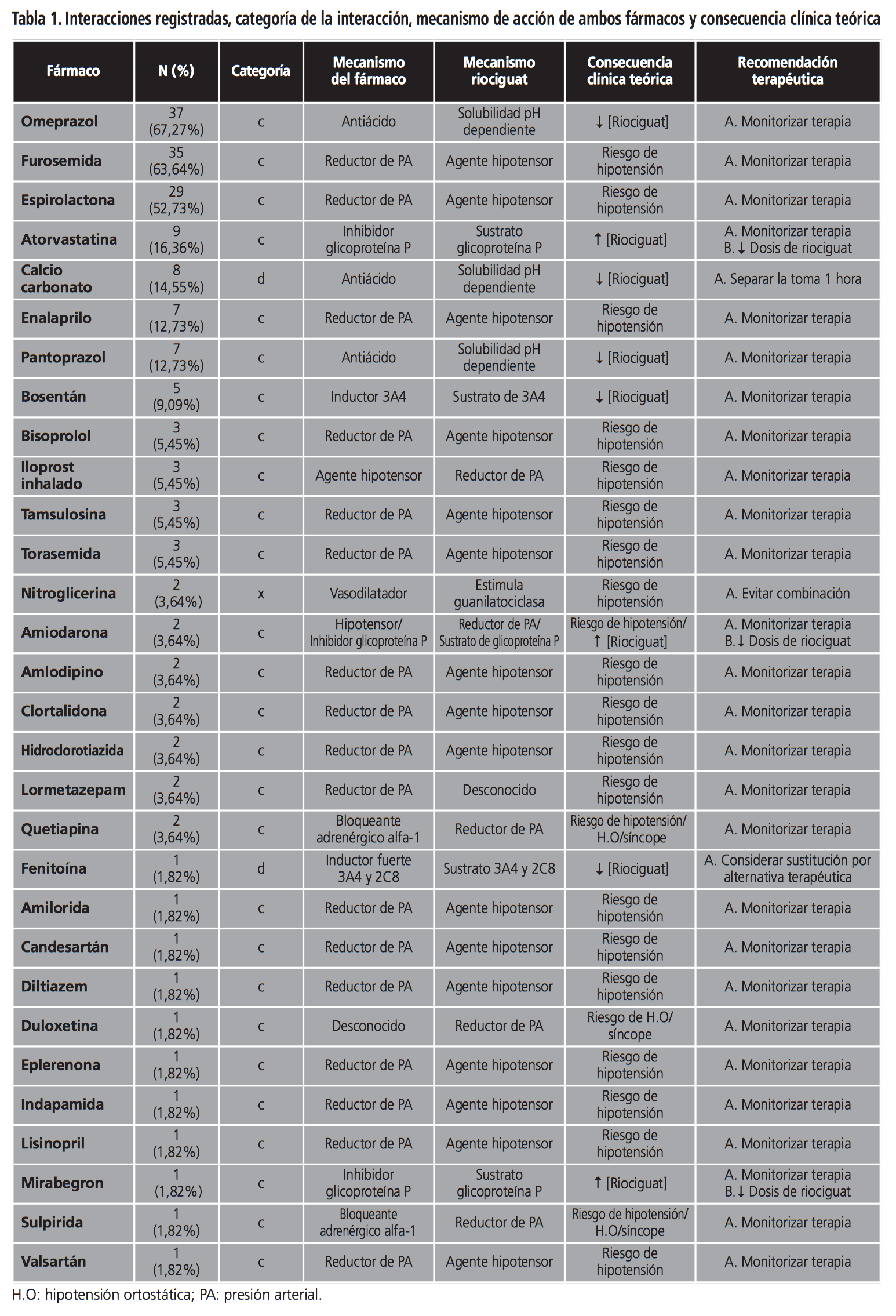
La mediana del número de fármacos administrados concomitantemente con riociguat fue 10 (rango: 1-25). Se analizaron un total 135 medicamentos, registrándose 176 interacciones potenciales pertenecientes a 30 (n=22,22%) fármacos diferentes. El 96,36% de los pacientes presentó al menos una interacción y la mediana de interacciones por paciente fue 3 (rango: 0-7). Los fármacos más frecuentemente implicados en dichas interacciones fueron: omeprazol (67,27%), furosemida (63,64%) espironolactona (52,73%) y atorvastatina (16,36%).
En función de su relevancia, la distribución de las interacciones potenciales fue: 27 de carácter leve o categoría C (90%), 2 de carácter moderado o categoría D (7,69%) y una interacción grave o categoría X (3,33%). Las dos interacciones de carácter D estaban presentes en 16,36% (n=9) de los pacientes, en las que riociguat interaccionaba con fenitoina (n=1, 1,82%) fuerte inductor del CYP3A4 y del CYP2C8 capaz de disminuir los niveles de riociguat (sustrato del CYP3A4 y del CYP2C8) y con carbonato cálcico (n=8, 14,55%) antiácido capaz de modificar la solubilidad del riociguat (solubilidad dependiente del pH) afectando por tanto a la exposición del fármaco en el organismo y, en consecuencia, a su eficacia clínica. La interacción grave se registró en dos pacientes (3,64%) que estaban recibiendo tratamiento con nitroglicerina en parches con el consiguiente aumento del riesgo de hipotensión.
De las diferentes interacciones registradas con los distintos fármacos, los principales mecanismos implicados se basaban en la sinergia hipotensora producida entre riociguat y otro fármaco con capacidad antihipertensiva (n=18, 60%) y la solubilidad pH dependiente que presenta riociguat y el empleo de un antiácido (n=3, 10%). En cuanto a las recomendaciones generales que se establecieron, en el 80% (n=24) sugerían monitorizar estrechamente la terapia con riociguat, 10% (n=3) recomendaban tanto la monitorización o disminución de la dosis de riociguat y en un 3,33% (n=1) consistían tanto en la elección de una alternativa terapéutica, separar la toma de ambos fármacos 1 hora y evitar dicha combinación respectivamente.
Teniendo en cuenta el total de interacciones registradas en todos los pacientes, la consecuencia clínica teórica de la interacción de riociguat con el otro fármaco, era en la mayoría de los casos, un aumento del riesgo de hipotensión, hipotensión ortostática o síncope (n=106, 60,23%), seguido de un descenso de los niveles de riociguat (n=58, 32,95%) o de un aumento de los mismos (n=12, 6,82%). Toda la información relativa a las interacciones detectadas se muestra en la tabla 1.
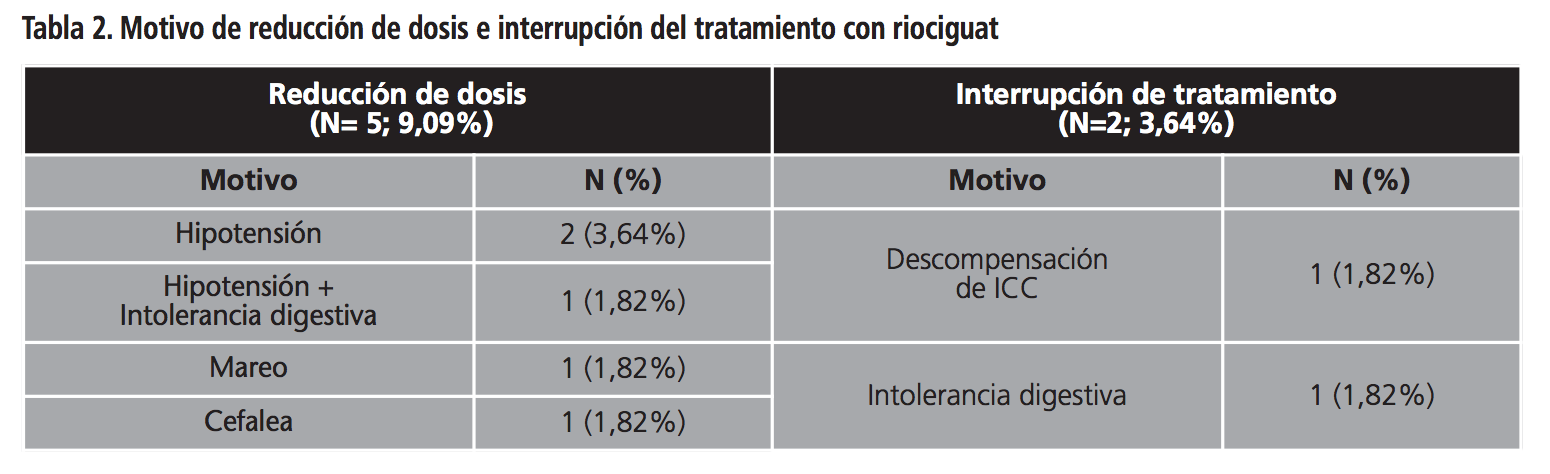
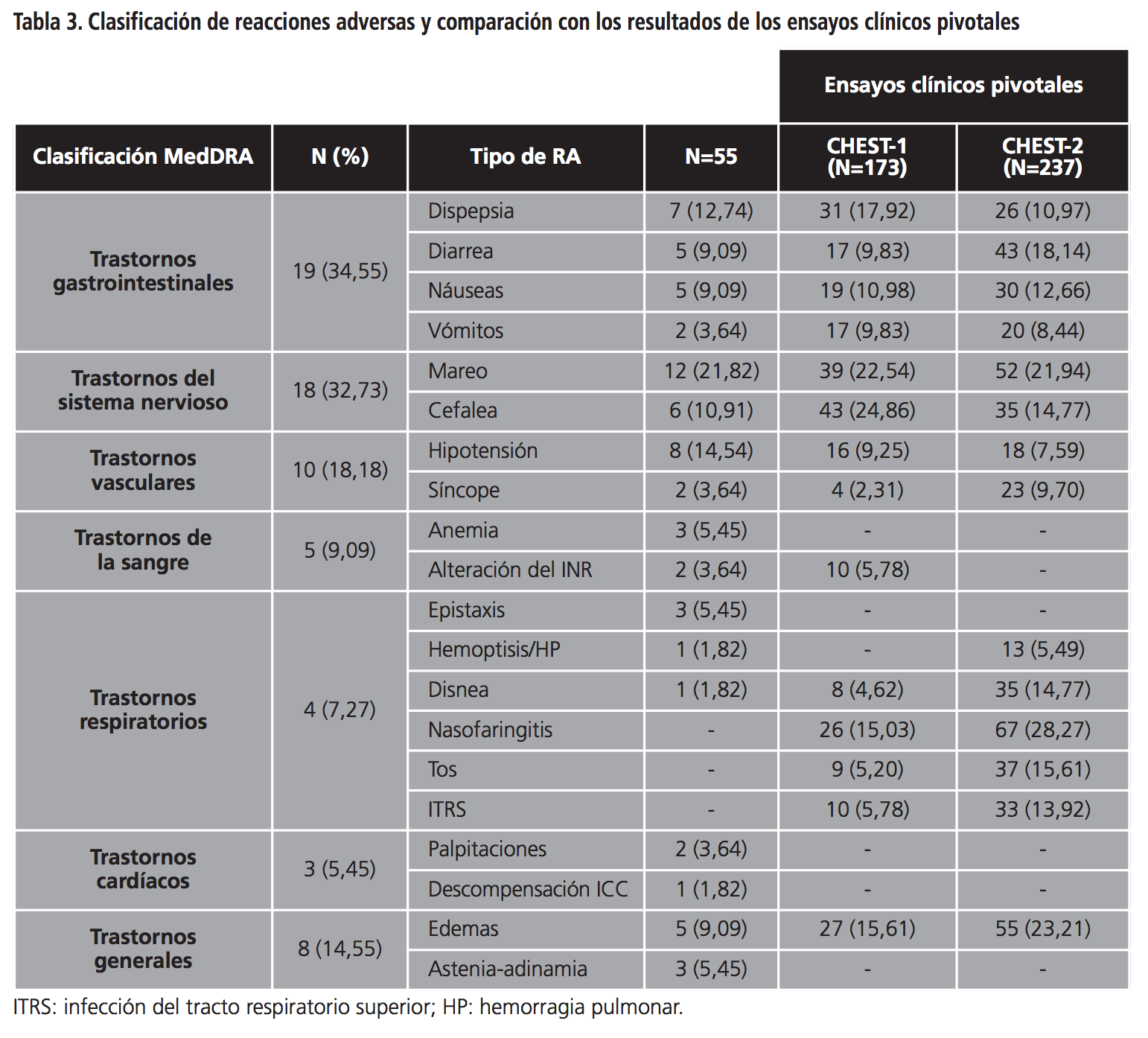
En cuanto a la evaluación de la seguridad el 9,09% (n=5) y el 3,64% (n=2) de los pacientes tuvieron que reducir la dosis e interrumpir el tratamiento con riociguat respectivamente por intolerancia al mismo. En todos estos casos (n=7) se detectaron interacciones potenciales, habiendo en el 85,71% (n=6) de los mismos al menos una interacción con otro fármaco con capacidad hipotensora. En la tabla 2 se muestra el número de pacientes que tuvieron que reducir la dosis o que interrumpir la terapia así como los motivos en cada caso. Con respecto a las RA, el 47,27% (n=26) de los pacientes experimentaron algún tipo de toxicidad asociada al tratamiento con riociguat. Del total de pacientes, el 34,55% (n=19) desarrollaron algún trastorno gastrointestinal, el 32,73% (n=18) a nivel del sistema nervioso y el 18,18% (n=10) asociados a trastornos vasculares. Cabe destacar que un paciente requirió ingreso en urgencias por descompensación de la insuficiencia cardiaca asociado al inicio con riociguat. Además se registraron 12 episodios de mareo, 8 de hipotensión, 7 de dispepsia y 6 de cefalea. La comparativa de las diferentes RA registradas en nuestro estudio con las de los ensayos clínicos pivotales se pueden observar en la tabla 3.
DISCUSIÓN
En nuestro estudio el 47% de los pacientes experimentaron alguna RA asociada al tratamiento con riociguat, destacando de entre todas ellas los trastornos digestivos (34,55%) y nerviosos (32,73%), en concreto las debidas a mareo (21,82%). Además consta una reducción de dosis y una interrupción del tratamiento en el 9,09% y 3,64% de nuestros pacientes respectivamente.
En cuanto a la suspensión del tratamiento asociada a riociguat, dos pacientes (3,64%) lo hicieron por ineficacia y otro (1,82%) por presentar síncope. En este último caso hay que indicar que teniendo en cuenta las dispensaciones realizadas desde el Servicio de Farmacia y los comentarios de evolución en la historia clínica electrónica, el paciente inició tratamiento con dosis de 2,5 mg lo que podría justificar el cuadro que obligó a suspender el tratamiento. Con respecto a los dos pacientes que suspendieron riociguat por ineficacia, al analizar las interacciones, uno de ellos estaba en tratamiento con un fármaco (omeprazol) que puede reducir los niveles de riociguat mientras que el otro paciente no.
Con respecto al paciente que interrumpió el tratamiento requiriendo ingreso en urgencias por descompensación de la ICC, estaba recibiendo junto con riociguat 3 fármacos (amiodarona, enalapril, espironolactona) con capacidad de inducir hipotensión y un fármaco capaz de aumentar los niveles de riociguat (amiodarona).
Teniendo en cuenta que casi la totalidad de los pacientes (96,36%) presentaban al menos una interacción potencial, la mediana3 de interacciones por paciente y el número de fármacos con los que se registró interacción, no se puede descartar que las RA presentes durante la terapia no estén asociadas a una posible interacción entre riociguat y otro fármaco. Esto es debido a que la mayoría de las interacciones registradas (67,05%) tenían como consecuencia clínica el riesgo de desarrollar hipotensión o aumentar los niveles de riociguat, lo que podría estar correlacionado con algunas de las manifestaciones clínicas neurológicas o vasculares como: mareo (21,82%), hipotensión (14,54%), síncope (3,64%) observadas en nuestros pacientes. Sin embargo, llama la atención que al analizar los dos pacientes que estaban en tratamiento con un fármaco (nitroglicerina parches) contraindicado, solo uno de ellos presentó como RA mareo mientras que el otro no desarrolló ninguna RA durante el estudio.
En líneas generales, nuestros resultados se aproximan al de otros estudios, como el EC CHEST-1 de Ghofrani HA y col., en el que el 92% de los pacientes que recibieron riociguat presentaron alguna RA frente al 47% de pacientes de nuestro estudio. Esta diferencia podría deberse a que al tratarse de un ECA, los pacientes están más monitorizados y la posibilidad de detectar posibles RA es mayor. Las RA que con mayor frecuencia se observaron en el EC CHEST-1 en comparación con nuestro estudio fueron: cefalea (24,86% vs. 10,91%), mareo (22,54% vs. 21,82%), dispepsia (17,92% vs. 12,74%) e hipotensión (9,25% vs. 14,54%) respectivamente. Los eventos adversos considerados graves asociados a riociguat incluyeron: síncope (2,31% vs. 3,64%), intolerancia digestiva (0,58% vs. 1,82%), insuficiencia renal aguda (0,58% vs. 0%) e hipotensión (0,58% vs. 3,64%) respectivamente. Cinco pacientes (2,89%) suspendieron el fármaco debido a RA y en ningún caso de asoció al tratamiento; un paciente tuvo que interrumpir el tratamiento por RA a nivel gastrointestinal al igual que en nuestro estudio13. Posteriormente Simonneau y cols., llevaron a cabo un estudio de extensión (CHEST 2), a partir de pacientes del CHEST-1 en el que se evaluó la eficacia y seguridad de riociguat a largo plazo. Tanto la tolerancia como la seguridad fueron similares a las observadas en el CHEST-1 destacando como efectos adversos: mareo (21,94%), dispepsia (10,97%), hipotensión (7,59%) y síncope (9,70%)17.
El gran número de interacciones registradas durante nuestro estudio, refleja la necesidad de llevar a cabo una estrecha monitorización de los pacientes tanto en la fase de titulación como de mantenimiento, ya que habitualmente las RA presentes durante el tratamiento y que suelen atribuirse solamente a riociguat, podrían derivar de una interacción con otro fármaco que esté siendo administrado concomitantemente. Además este seguimiento permitiría de cara a posibles cambios en la terapia concomitante evitar posibles interacciones potenciales que pueden llevar a una terapia inefectiva o insegura.
Hasta donde sabemos, este es el primer estudio realizado en población española que investiga el perfil de seguridad y de interacciones de riociguat en pacientes diagnosticados de HPTC. Esto es debido, en gran parte, a que del total de pacientes con HPTC en España, en nuestro centro se ha tratado la tercera parte de ellos con riociguat.
Al tratarse de un estudio retrospectivo, hay varias limitaciones a considerar: no se pudo medir la concentración plasmática de riociguat ya que el empleo de inhibidores del citocromo P450, la glicoproteína P o BCRP pueden modificar la exposición de riociguat en el organismo, el tamaño de la muestra era relativamente pequeño en comparación con los ECA, y los periodos entre consulta y consulta en la fase de mantenimiento impedían una evaluación más precisa de la tolerabilidad al tratamiento. Sin olvidar posibles factores de confusión tales como el cumplimiento terapéutico del paciente, el tabaco o factores relacionados con riociguat como la variabilidad interpaciente18,19.
A pesar de estas limitaciones, los resultados obtenidos muestran que riociguat es un fármaco seguro y bien tolerado. En cualquier caso, nuestros resultados deben ser considerados como exploratorios, siendo necesarios estudios prospectivos a largo plazo y con un mayor número de pacientes.
CONCLUSIONES
El perfil de seguridad de riociguat en pacientes con HPTC en nuestro centro es similar al de la evidencia disponible en los ensayos clínicos. Se trata de un fármaco bien tolerado en líneas generales, sin embargo la administración concomitante con determinados fármacos y un empleo inadecuado del mismo pueden conducir a situaciones que obliguen a la suspensión-interrupción del tratamiento.
Es fundamental que el Servicio de Farmacia participe en el seguimiento farmacoterapéutico del paciente y en la farmacovigilancia de estas nuevas terapias para garantizar así la seguridad al mismo y poder prevenir posibles eventos adversos derivados de la interacción con otros fármacos.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Barberà JA, Román A, Gómez-Sánchez MÁ, Blanco I, Otero R, López-Reyes R, et al. Guidelines on the Diagnosis and Treatment of Pulmonary Hypertension: Summary of Recommendations. Arch Bronconeumol. 2018 Apr;54(4):205-15.
2. Galiè N, Hoeper MM, Humbert M, Torbicki A, Vachiery J-L, Barbera JA, et al. Guidelines for the diagnosis and treatment of pulmonary hypertension: the Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT). Eur Heart J. 2009;30(20):2493-537.
3. Escribano-Subias P, Blanco I, López-Meseguer M, Lopez-Guarch CJ, Roman A, Morales P, et al. Survival in pulmonary hypertension in Spain: insights from the Spanish registry. Eur Respir J. 2012;40(3):596-603.
4. Subias PE, Cano MJR, Flox A. Medical treatment in patients with chronic thromboembolic pulmonary hypertension. Arch Bronconeumol. 2009;45 (Supl 6):S35-9.
5. Kim NH, Lang IM. Risk factors for chronic thromboembolic pulmonary hypertension. Eur Respir Rev Off J Eur Respir Soc. 2012;21(123):27-31.
6. Pepke-Zaba J, Delcroix M, Lang I, Mayer E, Jansa P, Ambroz D, et al. Chronic thromboembolic pulmonary hypertension (CTEPH): results from an international prospective registry. Circulation. 2011;124(18):1973-81.
7. Ficha técnica de Adempas®. [citado 17 Febrero 2018]. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002737/WC500165034.pdf.
8. Resumen sobre designación huérfana de Adempas®. [citado 17 Febrero 2018]. Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/Orphan_designation/2009/10/WC500006390.pdf.
9. Blower P, de Wit R, Goodin S, Aapro M. Drug-drug interactions in oncology: why are they important and can they be minimized? Crit Rev Oncol Hematol. 2005;55(2):117-42.
10. Sánchez Gómez E, Arco Prados Y. Revisión de las interacciones farmacológicas de los fármacos antineoplásicos orales dispensados en un servicio de farmacia. Farm Hosp. 2014;38(4):338-63.
11. Flores J, Armijo JA, Mediavilla A. Farmacología Humana. 5º Edición ed.: Masson-Salvat; 2008.
12. Ghofrani HA, Grimminger F. Soluble guanylate cyclase stimulation: an emerging option in pulmonary hypertension therapy. Eur Respir Rev. 2009;18(111):35-41.
13. Ghofrani H-A, D’Armini AM, Grimminger F, Hoeper MM, Jansa P, Kim NH, et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension. N Engl J Med. 2013;369(4):319-29.
14. Ghofrani H-A, Galiè N, Grimminger F, Grünig E, Humbert M, Jing Z-C, et al. Riociguat for the treatment of pulmonary arterial hypertension. N Engl J Med. 2013;369(4):330-40.
15. Bonderman D, Ghio S, Felix SB, Ghofrani H-A, Michelakis E, Mitrovic V, et al. Riociguat for patients with pulmonary hypertension caused by systolic left ventricular dysfunction: a phase IIb double-blind, randomized, placebo-controlled, dose-ranging hemodynamic study. Circulation. 2013;128(5):502-11.
16. Ghofrani H-A, Voswinckel R, Gall H, Schermuly R, Weissmann N, Seeger W, et al. Riociguat for pulmonary hypertension. Future Cardiol. 2010;6(2):155-66.
17. Simonneau G, D’Armini AM, Ghofrani H-A, Grimminger F, Jansa P, Kim NH, et al. Predictors of long-term outcomes in patients treated with riociguat for chronic thromboembolic pulmonary hypertension: data from the CHEST-2 open-label, randomised, long-term extension trial. Lancet Respir Med. 2016;4(5):372-80.
18. Zhao X, Wang Z, Wang Y, Zhang H, Blode H, Yoshikawa K, et al. Pharmacokinetics of the Soluble Guanylate Cyclase Stimulator Riociguat in Healthy Young Chinese Male Non-Smokers and Smokers: Results of a Randomized, Double-Blind, Placebo-Controlled Study. Clin Pharmacokinet. 2016;55(5):615-24.
19. Frey R, Becker C, Saleh S, Unger S, van der Mey D, Mück W. Clinical Pharmacokinetic and Pharmacodynamic Profile of Riociguat. Clin Pharmacokinet [revista en Internet]. 2017 [citado 17 Febrero 2018]. Disponible en: https://doi. org/10.1007/s40262-017-0604-7.
____
Descargar artículo en PDF: Interacciones medicamentosas y perfil de seguridad en pacientes tratados con riociguat
