Suñer-Barriga H1, Baixeras-Muñoz A2, Plo-Seco I1, Esteve-Pitarch E1
- Servicio de Farmacia, Hospital Universitario Joan XXIII. Tarragona, España.
- Facultad de Farmacia, Universidad de Barcelona. Barcelona, España.
Fecha de recepción: 27/03/2023 – Fecha de aceptación: 26/04/2023
Correspondencia: Helena Suñer Barriga · Servicio de Farmacia. Hospital Universitario Joan XXIII. C/ Dr. Mallafrè Guasch, 4, 43005 Tarragona, España · helesubar@gmail.com
____
El síndrome hepatorenal (SHR) se caracteriza por la presencia de una insuficiencia renal reversible que ocurre en pacientes con enfermedad hepática crónica grave, especialmente cirrosis avanzada. El tratamiento médico consiste en la expansión de volumen con albúmina y el uso de vasoconstrictores, siendo la terlipresina el fármaco con mayor evidencia en el tratamiento del SHR-1. Sin embargo, la terlipresina puede tener efectos adversos graves cuando se administra en forma de bolos endovenosos por lo que la bibliografia recomienda la administración en perfusión continua (PC), que permite lograr la misma efectividad con una reducción de efectos adversos e iniciar el tratamiento a dosis menores. Se describe el caso de un paciente ingresado con diagnostico de SHR al que se le inicia una PC de terlipresina y que al cuarto día de tratamiento acaba presentado una hipoperfusión y necrosis escrotal distal asociada, una reacción adversa rara que requirió la suspensión del tratamiento vasoconstrictor y la notificación de la reacción adversa al Sistema Español de Farmacovigilancia.
Palabras clave: terlipresina, perfusión continua, necrosis escrotal, reacción adversa a medicamentos, caso clínico.
Scrotal ischemia and necrosis associated with the use of continuous infusion terlipressin.
Hepatorenal syndrome (HRS) is a reversible renal failure that occurs in patients with severe chronic liver disease, especially advanced cirrhosis. The medical treatment consists of volume expansion with albumin and the use of vasoconstrictors, being terlipressin the drug with the most evidence in the treatment of HRS-1. However, terlipressin can have serious adverse effects when administered as intravenous boluses, reason why the literature recommends administration in continuous infusion, which achieves the same effectiveness with a reduction in adverse effects and allows initiate the treatment at lower doses. We describe the case of a hospitalised patient with a diagnosis of HRS who was started on continuous terlipressin infusion and who on the fourth day of treatment developed distal scrotal hypoperfusion and necrosis, a rare adverse reaction that required discontinuation of vasoconstrictor treatment and Notification to the Spanish Pharmacovigilance System.
Keywords: terlipressin, continuous perfusion, scrotal necrosis, drug-related side effects, case report.
____
Introducción
El síndrome hepatorenal (SHR) es el fallo renal reversible de carácter funcional que se produce en contexto de una enfermedad hepática crónica grave, especialmente cirrosis avanzada1. Existen dos tipos de SHR: tipo 1, caracterizado por una reducción rápida de la función renal; y tipo 2, asociado a enfermedad renal crónica2. Ocurre aproximadamente en el 10% de los pacientes hospitalizados con cirrosis como consecuencia de la vasoconstricción renal generada para compensar la vasodilatación esplácnica inducida por la hipertensión portal (HP)2.
El tratamiento médico consiste en la expansión de volumen con albúmina, para reducir el volumen sanguíneo circulante efectivo, y el uso de vasoconstrictores que actúan sobre el territorio esplácnico contrarrestando la vasodilatación3.
El fármaco vasoconstrictor con mayor evidencia es la terlipresina, análogo de la vasopresina indicado en el tratamiento del SHR-1. Tiene efecto similar y requiere menos dosis que cualquiera de sus análogos (5-10%) contribuyendo así a una menor frecuencia de complicaciones isquémicas4,5.
La terlipresina tiene receptores V1 situados en el músculo liso, vasos sanguíneos de la circulación esplácnica, renal, miometrial, urinaria, cutánea y en los adipocitos. Como consecuencia, se pueden producir efectos adversos graves resultado de su efecto a nivel de la circulación sistémica6. Tras una búsqueda bibliográfica en Pubmed (palabras clave: terlipressin, necrosis, ischemic reactions), los más descritos son dolor de cabeza, hipertensión, dolor abdominal, palidez cutánea y bradicardia. También se han descrito complicaciones más raras como colitis isquémica, lesiones en la piel e infartos de miocardio7.
La dosis habitual de terlipresina es 0,5-2 mg, según tolerancia, en bolos IV cada 4-6h3. Sin embargo, estudios recientes han demostrado que la perfusión continua (PC) permite lograr la misma efectividad con una reducción de efectos adversos e iniciar el tratamiento a dosis menores (2mg/día). Esto se explica por la farmacocinética de la terlipresina. La administración en bolos IV permite mantener una vasodilatación esplácnica de 3-4h post-dosis mientras que la PC la mantiene durante toda la administración, logrando alcanzar el rango terapéutico de dicho fármaco y evitando la administración rápida que, en muchos casos, viene asociada a reacciones adversas fatales8. A continuación, describimos un caso de hipoperfusión y necrosis escrotal distal asociada a la administración de terlipresina en PC.
Descripción Del Caso
Varón de 59 años, 90kg, ingresado en Digestivo por una segunda descompensación ascítico edematosa y disnea. Antecedentes médicos: HTA y DM2, dislipemia, cirrosis hepática mixta por enolismo y síndrome metabólico Child Pugh C diagnosticado en octubre 2021, coincidiendo con la primera descompensación ascítica. Sin antecedentes de peritonitis bacteriana espontánea, hemorragia digestiva alta por HP ni insuficiencia renal aguda.
A su llegada a urgencias se encuentra consciente y orientado, con leve ictericia de piel y mucosas, edemas en extremidades inferiores, escroto y pene, no flapping.
Ante hallazgos analíticos encontrados (tabla 1), se retira antihipertensivo habitual (atenolol), AINEs y otros nefrotóxicos y se inicia tratamiento con albúmina 10g/8h IV y furosemida 20 mg IV.
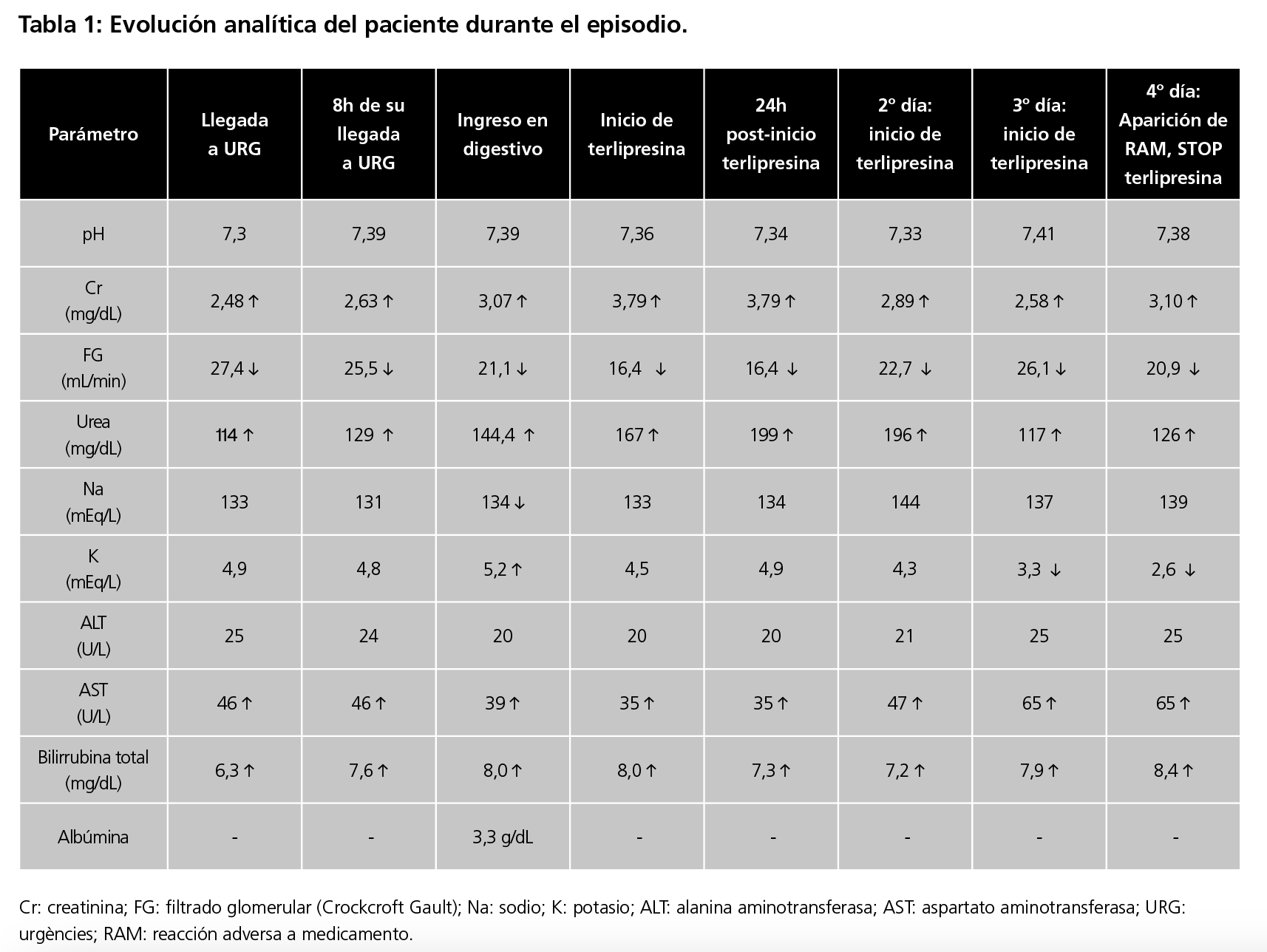
Tras 24h de seguimiento, el paciente se mantiene oligoanúrico (250 mL/24h) por lo que se retira furosemida IV y se intensifica albúmina a 1g/kg IV (90g). Se cursan hemocultivos y urocultivo para screening infeccioso, resultando negativos. Ante empeoramiento del 20% de la función renal (tabla 1) y sospecha de SHR se solicita sedimento de orina e interconsulta a Nefrología. Se obtiene sedimento sin eritrocitos, 10-25 leucocitos/campo, presencia de cilindros hialinos abundantes, Na en orina 23 mEq/L y excreción fraccionada de Na 0,21%(<1%) compatible con trastorno prerrenal.
Se confirma SHR por lo que tras dos dosis de 90g IV de albúmina se inicia (día +3 de ingreso) terlipresina en PC a dosis mínimas (1 mg/kg/12h; diluido en 100 mL de SG5%; velocidad de administración 8,3 mL/h). Se ajusta, además, pauta de albúmina a 20g/12h.
A las 24h de iniciar dicho tratamiento presenta hemoptisis abundante y regular estado general (acidosis metabólica, taquipnea, hipoperfusión distal y, persistencia de edemas en miembros inferiores y escroto). Se decide traslado a la unidad de críticos (UCI) para monitorización, inicio de hemodiálisis venovenosa continua y optimización del tratamiento.
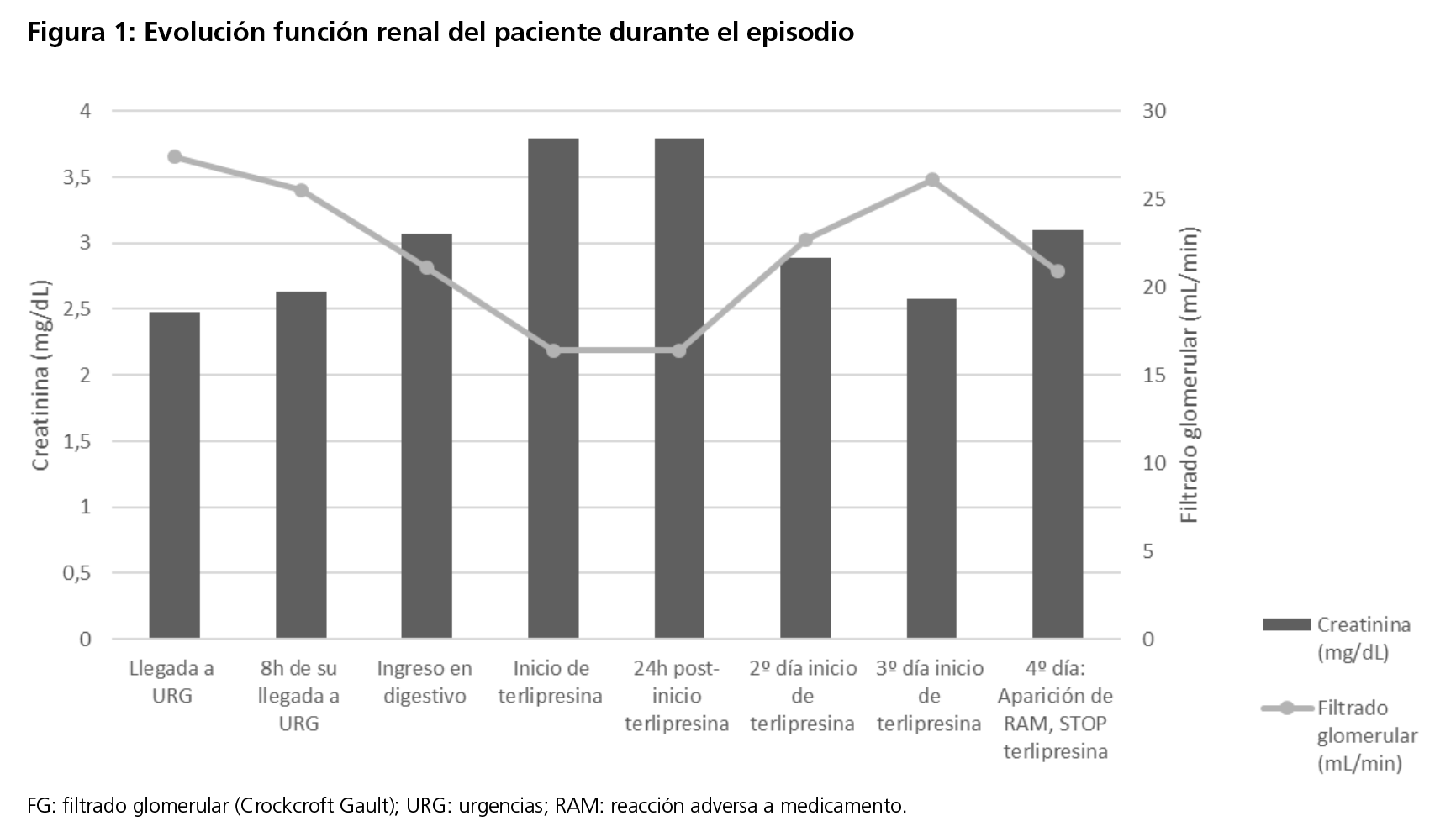
Tras las primeras horas en UCI se observa acidosis metabólica corregida, sin alteraciones iónicas en la analítica y creatinina en descenso (tabla 1, figura 1), por lo que se mantiene mismo tratamiento. Evoluciona favorablemente hasta el día +4 de inicio terlipresina momento en que el paciente presenta hematoma inguino-escrotal derecho con induración al tacto. Ante sospecha de reacción adversa a terlipresina, se suspende tratamiento. Tras valoración por Urología se diagnostica como hipoperfusión escrotal distal con presencia de escaras necróticas y exudado serohemático secundario probablemente a terlipresina.
Finalmente, el paciente es trasladado a otro hospital para valoración de trasplante hepático. La reacción adversa se clasificó como probable tras aplicar el algoritmo de causalidad de Naranjo9 y el caso fue notificado al Sistema Español de Farmacovigilancia.
Discusión
Describimos un caso de isquemia y necrosis escrotal asociado a la administración de terlipresina que, aunque raro, ya se había descrito en publicaciones previas6,7. En nuestro caso, dada la situación clínica del paciente, la oliguria, el edema con afectación escrotal y peneana y los antecedentes patológicos, se decidió en consenso entre farmacia-digestivo, iniciar terlipresina en PC para garantizar mayor seguridad del tratamiento. En semejanza con la bibliografía consultada, la aparición de la reacción adversa se dio en el 4º día de inicio de tratamiento. La mayoría de eventos isquémicos publicados son en administraciones de terlipresina en bolo IV y solamente dos casos reportados se relacionan con administraciones en PC7.
Si bien no hemos encontrado publicaciones de hipoperfusión y necrosis escrotal asociada a PC, nuestro caso podría no ser el primero. La aparición de este evento con este tipo de administración y a dosis bajas nos hace pensar que en muchos casos su aparición es inevitable e independiente de la dosis y forma de administración. Por ello, la PC no está exenta de reacciones adversas y es imprescindible garantizar una correcta vigilancia durante la infusión del fármaco. De hecho, una reciente alerta de seguridad de la AEMPS contraindica su uso en insuficiencia renal avanzada (creatinina sérica inicial ≥5,0 mg/dL) e insuficiencia hepática aguda debido al aumento de la mortalidad y del riesgo de acontecimientos adversos10.
Conflictos de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía:
- Ginès P, Solà E, Angeli P, Wong F, Nadim MK, Kamath P. Hepatorenal syndrome. Nature Reviews Disease Primers. 2018; 4:23. DOI: 10.1038/s41572-018-0022-7
- Best LMJ, Freeman S, Sutton AJ, Hawkins N, Tsochatzis E, Gurusamy KS. Treatment for hepatorenal syndrome in people with decompensated liver cirrhosis: A network meta-analysis. Cochrane Database Syst Rev. 2018;(9). DOI: 10.1002/14651858.CD013103.
- Mindikoglu AL, Pappas SC. New Developments in Hepatorenal Syndrome. Clin Gastroenterol Hepatol. 2018;16(2):162-177.e1. DOI: 10.1016/j.cgh.2017.05.041
- Moore K, Jamil K, Verleger K, Luo L, Kebede N, Heisen M, et al. Real-world treatment patterns and outcomes using terlipressin in 203 patients with the hepatorenal syndrome. Aliment Pharmacol Ther. 2020;52(2):351–8. DOI: 10.1111/apt.15836
- Wong F, Pappas SC, Curry MP, Reddy KR, Rubin RA, Porayko MK, et al. Terlipressin plus Albumin for the Treatment of Type 1 Hepatorenal Syndrome. N Engl J Med. 2021;384(9):818–28. DOI: 10.1056/NEJMoa2008290
- Macedo SS, Cabral C, Novais A, Teixeira M, Knock A. Terlipressin-related Ischaemic Necrosis of the Skin: A Rare Complication. Eur J Case Reports Intern Med. 2019;6(11):1. DOI: 10.12890/2019_001247
- Kulkarni A V., Kumar P, Rao NP, Reddy N. Terlipressin-induced ischaemic skin necrosis. BMJ Case Rep [Internet]. 2020 Jan 15;13(1):e233089. DOI: 10.1136/bcr-2019-233089
- Cavallin M, Piano S, Romano A, Fasolato S, Chiara A, Benetti G, et al. Terlipressin Given by Continuous Intravenous Infusion Versus Intravenous Boluses in the Treatment of Hepatorenal Syndrome: A Randomized Controlled Study. HEPATOLOGY. 2016;63(3):983–92. DOI: 10.1002/hep.28396
- C. A. Naranjo, U. Busto, E. M. Sellers, P. Sandor, I. Ruiz, E. A. Roberts, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther. 1981;30(2):239–45. DOI: 10.1038/clpt.1981.154
- AEMPS. Terlipresina : nuevas recomendaciones de uso en el síndrome hepatorrenal tipo 1 para evitar riesgos graves [Internet]. AEMPS. Nota de seguridad; 2022. p. 1–4.
____
