Márquez Peiró JF1, Gaspar Carreño M2, García Cases S3, Achau Muñoz R2
1 Especialista en Farmacia Hospitalaria. Coordinador del Grupo de Productos Sanitarios
2 Especialista en Farmacia Hospitalaria. Miembro del Grupo de Productos Sanitarios. Servicio de Farmacia Hospital Intermutual de Levante (Valencia)
3 Especialista en Farmacia Hospitalaria. Miembro del Grupo de Productos Sanitarios. Servicio de Farmacia. Centro Sociosanitario La Florida (Alicante)
Fecha de recepción: 21/05/2020 – Fecha de aceptación: 22/05/2020
Correspondencia: Juan Francisco Márquez Peiró – Plaza de Gómez Ulla, 15 – puerta 5D – 03015 Alicante (España)
marquez_juapei@gva.es
____
RESUMEN
Las mascarillas son un elemento básico de protección y limitación de la propagación de la infección por coronavirus. En concreto y en la situación de pandemia sanitaria mundial ante la que nos encontramos frente al COVID-19. Podemos diferenciar varios tipos de mascarillas (quirúrgicas, autofiltrantes, higiénicas, etc.), teniendo cada una de ellas una consideración diferente en cuanto a tipo de producto, requisitos normativos y protección que nos ofrecen.
La situación de pandemia actual en la que nos encontramos, hace imprescindible el uso de las mismas para limitar la propagación de agentes infecciosos.
Palabras clave: Producto sanitario, mascarillas, equipo protección individual, pandemia, farmacéutico.
Masks: essential product in the pandemic COVID-19
SUMMARY
Masks are a basic element of protection and limitation of the spread of coronavirus infection. We can distinguish several types of masks (surgical, auto filtering, hygienical, etc.), which have different considerations related to the type of product, regulatory requirements, and grade of protection. The current pandemic situation makes essential the use of masks to limit the spread of infectious agents.
Key words: Medical device, mask, personal protective equipment, pandemic, pharmacist.
____
La necesidad de protección frente al COVID-19 durante la pandemia actual, ha ocasionado una elevada demanda de mascarillas quirúrgicas y autofiltrantes, provocando su escasez, siendo necesario que las autoridades competentes hayan autorizado de forma excepcional y temporal la comercialización de productos que no cumplen de forma estricta la normativa vigente para su introducción en el mercado, aunque sí se especifica que deben ser evaluados. Por ello, es esencial conocer los aspectos más importantes de éstos para su correcta identificación y conocer sus prestaciones, tanto para su uso eficiente, como para garantizar un adecuado nivel de protección.
Mascarillas quirúrgicas
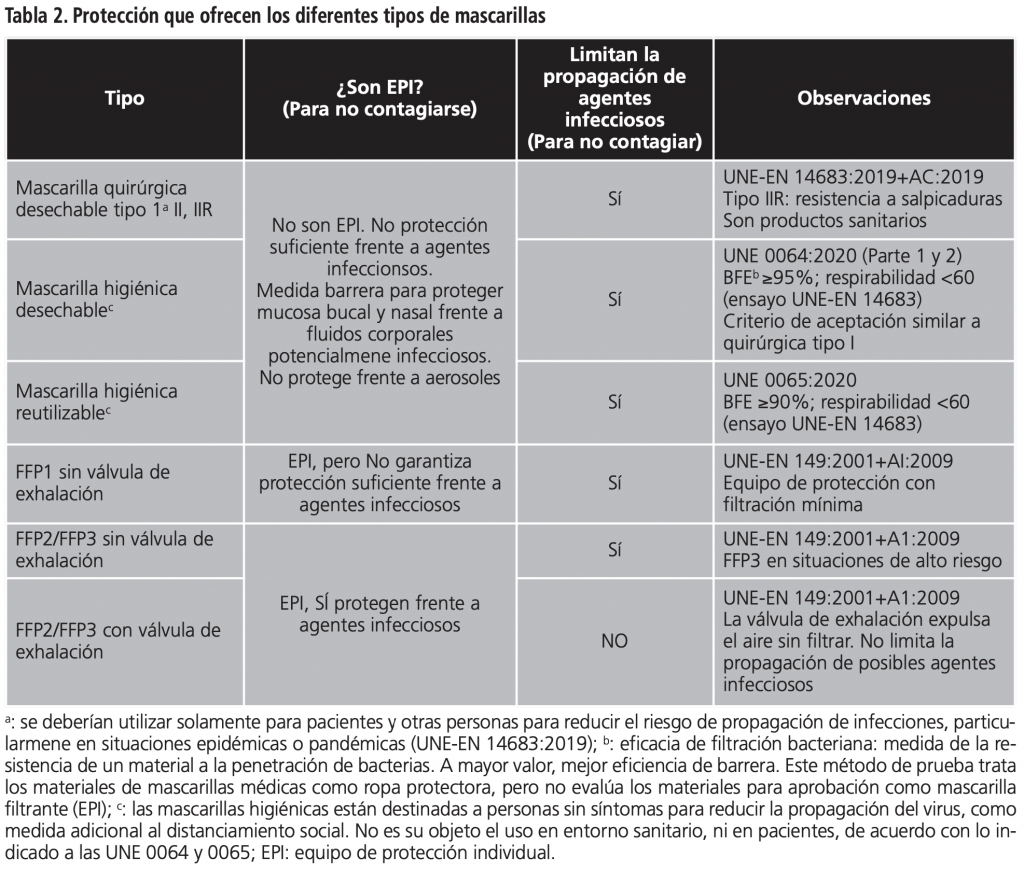
Son productos sanitarios (PS) de clase I, no estériles de forma habitual, y, por tanto, para su introducción en el mercado y puesta en servicio deben cumplir con los requisitos esenciales de seguridad y funcionamiento que le son de aplicación, no participando ningún Organismo Notificado (ON) en la evaluación de la conformidad1. Cuando cumple con estos requisitos, el fabricante pone el marcado CE y emite la Declaración UE de conformidad. La norma armonizada UNE-EN 14683:20192 da presunción de conformidad con los requisitos esenciales de seguridad y funcionamiento, y es habitual que los fabricantes se basen en ella para realizar los ensayos correspondientes, pudiendo aparecer en el marcado de las mascarillas.
El nivel de eficacia que ofrece depende de factores como la eficacia de filtración, calidad del material y adaptabilidad a la cara. Atendiendo a la eficacia de filtración bacteriana (EFB) tenemos de tipo I y de tipo II. Las de tipo II pueden ser a su vez resistentes a salpicaduras, lo que se indica con la letra “R”, teniendo las II-R. Es importante saber el tipo de mascarilla quirúrgica ante el que estamos para su uso apropiado, ya que la finalidad de uso es diferente. Así, las de tipo I deben ser usadas por pacientes y otras personas para reducir el riesgo de propagación de infecciones, particularmente en situaciones de epidemia.
Si esta información no aparece en el marcado se debe solicitar al proveedor información técnica o certificados por laboratorio acreditado sobre resultados de los ensayos realizados sobre la mascarilla, sobre todo de parámetros críticos como la EFB, respirabilidad o el ensayo de resistencia a salpicaduras.
En la situación actual de escasez de estos PS nos podemos encontrar con mascarillas certificadas bajo otros estándares como los de EE.UU. o China, siendo importante conocerlos para saber a qué tipo de mascarilla quirúrgica sería asimilable3. Además, la AEMPS está emitiendo autorizaciones expresas para la comercialización de estos productos que no han pasado un procedimiento de evaluación de la conformidad, pero asegurando que cumplen con los requisitos de funcionamiento de la norma EN 14683:2019 en los puntos 5.2.2 y 5.2.3 (EFB y Respirabilidad) y en el caso del tipo IIR, además, debe cumplir el punto 5.2.4 (Resistencia a las salpicaduras), exigiendo un certificado emitido por un laboratorio acreditado para la norma UNE-EN 14683 y la ISO 22609, si procede, en el que se indique que los productos cumplen con ellas. Estos productos no llevarán marcado CE y se podrán identificar porque en su etiquetado debe aparecer el número de autorización expresa4. Una vez finalice la crisis del COVID-19 para seguir comercializándose deberán ostentar el marcado CE de conformidad.
Mascarillas autofiltrantes
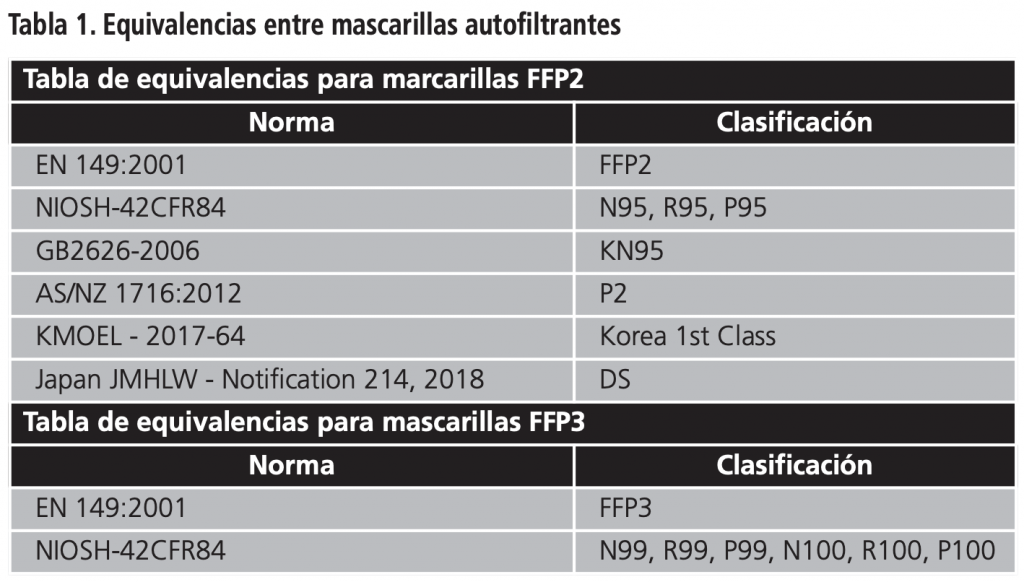
Son equipos de protección individual (EPI) de categoría III, y para su introducción en el mercado y puesta en servicio deben cumplir con los requisitos esenciales de salud y seguridad que se establecen en el Reglamento 2016/4255. En su evaluación de la conformidad participa un ON, por lo que si cumple con estos requisitos esenciales veremos el “logo” CE junto con cuatro dígitos que identifican a este ON (Ej: CE 0123). La norma armonizada UNE-EN 149:2001+A1:2010 da presunción de conformidad con estos requisitos esenciales, apareciendo en el marcado de la mascarilla. Las mascarillas autofiltrantes se clasifican según su eficacia de filtración de partículas en FFP1, FFP2 y FFP3, siendo las FFP3 las de mayor eficacia de filtración de partículas. Es importante un ajuste adecuado a la cara para forzar al aire a entrar y salir por el material filtrante y que pueda ejercer su función de filtración de partículas. Si tiene válvula de exhalación, el aire exhalado sale al ambiente directamente sin filtrar, por lo que estas mascarillas no son adecuadas para pacientes sospechosos, posibles o confirmados de infección por coronavirus ya que no limitan su propagación.
Debido a la escasez de mascarillas autofiltrantes, se ha autorizado con excepcionalidad, mediante la Resolución de 23 de abril de 2020 de la Secretaria General de Industria6 la aceptación de EPI sin el marcado CE reglamentario en base a normas armonizadas, y por ello amplía el listado de normas consideradas como equivalentes a la europea. Por tanto, podemos encontrarnos ante mascarillas filtrantes sin marcado CE, solo para personal sanitario y sin entrar en canales habituales de distribución al público, con otros EPI con autorización temporal de comercialización cuando garanticen un nivel adecuado de salud y seguridad de conformidad con los requisitos esenciales establecidos en el Reglamento 2016/425, aunque los procedimientos de evaluación de la conformidad, incluida la colocación del marcado CE, no se hayan efectuado completamente según las normas armonizadas, así como EPIs con marcado CE en base a una especificación técnica distinta de las normas armonizadas.
Ante dudas sobre si la mascarilla está dentro de estos supuestos o si podría ser un producto falsificado que se ha podido introducir en el canal de suministro legal que puede no ofrecer un nivel de protección adecuado, se debe solicitar información adicional al fabricante o proveedor, como la Declaración UE de conformidad, la autorización excepcional emitida por la autoridad competente, o resultados de laboratorios acreditados sobre los ensayos realizados.
Es necesario saber el estándar que cumple para conocer los criterios de aceptación, y saber a qué tipo de mascarilla FFPx sería asimilable (Tabla 1). La documentación y certificados que acompañan a estos EPI se puede verificar siguiendo lo establecido en un documento publicado por el Centro Nacional de Medios de Protección del Instituto Nacional de Seguridad y Salud en el Trabajo7. Además, existen determinadas páginas webs de la Unión Europea que nos pueden ayudar, como la web de la European Safety Federation (https://eu-esf.org/covid-19) o la base de datos NANDO de la Comisión Europea para la consulta sobre el Organismo Notificado (https://ec.europa.eu/growth/tools-databases/nando/).
Duración de uso
Una de las dudas frecuentes es saber durante cuánto tiempo puedo utilizar las mascarillas, sobre todo ante la escasez de estas y el incremento de su precio. Esto va a depender del tipo de mascarilla, y actividad que se realice, entre otros aspectos.
Las mascarillas quirúrgicas son PS de un solo uso, no estando permitida su reutilización en la actual normativa nacional. Se deberían desechar al finalizar la actividad realizada, aunque el CDC de EE.UU. ha emitido recomendaciones para su posible reutilización en determinadas circunstancias8.
Algo parecido ocurre con las autofiltrantes, dónde la UNE-EN 149:2001 establece que podemos tener mascarillas reutilizables (R) o de uso durante un solo turno de trabajo (NR). Las NR están diseñadas para usarse y desecharse de un día para otro, indicándose en general un uso de unas 8 horas, aunque podrían usarse más o menos tiempo según la actividad que se esté realizando.
El ECDC, la OMS o el CDC de EE.UU. han emitido recomendaciones para su uso eficiente, uso prolongado y reutilización. Es importante que la dirección de los centros establezca instrucciones claras sobre cómo y cuándo se puede implementar estas prácticas para evitar la diseminación de la infección y proteger la salud de los trabajadores que atienden a pacientes con COVID-198.
En la tabla 2, se resume la protección que ofrecen los diferentes tipos de mascarillas.
Desinfección
Otra de las dudas frecuentes es saber si es posible la desinfección de las mascarillas para poder utilizarlas durante más tiempo. Para que esta práctica se realice con garantías y sin riesgos, es necesario saber que el proceso al que se va a someter a la mascarilla es efectivo para inactivar el virus, que no va a afectar a la mascarilla en lo que se refiere a su capacidad de filtración y/o ajuste a la cara, y además, que no dejará residuos nocivos para el usuario. Se han publicado varios estudios9 sobre diferentes métodos de desinfección y se ha visto que determinadas prácticas pueden afectar a la capacidad de filtración, como puede ser pulverizar soluciones alcohólicas o de hipoclorito de sodio. Otras como el calor seco a 70ºC o el uso de gas plasma o vapor de peróxido de hidrógeno parece que pueden ser de utilidad. Por ejemplo, la norma UNE-EN 149 ensaya las mascarillas tras pasar 24 horas a 70ºC, por lo que utilizar calor seco a 70ºC durante 30-60 minutos se entiende que no afectará a la capacidad de filtración, si bien, hay que ver si esto es suficiente para inactivar el virus10.
En conclusión, conocer los requisitos que debe cumplir cada mascarilla, así como la información del marcado y las excepciones autorizadas en la actual pandemia por el SARS-CoV-2 es esencial. Aquí, el farmacéutico de hospital, conocedor de productos sanitarios es uno de los profesionales que participa en resolver consultas para garantizar así su uso racional y óptimo.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Real Decreto 1591/2009, de 16 de octubre, por el que se regulan los productos sanitarios. (BOE núm. 268, de 6 de noviembre).
2. UNE-EN 14683:2019+AC:2019. Mascarillas quirúrgicas. Requisitos y métodos de ensayo.
3. Tipos de mascarillas quirúrgicas. Documento del Grupo de Productos Sanitarios de la SEFH. Disponible en: https://gruposdetrabajo.sefh.es/gps/images/ stories/documentos/Identificacion_mascarillas_GPS_quir.pdf.
4. Instrucciones para la gestión de solicitudes establecidas en la Orden SND/326/2020. Agencia Española de Medicamentos y Productos Sanitarios.
5. Reglamento (UE) 2016/425 del Parlamento Europeo y del Consejo, de 9 de marzo de 2016, relativo a los equipos de protección individual y por el que se deroga la Directiva 89/686/CEE del Consejo.
6. Resolución de 23 de abril de 2020, referente a los EPIs en el contexto de la crisis sanitaria ocasionada por el COVID-19. (BOE núm. 115, de 25 de abril).
7. Verificación de certificados/informes que acompañan a los EPI. Centro Nacional de Medios de Protección. Instituto Nacional de Seguridad y Salud en el Trabajo.
8. Uso óptimo de mascarillas filtrantes y quirúrgicas. Documento del Grupo de Productos Sanitarios de la SEFH. Disponible en: https://gruposdetrabajo.sefh. es/gps/images/stories/documentos/GPS_Uso_optimo_mascarillas.pdf.
9. Desinfección y re-esterilización de mascarillas. Disponible en: https://gruposdetrabajo.sefh.es/gps/images/stories/documentos/COVID-19_DESINFEC_MASCARILLAS.pdf.
10. Prevención de riesgos laborales vs. COVID-19. Compendio no exhaustivo de fuentes de información. Versión de 9 de abril de 2020. Instituto Nacional de Seguridad y Salud en el Trabajo.
____
