Fortes-González MS, Vazquez-Blanco S, Herrero-Poch L, De Miguel-Bouzas JC, Castro-Domínguez JM, Villamayor-Blanco L
Servicio de Farmacia Hospitalaria. Hospital Povisa. Vigo (España)
Fecha de recepción: 19/10/2020 – Fecha de aceptación: 24/11/2020
Correspondencia: María Susana Fortes-González – Hospital Povisa (Servicio de Farmacia) – C/Salamanca, 5 – 36211 Vigo (España)
susana.fortes.gzlez@gmail.com
____
RESUMEN
Objetivos: Los medicamentos de alto impacto económico (MAIE) constituyen un reto para los servicios de salud públicos de los países europeos. Sin embargo, no existe consenso sobre qué constituye un MAIE. El objetivo del estudio fue configurar una lista de MAIE dispensados por los servicios de farmacia hospitalarios y analizar la situación respecto a estos fármacos en España.
Métodos: Se consideraron MAIE aquellos fármacos con un coste >10.000 €/año (MAC) o con un elevado volumen de consumo (MEC). Se estimaron los precios (PVL) por dosis diaria definida o dosis diaria prescrita.
Resultados: Un total de 147 principios activos fueron considerados MAC, correspondiendo mayoritariamente con los grupos: L (69,4%), J (10,9%) y A (10,2%). El PVL medio diario de los MAC fue 218,6 € (28,6-2.892,5). El 38,8% de los MAC fueron innovadores, 26,5% huérfanos y 34,0% biológicos. Dieciséis medicamentos tuvieron un coste >10.000 €/envase. Los MEC pertenecieron principalmente al grupo L (45,0%) y J (35,0%). El PVL medio diario de los MEC fue 154,4 € (1,1-1.629,3). El 35,5% fueron innovadores, 5,0% huérfanos y 60,0% biológicos.
Conclusiones: Un elevado número de MAIE son dispensados por los servicios de farmacia hospitalarios, principalmente antineoplásicos y antiinfecciosos. Aunque el PVL mínimo diario para considerar un medicamento de alto impacto es 27,4 €, el PVL medio diario de los MAC fue >200 €. Sin embargo, el elevado consumo de algunos fármacos, hace que medicamentos con un coste tan bajo como 1,1 € puedan ser considerados MAIE. Se puede establecer una nueva categoría de MAC para aquellos con un coste >10.000 €/envase.
Palabras clave: Farmacoeconomía, política sanitaria, tecnología de alto coste, coste de los medicamentos.
Medicines with high economic impact in the hospital setting
SUMMARY
Objetivos: Los medicamentos de alto impacto económico (MAIE) constituyen un reto para los servicios de salud públicos de los países europeos. Sin embargo, no existe consenso sobre qué constituye un MAIE. El objetivo del estudio fue configurar una lista de MAIE dispensados por los servicios de farmacia hospitalarios y analizar la situación respecto a estos fármacos en España.
Métodos: Se consideraron MAIE aquellos fármacos con un coste >10.000 €/año (MAC) o con un elevado volumen de consumo (MEC). Se estimaron los precios (PVL) por dosis diaria definida o dosis diaria prescrita.
Resultados: Un total de 147 principios activos fueron considerados MAC, correspondiendo mayoritariamente con los grupos: L (69,4%), J (10,9%) y A (10,2%). El PVL medio diario de los MAC fue 218,6 € (28,6-2.892,5). El 38,8% de los MAC fueron innovadores, 26,5% huérfanos y 34,0% biológicos. Dieciséis medicamentos tuvieron un coste >10.000 €/envase. Los MEC pertenecieron principalmente al grupo L (45,0%) y J (35,0%). El PVL medio diario de los MEC fue 154,4 € (1,1-1.629,3). El 35,5% fueron innovadores, 5,0% huérfanos y 60,0% biológicos.
Conclusiones: Un elevado número de MAIE son dispensados por los servicios de farmacia hospitalarios, principalmente antineoplásicos y antiinfecciosos. Aunque el PVL mínimo diario para considerar un medicamento de alto impacto es 27,4 €, el PVL medio diario de los MAC fue >200 €. Sin embargo, el elevado consumo de algunos fármacos, hace que medicamentos con un coste tan bajo como 1,1 € puedan ser considerados MAIE. Se puede establecer una nueva categoría de MAC para aquellos con un coste >10.000 €/envase.
Key words: Economics, pharmaceutical, health policy, high cost, technology, drug costs.
____
INTRODUCCIÓN
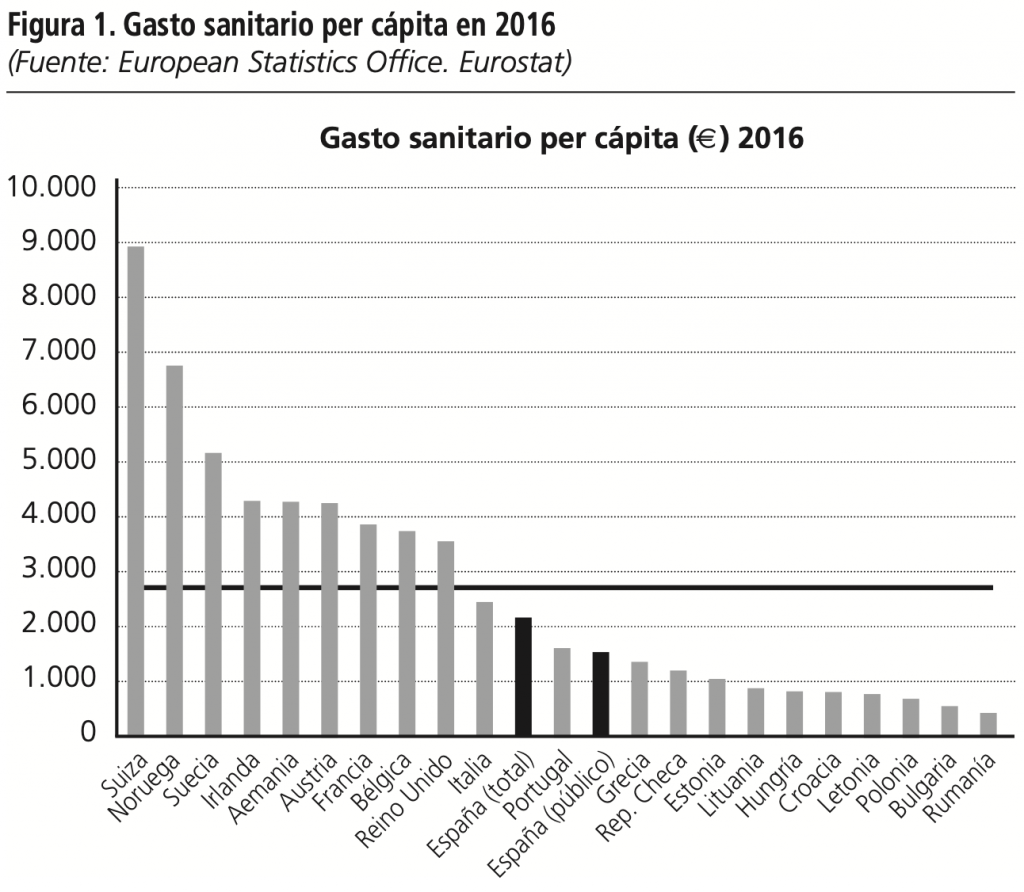
El gasto sanitario mundial ha aumentado considerablemente en los últimos años1. El gasto total del sistema sanitario español supone aproximadamente 105.000 millones de euros (74.000 millones financiados por el sector público y 31.000 millones por el sector privado), lo que corresponde al 9% de su PIB (6,4% gasto sanitario público y 2,6% privado)2. España se encuentra entre los países europeos con menor gasto per cápita, con una inversión en 2016 de 2.161 €/habitante (correspondiendo al sector público 1.530 €/habitante) muy por debajo de los 2.716 €/habitante que destina de media la Unión Europea3, tal como muestra la figura 1.
La prestación farmacéutica supone una gran parte del presupuesto destinado a Sanidad. Con la aparición de los nuevos tratamientos para la hepatitis C se volvió a poner de nuevo el foco en la asequibilidad de los medicamentos4,5. La amplia variación en el precio de los medicamentos entre los distintos países pone de manifiesto la falta de uniformidad en los criterios de asignación de precio6. En España, la financiación pública de medicamentos es selectiva y no indiscriminada. El Ministerio de Sanidad, Consumo y Bienestar Social (MSC) es el encargado de decidir la inclusión en la prestación farmacéutica del Sistema Nacional de Salud (SNS) y la Comisión Interministerial de Precios de Medicamentos y Productos Sanitarios (CIPM) la encargada de fijar los precios7. La Comisión Permanente de Farmacia del SNS publicó en 2013 un documento de consenso para la elaboración de informes de posicionamiento terapéutico (IPT) que debían sentar las bases para la financiación selectiva y fijación de precios de los medicamentos8.
El uso de tecnologías de alto impacto, entre ellos medicamentos innovadores, se ha identificado como uno de los mayores retos a los que se enfrentan los servicios de salud de la Unión Europea9,10. El concepto de medicamentos de alto impacto económico no ha sido definido claramente a nivel internacional11. El hecho de que el precio de un medicamento sea intrínsecamente elevado, no debería ser el único criterio para clasificarlo como de alto impacto, sino que también debería incluir otros factores como la demanda del producto. En Australia, por ejemplo, se incluyen en este término medicamentos con un modesto coste de adquisición pero que debido a su elevado volumen de consumo se convierten en fármacos de alto impacto económico11. La OMS introdujo el concepto premium-priced medicine para referirse a aquellos medicamentos cuyo coste de adquisición por un sistema de salud público es superior a 10.000 €/paciente en un año12.
En España tampoco se ha establecido una definición específica del término. Hasta la fecha, organismos como el MSC o la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), no han publicado ningún listado oficial de aquellos medicamentos considerados de alto impacto, ni se ha determinado un umbral económico a partir del cual un medicamento puede considerarse de alto coste.
El alto impacto económico también es abordado de diferentes formas dentro del territorio nacional. Las agencias evaluadoras de medicamentos no tienen entre sus funciones la selección de medicamentos, labor que tradicionalmente era llevada a cabo por las Comisiones de Farmacia y Terapéutica en el ámbito hospitalario. El hecho de que cada hospital valorase de forma propia la inclusión de un determinado medicamento en la Guía Farmacoterapéutica de cada hospital conducía a diferencias en la equidad del acceso a medicamentos en las diferentes áreas sanitarias. Por este motivo, surgieron diferentes iniciativas entre los distintos servicios de salud públicos españoles para tratar de garantizar la homogeneidad de criterios de utilización de medicamentos en todos los hospitales de la misma Comunidad Autónoma. Así, por ejemplo en Galicia surgió la Comisión Autonómica Central de Farmacia y Terapéutica (CACFT).
El objetivo del presente estudio es confeccionar una lista de aquellos medicamentos dispensados por los servicios de farmacia hospitalaria que podrían ser considerados de alto impacto económico, así como analizar la problemática de dichos medicamentos en España.
MÉTODOS
Para identificar aquellos medicamentos con elevado impacto económico fue necesario que cumplieran una de las siguientes condiciones: ser medicamentos de alto coste (MAC) o medicamentos de elevado consumo (MEC).
Los MAC se definieron de acuerdo al concepto de premium-priced medicines de la OMS, como aquellos con un precio de venta laboratorio (PVL) >10.000 €/año para un sistema público de salud12, es decir, con un coste >27,4 €/día. Debido a que numerosas presentaciones de medicamentos contienen la cantidad necesaria para 4 semanas de tratamiento, se realizó una búsqueda libre en el programa BotPlus 2.0 utilizando como criterio aquellos medicamentos autorizados y comercializados con PVL >760 €. Se excluyeron: medicamentos no financiados, de dispensación con receta, envases clínicos, medicamentos con indicación exclusivamente en pediatría, para tratamientos agudos, inmunoglobulinas específicas, antídotos y agentes diagnósticos o para el marcaje de moléculas. Tampoco se incluyeron los factores de la coagulación y la proteína C por su gran variabilidad para calcular las dosis diarias. Entre los fármacos comercializados a distintas dosis, se eligió aquella presentación cuya dosis fuese más similar a la pauta posológica recomendada como dosis de mantenimiento en ficha técnica. Para aquellos fármacos con genérico/biosimilar comercializado, en condiciones de igualdad de dosis y tamaño de envase, se seleccionó el medicamento de menor PVL. Finalmente, se comprobó el coste anual de cada tratamiento para eliminar aquellos cuyo importe anual fuese <10.000 €.
Los MEC se obtuvieron de los datos publicados por el informe del SNS de 2017 que contiene los 20 primeros principios activos de mayor consumo en importe de 2016 en la prestación farmacéutica hospitalaria. Se incluyeron todos los principios activos, independientemente de que cumplieran los criterios de inclusión y exclusión para considerarse MAC.
Las variables registradas fueron el nombre del medicamento, principio activo, descripción de la presentación, grupo terapéutico, condiciones de dispensación, PVL, grado de innovación terapéutica y la condición de medicamento huérfano. Se consideraron medicamentos claramente innovadores aquellos clasificados por el Center for Drug Evaluation and Research (CDER) de la Food and Drug Administration (FDA) como first in class, es decir, aquellos fármacos con un mecanismo de acción novedoso para tratar una determinada enfermedad. La designación de medicamento huérfano fue obtenida del registro de medicamentos huérfanos de la Unión Europea13.
Se calculó el coste por dosis diaria definida (DDD), entendiéndose como DDD la dosis de mantenimiento en la principal indicación del fármaco para una vía de administración determinada en adultos. Se emplearon las DDD establecidas por la OMS, que son publicadas en la web del WHO Collaborating Centre for Drug Statistics Methodology14. Para aquellos principios activos cuya DDD no ha sido asignada por la OMS, se estimó la dosis diaria prescrita (PDD) de acuerdo a la posología recomendada en la ficha técnica de cada medicamento. Para ello se tuvieron en cuenta las siguientes consideraciones: a) en aquellos medicamentos en los que se dosifica por peso, se consideró como peso medio de un adulto 70 kg, b) en medicamentos dosificados por superficie corporal (SC), se empleó una SC de 1,81 m2, calculada mediante la fórmula de Dubois para una talla 170 cm y un peso de 70 kg c) en aquellos fármacos con una dosis inicial distinta de la de mantenimiento, se tuvo en cuenta solo la dosis de mantenimiento, d) en el caso de medicamentos que se administran de forma intermitente, la dosis administrada se dividió entre el número de días de tratamiento para obtener la dosis diaria, e) la duración del tratamiento no se tuvo en cuenta, incluso cuando el fármaco se administraba por un tiempo limitado, como por ejemplo en el caso de los antibióticos.
RESULTADOS
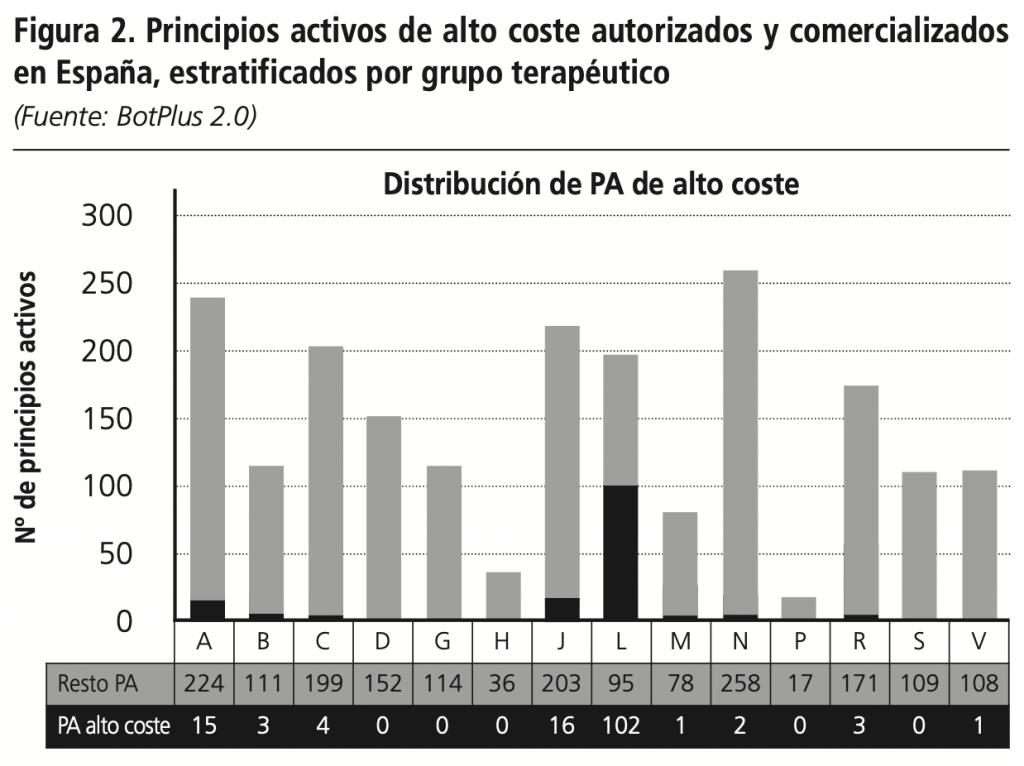
CCon fecha de 12/02/2019 se realizó la búsqueda en Botplus, que mostró un total de 479 medicamentos autorizados y comercializados con un PVL ≥760 €/envase. Tras la aplicación de los criterios de exclusión, finalmente se obtuvo una lista de medicamentos de alto coste, que incluía un total de 274 medicamentos y 147 principios activos, que suponen el 7,3% de los principios activos autorizados y comercializados en España. El Anexo I (ver en el PDF) contiene la lista detallada de los MAC, de los que el 53,3% de los medicamentos son de uso hospitalario (H) y 46,7% de dispensación hospitalaria sin cupón precinto (DIHSC). El 52,4% de estos medicamentos disponía de IPT. En cuanto a la distribución de los principios activos por código ATC, los más representados fueron los correspondientes al grupo L de antineoplásicos e inmunomoduladores (69,4%), J de antiinfecciosos sistémicos (10,9%) y A de tracto alimentario y metabolismo (10,2%). La figura 2 muestra la distribución de los principios activos de alto coste sobre el total de principios activos autorizados comercializados estratificado por grupo terapéutico.
El PVL medio de los MAC fue de 3.422,8 €/envase (768,3-70.000 €/envase). Un total de 16 medicamentos (5,8%) tenían un precio ≥10.000 €/envase, siendo los más caros Ivacaftor (18.000 €), Eliglustat (20.712 €) y Nusinersen (70.000 €). En cuanto al precio diario, el PVL medio de los MAC fue de 218,6 €/día (28,6-2.892,5). Un total de 15 medicamentos superaron el umbral de 500 €/día, de los que 5 tuvieron un coste >1.000 €/día: Velaglucerasa alfa (1.057,16 €/día), Imiglucerasa (1.110,24 €/día), Idursulfasa (2.240,73 €/día), Sebelipasa alfa (2.245,00 €/día) y Galsulfasa (2.892,48 €/día). El PVL medio anual de los MAC fue de 70.388,6 € (10.433,3-1.055.755,2), encontrándose 7 de ellos por encima de los 250.000 €/año: Eliglustat (269.995,71 €/año), Eculizumab (346.506,67 €/año), Velaglucerasa (385.861,58 €/año), Imiglucerasa (405.237,60 €/año), Idursulfasa (817.864,63 €/año), Sebelipasa alfa (819.425,00 €/año), Galsulfasa (1.055.755,20 €/año).
El 38,8% de los principios activos de alto coste se consideraron innovadores. El PVL medio de los medicamentos innovadores (first in class) fue de 4.000,2 €/envase frente a los 3.096,2 €/envase de los fármacos no innovadores. El 26,5% fueron designados como medicamentos huérfanos, con un PVL medio de 5.338,3 €/envase respecto al 2.862,6 €/envase de los no clasificados como huérfanos. El 34,0% de los principios activos eran biológicos. El PVL medio de los medicamentos biológicos fue de 2.094,2 €, mientras que el de las moléculas químicas fue de 4.105,5 €. El 78,5% de los MAC se comercializaron en la última década.
El Anexo II (ver en el PDF) contiene los MEC según el MSC, siendo el 77,2% H y el 22,8% DIHSC. Principalmente eran principios activos del grupo L (45%) y J (35%). El 35% de los principios activos tenían IPT. En cuanto a sus principales características, el 35% eran first in class, el 5% huérfanos y el 60% biológicos. El PVL medio de los MEC fue de 810,1 €/envase (6,1-15.667,7). Los 3 medicamentos (1,4%) con un precio ≥10.000 €/envase eran fármacos para el tratamiento de la hepatitis C. El PVL medio diario de los MEC fue de 154,4 €/día (1,1-1.629,3). El factor VIII de la coagulación superó el coste de 1.000 €/día. El PVL medio anual de estos tratamientos fue de 40.214,6 € (417,4-594.681,4). La distribución de PVL por envase por categorías fue la siguiente: 1.940,5 € para first in class versus 661,4 € no innovadores, 5.527,0 € medicamentos huérfanos versus 697,8 € no huérfanos, y 536,7 € para fármacos biológicos versus 2.216,2 € de las moléculas sintéticas.
DISCUSIÓN
El gasto que los hospitales destinan a medicamentos ha aumentado un 32% desde 2013, ascendiendo la factura hospitalaria a 6.985 millones € en 201615-18. Entre los motivos de este aumento se encuentra el desarrollo de la dispensación a pacientes externos. En 1982 se iniciaba la dispensación de medicamentos a pacientes hemofílicos desde los servicios de farmacia hospitalaria y desde entonces se han ido incluyendo de forma progresiva un elevado número de patologías que implican la dispensación de fármacos de elevado impacto económico y/o sanitario19.
No existe una definición cuantitativa del concepto de medicamentos de alto impacto, ya que no se ha establecido ningún importe de referencia para distinguir dichos medicamentos. En nuestro estudio hemos seleccionado el umbral de 10.000 €/año, de acuerdo al concepto de la OMS de premium-priced medicines, por tratarse de un organismo internacional de reconocido prestigio12. Por encima de este margen hemos encontrado un total de 147 principios activos autorizados y comercializados. La mayoría de los MAC eran antineoplásicos, antiinfecciosos y fármacos para el tracto alimentario. Se podría establecer una nueva categoría de medicamentos, ultra premium-priced medicines, para fármacos con un importe >10.000 €/envase. Este es el caso de algunos fármacos destinados al tratamiento de la hepatitis C, melanoma, amiloidosis transtiretina, atrofia muscular espinal, fibrosis quística, esclerosis múltiple y algunos déficits enzimáticos.
Por otro lado, coincidiendo con otros autores20, decidimos incluir medicamentos con gran repercusión en el gasto sanitario debido a su elevado consumo independientemente de su precio. Entre los MEC se encuentran fármacos para la hepatitis C, VIH y algunos tumores, que son algunas de las áreas donde mayor desarrollo y progreso se ha experimentado en los últimos años6,18. Algunos de estos fármacos han dispuesto recientemente de genérico o biosimilar, por lo que habrá que esperar para ver su impacto en el gasto hospitalario de los próximos años. Una limitación de nuestro estudio es que la lista de MEC se confeccionó a partir de los datos de consumo hospitalario de medicamentos publicados por el SNS, que incluye solo los 20 primeros principios activos de mayor gasto hospitalario. Sin embargo los consideramos representativos, ya que solo ellos suponen el 40% del gasto. El gasto anual en ombitasvir/paritaprevir/ritonavir en 2016 supuso 178 millones €, pero actualmente no se encuentra comercializado18.
Otra importante causa del incremento del gasto ha sido el aumento del precio de los medicamentos. El PVL medio de los fármacos de uso/dispensación hospitalaria ha pasado de 273,3 € en 2012 a 584,3 € en 201618. En España la fijación de precios debe tener en cuenta la utilidad terapéutica y el grado de innovación del medicamento, entre otros7.
En cuanto a la utilidad terapéutica, se podría considerar que los medicamentos huérfanos poseen un valor añadido, ya que están destinados al diagnóstico, prevención y tratamiento de enfermedades raras. El PVL de los medicamentos huérfanos fue aproximadamente el doble del resto de medicamentos. Por contra, el PVL medio de los fármacos biológicos fue aproximadamente la mitad del PVL de los fármacos convencionales, a pesar de que el desarrollo y proceso de fabricación de medicamentos biológicos es más complejo que el de los fármacos basados en compuestos químicos.
No hay consenso en cuanto a lo que constituye una innovación terapéutica. La originalidad de una molécula puede referirse al área terapéutica, vía de administración, efectividad, seguridad o calidad de vida12. En nuestro estudio hemos considerado medicamentos innovadores aquellos clasificados como first in class. Este subgrupo de medicamentos se ha comercializado a un precio aproximadamente un 25% superior al resto de medicamentos de alto impacto, lo que parece indicar que el grado de innovación es un factor que se ha tenido en cuenta para la asignación del precio. Otros autores han propuesto el término advance in class, para referirse a aquellos fármacos que pese a no ser los primeros de su clase, presentan una importante ventaja en eficacia o seguridad sobre los existentes21. A pesar de que hemos empleado un enfoque más conservador incluyendo en el término innovador solo a los principios activos first in class, se ha conseguido eliminar la subjetividad de definir qué supone una ventaja significativa de un fármaco respecto a otro existente.
Para nuestro conocimiento no se ha publicado ninguna lista de medicamentos de alto impacto en España, por lo que no podemos establecer comparaciones a nivel nacional. Hemos encontrado que más de la mitad de los principios activos de nuestro listado disponían de IPT, pero no se puede afirmar que todos los fármacos con IPT se consideren medicamentos de alto impacto por el MSC. Los IPT surgieron en 2013 como iniciativa para la elaboración de un documento único, reconocible para todo el SNS8. Sin embargo no han conseguido evitar la redundancia en la evaluación de medicamentos, ya que las Comunidades Autónomas (CCAA) han constituido diferentes comités evaluadores. Tampoco se ha encontrado ningún listado autonómico de medicamentos de alto impacto con el que comparar nuestros datos, entre otros motivos por la falta de acceso público a la mayoría de sus páginas web. Se ha podido acceder libremente a determinados documentos de Asturias, Murcia, Valencia y Galicia que declaran ciertos fármacos como de alto impacto, aunque desconocemos si se trata del 100% de medicamentos calificados como tal. Los principios activos de nuestro listado habían sido clasificados como de alto impacto por al menos una, dos o tres de estas CCAA en el 83,0%, 26,5% y 20,4% de los casos respectivamente. Hubo unanimidad en cuanto a afatinib, carfilzomib, crizotinib, daratumumab, everolimus, nintedanib, nivolumab, palbociclib, pembrolizumab, pertuzumab y pomalidomida22-25.
En conclusión, nuestra definición de medicamentos de alto impacto económico coincide con el concepto de premium-priced medicines de la OMS. Este estudio demuestra que desde los servicios de farmacia hospitalaria se dispensa un gran número de fármacos de alto impacto económico y/o sanitario, principalmente antineoplásicos y antiinfecciosos. Aunque el mínimo PVL diario para considerar un medicamento como de alto impacto fue 27,4 €, el PVL medio diario de los MAC fue superior a 200 €. Sin embargo, dado el elevado consumo de algunos medicamentos, fármacos con un coste tan bajo como 1,1 €/día pueden ser calificados como de alto impacto. Por otra parte, aquellos medicamentos con un PVL >10.000 €/envase podrían ser considerados como una nueva categoría de medicamentos denominada ultra-premium-priced medicines.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Gronde TV, Uyl-de Groot CA, Pieters T. Addressing the challenge of high-priced prescription drugs in the era of precision medicine: A systematic review of drug life cycles, therapeutic drug markets and regulatory frameworks. PLoS One. 2017;12(8):e0182613. doi:10.1371/journal.pone.0182613.
2. Portal Estadístico del SNS – Sanidad en datos [Base de datos en Internet]. Ministerio de Sanidad, Consumo y Bienestar Social. [citado 05 febrero 2019]. Disponible en: https://www.mscbs.gob.es/estadEstudios/sanidadDatos/home.htm.
3. Database – Eurostat [Base de datos en Internet]. European Commission. [citado 16 octubre 2020]. Disponible en: https://ec.europa.eu/eurostat/data/database.
4. Schaffer SK, Messner D, Mestre-Ferrandiz J, Tambor E, Towse A. Paying for Cures: Perspectives on Solutions to the “Affordability Issue.” Value Health. 2018;21(3):276-9. doi:10.1016/j.jval.2017.12.013.
5. Gornall J, Hoey A, Ozieranski P. A pill too hard to swallow: how the NHS is limiting access to high priced drugs. BMJ. 2016;354:i4117. doi:10.1136/bmj.i4117.
6. Fojo T, Lo AW. Price, value, and the cost of cancer drugs. Lancet Oncol. 2016;17(1):3-5. doi:10.1016/S1470-2045(15)00564-1.
7. BOE, número 178, de 27-07-06. Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios.
8. Agencia Española de Medicamentos y Productos Sanitarios, Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia, Comisión Permanente de Farmacia del Sistema Nacional de Salud. Propuesta de colaboración para la elaboración de los informes de posicionamiento terapéutico de los medicamentos. [Internet]. 2013. [citado 16 octubre 2020]. Disponible en: https://www. aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/propuesta-colaboracion-informes-posicionamiento-terapeutico.pdf.
9. Garattini S, Bertele’ V, Godman B, et al. Enhancing the rational use of new medicines across European health care systems. Eur J Clin Pharmacol. 2008;64(12):1137-8. doi:10.1007/s00228-008-0537-z.
10. Chambers JD, Thorat T, Pyo J, Chenoweth M, Neumann PJ. Despite High Costs, Specialty Drugs May Offer Value For Money Comparable To That Of Traditional Drugs. Health Aff (Millwood). 2014;33(10):1751-60. doi:10.1377/hlthaff.2014.0574.
11. Hasan SS, Lu CY, Babar Z-U-D. Access to High Cost Medicines: An Overview. En: Zaheer-Ud-Din Babar editors. Equitable Access to High Cost Pharmaceuticals. Academic Press; 2018. pp. 1-10.
12. World Health Organization. Access to new medicines in Europe: technical review of policy initiatives and opportunities for collaboration and research. [Internet]. Denmark: WHO Regional Office for Europe; 2015 [citado 16 octubre 2020]. Disponible en: https://www.euro.who.int/__data/assets/pdf_file/0008/306179/Access-new-medicines-TR-PIO-collaboration-research.pdf.
13. European Commission. Register of designated Orphan Medicinal Products (alphabetical). [citado 16 octubre 2020]. Disponible en: https://ec.europa.eu/health/documents/community-register/html/reg_od_act.htm?sort=a.
14. ATC/DDD Index. WHO Collaborating Centre for Drug Statistics Methodology; 2019. [citado 16 octubre 2020]. Disponible en: https://www.whocc.no/atc_ddd_index/.
15. Ministerio de Sanidad, Servicios Sociales e Igualdad. Informe anual del Sistema Nacional de Salud 2013 [Internet]. Ministerio de Sanidad, Consumo y Bienestar Social. 2014. [citado 16 octubre 2020]. Disponible en: https:// www.mscbs.gob.es/organizacion/sns/planCalidadSNS/pdf/equidad/Informeanual2013/Informe_2013_SNS_WEB.pdf.
16. Ministerio de Sanidad, Servicios Sociales e Igualdad. Informe anual del Sistema Nacional de Salud 2015 [Internet]. Ministerio de Sanidad, Consumo y Bienestar Social. 2016. [citado 16 octubre 2020]. Disponible en: https://www. mscbs.gob.es/estadEstudios/estadisticas/sisInfSanSNS/tablasEstadisticas/Inf_Anual_SNS_2015.1.pdf.
17. Ministerio de Sanidad, Servicios Sociales e Igualdad. Informe anual del Sistema Nacional de Salud 2016 [Internet]. Ministerio de Sanidad, Consumo y Bienestar Social. 2017. [citado 16 octubre 2020]. Disponible en: https://www. mscbs.gob.es/estadEstudios/estadisticas/sisInfSanSNS/tablasEstadisticas/InfAnualSNS2016/Informe_Anual_SNS_2016_completo.pdf.
18. Ministerio de Sanidad, Servicios Sociales e Igualdad. Prestación farmacéutica. En: Informe anual del Sistema Nacional de Salud 2017 [Internet]. Ministerio de Sanidad, Consumo y Bienestar Social. 2018. [citado 16 octubre 2020]. Disponible en: https://www.mscbs.gob.es/estadEstudios/estadisticas/sisInfSanSNS/tablasEstadisticas/InfAnualSNS2017/7_CAP_17.pdf.
19. Gómez-Domingo MR, Suñé-Arbussá JM. Dispensación ambulatoria en un hospital general de nivel terciario. Farm Hosp. 1996;20(5):289-94.
20. Vogler S, Zimmermann N, Babar Z-U-D. Price comparison of high-cost originator medicines in European countries. Expert Rev Pharmacoecon Outcomes Res. 2016;17(2):221-30. doi:10.1080/14737167.2016.1223543.
21. Lanthier M, Miller KL, Nardinelli C, Woodcock J. An Improved Approach To Measuring Drug Innovation Finds Steady Rates Of First-In-Class Pharmaceuticals, 1987-2011. Health Aff (Millwood). 2013;32(8):1433-9. doi:10.1377/hlthaff.2012.0541.
22. Astursalud. Comisión del Uso Racional de los Medicamentos y Productos Sanitarios (CURMP). [citado 16 octubre 2020]. Disponible en: https://www.astursalud.es/noticias/-/noticias/comision-del-uso-racional-de-los-medicamentos-y-productos-sanitarios-curmp-.
23. Consejería de Salud Región de Murcia. Murciasalud, el portal sanitario de la Región de Murcia. Comisión de Farmacia y Terapéutica de la Región de Murcia. [citado 16 octubre 2020]. Disponible en: http://www.murciasalud.es/pagina.php?id=285307&expand=1.
24. Conselleria de Sanitat Universal i Salut Pública. (PAISE) Programa de medicaments d’alt impacte sanitari i/o econòmic. [citado 16 octubre 2020]. Disponible en: http://www.san.gva.es/web/dgfps/-paise-programa-de-medicamentos-de-alto-impacto-sanitario-y/o-economico1.
25. Servicio Galego de Saúde. Comisión Autonómica Central de Farmacia y Terapéutica. [citado 21 diciembre 2020]. Disponible en: https://www.sergas.es/Asistencia-sanitaria/Comision-Autonomica-Central-de-Farmacia-e-Terapeutica.
____