Bolaños Rosales DM1, Xajil Ramos LY1,2, González Salazar LS3
1 Facultad de Química Biológica. Universidad Mariano Gálvez. Ciudad de Guatemala (Guatemala)
2 Unidad de Investigaciones en Farmacogenética y Farmacogenómica, Facultad de Ciencias Químicas y Farmacia, Universidad de San Carlos de Guatemala. Red Latinoamericana de Implementación y Validación de Guías Clínicas Farmacogenómicas (RELIVAF), CYTED 219RT0572 (Guatemala)
3 Servicio de Dermatología. Hospital Nacional San Juan de Dios de Santa Ana (El Salvador)
Fecha de recepción: 16/06/2021 – Fecha de aceptación: 28/06/2021
Correspondencia: Denisse Michell Bolaños Rosales – 3ave. 19-63 zona 3 01003 Guatemala
denisse.5656@gmail.com
____
Resumen
Objetivos: Identificar los medicamentos inductores a reacciones adversas cutáneas severas que se han reportado hasta el año 2020 en países de Iberoamérica, identificando los medicamentos inductores que se asocian a cada síndrome (SSJ, NET, DRESS y PEAG).
Métodos: Estudio retrospectivo, no experimental. Se realizó una revisión sistemática de la literatura médica relacionada a los medicamentos inductores de reacciones adversas cutáneas severas en Iberoamérica, expuesta en la base de datos PubMed, Scopus, Scielo y Google académico, limitando la búsqueda a artículos publicados en español y sin límites de tiempo. 27 de 574 publicaciones identificaron los medicamentos inductores a reacciones adversas cutáneas severas, excluyendo los casos de estas reacciones en las que no se especificó su asociación secundaria a medicamentos.
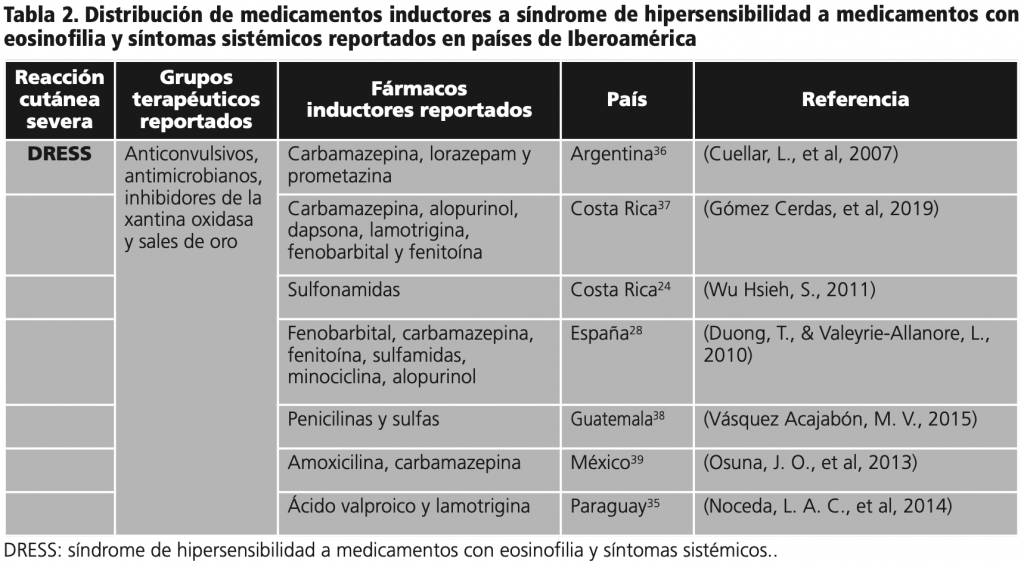
Resultados: Los hallazgos incluyeron reportes de los siguientes países: Argentina, Costa Rica, Guatemala, México, Paraguay, Ecuador, Perú y España. Entre los medicamentos inductores a reacciones adversas cutáneas severas reportados, se incluyeron aquellos pertenecientes a diversos grupos terapéuticos: anticonvulsivos, AINES, inhibidores de la xantina oxidasa, antimicrobianos, antirretrovirales, sales de oro y antagonistas de canales de calcio, todos ellos con un pronóstico entre grave y mortal.
Conclusiones: Se determinó que los medicamentos inductores a reacciones adversas cutáneas severas comprendieron una amplia variedad, pertenecientes a diversos grupos terapéuticos, siendo los más frecuentes: anticonvulsivantes, alopurinol y algunos antibióticos. No se observó una tendencia específica de algún medicamento por país o región.
Palabras clave: Síndrome de Stevens-Johnson, NET, DRESS, pustulosis exantemática aguda generalizada, toxicodermias.
Severe cutaneous adverse reactions drugs reported in Ibero-American countries
Summary
Aim: Identify induce severe skin reaction´s drugs that have been reported up to 2020 in Iberoamerican countries, recognizing the associated drugs with each syndrome (SSJ-NET, DRESS and AGEP).
Data selection and methodology: A retrospective, non-experimental study was performed based on a systematic review of the medical literature related to induce sever skin reation´s drugs available in the databases of PubMed, Scopus, Scielo and Google scholar. The search and data selection were limited on reviewed articles published in Spanish, with no time limit. 27 of 574 clinical cases identified the drugs that induce serious skin reactions, excluding the cases of patients with skin reactions that do not specify whether they are secondary to drugs.
Results: The findings included the report from the following countries: Argentina, Costa Rica, Guatemala, Mexico, Paraguay, Ecuador, Peru and Spain. The reported drugs that cause server skin reactions, belong to the following therapeutic groups: anticonvulsants, antibacterials, antiretrovirals, minocycline, lamotrigine, gold sales, beta-lactams, macrolides, quinolones, antifungals, calcium channel blockers, protease inhibitors, nonsteroidal anti-inflammatory drugs and acetaminophen; presenting pharmacological interactions, all of them between serious and fatal prognosis.
Conclusions: When comparing the findings, it was determined that the drugs that cause server skin reactions belong to many diverse therapeutic groups, being the more frequently: anticonvulsants, alopurinol and some antibiotics. No specific tendency was found related on a specific drug reported on the analyzed countries.
Key words: Stevens-Johnson syndrome, NET, DRESS, acute generalized exanthematous pustulosis, toxicoderma.
____
INTRODUCCIÓN
La OMS define una reacción adversa a medicamento como una respuesta nociva y no intencionada, que se produce a dosis normalmente utilizadas en seres humanos para profilaxis, diagnóstico o tratamiento de una enfermedad o para modificar una función fisiológica1. Entre su clasificación de la A – F, las reacciones de tipo B, establece que no son predecibles por el mecanismo de acción del fármaco y dependen de la susceptibilidad del paciente; estas reacciones pueden ser de causa inmunológica o no inmunológicas1.
Esta susceptibilidad individual de cada paciente determina tanto la severidad de las reacciones adversas (desde las leves y autolimitadas hasta las más severas) así como los órganos que se encuentren afectados (ya sea en forma individual o en un conjunto).
Hablando específicamente de la piel, las reacciones adversas cutáneas severas inducidas por medicamentos conforman un conjunto de enfermedades de la piel que se presentan posterior a la administración a determinados medicamentos, estas incluyen reacciones de necrosis de la epidermis, mucosas y anexos cutáneos con ocasional afección sistémica.
El desconocimiento y la baja incidencia poblacional de estas enfermedades hace que se consideren enfermedades muy raras y son poco estudiadas y reportadas. Es por esto que se considera importante identificar los medicamentos inductores a reacciones adversas cutáneas severas de los casos que se han reportado en Iberoamérica. El objetivo de este estudio es brindar una actualización a partir de una recopilación de datos para identificar los medicamentos que con mayor frecuencia causan estas reacciones que permitan relacionar los cuadros clínicos a los fármacos sospechosos.
DEFINICIÓN Y FISIOPATOLOGÍA
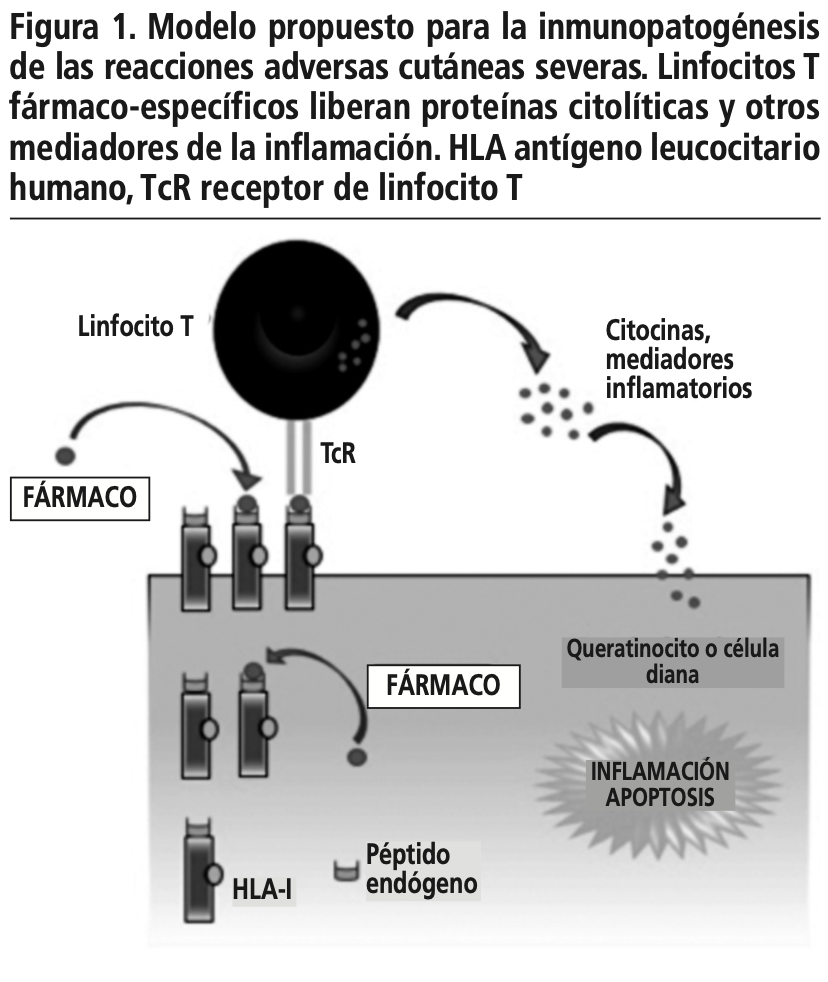
Las reacciones adversas cutáneas severas, por sus siglas en inglés (SCARs) son reacciones complejas donde las células del sistema inmune adaptativo (linfocito T) y otras células del sistema inmune innato (células natural killer, células linfoides innatas, monocitos, macrófagos y células dendríticas) participan en la patogenia de los cuadros clínicos. Además de esto, células propias de tejidos específicos como los queratinocitos de la piel pueden contribuir a la fisiopatogenia al secretar quimocinas u otros mediadores inflamatorios. Todo esto junto con los factores genéticos que se detallaran más adelante es responsable de las diferentes variedades clínicas de las reacciones severas cutáneas a drogas2. Específicamente las reacciones adversas cutáneas severas son reacciones tipo IV de hipersensibilidad tardía en la clasificación de Gell and Coombs3 en las cuales linfocitos T fármaco-específicos pueden identificarse en la sangre periférica o infiltrados cutáneos. La variación de las condiciones clínicas de las reacciones adversas cutáneas severas ha llevado a que estas reacciones de tipo IV sean subclasificadas de acuerdo con los diferentes patrones de producción de citocinas a cargo de los linfocitos T. Esto conlleva a distintos patrones de inflamación y daño tisular, que tienen como resultado los hallazgos físicos diversos que se observan en cada fenotipo clínico que presentan estas reacciones adversas cutáneas severas.
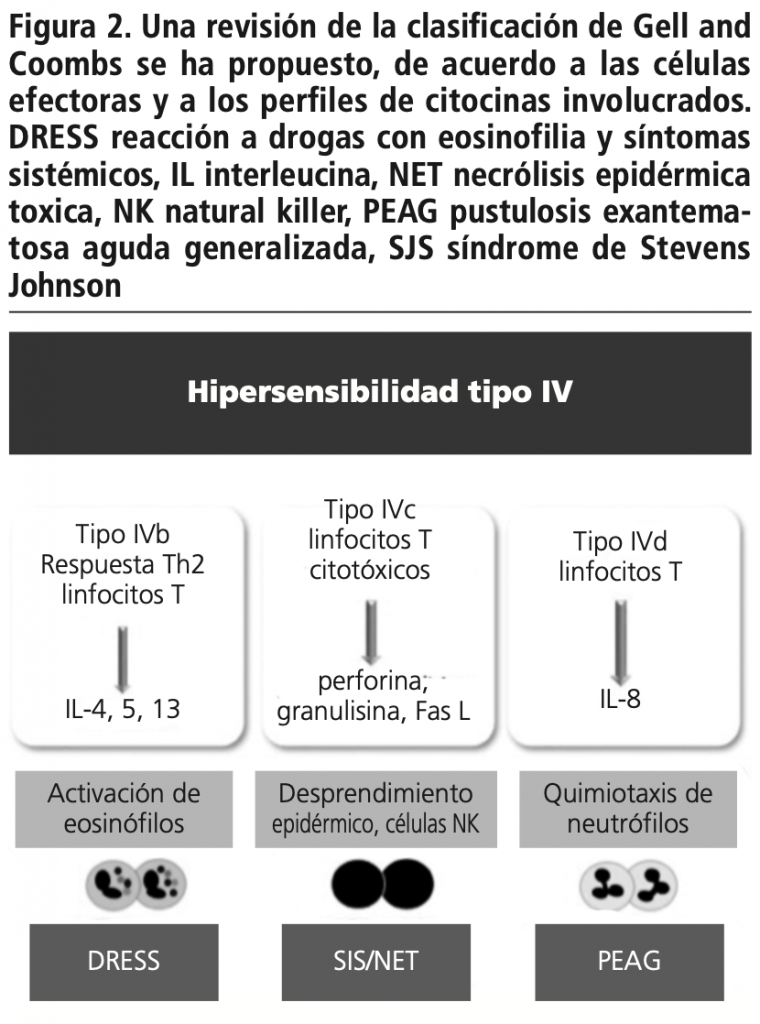
De esta forma las reacciones de hipersensibilidad tardía o tipo IV se subclasifican en: reacciones IVa con activación de linfocitos Th1 que conlleva a la participación de monocitos y liberación de interferón gamma (IFN-ϒ). Reacciones IVb con activación de linfocitos Th2, con producción de interleucina (IL) IL-4, IL-13 e IL-5 que conlleva a eosinofilia característica de las reacciones a drogas. Reacciones IVc donde los linfocitos citotóxicos son los agentes principales de daño tisular y por último reacciones IVd donde los linfocitos T por medio de la IL-8 promueven la quimiotaxis de neutrófilos.
Tradicionalmente se considera al síndrome de hipersensibilidad a medicamentos con eosinofilia y síntomas sistémicos (DRESS) una reacción IVb, el síndrome de Stevens Johnson/necrólisis epidérmica toxica (SSJ/NET) una reacción IVc y la pustulosis exantematosa aguda generalizada (PEAG) una reacción IVd. Aunque esta clasificación pueda ayudar a entender las reacciones adversas a drogas mediadas por los linfocitos T, en ocasiones hay síndromes con traslapes, además que estas reacciones no siempre son mutualmente excluyentes (figuras 1 y 2).
En la actualidad estas reacciones se basan en reportes de casos y en estudios retrospectivos, ya que existen pocos datos epidemiológicos de su prevalencia. Se estima que un 10-15% de los pacientes medicados desarrollan reacciones cutáneas severas inducidas por medicamentos, representan el 3,5% de las causas de ingreso en Europa, y en Estados Unidos se calculan 197.000 muertes anuales a causa de ellas4. En este conjunto de reacciones se encuentran: la necrólisis epidérmica tóxica (NET), el síndrome de Stevens Johnson (SSJ), el síndrome de hipersensibilidad a medicamentos con eosinofilia y síntomas sistémicos (DRESS) y la pustulosis exantemática aguda generalizada (PEAG).
PUSTULOSIS EXANTEMATOSA AGUDA GENERALIZADA
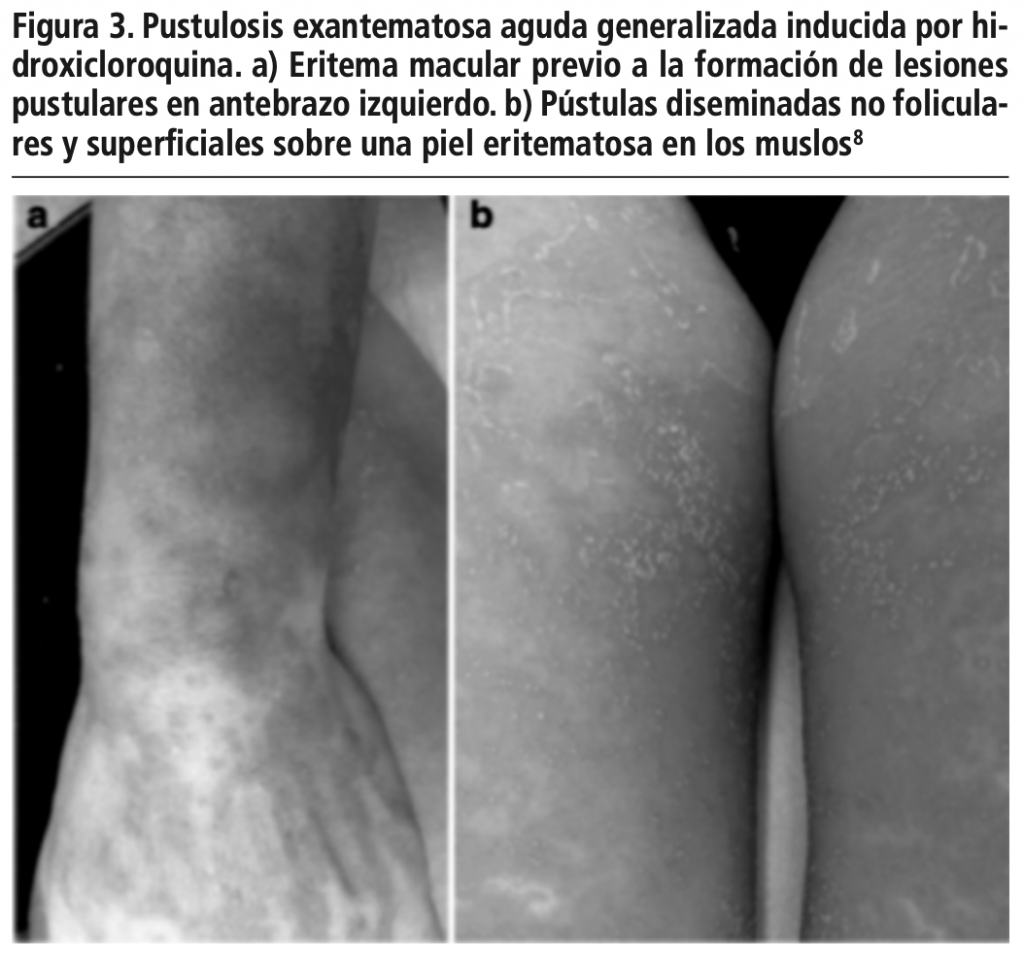
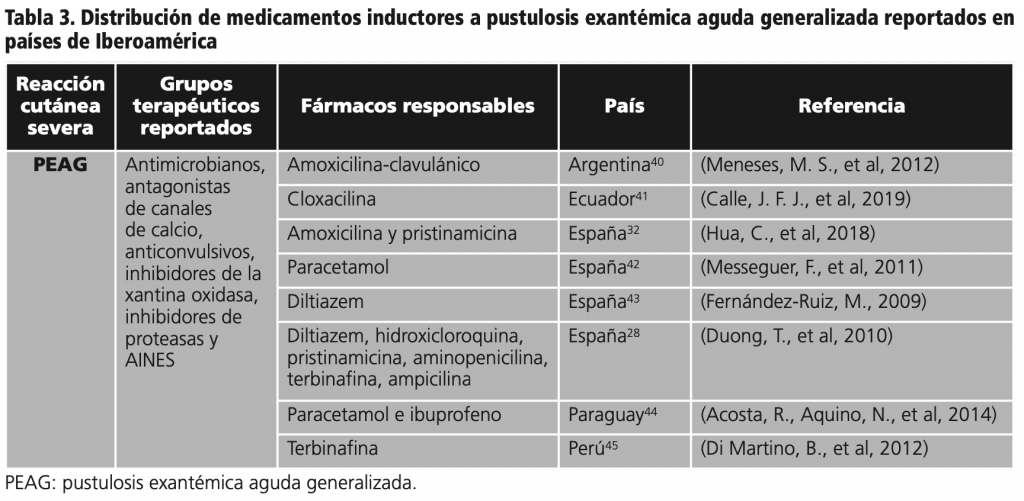
La pustulosis exantematosa aguda generalizada (PEAG o AGEP por sus siglas en inglés) se caracteriza por la aparición aguda de pústulas estériles de distribución no folicular en una base de piel eritematosa, acompañado de fiebre y neutrofilia5, de inicio rápido y resolución espontanea después de 2 semanas de la suspensión del medicamento, es de las reacciones adversas cutáneas severas menos frecuentes: menos de 10 casos por millón de habitantes por año6. De la misma manera presenta una mortalidad más baja que las otras reacciones que se estudian; el estudio internacional EuroSCAR estimó una tasa de mortalidad de aproximadamente 4%7 (figura 3).
REACCIÓN A DROGAS CON EOSINOFILIA Y SÍNTOMAS SISTÉMICOS (DRUG REACTION WITH EOSINOPHILIA AND SYSTEMIC SYMPTOMS, DRESS)
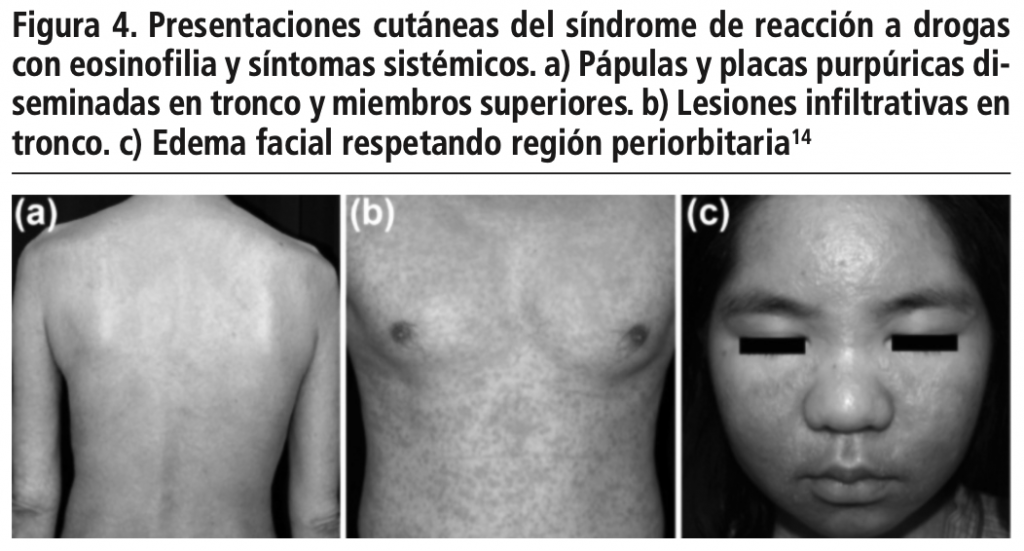
El DRESS se caracteriza por la tríada de: rash cutáneo polimorfo, alteraciones hematológicas como eosinofilia y linfocitosis atípica periférica, e involucro de órganos internos9. Se trata de una reacción adversa cutánea severa que puede tener un inicio tardío (hasta 8 semanas) no siendo raro que tenga una evolución prolongada con recaídas frecuentes. Si bien la participación del herpes virus 6 como parte de su etiología, se considera que el 80% de los casos de DRESS sean secundarios a fármacos10. La incidencia exacta es difícil de calcular debido a la presentación tan variable que este síndrome puede presentar, estudios japoneses describen la incidencia en 10 casos por millón por año11, sin embargo la frecuencia podría estar aumentando a medida que nuevas formas más leves de la enfermedad están en estudio12. Análisis retrospectivos han reportado como las principales causas de muerte la falla multiorgánica, shock séptico o cardiogénico con tasas de mortalidad de 5-10%13 (figura 4).
SÍNDROME DE STEVENS-JOHNSON/NECRÓLISIS EPIDÉRMICA TÓXICA (SSJ/NET)
Las manifestaciones típicas del SSJ/NET son característicamente el desprendimiento epidérmico simulando quemadura cutánea, esto se acompaña de daño de las mucosas, siendo la mucosa conjuntival y oral las más frecuentemente afectadas. Los órganos internos pueden estar afectados pero de menor manera que el DRESS15. Aunque la reacción a drogas es la causa etiológica más frecuente16, otros factores etiológicos son responsables del 15% de los casos. Casos idiopáticos de SSJ/NET son más comunes en los niños, y solo una pequeña facción están atribuidos a agentes infecciosos como Mycoplasma pneumoniae17. La incidencia es variable dependiendo de la población afectada: ha sido descrita en 1,53 a 1,89 casos por millón por año en Alemania7, siendo más elevada en descendientes asiáticos18. Como dato importante se describe una incidencia 100 veces mayor en pacientes VIH (+)19. Las tasas de mortalidad se relacionan directamente al porcentaje de superficie corporal afectado. El grupo de investigación de RegiSCAR, responsable de la documentación y de la creación de criterios diagnósticos de las reacciones adversas cutáneas severas, ha descrito frecuencias de 12%, 29% y 46% para el SSJ, traslape SSJ/NET y NET respectivamente20. En adición, los pacientes que sobreviven al síndrome SSJ/NET presentan riesgo aumentado de tener secuelas incluyendo cicatrices cutáneas, complicaciones pulmonares, genitourinarias y dentales y de mayor importancia y con frecuencia lesiones oculares residuales. La mayoría de estas secuelas tienen un impacto considerable en la calidad de vida del paciente, y vuelven al SSJ/NET una condición crónica21 (figura 5).
La incidencia aproximada de NET es de 0,4 a 1,2 casos por millón de personas al año y la del SSJ entre 1 a 6 casos por millón de personas al año22. Se desconoce la incidencia global del síndrome de DRESS, pero se calcula que aparece en 1/1.000 a 1/10.000 pacientes que toman anticonvulsivantes y/o sulfonamidas22. El síndrome de PEAG tiene una incidencia de 1 a 5 casos/millón al año23.
Se realizó un estudio retrospectivo, no experimental con el objetivo de identificar los medicamentos inductores a reacciones adversas cutáneas severas que se han reportado hasta el año 2020 en países de Iberoamérica, e identificar los medicamentos que se asocian por cada síndrome (SSJ-NET, DRESS and PEAG) a través de una revisión sistemática de la literatura médica relacionada y expuesta en la base de datos PubMed, Scopus, Scielo y Google académico, limitando la búsqueda a artículos publicados en español y sin límites de tiempo. Entre las limitaciones del estudio puede mencionarse la infra notificación de estas reacciones adversas, ya que no existen reportes de todos los países de esta región.
MÉTODOS
Se realizó un estudio retrospectivo, no experimental con el objetivo de identificar los medicamentos inductores a reacciones adversas cutáneas severas que se han reportado hasta el año 2020 en países de Iberoamérica, y su asociación por cada tipo de reacción adversa cutánea severa a drogas (SSJ-NET, DRESS and PEAG). Se realizó una revisión sistemática de la literatura médica relacionada a los medicamentos inductores de reacciones adversas cutáneas severas en Iberoamérica, expuesta en la base de datos PubMed, Scopus, Scielo y Google académico, limitando la búsqueda a artículos publicados en español y sin límites de fecha de publicación, utilizando los siguientes términos: toxicodermias severas, reacción grave medicamentosa por SSJ-NET, DRESS y PEAG. Se excluyeron los casos de reacciones adversas cutáneas severas en las que no se especificó asociación secundaria a medicamentos, publicaciones sin acceso a texto completo, de países no pertenecientes a Iberoamérica o realizadas en un idioma distinto al español. Los artículos se revisaron independientemente por los investigadores, incluyendo 27 de 574 publicaciones que identificaron los medicamentos inductores a reacciones cutáneas severas. Se incluyeron publicaciones originarias de Argentina, Costa Rica, Guatemala, México, Paraguay, Ecuador, Perú y España (figura 6).
RESULTADOS
Ver tablas 1, 2 y 3.

DISCUSIÓN
De 574 publicaciones identificadas, 27 cumplieron con los criterios de inclusión (figura 2), incluyendo publicaciones provenientes de Argentina (2), Costa Rica (3), Ecuador (2), España (8), Guatemala (4), México (4), Paraguay (3) y Perú (1).
En esta revisión se determinó que la etiopatogenia de las reacciones adversas cutáneas severas incluyó una amplia variedad de medicamentos en su mayoría pertenecientes a los grupos terapéuticos: anticonvulsivos, AINES, inhibidores de la xantina oxidasa, antimicrobianos, antirretrovirales, algunos en asociación farmacológica; todas ellas con un pronóstico entre grave y mortal.
En cuanto a la mortalidad por fármacos, datos recientes indican un aumento en la última década, las tasas de mortalidad por fármacos procedentes de dos metaanálisis indican una prevalencia entre 0,32-5% (IC 95%)46,47. Los datos existentes para la mortalidad debida a fármacos son aún imprecisos por lo que se requieren estudios más amplios y específicos sobre el tema dada su trascendencia en clínica.
De acuerdo con la revisión de medicamentos inductores del síndrome de Stevens-Johnson y necrólisis epidérmica tóxica destacaron los reportes de fenitoína, sulfas y alopurinol. El síndrome de Stevens-Johnson y la necrólisis epidérmica tóxica son clínicamente similares, los cambios afectan <10% de la superficie corporal en el SSJ y >30% en NET; cuando se ve compromiso del 15 al 30% de la superficie corporal, se clasifica como un traslape entre ambas entidades (SSJ-NET)48, por esta razón fueron analizados en la misma clasificación. Se encontró un reporte atribuido a drogas antineoplásicas únicamente en Guatemala. Los grupos de medicamentos asociados a las reacciones adversas cutáneas severas fueron similares en todos los países en los que se identificó la relación: agente causal-cuadro clínico. Es por eso que se encuentra una similitud en los fármacos relacionados a SJS/NET, DRESS y PEAG entre todos los países que se incluyeron en la investigación.
La gran variabilidad de medicamentos y grupos terapéuticos encontrados en la presente revisión no mostró ninguna tendencia por medicamento o país. Estudios de farmacogenética ha demostrado que existen grupos poblacionales en los que algunas variantes alélicas se expresan con mayor frecuencia que en otras y esto puede incidir de forma directa en la respuesta a los medicamentos cuando estas variantes están implicadas en procesos bioquímicos farmacocinéticos49.
En cuanto a las reacciones de hipersensibilidad asociadas a fármacos, es un claro y conocido ejemplo la relación existente entre la expresión de alelos del gen HLA y el desarrollo de algunas reacciones adversas cutáneas severas, tales como la variante HLA-B*1502 que se asocia al desarrollo de SJS o NET inducido por anticonvulsivantes (carbamazepina o fenitoína), HLA-B*5801 asociado al desarrollo de SJS o NET inducido por alopurinol y HLA-B*5701 asociado a reacción de hipersensibilidad por abacavir50. Existe además evidencia que este riesgo aumenta al existir más de un gen implicado, por ejemplo, el riesgo de desarrollar SJS o NET inducido por fenitoína aumenta en pacientes que son portadores de variantes alélicas de CYP2C9 y HLA-B*1502 a la vez51.
Este comportamiento se ha evidenciado en ciertos grupos poblacionales que pueden definirse como grupos vulnerables, al presentar mayor frecuencia de ciertas variantes alélicas asociadas a reacciones adversas a fármacos. Tal es el caso del alelo HLA-B*1502, que se ha reportado específicamente en ancestros chinos Han asiáticos y se ha atribuido a esto la explicación del alto riesgo de esta población a desarrollar SSJ/NET inducida por carbamazepina, comparado con población caucásica y japonesa. También se conoce el efecto protector que se asocia a la presencia de la variante HLA-B*0702 contra las reacciones adversas graves por carbamazepina específicamente en población caucásica50.
También es conocida la relación entre un menor riesgo asociado de padecer el síndrome de hipersensibilidad inducido por abacavir en personas de raza negra y con diagnóstico de VIH, en comparación con individuos caucásicos en las mismas condiciones, que demuestra diferencias étnicas en relación al gen HLA-B*570152.
El gen HLA-B es uno de los más estudiados en la implicación de su expresión en distintas variantes alélicas. La distribución de frecuencias poblacionales de estas variantes demuestra diferencias importantes. La variante HLA-B*15:02 se encuentra con mayor frecuencia en poblaciones de Asia del Este (6,88%), Asia del Sur y Central (4,64%) y Oceanía (5,37%), encontrándose en nula o muy baja frecuencia en poblaciones de África (0,00%), grupos afroamericanos (0,10%) y caucásicos (0,04%) y americanos (0,16%). La variante HLA-B*15:01 se encuentra con mayor frecuencia en poblaciones de Asia del Sur y Central (4,49%) y población caucásica (3,23%), encontrándose en baja frecuencia en poblaciones del Medio Oriente (1,70%), América (1,55%), Oceanía (1,11%) y África (0,79%)53.
Esto es importante, ya que permite identificar poblaciones en riesgo, y determinar posibles acciones de seguimiento y vigilancia de reacciones adversas a los medicamentos asociados. En este sentido, el desarrollo de la farmacogenética en la actualidad apunta no solo a determinar los genes asociados a estas reacciones, sino más bien a su aplicación en la práctica clínica al poder predecir la respuesta de un paciente a un medicamento en específico tanto en la eficacia como en la seguridad (medicina personalizada). Este es el caso del abacavir, para el cual la Administración de Medicamentos y Alimentos del gobierno de los Estados Unidos (FDA) y la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) han incluido en sus fichas técnicas la necesidad de realizar un screening farmacogenético previo al abordaje terapéutico y la aplicación de las pautas de dosificación de las sociedades profesionales, tales como el Consorcio de Implementación de Farmacogenética Clínica (CPIC)54. La farmacogenética también se ha constituido y considerado en la actualidad como una herramienta clínica en farmacovigilancia, recordando que uno de los objetivos de esta disciplina es la identificación de grupos de riesgo y la prevención de reacciones adversas55.
Debido a esto es importante el estudio de las relaciones genéticas en poblaciones, que a su vez permitan el desarrollo de nuevas prácticas que permitan prevenir y disminuir los efectos adversos a los medicamentos conociendo el comportamiento tanto poblacional, como individual, sin discriminar el hecho de tratarse de efectos poco frecuentes o conocidos. El coste que el abordaje de reacciones adversas graves puede representar a los sistemas de salud es considerable y, por lo tanto, el disminuirlos o evitarlos podría significar un beneficio económico en los mismos. Es necesario impulsar actividades de farmacovigilancia activa en los servicios de salud, que permitan disponer de información y datos poblacionales para determinar el comportamiento de estas y crear a futuro pautas de tratamiento propias de la región.
Es necesario mencionar que una cuestión importante e inherente a la recolección de reportes sobre reacciones cutáneas severas inducidas por medicamentos es su infra detección56. Se sabe que cuando se aplica una monitorización intensiva, en cualquiera de sus variantes, se obtiene un mayor número de reportes comparado a otros métodos de detección, por ejemplo, los casos de notificación voluntaria. Esto puede considerarse una limitación al presente estudio, ya que no se encontró información de estas reacciones en todos los países de la región. Además, debe considerarse que la no existencia de reportes no es indicativa de la ausencia de casos o de la existencia de casos atribuidos a otros medicamentos.
A pesar de ello, se considera que los resultados obtenidos representan un aporte importante al conocimiento de las reacciones cutáneas severas inducidas por medicamentos en Iberoamérica.
Las reacciones cutáneas severas inducidas por medicamentos (SSJ, NET, DRESS y PEAG) son un problema clínico que pasa frecuentemente inadvertido por el personal de salud ya que en algunas ocasiones no está familiarizado con ellas. Es importante socializar estos problemas, ya que representan un interés sanitario, económico y social creciente.
Agradecimientos: Esta investigación fue desarrollada en la Facultad de Química Biológica de la Universidad Mariano Gálvez de Guatemala y contó con el apoyo de la Decana Rebeca Méndez, Directora del Instituto de Investigaciones Químicas, Biológicas, Biomédicas y Biofísicas (I2QB3).
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Bolte, M. C. (2011). Reacciones medicamentosas severas en piel. Revista Médica Clínica Las Condes, 22(6),757-765.
2. Bellón, T. (2019). Mechanisms of Severe Cutaneous Adverse Reactions: Recent Advances. In Drug Safety. https://doi.org/10.1007/s40264-019-00825-2.
3. Coombs, R.R.A., Gell, P. G. H. (1968). Classification of allergic reactions responsible for drug hypersensitivity reactions. Clinical Aspects of Immunology.
4. Zambernardi A, Label M. (Zambernardi, 2018) Reacciones cutáneas adversas a medicamentos: cómo identificar el desencadenante. Actas Dermosifiliogr. https://doi.org/10.1016/j.ad.2018.02.017.
5. Sidoroff, A., Dunant, A., Viboud, C., Halevy, S., Bavinck, J. N. B., Naldi, L., Mockenhaupt, M., Fagot, J. P., & Roujeau, J. C. (2007). Risk factors for acute generalized exanthematous pustulosis (AGEP) – Results of a multinational case-control study (EuroSCAR). British Journal of Dermatology. https://doi.org/ 10.1111/j.1365-2133.2007.08156.x.
6. Roujeau, J. C., Haddad, C., Paulmann, M., & Mockenhaupt, M. (2014). Management of nonimmediate hypersensitivity reactions to drugs. In Immunology and Allergy Clinics of North America. https://doi.org/10.1016/j.iac.2014.04.012.
7. Mockenhaupt, M. (2012). Epidemiology of cutaneous adverse drug reactions. In Adverse Cutaneous Drug Eruptions. https://doi.org/10.1159/000335612.
8. Lerch, M., Mainetti, C., Terziroli Beretta-Piccoli, B., & Harr, T. (2018). Current Perspectives on Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis. In Clinical Reviews in Allergy and Immunology. https://doi.org/10.1007/s12016-017-8654-z.
9. Walsh, S., Diaz-Cano, S., Higgins, E., Morris-Jones, R., Bashir, S., Bernal, W., & Creamer, D. (2013). Drug reaction with eosinophilia and systemic symptoms: Is cutaneous phenotype a prognostic marker for outcome? A review of clinicopathological features of 27 cases. British Journal of Dermatology. https://doi. org/10.1111/bjd.12081.
10. Kardaun, S. H., Sekula, P., Valeyrie-Allanore, L., Liss, Y., Chu, C. Y., Creamer, D., Sidoroff, A., Naldi, L., Mockenhaupt, M., & Roujeau, J. C. (2013). Drug reaction with eosinophilia and systemic symptoms (DRESS): An original multisystem adverse drug reaction. Results from the prospective RegiSCAR study. British Journal of Dermatology. https://doi.org/10.1111/bjd.12501.
11. Shiohara, T., Kano, Y., Takahashi, R., Ishida, T., & Mizukawa, Y. (2012). Drug-induced hypersensitivity syndrome: Recent advances in the diagnosis, pathogenesis and management. Chemical Immunology and Allergy. https://doi. org/10.1159/000335624.
12. Ortonne, N. (2016). Is DRESS syndrome a single entity or within a spectrum of adverse reactions to drug? In British Journal of Dermatology. https://doi.org/ 10.1111/bjd.14986.
13. Chen, Y.-C., Chiu, H.-C., & Chu, C.-Y. (2010). Drug Reaction With Eosinophilia and Systemic Symptoms. Archives of Dermatology. https://doi.org/ 10.1001/archdermatol.2010.198.
14. Cho, Y. T., Yang, C. W., & Chu, C. Y. (2017). Drug reaction with eosinophilia and systemic symptoms (DRESS): An interplay among drugs, viruses, and immune system. International Journal of Molecular Sciences. https://doi.org/ 10.3390/ijms18061243.
15. Morel, E., Escamochero, S., Cabañas, R., Díaz, R., Fiandor, A., & Bellón, T. (2010). CD94/NKG2C is a killer effector molecule in patients with Stevens-Johnson syndrome and toxic epidermal necrolysis. Journal of Allergy and Clinical Immunology. https://doi.org/10.1016/j.jaci.2009.10.030.
16. Dodiuk-Gad, R. P., Chung, W. H., Valeyrie-Allanore, L., & Shear, N. H. (2015). Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis: An Update. In American Journal of Clinical Dermatology. https://doi.org/10.1007/s40257-015-0158-0.
17. Olson, D., Watkins, L. K. F., Demirjian, A., Lin, X., Robinson, C. C., Pretty, K., Benitez, A. J., Winchell, J. M., Diaz, M. H., Miller, L. A., Foo, T. A., Mason, M. D., Lauper, U. L., Kupfer, O., Kennedy, J., Glodé, M. P., Kutty, P. K., & Dominguez, S. R. (2015). Outbreak of mycoplasma pneumoniae-associated stevens-johnson syndrome. Pediatrics. https://doi.org/10.1542/peds.2015-0278.
18. Hsu, D. Y., Brieva, J., Silverberg, N. B., & Silverberg, J. I. (2016). Morbidity and Mortality of Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis in United States Adults. Journal of Investigative Dermatology. https://doi.org/ 10.1016/j.jid.2016.03.023.
19. Mittmann, N., Knowles, S. R., Koo, M., Shear, N. H., Rachlis, A., & Rourke, S. B. (2012). Incidence of Toxic Epidermal Necrolysis and Stevens-Johnson Syndrome in an HIV Cohort. American Journal of Clinical Dermatology. https://doi.org/ 10.2165/11593240-000000000-00000.
20. Sekula, P., Dunant, A., Mockenhaupt, M., Naldi, L., Bouwes Bavinck, J. N., Halevy, S., Kardaun, S., Sidoroff, A., Liss, Y., Schumacher, M., & Roujeau, J. C. (2013). Comprehensive survival analysis of a cohort of patients with Stevens-Johnson syndrome and toxic epidermal necrolysis. Journal of Investigative Dermatology. https://doi.org/10.1038/jid.2012.510.
21. Yang, C. W., Cho, Y. T., Chen, K. L., Chen, Y. C., Song, H. L., & Chu, C. Y. (2016). Long-term sequelae of stevens-johnson syndrome/toxic epidermal necrolysis. Acta Dermato-Venereologica. https://doi.org/10.2340/00015555-2295
22. Bolognia J, Jorizzo J, Rapini R. (2005) Dermatología. 1ª ed, Madrid, Elsevier, 2005:333-353.
23. Callen J. Jorizzo J, Bolognia J, Piette W, Zone J. (2011). Signos cutáneos de las enfermedades sistémicas. 4º edición, Barcelona, Elsevier, 2011:401-410.
24. Wu Hsieh, S. (2011). Síndrome de DRESS y Síndrome de Steven Johnson. Medicina Legal de Costa Rica, 28(1), 65-69.
25. Núñez, J. G. (2017). Síndrome de Stevens Johnson por consumo de Aines (Bachelor’s thesis, Universidad Técnica de Ambato-Facultad de Ciencias de la Salud-Carrera de Psicología Clínica).
26. Ordóñez Fernández, L. (2013). La notificación espontánea de casos de necrólisis epidérmica tóxica, síndrome de Stevens-Johnson y eritema multiforme asociada a medicamentos.
27. Posa Podean, D. (2016). Reacciones cutáneas graves asociadas a medicamentos: Análisis del registro PIELenRed.
28. Duong, T., & Valeyrie-Allanore, L. (2010). Toxidermias. EMC – Tratado de Medicina, 14(3),1-13. doi:10.1016/s1636-5410(10)70497-9.
29. Andrade, K. O. N. F., Erazo, E. M. A., & Garcia, T. E. E. Trimetoprim-sulfametoxazol: un caso de necrólisis epidérmica tóxica. Asociacion de medicina interna de Guatemala, 21.
30. Chang, P. (2010). Surcos de Beau. Reporte de 20 casos. Dermatología Cosmética, Médica y Quirúrgica, 8(4),236-240.
31. Rivas Ovalle, D. G. (2014). Comparación de la evolución clínica postoperatoria a la administración de dexketoprofeno, una hora pre y postoperatoriamente a la extracción quirúrgica de terceros de la Universidad de San Carlos de Guatemala (Doctoral dissertation, Universidad de San Carlos de Guatemala).
32. Hua, C., & Valeyrie-Allanore, L. (2018). Síndromes de Stevens-Johnson y de Lyell. EMC-Dermatología, 52(2),1-9.
33. Martínez Cabriales, S. A., Gómez Flores, M., & Ocampo Candiani, J. (2015). Actualidades en farmacodermias severas: síndrome de Stevens-Johnson (SSJ) y necrólisis epidérmica tóxica (NET). Gac Med Mex, 151(6),777-87.
34. Sánchez-Michaca, V. J., Sánchez-Torres, R., del Pilar Espinosa-Dzib, M., Jiménez-Urueta, P. S., & García-Galavis, J. L. (2009). Necrólisis epidérmica tóxica tratada con inmunoglobulina. Informe de un caso. Acta Pediátrica de México, 30(2),104-108.
35. Noceda, L. A. C., Morínigo, E. A., Vega, L. M., de Recalde, L. R., Morel, Z., & de Giménez, M. P. (2014). Síndrome DRESS y necrólisis epidérmica tóxica por el uso de lamotrigina: a propósito de dos casos. Pediatría (Asunción), 41(2), 131-138.
36. Cuellar, L., Sehtman, A., Del Sel, J. M., Allevato, M., & Cabrera, H. (2007). Síndrome DRESS desencadenado por psicofármacos. Act Terap Dermatol, 30, 304.
37. Cerdas, M. T. G., Morales, T. M. C., & Jiménez, O. U. (2019). DRESS syndrome: diagnostic and therapeutic approach. Revista Médica Sinergia, 4(06), 60-72.
38. Vásquez Acajabón, M. V. (2015). Farmacodermias en pacientes Hospitalizados (Doctoral dissertation, Universidad de San Carlos de Guatemala).
39. Osuna, J. O., Bahena, M. E. T., Herera, A. V., Cortés, E. R., & Cedillos, C. M. (2013). Reacción por drogas con eosinofilia: síndrome DRESS, un gran simulador. Dermatología cosmética, médica y quirúrgica, 11(2),142-147.
40. Meneses, M. S., Copparoni, C., Samper, A., Mendez, D., & Valdemoros, P. (2012). Pustulosis exántematica aguda generalizada: Presentación de un caso y revisión de la literatura. Revista argentina de dermatología, 93(1),00-00.
41. Calle, J. F. J., Gavilanez, N. M. J., Bohórquez, F. A. B., & Vergara, J. S. C. (2019). Lesiones de la piel en pacientes de la unidad de terapia intensiva. RECIMUNDO, 3(3 ESP), 498-512.
42. Messeguer, F., Agustí-Mejias, A., Requena, C., & Pérez-Ferriols, A. (2011). Claves diagnósticas de la pustulosis exantemática aguda generalizada. Piel, 26(1),7-11.
43. Fernández-Ruiz, M., López-Medrano, F., García-Ruiz, F., & Rodríguez-Peralto, J. (2009). Pustulosis exantemática aguda generalizada inducida por diltiazem: presentación de un caso y revisión de la literatura. ActasDermo-Sifiliográficas,100(8),725-727.
44. Acosta, R., Aquino, N., Rivelli, V., Gorostiaga, G., Celías, L., Mendoza, G., & Aldama, A. (2014). Pustulosis exantemática aguda generalizada. Presentación de dos casos pediátricos. Pediatría (Asunción), 41(1),45-49.
45. Di Martino, B., Riveros, R., Medina, R., Knopfelmacher, O., Rodríguez, M., & Bolla, L. (2012). Pustulosis exantemática aguda generalizada (PEAG): presentación de tres casos. Gac Dermatol, 7(1),19-23.
46. Eaton, L. (2002). Adverse reactions to drugs increase. BMJ: British Medical Journal: International Edition, 324(7328),8-8.
47. Puche Cañas, E., & Luna del Castillo, J. D. (2007). Reacciones adversas a medicamentos en pacientes que acudieron a un hospital general: un meta-análisis de resultados. In Anales de medicina interna (Vol. 24, No. 12, pp. 574-578). Arán Ediciones, SL.
48. Chaves, A. L., & Coto, J. F. N. (2013). Enfermedades dermatológicas que requieren un manejo similar a las quemaduras. Revista Clínica Escuela de Medicina UCR-HSJD, 3(1).
49. Ortega, V. E., & Meyers, D. A. (2014). Pharmacogenetics: Implications of race and ethnicity on defining genetic profiles for personalized medicine. In Journal of Allergy and Clinical Immunology. https://doi.org/10.1016/j.jaci. 2013.10.040.
50. Chung, W. H., & Hung, S. I. (2010). Genetic markers and danger signals in Stevens-Johnson syndrome and toxic epidermal necrolysis. Allergology International. https://doi.org/10.2332/allergolint.10-RAI-0261.
51. Caudle, K. E., Rettie, A. E., Whirl-Carrillo, M., Smith, L. H., Mintzer, S., Lee, M. T., Klein, T. E., & Callaghan, J. T. (2014). Clinical pharmacogenetics implementation consortium guidelines for CYP2C9 and HLA-B genotypes and phenytoin dosing. In Clinical Pharmacology and Therapeutics. https://doi.org/10.1038/clpt. 2014.159.
52. Chaponda, M., & Pirmohamed, M. (2011). Hypersensitivity reactions to HIV therapy. British Journal of Clinical Pharmacology. https://doi.org/10.1111/j. 1365-2125.2010.03784.x.
53. Clinical Pharmacogenetics Implementation Consortium. Clinical Pharmacogenetics Implementation Consortium (CPIC) Guidelines for HLA-B Genotype and Abacavir Dosing: 2014 Update. Supplemental Table S1. Frequencies of alleles in major racial/ethnic groups.
54. Dean, Laura. 2012. Abacavir Therapy and HLA-B*57:01 Genotype.
55. Bondon-Guitton, E., Despas, F., & Becquemont, L. (2016). The contribution of pharmacogenetics to pharmacovigilance. Therapie, 71(2),223-228. https:// doi.org/10.1016/j.therap.2016.02.004.
56. Belton, K. J., & European Pharmacovigilance Research Group. (1997). Attitude survey of adverse drug-reaction reporting by health care professionals across the European Union. European journal of clinical pharmacology, 52(6), 423-427.
____