Alañón Pardo MM1, Proy Vega B1, Roncero García-Escribano O2, Valenzuela Gámez JC1
1 Servicio de Farmacia
2 Servicio de Digestivo
Hospital General La Mancha-Centro. Alcázar de San Juan. Ciudad Real (España)
Fecha de recepción: 29/11/2019 – Fecha de aceptación: 19/12/2019
Correspondencia: María del Mar Alañón Pardo – Hospital General La Mancha-Centro (Servicio de Farmacia) – Avda. de la Constitución, 3 – 13600 Alcázar de San Juan, Ciudad Real (España)
malanonp@sescam.jccm.es
_____
RESUMEN
La monitorización farmacocinética de terapias biológicas dirigidas frente al factor de necrosis tumoral-a (TNF-a) ha sido recientemente introducida en nuestro centro hospitalario gracias a la iniciativa de nuestro equipo de enfermedad inflamatoria intestinal, formado por farmacéuticos, digestólogos y analistas clínicos, con la finalidad de optimizar la terapia en los pacientes que se mantienen en remisión clínica (monitorización “pro-activa”), o que presentan un fracaso terapéutico (monitorización “re-activa”).
Se presenta un caso clínico de una paciente diagnosticada de enfermedad de Crohn y en tratamiento combinado con metotrexato y adalimumab. En septiembre de 2018, adalimumab fue intensificado de forma empírica a dosis de 40 mg administrados semanalmente por la aparición de manifestaciones extradigestivas (artralgias y parestesias en miembros inferiores). En febrero de 2019, la paciente se mantenía en remisión clínica con respecto a los síntomas intestinales, pero continuaba con las manifestaciones extradigestivas y refería aftas orales recurrentes. Por este motivo, se monitorizaron los niveles séricos de adalimumab, los cuales superaron ampliamente el intervalo terapéutico recomendado (5-12 µg/ml). En este sentido, se describe el seguimiento multidisciplinar del caso clínico y el ajuste posológico realizado en base a predicciones bayesianas, principios farmacocinéticos y farmacodinámicos y la clínica de la paciente. La monitorización farmacocinética de los niveles supraterapéuticos de adalimumab fue una herramienta útil para la optimización de dosis de adalimumab y la valoración objetiva de reacciones adversas en esta paciente. Este caso se ha notificado al Sistema Español de Farmacovigilancia.
Palabras clave: Monitorización farmacocinética, adalimumab, enfermedad inflamatoria intestinal.
Pharmacokinetic monitoring of supratherapeutic adalimumab levels in patient with Crohn’s disease
SUMMARY
The pharmacokinetic monitoring of biological therapies against tumor necrosis-a (TNF-a) was recently introduced at our hospital thanks to the initiative of our inflammatory bowel disease team, composed of specialists in pharmacology, digestive system disease, and clinical analysis. The aim of the program was to optimize the therapy delivered to patients in clinical remission (pro-active monitoring) or clinical failure (reactive monitoring).
We report the case of a patient diagnosed with Crohn’s disease and under combined treatment with methotrexate and adalimumab. In September 2018, the dose of adalimumab was empirically increased to 40 mg/week due to the onset of extraintestinal manifestations (arthralgias and paraesthesias in lower limbs). In February 2019, the patient was in clinical remission with respect to the intestinal symptoms, but the extraintestinal manifestations persisted and the patient also reported anal aphthae. Consequently, serum adalimumab concentrations were monitored and found to widely exceed the recommended therapeutic interval (5-12 µg/ml). We report the multidisciplinary follow-up of the clinical case and the dosage adjustment based on Bayesian predictions, pharmacokinetic and pharmacodynamic principles, and the patient’s clinical situation. Pharmacokinetic monitoring of supratherapeutic adalimumab levels proved to be a useful tool to achieve the optimal dosage of this drug and to objectively evaluate the patient’s adverse reactions. The Spanish Pharmacosurveillance System has been notified of this case.
Key words: Therapeutic drug monitoring, adalimumab, chronic inflammatory diseases.
INTRODUCCIÓN
La monitorización farmacocinética de terapias biológicas en enfermedad inflamatoria intestinal (EII) ha sido implementada en nuestro centro hospitalario debido a la buena correlación entre los niveles séricos de los fármacos y la respuesta clínica, la variabilidad inter-individual farmacocinética/farmacodinámica (PK/PD) y la disponibilidad de la técnica analítica1-3.
Nuestro equipo de EII está formado por farmacéuticos, digestólogos y analistas clínicos, y contribuye en la individualización posológica según algoritmos terapéuticos, principios PK/PD y criterios clínicos.
Adalimumab es un anticuerpo monoclonal humano recombinante, considerado una alternativa a infliximab como terapia biológica de primera línea en EII moderada-grave según los protocolos establecidos en nuestro centro4. Sus niveles séricos recomendados en EII se sitúan entre 5 y 12 µg/mL1-3.
DESCRIPCIÓN DEL CASO
Mujer de 49 años, diagnosticada de enfermedad de Crohn ileal estenosante en 2015. Índice de masa corporal (IMC): 29,0 Kg/m2. La tabla 1 describe su historia farmacoterapéutica.
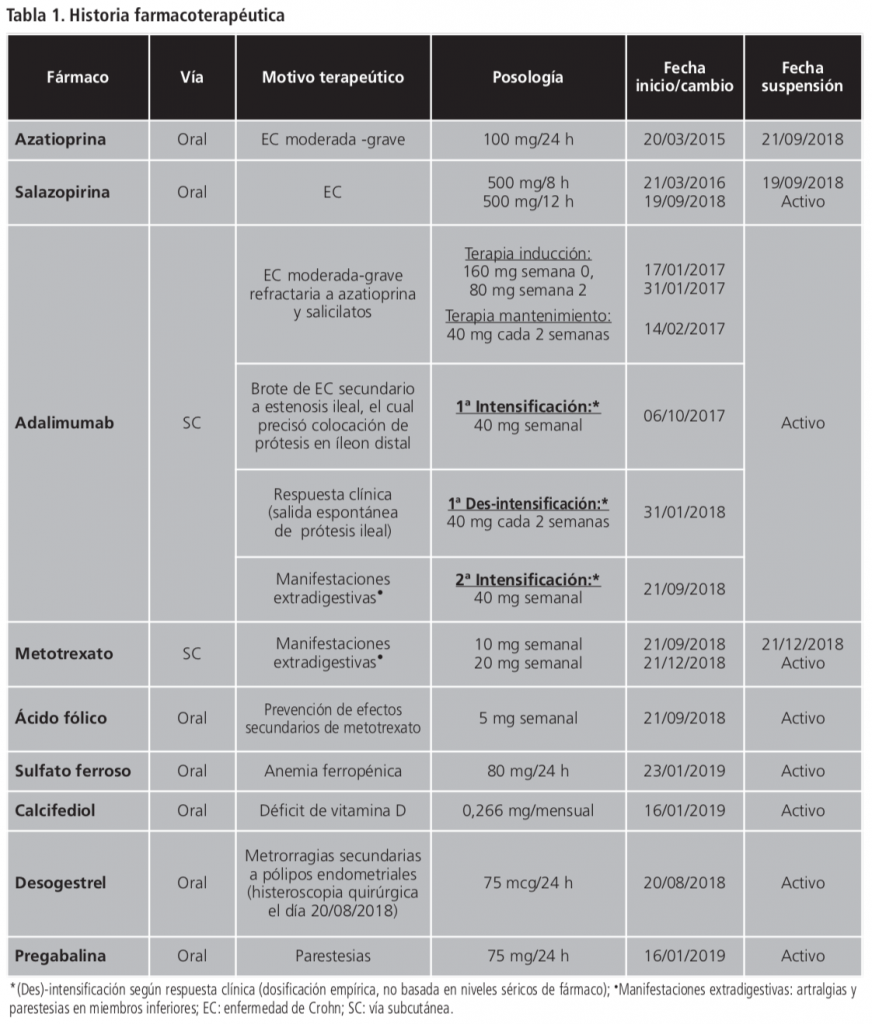
El 21/12/2018, su médico digestivo realizó una interconsulta al Servicio de Farmacia para la monitorización farmacocinética de adalimumab, intensificado de forma empírica en dosis de 40 mg administrados semanalmente debido a manifestaciones extradigestivas (artralgias y parestesias en miembros inferiores) desde septiembre de 2018. La paciente se mantenía en remisión clínica con respecto a los síntomas intestinales. Sin embargo, continuaba con parestesias y refería aftas orales recurrentes.
El 16/01/2019, la paciente fue valorada por Reumatología, prescribiendo pregabalina para el tratamiento de las parestesias. Las exploraciones complementarias descartaron enfermedad reumatológica concomitante.
En la Farmacia de Pacientes Externos, la paciente recibió información oral y escrita para la correcta extracción de niveles séricos valle (Cmin) de adalimumab. La adherencia fue estimada mediante: 1) “razón posesión de medicación (MPR), calculada como porcentaje de días cubiertos con medicación dispensada respecto al total de días con medicación prescrita; y 2) cuestionario Morisky-Green. La paciente fue considerada “adherente” (MPR ≥80% y contestó adecuadamente todas las preguntas del cuestionario).
El 01/02/2019 (día 0) se tomaron muestras de sangre y heces. Parámetros de laboratorio (valores de referencia): hemoglobina: 14,1 g/dL (12-16), leucocitos: 6,6 x103/µL (4,5-11), velocidad sedimentación glomerular: 12 mm/h (1-21), albúmina: 4,6 g/dL (3,5-5), proteína C reactiva: 0,1 mg/dL (0-0,5), calprotectina fecal (CPF) <30 µg/g (0-50). La Cmin de adalimumab fue 38,0 µg/mL, cuantificada en el Laboratorio de Análisis Clínicos mediante inmunocromatografía de flujo lateral (Quantum Blue®).
En la Unidad de Farmacocinética Clínica, el farmacéutico llevó a cabo la interpretación del nivel y estimación de parámetros farmacocinéticos (PK) mediante un modelo poblacional monocompartimental con absorción y eliminación de primer orden, implementado en el programa informático de ajuste bayesiano MW-Pharm++. El aclaramiento (CL) poblacional fue estimado con la siguiente ecuación5: Cl (L/h)=0,017 (L/h)*(CPF (µg/g)/273 (µg/g))^(0,06)*(IMC (Kg/m2)/24 Kg/m2)^(0,97)*4,8^AAF, donde AAF=0 ó 1 en ausencia o presencia de anticuerpos frente al fármaco (AAF), respectivamente. El resto de parámetros PK poblacionales se establecieron según bibliografía [constante de velocidad de absorción = 0,15 días-1, volumen de distribución (Vd)=4,07 L]4,6.
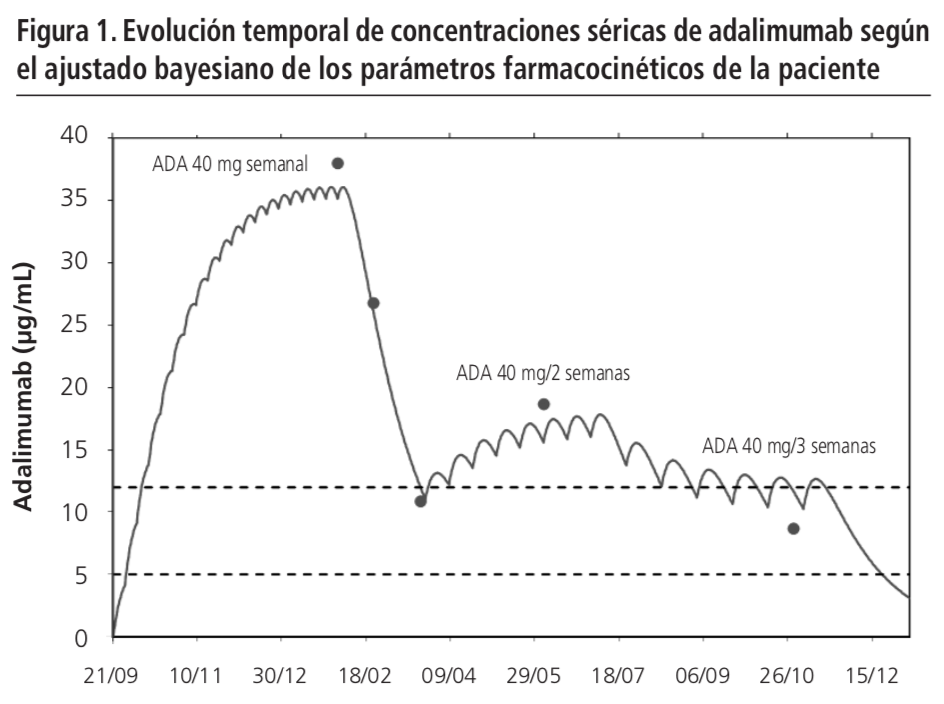
La figura 1 muestra la predicción bayesiana de niveles séricos de adalimumab frente al tiempo. La Cmin observada (38,0 µg/mL) superaba ampliamente el intervalo terapéutico (5-12 µg/mL) y no era acorde con la Cmin predicha poblacional (15,9 µg/mL). Por esto, se confirmó telefónicamente con la paciente la correcta extracción de la muestra. Asimismo, se realizó una segunda dilución de la muestra para descartar posible efecto matriz. Tras confirmar el nivel supraterapéutico y teniendo en cuenta la estimación de los parámetros PK individuales [Cl=0,0061 L/h, semivida=22,1 días], el farmacéutico recomendó suspender temporalmente adalimumab para favorecer su eliminación y repetir nuevo control en 3 semanas.
El 22/02/2019 (día +21), la Cmin de adalimumab fue 26,8 µg/mL (Cmin predicha individuaI ó iPRED=27,4 µg/mL). Tras estudiar su velocidad de eliminación, se recomendó mantener suspensión de adalimumab y repetir nuevo control en 4 semanas.
La Cmin extraída el 22/03/2019 (día +49) fue 10,9 µg/mL (iPRED=11,3 µg/mL), situándose dentro del intervalo terapéutico. Se recomendó reiniciar adalimumab espaciándolo a 40 mg cada 2 semanas (iPRED=16 µg/mL) ó cada 3 semanas (iPRED=10 µg/mL) según la clínica, y repetir nuevo control en 8-12 semanas.
Su médico decidió reiniciar adalimumab con la pauta bisemanal por la mayor experiencia con el espaciamiento de dosis progresivo. En la analítica de control del 03/06/2019, la Cmin fue 18,7 µg/mL. Por ello, se modificó la pauta a trisemanal.
En su última revisión médica, la paciente se mantenía en remisión clínica digestiva, habían desaparecido las manifestaciones extraintestinales. Según la Cmin extraída el 29/10/2019 (8,7 µg/mL), se decidió mantener la misma pauta (40 mg cada 3 semanas).
Según algoritmo de Naranjo7, las aftas orales, artralgias y parestesias fueron clasificadas como reacciones adversas (RA) “probables”. Este caso fue notificado al Sistema Español de Farmacovigilancia.
DISCUSIÓN
El farmacéutico clínico integrado en el equipo de EII aporta valor en el seguimiento farmacocinético de terapias biológicas. Entre sus aportaciones, destaca su información al paciente, explicándole los motivos de la monitorización y entregándole instrucciones para la correcta extracción de la muestra. También participa en la posible detección de falta de adherencia y sus causas. Estos aspectos son importantes a tener en cuenta para interpretar correctamente los niveles séricos del fármaco. Asimismo, el farmacéutico puede contribuir a la individualización posológica, aplicando principios PK/PD (modelo poblacional optimizado) y algoritmos terapéuticos.
En esta paciente, la monitorización farmacocinética de adalimumab tuvo doble finalidad: 1) optimizar terapia de mantenimiento (monitorización “pro-activa”) y, 2) valorar posibles RA (monitorización “re-activa”). Los niveles supraterapéuticos de adalimumab probablemente fueran debidos a la carga inflamatoria baja, el tratamiento concomitante con metotrexato y/o la ausencia de inmunogenicidad. Estos factores reducen el aclaramiento del fármaco y aumentan sus niveles séricos1-3. En nuestro centro, la determinación de AAF no fue posible debido a la sensibilidad al fármaco de la técnica analítica. La intensificación empírica por respuesta clínica puede inducir niveles supraterapéuticos de adalimumab y aumentar el riesgo de RA. Las manifestaciones neurológicas en pacientes expuestos a inhibidores del factor de necrosis tumoral han sido descritas en algunos estudios prospectivos, estimando una prevalencia del 4%8. Dichas manifestaciones incluyen desmielinización del sistema nervioso central y/o periférico, neuritis óptica, polineuropatía inflamatoria y esclerosis múltiple4,8-10.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Mitrev N, Vande Casteele N, Seow CH, Andrews JM, Connor SJ, Moore GT, et al. Review article: consensus statements on therapeutic drug monitoring of anti-tumour necrosis factor therapy in inflammatory bowel diseases. Aliment Pharmacol Ther. 2017,46:10371053. DOI:10.1111/apt.14368.
2. Khan A, Berahmana AB, Day AS, Barclay ML, Schultz M. New Zealand Society of Gastroenterology Guidelines on Therapeutic Drug Monitoring in Inflammatory Bowel Disease. N Z Med J. 2019;132:46-62.
3. Sanchez-Hernandez JG, Rebollo N, Muñoz F, Martín Suárez A, Calvo MV. Therapeutic drug monitoring of tumour necrosis factor inhibitors in the management of chronic inflammatory diseases. Ann Clin Biochem. 2019;56:28-41. DOI: 10.1177/0004563218782286.
4. European Medicines Agency. Ficha Técnica de Adalimumab (Humira®) [consultado 31/03/2019]. Disponible en: https://www.ema.europa.eu/en/documents/product-information/humira-epar-product-information_en.pdf.
5. Sánchez-Hernandez JG, Rebollo Díaz N, Sáez Fernández EM, Piñero Pérez MC, Pedraza Nieto I, Fernández Caballero R, et al. Influencia del índice de masa corporal en la dosificación de adalimumab en enfermedad inflamatoria intestinal. En: Sociedad Española de Farmacia Hospitalaria. Libro de comunicaciones. 63 Congreso Nacional de la Sociedad Española de Farmacia Hospitalaria. 2018. Disponible en: https://www.sefh.es/eventos/63congreso/img/libro-comunicaciones-63Congreso.pdf.
6. Berends SE, Strik AS, Van Selm JC, Lowenberg M, Ponsioen CY, D’Haens GR, et al. Explaining interpatient variability in adalimumab Pharmacokinetics in patients with Crohn’s Disease. Ther Drug Monit. 2018,40:202-211.
7. Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts EA, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther. 1981,30:239-245. DOI:10.1038/clpt.1981.154.
8. Kaltsonoudis E, Zikou AK, Voulgari PV, Konitsiotis S, Argyropoulou MI, Drosos AA. Neurological adverse events in patients receiving an anti-TNF therapy: a prospective imaging and electrophysiological study. Arhritis Res Ther. 2014. DOI:10.1186/ar4582.
9. Tejera-Segura B, Ferraz-Amaro I. Biological therapy and neurological manifestations. What do we know? Reumatol Clin. 2017;13:102-106. DOI:10.1016/ j.reuma.2016.04.012.
10. Kemanetzoglou E, Andreadou E. CNS Demyelination with TNF-ɑBlockers. Curr Neurol Neurosci Rep. 2017;17:36. DOI:10.1007/s11910-017-0742-1.
____
