Alañón Pardo MM1, Roncero García-Escribano O2, Bernardos Martín E2, Legaz Huidobro ML2, Moreno López MP2, Valenzuela Gámez JC1
1 Servicio de Farmacia
2 Servicio de Digestivo
Hospital General La Mancha – Centro (Alcázar de San Juan). Ciudad Real (España)
Fecha de recepción: 10/03/2020 – Fecha de aceptación: 30/03/2020
Correspondencia: María del Mar Alañón Pardo – Avenida de la Constitución, 3 – 13600 Alcázar de San Juan, Ciudad Real (España)
malanonp@sescam.jccm.es
____
RESUMEN
Objetivo: Analizar la actividad desarrollada por un equipo multidisciplinar formado por farmacéuticos, digestólogos y analistas clínicos para la monitorización farmacocinética (TDM) de terapias anti-TNFa en la enfermedad inflamatoria intestinal (EII).
Métodos: Estudio observacional prospectivo (enero–diciembre 2019) de las interconsultas de TDM de anti-TNFa (infliximab/adalimumab) en pacientes adultos con EII, solicitadas por digestólogos a la Unidad de Farmacocinética Clínica (UFC) del Servicio de Farmacia de un hospital general. Las concentraciones séricas (Cs) de anti-TNFa fueron cuantificadas en el Laboratorio de Análisis Clínicos mediante cromatografía de flujo lateral. Cuando las Cs fueron indetectables, se analizó la presencia de anticuerpos anti-fármaco (AAF).
La UFC realizó recomendaciones en base a la correcta interpretación de las Cs de anti-TNFa, algoritmos terapéuticos y modelos farmacocinéticos poblacionales implementados en el programa informático de ajuste bayesiano MW-Pharm++®.
Resultados: Se solicitaron interconsultas para 84 pacientes (81,0% enfermedad de Crohn, 8,3% AAF positivos) con infliximab (46,4%) ó adalimumab (53,6%). 64,3% recibía otros inmunomoduladores (IMM) concomitantes. 63 interconsultas (75,0%) se relacionaron con monitorización ‘pro-activa’ (optimizar tratamiento); el resto fueron ‘re-activas’ a fallo terapéutico. Se observaron Cs de anti-TNFa subterapéuticas en 36,9% de pacientes, terapéuticas en 39,3% y supraterapéuticas en 23,8%. Las Cs subterapéuticas/indetectables fueron significativamente (p≤0,004) más frecuentes en pacientes tratados con infliximab versus adalimumab (64,1% vs. 13,3%); y en ‘no-adherentes’ versus ‘sí-adherentes’ al IMM concomitante (85,7% vs. 25,5%).
Conclusiones: En estos pacientes, la TDM de anti-TNFa es frecuentemente ‘pro-activa’. Existe gran variabilidad en las Cs de anti-TNFa, explicada en parte por el fármaco anti-TNFa y la adherencia al IMM.
Palabras clave: Monitorización farmacocinética, infliximab, adalimumab, enfermedad inflamatoria intestinal.
Pharmacokinetic monitoring of biological therapies in inflammatory bowel disease
SUMMARY
Objective: To analyze the activity developed by a multidisciplinary team of pharmacists, digestive specialists and clinical analysts for the therapeutic drug monitoring (TDM) of anti-TNFa therapies in inflammatory bowel disease (IBD).
Methods: A prospective observational study (January-December 2019) was conducted of referrals from digestive specialists to the Clinical Pharmacokinetics Unit (CPU) of our general hospital for the TDM of anti-TNFa drugs (infliximab/adalimumab) in adults with IBD. Serum anti-TNFa concentrations were quantified in our Clinical Analysis Laboratory using lateral flow chromatography. When concentrations were undetectable, the presence of anti-drug antibodies (ADAs) was analyzed.
CPU recommendations were based on the correct interpretation of anti-TNFa concentrations, therapeutic algorithms, and populational pharmacokinetic models implemented using MW-Pharm++® software.
Results: Referrals were received for 84 patients (81.0% with Crohn’s disease, 8.3% with ADAs) treated with infliximab (46.4%) or adalimumab (53.6%); 64.3% were also treated with concomitant immunomodulators (IMMs). Sixty-three referrals (75.0%) were for proactive monitoring (treatment optimization) and the remainder for reactive monitoring after therapeutic failure. Anti-TNFa concentrations were subtherapeutic in 36.9% of patients, therapeutic in 39.3%, and supratherapeutic in 23.8%. Subtherapeutic/undetectable concentrations were significantly more frequent (p≤0.004) in patients treated with infliximab versus adalimumab (64.1% vs.. 13.3%) and in concomitant IMM non-adherents versus adherents (85.7% vs. 25.5%).
Conclusions: Anti-TNFa TDM is frequently proactive in patients with IBD. The wide variability in anti-TNFa concentrations is in part explained by the type of anti-TNFa drug and adherence to IMM.
Key words: Pharmacokinetic monitoring, infliximab, adalimumab, inflammatory bowel disease.
____
INTRODUCCIÓN
La terapia biológica dirigida frente al factor de necrosis tumoral alfa (anti-TNFa) ha supuesto un cambio importante en el manejo de enfermedades crónicas inmunomediadas, como la enfermedad inflamatoria intestinal (EII). Sin embargo, existe elevada variabilidad en la respuesta clínica: el 15-20% de pacientes no responde a la terapia de inducción (falta de respuesta primaria), y hasta el 60% pierde la respuesta inicial con el tiempo (pérdida de respuesta secundaria)1-4. La falta de respuesta puede deberse a una eliminación acelerada del fármaco (fallo farmacocinético), ó porque su mecanismo de acción no está dirigido a la principal diana terapéutica (fallo farmacodinámico).
Múltiples publicaciones científicas han puesto de manifiesto una correlación entre las concentraciones séricas de fármacos anti-TNFaɑy la respuesta terapéutica en pacientes con EII5-8. Asimismo, la dosificación basada en concentraciones séricas ha sido relacionada con mejores resultados terapéuticos frente a la dosificación empírica7,8.
Sin embargo, las concentraciones séricas de anti-TNFaɑ pueden afectarse por su elevada variabilidad farmacocinética interindividual. Debido a su naturaleza proteica, estas terapias biológicas pueden producir inmunogenicidad. La aparición de anticuerpos anti-fármaco (AAF) se ha relacionado con la formación de imununocomplejos que aceleran el aclaramiento plasmático de los fármacos, disminuyendo sus concentraciones séricas y su efecto terapéutico. Asimismo, los AAF denominados ‘neutralizantes’ bloquean el lugar de unión del fármaco al TNFa, reduciendo su actividad farmacológica. En cambio, el uso concomitante de fármacos inmunomoduladores (IMM) ha sido relacionado con menor formación de AAF9. Otros factores que pueden modificar la eliminación de los fármacos anti-TNFa en los pacientes son: el sexo, el índice de masa corporal (IMC), la carga inflamatoria o extensión y gravedad de la enfermedad, y la existencia de polimorfismos genéticos en el sistema retículo-endotelial implicado en el catabolismo de estos fármacos9,10. En este sentido, la introducción de modelos farmacocinéticos predictivos ayudaría a la correcta interpretación de concentraciones séricas y la individualización posológica.
La falta de adherencia terapéutica constituye un problema prioritario para la Organización Mundial de la Salud, debido a su elevada prevalencia en pacientes con enfermedades inmunomediadas crónicas y a su relación con un peor control de la enfermedad, un incremento de la morbimortalidad y un incremento del gasto sanitario11. Se ha reportado hasta un 15% de pacientes ‘no-adherentes’ con EII, principalmente para terapias biológicas subcutáneas debido al dolor de la inyección12. Otros autores han encontrado peor adherencia para los fármacos IMM concomitantes13.
La monitorización farmacocinética de terapias biológicas [therapeutic drug monitoring (TDM)] en pacientes con EII podría contribuir a la identificación temprana de fallos terapéuticos y su etiología, incluso antes de la manifestación de los síntomas clínicos. De esta manera, permitiría la optimización del tratamiento, especialmente importante en los pacientes con EII teniendo en cuenta las pocas alternativas terapéuticas cuando fracasan los anti-TNFa. Dado que las terapias biológicas suponen un alto impacto económico, la TDM facilitaría el desescalado terapéutico en aquellos pacientes con buena respuesta sostenida y concentraciones séricas elevadas, reduciendo además la exposición innecesaria al fármaco y la iatrogenia del tratamiento. Asimismo, la medición de concentraciones séricas de fármaco es un método directo para evaluar la adherencia11.
Dada la reciente introducción de la técnica analítica en nuestro centro hospitalario, el objetivo principal de este estudio fue analizar la actividad de TDM de terapias anti-TNFa (infliximab o adalimumab) en pacientes con EII, desarrollada por un equipo multidisciplinar formado por farmacéuticos, digestólogos y analistas clínicos. Los objetivos secundarios fueron analizar las concentraciones séricas basales de anti-TNFa y su implicación en la actitud terapéutica en los pacientes monitorizados.
MATERIAL Y MÉTODOS
Diseño, población y ámbito del estudio
Estudio observacional prospectivo (enero–diciembre 2019) de las interconsultas de los digestólogos solicitadas al Servicio de Farmacia para la TDM de terapias biológicas (infliximab o adalimumab) en pacientes adultos con EII desde su implantación en un hospital general universitario, con una población adscrita de 122.383 habitantes y perteneciente al Servicio de Salud de Castilla – La Mancha (España).
Circuito operativo
Se desarrolló un equipo multidisciplinar formado por farmacéuticos, digestólogos y analistas clínicos para definir el circuito de TDM y seleccionar las variables incluidas en la petición electrónica al Servicio de Farmacia (“fármaco anti-TNFa”, “IMM concomitantes”, “diagnóstico”, “motivo de petición”, “fecha última dosis”, “fecha extracción muestra”, “peso corporal”, “talla”,“observaciones”) y en la petición electrónica de pruebas de laboratorio al Servicio de Análisis Clínicos [hemograma, concentraciones séricas de anti-TNFa, albúmina, proteína C reactiva (PCR) y calprotectina fecal (CPF)].
El mismo día que el paciente acudía a las consultas externas de Aparato Digestivo, su médico le entregaba el volante del laboratorio, indicándole la fecha exacta de la extracción.
En las áreas de dispensación a pacientes externos y ambulantes, el farmacéutico entregaba al paciente información oral y escrita para la correcta extracción de concentraciones séricas valle (Cmin) de los fármacos anti-TNFa: el mismo día de la siguiente administración del fármaco, antes de su infusión intravenosa en el Hospital de Día (infliximab) ó antes de su inyección subcutánea (adalimumab). Asimismo, la adherencia fue evaluada mediante dos métodos indirectos: 1) cálculo a partir de registros electrónicos de dispensación de la “razón posesión de medicación” (MPR), definida como porcentaje de días cubiertos con medicación dispensada respecto al total de días con medicación prescrita; y 2) cuestionario de Morisky-Green. Los pacientes fueron considerados ‘adherentes’ a los anti-TNFa y/o IMM concomitantes cuando el MPR calculado fue ≥80% y respondieron adecuadamente a todas las preguntas del cuestionario.
Las concentraciones séricas de anti-TNFa fueron cuantificadas en el Laboratorio de Análisis Clínicos del hospital mediante inmunocromatografía de flujo lateral en formato monotest (Quantum Blue®). La presencia o ausencia de AAF solamente fue determinada en caso de concentraciones indetectables de infliximab (<0,4 µg/mL) o adalimumab (<1,3 µg/mL) debido a la sensibilidad al fármaco de la técnica analítica (“drug-sensitive”). Esta determinación fue realizada en un laboratorio externo, mediante enzimoinmunoensayo tipo sándwich: Matriks Biotek® (anticuerpos anti-infliximab) y Theradiag® (anticuerpos anti-adalimumab).
En la Unidad de Farmacocinética Clínica (UFC), el farmacéutico llevó a cabo la interpretación de la concentración sérica del fármaco y recomendaciones farmacocinéticas en base a la estimación de parámetros farmacocinéticos y modelos poblacionales optimizados14-17, implementados en el programa informático de ajuste bayesiano MW-Pharm++.
Las decisiones terapéuticas fueron tomadas en base a un algoritmo (Figura 1)9,18-21, considerando las concentraciones séricas del fármaco, inmunogenicidad y actividad de la EII, así como las recomendaciones farmacocinéticas y gráficas de predicción bayesiana registradas en la historia clínica electrónica.
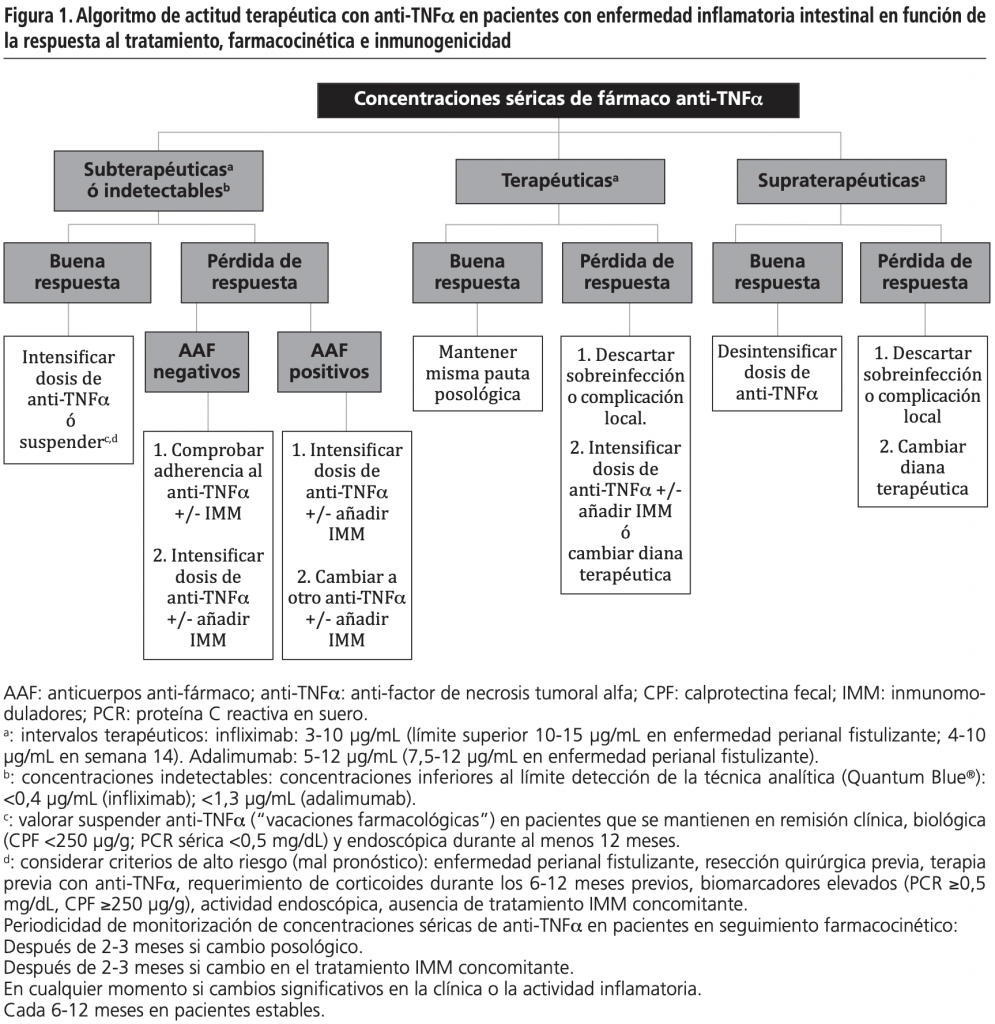
Variables
Para cada paciente, se registraron variables sociodemográficas [sexo (varón/mujer), edad], antropométricas (IMC), descriptivas de la enfermedad [tipo EII (enfermedad de Crohn/colitis ulcerosa), afectación perianal fistulizante (sí/no), manifestaciones extradigestivas (sí/no)], parámetros analíticos de actividad [albúmina, PCR, velocidad de sedimentación glomerular (VSG) en suero y calprotectina en heces], farmacológicas [fármaco anti-TNFa (infliximab/adalimumab, original ó biosimilar) y pauta posológica actual, fase de tratamiento (inducción/mantenimiento), IMM (azatioprina, 6-mercaptopurina, metotrexato) y corticoides concomitantes, terapia previa con anti-TNFa (sí/no), adherencia, efectos adversos], farmacocinéticas [concentración sérica de anti-TNFa, imunogenicidad (presencia o ausencia de AAF en suero), aclaramiento plasmático (Cl), volumen de distribución (Vd) y vida media (t1/2) del fármaco anti-TNFa], motivos de interconsulta [TDM ‘proactiva’ (control de inducción/mantenimiento) y ‘reactiva’ [falta de respuesta primaria, pérdida de respuesta secundaria ó efectos adversos)] y decisión terapéutica tomada.
Análisis estadístico
Para el análisis descriptivo, las variables cuantitativas se expresaron en medidas de tendencia central y dispersión y las cualitativas, en frecuencias absolutas y relativas.
Para el análisis bivariante, se utilizó el test X2 de Pearson para comparar proporciones entre grupos ó el test exacto de Fisher en los casos de tablas 2×2 en las que el porcentaje de frecuencias esperadas menores de 5 fue superior al 20%. Para analizar las diferencias entre los valores medios entre dos grupos independientes, se aplicó el test “t” de Student; o bien, U de Mann-Whitney cuando no se cumplía la hipótesis de normalidad. El nivel de significación estadística fue p<0,05. El software utilizado fue IBM-SPSS Statistics v.19.
RESULTADOS
Desde su implantación, se han solicitado interconsultas de TDM para 84 pacientes (71,4% varones, edad media: 45,7±16,4 años, IMC: 26,5±6,6 Kg/m2) diagnosticados de enfermedad de Crohn (81,0%) ó colitis ulcerosa (19,0%) y en tratamiento con infliximab (46,4%) ó adalimumab (53,6%) (Tabla 1). La mayoría (60,7%) de fármacos anti-TNFa estaban dosificados según su ficha técnica. La utilización de biosimilares fue significativamente más frecuente (p<0,001) en los pacientes tratados con infliximab (84,6%) que en los pacientes tratados con adalimumab (13,3%). El 64,3% de pacientes tenía prescrito IMM concomitantes (principalmente, tiopurinas) y el 13,1%, corticoides. El 92,9% de pacientes fue adherente al anti-TNFa y el 87,0%, al IMM concomitante.

La monitorización fue ‘re-activa’ en 21 interconsultas (25,0%): falta de respuesta primaria (19,0%), pérdida de respuesta secundaria (71,4%) y efectos adversos (9,5%). 63 interconsultas (75,0%) se relacionaron con monitorización ‘pro-activa’: control de inducción (11,1%) y terapia mantenimiento (88,9%).
Las concentraciones séricas basales de anti-TNFa, inmunogenicidad y parámetros farmacocinéticos individuales se analizaron en la tabla 2. Se encontraron concentraciones terapéuticas de anti-TNFa en el 39,3% de pacientes.
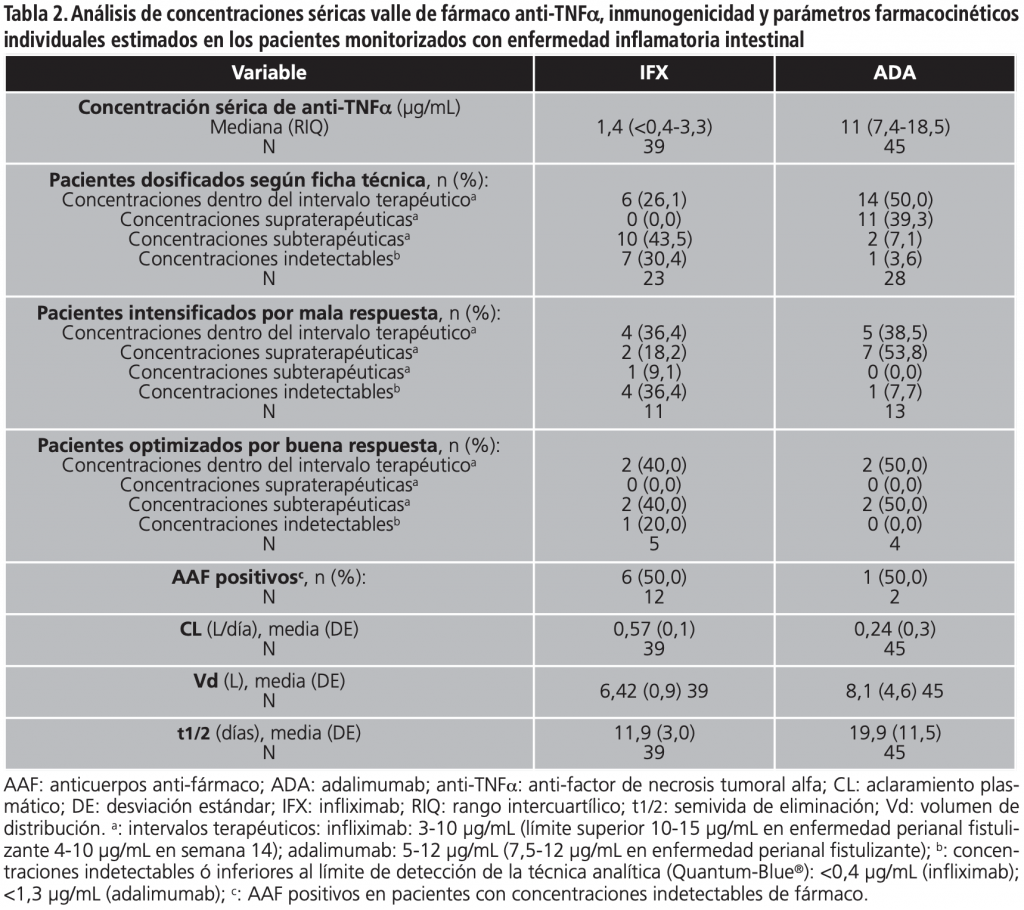
Entre los pacientes dosificados según ficha técnica, la mayoría de pacientes con infliximab presentó concentraciones subterapéuticas (43,5%) ó indetectables (30,4%). Por el contrario, la mayoría de pacientes con adalimumab presentó concentraciones terapéuticas (50,0%) ó supraterapéuticas (39,3%).
La tabla 3 compara las variables descriptivas en función de las concentraciones subterapéuticas ó indetectables de fármaco anti-TNFa. Las concentraciones subterapéuticas ó indetectables fueron significativamente (p≤0,004) más frecuentes en los pacientes en tratamiento con infliximab versus los pacientes que recibían adalimumab (64,1% vs. 13,3%); y en los ‘no-adherentes’ versus ‘sí-adherentes’ al IMM concomitante (85,7% vs. 25,5%). No se encontraron diferencias estadísticamente significativas en cuanto a la frecuencia de concentraciones subterapéuticas ó indetectables de fármaco original versus biosimilar para infliximab (66,7% vs. 62,5%, p=0,615), ni tampoco para adalimumab (10,3% vs. 33,3%, p=0,175).

Los AAF fueron positivos en la mitad de los pacientes con concentraciones indetectables de fármaco (n=14). Debido al reducido número de pacientes, no fue posible valorar su asociación con las distintas variables del estudio. Sin embargo, cabe destacar que la mayoría de pacientes con AAF positivos se caracterizaron por recibir terapia combinada con infliximab y otros IMM (71,4%), siendo baja la adherencia al IMM concomitante (60,0%); y además presentaron un IMC >30 Kg/m2 (57,1%).
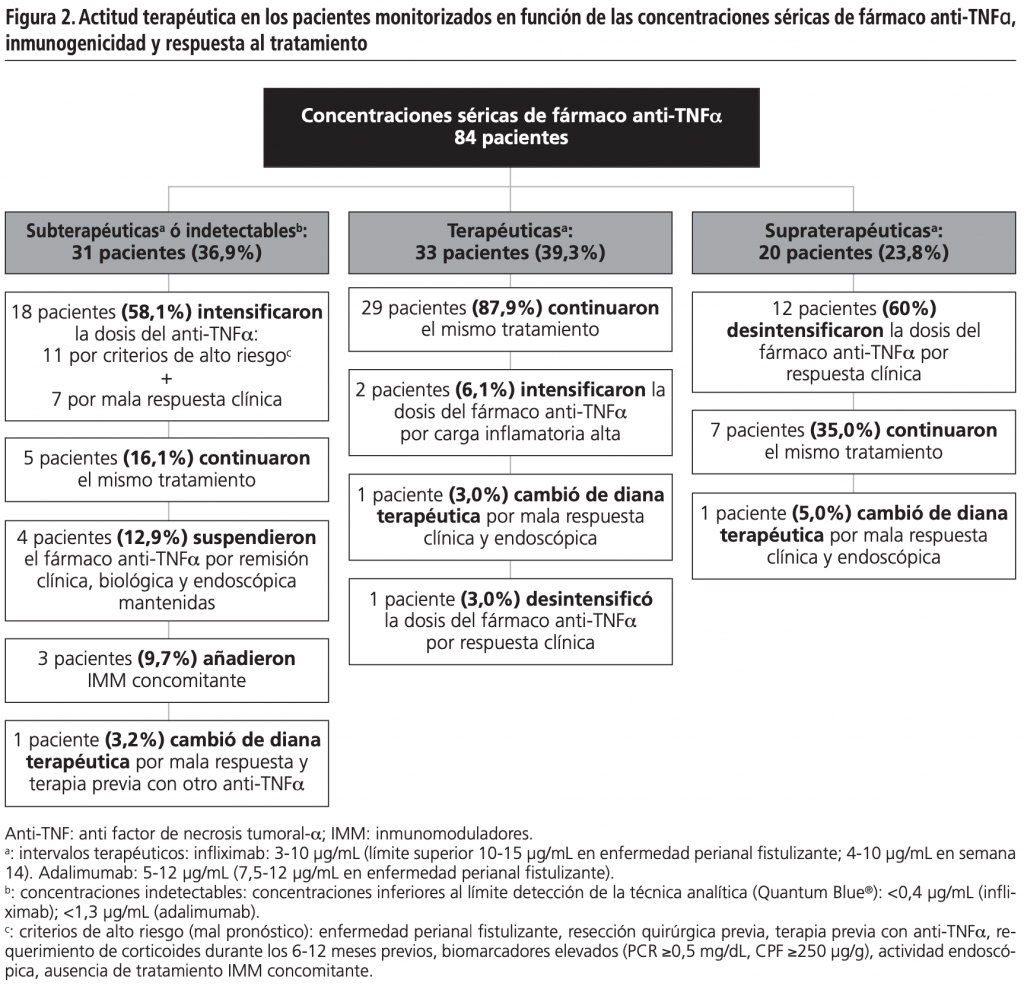
La figura 2 describe la actitud terapéutica tomada en los pacientes monitorizados según las concentraciones séricas de anti-TNFa, inmunogenicidad y respuesta al tratamiento. La terapia anti-TNFa fue modificada según el algoritmo en 47,6% de pacientes.
Se detectaron 12 efectos adversos en 10 pacientes con terapia anti-TNFa (40,0% infliximab vs. 60,0% adalimumab), combinada con IMM. En este grupo de pacientes, las concentraciones de anti-TNFa fueron mayoritariamente terapéuticas (40,0%) ó supraterapéuticas (30,0%). Los efectos adversos registrados fueron: infecciones recurrentes (58,3%), artralgias (8,3%), parestesias (8,3%), cefaleas (8,3%), reacciones infusionales (8,3%) y hepatitis autoinmune (8,3%).
DISCUSIÓN
Según la experiencia en nuestra práctica clínica, las tres cuartas partes de las interconsultas de TDM de terapias biológicas en pacientes con EII son ‘pro-activas’, siendo su principal finalidad el control de la terapia de mantenimiento. En este escenario, la monitorización de las concentraciones séricas de fármaco sería útil en la optimización del tratamiento biológico, permitiendo seleccionar de forma objetiva la dosis mínima efectiva con la consiguiente reducción de costes y el riesgo de efectos adversos (principalmente, infecciones y algunos tumores)9,22. Esta actitud ha permitido desintensificar la dosis del anti-TNFa en el 15,5% de pacientes a consecuencia de concentraciones elevadas de fármaco y buena respuesta. Asimismo, se ha suspendido la terapia anti-TNFa en cuatro pacientes debido a concentraciones subterapéuticas ó indetectables de fármaco y respuesta clínica, biológica y endoscópica sostenidas. En este grupo de pacientes, sería interesante en futuras investigaciones evaluar la evolución de la enfermedad y los resultados clínicos durante un seguimiento a más largo plazo.
La TDM ‘pro-activa’ parece ser una herramienta objetiva para mejorar y anticipar las decisiones en el manejo clínico habitual de pacientes con EII, prevenir posibles recaídas e identificar la etiología de los fracasos terapéuticos, incluso antes de que se manifiesten los síntomas clínicos9,22. Por otro lado, la monitorización fue ‘re-activa’ en la cuarta parte de las interconsultas, pudiendo identificar mecanismos para guiar las decisiones terapéuticas ante falta de respuesta. En base a estos escenarios, más de la mitad (58,1%) de los pacientes monitorizados con concentraciones subterapéuticas o indetectables de fármaco ha intensificado su terapia anti-TNFa por mala respuesta o criterios de alto riesgo de recaídas (fallo farmacocinético). Dos pacientes cambiaron su terapia anti-TNFa por otro fármaco con diferente mecanismo de acción debido a concentraciones terapéuticas ó supraterapéuticas de anti-TNFa y mala respuesta (fallo farmacodinámico).
Como sucede en otros estudios realizados en práctica clínica21-24, nuestros resultados muestran gran variabilidad en las concentraciones séricas de anti-TNFa. Los pacientes monitorizados presentaron con poca frecuencia concentraciones dentro de los intervalos terapéuticos óptimos. Se encontraron concentraciones subterapéuticas o indetectables de anti-TNFa en el 36,9% de pacientes, siendo más frecuentes en los pacientes tratados con infliximab que en los que recibían adalimumab. Estos resultados son acordes con los obtenidos por otros autores21,24. Estas diferencias en las concentraciones séricas en función del fármaco biológico empleado pueden estar relacionadas con el mayor riesgo de inmunogenicidad asociado a infliximab por tratarse de un anticuerpo monoclonal quimérico (humano-ratón), con el consiguiente aumento del aclaramiento plasmático del fármaco25. Por el contrario, adalimumab es un anticuerpo monoclonal humano recombinante y se ha relacionado con menor incidencia de AAF9,25. Sin embargo, existen otros factores que influyen en la inmunogenicidad de los anti-TNFa, como su estructura tridimensional o modificaciones postraslacionales, vía de administración, características individuales del paciente y medicación inmunosupresora concomitante9,22. El porcentaje de pacientes adherentes al IMM concomitante fue significativamente inferior en los pacientes en tratamiento con infliximab frente a los que recibían adalimumab. Esta falta de adherencia al IMM elevaría el porcentaje de pacientes en monoterapia con infliximab, lo que supondría mayor riesgo de inmunogenicidad. Por el contrario, a pesar de los posibles problemas relacionados con la administración subcutánea, no se encontraron diferencias significativas en cuanto a la adherencia al anti-TNFa.
El 21,4% de pacientes monitorizados fueron obesos, coincidiendo con la prevalencia de obesidad en la EII reportada en otros estudios (15-40,0%)26. La situación de inflamación crónica que se produce en la obesidad puede modificar el aclaramiento plasmático de los fármacos anti-TNFa, en relación con el aumento de la proteolisis y formación de AAF neutralizantes26. En este sentido, la mayor frecuencia de concentraciones subterapéuticas o indetectables de anti-TNFa en el grupo de pacientes tratados con infliximab podría relacionarse también con su mayor frecuencia de obesidad en comparación con el grupo de pacientes que recibían adalimumab.
Según nuestros resultados, la TDM puede tener utilidad en la individualización posológica, teniendo en cuenta que la dosificación empírica por respuesta clínica parece inducir concentraciones de anti-TNFa fuera de intervalos terapéuticos óptimos, al igual que se ha descrito en algunas descripciones de casos27. En cambio, la farmacocinética clínica parece ser una nueva herramienta para ajustar el esquema posológico a la concentración objetivo, y añade a la práctica clínica un parámetro objetivo para individualizar la terapia.
Las concentraciones subterapéuticas ó indetectables de anti-TNFa fueron significativamente más frecuentes en los pacientes tratados con infliximab y en los pacientes ‘no-adherentes’ al IMM concomitante. Por este motivo, se debe evaluar la adherencia al IMM durante el seguimiento farmacocinético del paciente para interpretar correctamente las concentraciones séricas de anti-TNFa.
La utilización de biosimilares fue significativamente más frecuente para infliximab debido a su introducción más temprana en el hospital que adalimumab. No obstante, no se encontraron diferencias significativas en la frecuencia de concentraciones subterapéuticas ó indetectables de fármaco original versus biosimilar, confirmando los resultados obtenidos por otros autores28,29.
Los efectos adversos fueron poco frecuentes, consistiendo mayoritariamente en infecciones recurrentes y relacionándose principalmente con concentraciones terapéuticas o supraterapéuticas de anti-TNFa y con la utilización de IMM concomitantes.
El presente trabajo expone algunas aportaciones farmacéuticas durante el seguimiento farmacocinético de terapias biológicas. En primer lugar, el farmacéutico entrega información oral y escrita al paciente, explicándole los motivos de la monitorización farmacocinética y las instrucciones para la correcta extracción de la muestra. También participa en la posible detección de falta de adherencia y sus causas, como olvidos frecuentes, errores en la técnica de administración ó remisión clínica. Estos aspectos son importantes a tener en cuenta a la hora de interpretar correctamente las concentraciones séricas obtenidas. El farmacéutico contribuye también a la individualización posológica en base a principios farmacocinéticos y farmacodinámicos (modelos poblacionales optimizados), pudiendo llevar a cabo la simulación y predicción bayesiana del comportamiento cinético del fármaco ante posibles cambios en los principales factores que afectan a su aclaramiento en los pacientes monitorizados. Otras contribuciones farmacéuticas incluyen el asesoramiento a los facultativos clínicos y la constante mejora y actualización de protocolos, algoritmos terapéuticos y modelos farmacocinéticos poblacionales.
Este trabajo presenta algunas limitaciones. Al tratarse de un estudio en práctica clínica, algunas decisiones terapéuticas se han ido implementando según el investigador sin ajustarse en su totalidad al algoritmo establecido. La medición de concentraciones de fármaco y AAF debe combinarse junto con parámetros clínicos objetivos de actividad de la enfermedad (como Harvey Bradshaw para enfermedad de Crohn; Mayo para colitis ulcerosa). Sin embargo, estos indicadores no fueron analizados en este estudio porque no son recogidos de forma homogénea en la historia clínica.
El reducido tamaño muestral en algunos subgrupos impide tener potencia para obtener resultados estadísticamente significativos en algunas comparaciones.
Los AAF solamente pueden determinarse cuando las concentraciones de fármaco son indetectables, ya que por el momento la técnica analítica disponible en el hospital es sensible a fármaco (“drug sensitive”). Por este motivo, no pudieron analizarse en el grupo de pacientes con concentraciones detectables de anti-TNFa, probablemente enmascarados por exceso de fármaco aunque continúen produciéndose30. Para optimizar la posible detección de AAF y minimizar la interferencia por el fármaco, las muestras de suero fueron extraídas en valle.
CONCLUSIONES
En nuestros pacientes con EII, la TDM de terapias anti-TNFa es frecuentemente ‘pro-activa’ y ha permitido individualizar la terapia en la mitad (47,6%) de los pacientes monitorizados.
Existe gran variabilidad en las concentraciones séricas de anti-TNFa, explicada en parte por el tipo de fármaco biológico utilizado y la adherencia al IMM concomitante.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Vande Casteleele N, Ferrante M, Van Assche G, Ballet V, Compernolle G, Van Steen K, et al. Trough concentrations of infliximab guide dosing for patients with inflammatory bowel disease. Gastroenterology. 2015;148:1320-1329.
2. Gisbert JP, Panes J. Loss of response and requirement of infliximab dose intensification in Crohn’s disease: a review. Am J Gastroenterol. 2009;104:760-767.
3. Arias MT, Vande Castelee N, Vermeire S, de Buck van Overstraeten A, Billiet T, Baert F, et al. A panel to predict long-term outcome of infliximab therapy for patients with ulcerative colitis. Clin Gastroenterol Hepatol. 2015;13:531-538.
4. Qiu Y, Chen BL, Mao R, Zhang SH, He Y, Zeng ZR, et al. Systematic review with meta-analysis: loss of response and requirement of anti-TNFa dose intensification in Crohn’s disease. J Gastroenterol. 2017;52:535-554. doi: 10.1007/s00535-017-1324-3.
5. Papamichael K, Rakowsky S, Rivera C, Cheifetz AS, Osterman MT. Association between serum infliximab trough concentrations during maintenance therapy and biochemical, endoscopic, and histologic remission in Crohn’s Disease. Inflamm Bowel Dis. 2018;24:2266-2271. doi: 10.1093/ibd/izy132.
6. Juncadella A, Papamichael K, Vaughn BP, Cheifetz AS. Maintenance Adalimumab concentrations are associated with biochemical, endoscopic, and histologic remission in inflammatory Bowel Disease. Dig Dis Sci. 2018;63:3067-3073. doi: 10.1007/s10620-018-5202-5.
7. Papamichael K, Cheifetz AS. Therapeutic drug monitoring in inflammatory bowel disease: for every patient and every drug? Curr Opin Gastroenterol. 2019 doi: 10.1097/MOG.0000000000000536.
8. Papamichael K, Juncadella A, Wong D, Rakowsky S, Sattler LA, Campbell JP, et al. Proactive Therapeutic Drug Monitoring of Adalimumab is associated with better long-term outcomes compared with standard of care in patients with inflammatory bowel disease. J Crohns Colitis. 2019;13:976-981. doi: 10.1093/ ecco-jcc/jjz018.
9. Sanchez-Hernandez JG, Rebollo N, Muñoz F, Martín Suárez A, Calvo MV. Therapeutic drug monitoring of tumour necrosis factor inhibitors in the management of chronic inflammatory diseases. Ann Clin Biochem. 2019;56:28-41 DOI: 10.1177/0004563218782286.
10. Roopenian DC, Akilesh S. FcRn: The neonatal Fc receptor comes of age. Nat Rev Inmmunol. 2007;7:71-25.
11. Sáez Belló M, Llopis Salvia P, Alegre Sancho JJ, Paredes Arquila JM, Asencio Muñoz MDC, Climente Martí M. Clinical Utility of Serum Concentrations of Adalimumab as Predictor of Treatment Adherence. Reumatol Clin. 2018. doi: 10.1016/j.reuma.2018.01.004.
12. Hirai F, Watanabe K, Matsumoto T, Limuro M, Kanamata N, Kubokura N, et al. Patients’ assessment of adalimumab self-injection for Crohn’s disease: a multicenter questionnaire survey (The PEARL Survey). Hepatogastroenterology. 2014;61(134):1654-60.
13. Alañón Pardo MM, Áreas del Águila VL, Cuadra Díaz JL, Paulino Huertas M, Ariza Hernández A, Rodríguez Martínez M. Utilización de fármacos biológicos en artritis reumatoide: monoterapia y terapia combinada. Rev. O.F.I.L – ILAPHAR 2018;28,2:129-136.
14. Fasanmade AA, Adedokun OJ, Ford J, Hernandez D, Johanns J, Hu C, et al. Population pharmacokinetic analysis of infliximab in patients with ulcerative colitis. Eur J Clin Pharmacol. 2009;65:1211-128. doi: 10.1007/s00228-009-0718-4.
15. Fasanmmade AA, Adedokun OJ, Blank M, Zhou H, Davis HM. Pharmacokinetic properties of infliximab in children and adults with Crohn’s disease: a retrospective analysis of data from 2 phase III clinical trials. Clin Ther. 2011;33: 946-964. doi: 10.1016/j.clinthera.2011.06.002.
16. Dotan I, Ron Y, Yanai H, Becker S, Fishman S, Yahav L, et al. Patient factors that increase infliximab clearance and shorten half-life in inflammatory bowel disease: a population pharmacokinetic study. Inflamm Bowel Dis. 2014;20: 2247-2259.
17. Berends SE, Strik AS, Van Selm JC, Lowenberg M, Ponsioen CY, D’Haens GR, et al. Explaining interpatient variability in adalimumab pharmacokinetics in patients with Crohn’s Disease. The Drug Monit. 2018;40:202-211. doi: 10.1097/ FTD.0000000000000494.
18. Mitrev N, Vande Casteele N, Seow CH, Andrews JM, Connor SJ, Moore GT, et al. Review article: consensus statements on therapeutic drug monitoring of anti-tumour necrosis factor therapy in inflammatory bowel diseases. Aliment Pharmacol Ther. 2017,46:1037-1053. DOI:10.1111/apt.14368.
19. Lamb CA, Kennedy NA, Raine T, Hendy PA, Smith PJ, Limdi JK, et al. British Society of Gastroenterology consensus guidelines on the management of inflammatory bowel diseases in adults. Gut. 2019;68:s1-s106. doi: 10.1136/gutjnl-2019-318484.
20. Khan A, Berahmana AB, Day AS, Barclay ML, Schultz M. New Zealand Society of Gastroenterology Guidelines on Therapeutic Drug Monitoring in Inflammatory Bowel Disease. N Z Med J. 2019;132:46-62. DOI: 10.1053/j.gastro.2017.07.031.
21. Vera Rivero FM. Utilidad de la monitorización de niveles de fármaco en la optimización del tratamiento biológico en la enfermedad inflamatoria intestinal [tesis doctoral]. UMA Editorial: Universidad de Málaga; 2016.
22. García Ruiz de Morales JM, Pascual – Salcedo D, Llinares Tello F, Valor Méndez L. Tratamiento con fármacos anti-TNF: utilidad de la monitorización de niveles de fármaco y anticuerpos antifármaco en la práctica clínica. Med Clin. (Barc) 2016;147:410-416.
23. García Martínez M, Bellés Medall MD, Ferrando Piqueres R, Gallego Iglesias B, Liñana Granell C, Ibáñez Benages E. Monitorización farmacocinética y respuesta clínica de adalimumab en reumatología. Rev. O.F.I.L. 2014;24:139-147.
24. Valdés-Delgado T, Argüelles-Arias F, Guerra-Veloz MF, Merino V, Maldonado-Pérez B, Castro-Laria A, et al. Estudio Piloto sobre la utilidad de la monitorización de niveles y anticuerpos anti-infliximab en pacientes con enfermedad inflamatoria intestinal en práctica clínica. Estudio “inflixilevel”. RAPD 2018; 41:68-72.
25. Thomas SS, Borazan N, Barroso N, Duan L, Taroumian S, Kretzmann B, et al. Comparative immunogenicity of TNF inhibitors: Impact on clinical efficacy and tolerability in the management of autoimmune diseases. A systematic review and meta-analysis. BioDrugs. 2015;29:241-258/.
26. Singh S, Dulai PS, Zarrinpar A, Ramamoorthy S, Sandborn WJ. Obesity in IBD: epidemiology, pathogenesis, disease course and treatment outcomes. Nat Rev Gastroenterol Hepatol. 2017;14:110-121. doi: 10.1038/nrgastro.2016.181.
27. Alañón Pardo MM, Proy Veja B, Roncero García-Escribano O, Valenzuela Gámez JC. Monitorización farmacocinética de niveles supraterapéuticos de adalimumab en paciente con enfermedad de Crohn. Rev. O.F.I.L – ILAPHAR. Fecha de aceptación: 19/12/2019 (pendiente de publicación).
28. Guerrero Puente PL, Iglesias Flores E, Benítez JM, Medina Medina R, Salgueiro Rodríguez I, Aguilar Melero P, et al. Evolution after switching to biosimilar infliximab in inflammatory bowel disease patients in clinical remission. Gastroenterol Hepatol. 2017;40:595-604. doi: 10.1016/j.gastrohep.2017.07.005.
29. Smits LJ, Derikx LA, de Jong DJ, Boshuizen RS, van Esch AA, Drenth JP, et al. Clinical Outcomes Following a Switch from Remicade® to the Biosimilar CT-P13 in Inflammatory Bowel Disease Patients: A Prospective Observational Cohort Study. J Crohns Colitis. 2016;11:1287-1293.
30. Ungar B, Chowers Y, Yavzori M, Picard O, Fudim E, Har-Noy O, et al. The temporal evolution of antidrug antibodies in patients with inflammatory bowel disease treated with infliximab. Gut. 2014;63:1258.1264.
____
