Fecha de recepción: 30/06/2017 – Fecha de aceptación: 28/01/2018
Alañón Pardo MM, Áreas del Águila VL, Rodríguez Martínez M
Servicio de Farmacia. Hospital General Universitario de Ciudad Real. Ciudad Real (España)
____
Correspondencia:
María del Mar Alañón Pardo
Calle Real, 133
13380 Aldea del Rey (Ciudad Real)
Correo electrónico: malanonp@sescam.jccm.es
____
RESUMEN
Objetivo: Analizar la persistencia al tratamiento modificador de la enfermedad (TME) en pacientes con esclerosis múltiple (EM).
Métodos: Estudio observacional retrospectivo en pacientes con EM que iniciaron (naive) ó cambiaron el TME (pretratados) con interferón beta (INF-β), acetato de glatirámero (AG), fingolimod y/o natalizumab desde enero 2009 hasta diciembre 2014 en una consulta externa de atención farmacéutica de un hospital general universitario, y en seguimiento hasta diciembre 2015. La persistencia al TME fue calculada al primer (P1), segundo (P2) y quinto año (P5), y se definió como tiempo transcurrido desde el inicio hasta discontinuación (suspensión o cambio) del TME.
Resultados: Se realizaron 115 prescripciones de TME (59 inicios, 56 cambios). P1, P2 y P5 fue 78,3%, 62,1% y 30,8%, respectivamente. La persistencia fue mayor (p≤0,030) para INF-β-1-A-intramuscular que AG al primer (92,5% vs. 40,0%) y segundo año (68,8% vs. 21,4%). La mediana de tiempo hasta la discontinuación del TME fue de 46,5 meses [IC95%: 39,9-52,9], siendo menor en los pacientes pretratados (30,8 meses) que en pacientes naive (56,0 meses) (B=0,766, HR=2,15 [IC95%: 0,062-0,903], p=0,018). Los pacientes tratados con INF-β-1A-intramuscular, INF-β-1A-subcutáneo y fingolimod permanecieron más tiempo en tratamiento: 55,1, 50,2 y 49,2 meses, respectivamente. Causas de discontinuación: “falta de efectividad” (36,4%), “intolerancia/efectos adversos” (36,4%), “embarazo/lactancia” (10,9%), “anticuerpos virus JC” (10,9%), “contraindicación por enfermedad grave” (5,5%).
Conclusiones: La persistencia al TME se redujo con el tiempo, siendo mayor para pacientes naive que para los pretratados. INF-β-1A es el fármaco con el que los pacientes con EM se mantienen más tiempo en tratamiento.
Palabras clave: Esclerosis múltiple, persistencia, tratamiento inmunomodulador.
____
INTRODUCCIÓN
La esclerosis múltiple (EM) es una enfermedad crónica, autoinmune, desmielinizante y neurodegenerativa del sistema nervioso central, que afecta entre 47,7 y 79 personas por cada 100.000 habitantes en España1. Debido a una mejoría de los métodos diagnósticos y a una mayor longevidad de la población, se ha observado un incremento significativo en su incidencia, diagnosticándose entre 2,2 y 5,3 nuevos casos por 100.000 habitantes en los últimos diez años. Es considerada también la segunda causa de discapacidad en adultos jóvenes1.
Aunque su intención no sea curativa, el tratamiento crónico de la EM pretende modificar el curso de la enfermedad y ha demostrado ser eficaz en disminuir el número de brotes y enlentecer la progresión de la discapacidad2. Por esta razón, la persistencia, entendida como tiempo durante el cual el paciente continúa con el tratamiento modificador de la enfermedad (TME), es fundamental para garantizar resultados óptimos3.
Los ensayos clínicos pivotales de los fármacos modificadores evaluaron sus resultados a corto plazo (generalmente, 1-2 años). Las cifras de discontinuación del TME fueron reducidas (8-15%)4, probablemente debido al mayor control de los pacientes evaluados. Dado que estos estudios se realizaron en condiciones ideales, posiblemente sus resultados no sean completamente representativos de la práctica clínica habitual “Real World Data” (RWD).
Al igual que ocurre en otras enfermedades crónicas, la persistencia al TME puede disminuir con el tiempo5-8. Así pues, el 16,9%-38,9% de los pacientes con EM interrumpen el TME en los tres primeros años4-11; aproximadamente la mitad lo hacen durante los dos primeros años4.
Los posibles factores relacionados con la discontinuación del TME son: sexo, forma evolutiva y tiempo de evolución de la enfermedad, grado de discapacidad (alta puntuación en la Expanded Disability Status Scale, EDSS), efectos adversos, dificultades para administración del tratamiento, necesidad de fármacos sintomáticos adicionales, percepción por el paciente de falta de efectividad y curso impredecible de la enfermedad4,7,8,10-13.
El seguimiento farmacoterapéutico (SFT) del paciente con EM en las consultas externas de atención farmacéutica puede ser una aportación al RWD de persistencia al TME por medio de la recogida de datos fuera de las restricciones controladas de los ensayos clínicos aleatorizados14.
Asimismo, los resultados percibidos por los pacientes (“Patients Reported Outcomes”, PROs) son un valor añadido del SFT, permitiendo conocer el punto de vista del paciente sobre su enfermedad o tratamiento. Al paciente con EM le preocupa sobre todo su calidad de vida, capacidad funcional, estado psicológico y los síntomas de la enfermedad. Los cuestionarios pueden ser herramientas válidas para medir estos aspectos durante la entrevista farmacéutica15.
Ante la falta de estudios que evalúen los resultados en salud desde la perspectiva del paciente con EM valorada durante la entrevista farmacéutica, se planteó desarrollar el presente estudio. El objetivo principal fue evaluar la persistencia al TME en pacientes con EM; los objetivos secundarios fueron analizar la reducción en la tasa anual de brotes (rTAB) y los efectos adversos asociados al TME.
MÉTODOS
Estudio observacional y retrospectivo realizado en un hospital general universitario con una población adscrita de 313.903 habitantes. Se incluyeron pacientes diagnosticados de EM que iniciaron (naive) ó cambiaron el TME (pretratados) desde enero 2009 hasta diciembre 2014 en el Área de Atención Farmacéutica a Pacientes Externos y que mantuvieron este tratamiento hasta diciembre de 2015.
Las variables analizadas fueron: demográficas (sexo, edad), clínicas (forma evolutiva remitente-recurrente (EMRR) y secundaria progresiva (EMSP), duración de EM (tiempo transcurrido desde el diagnóstico hasta el momento del estudio), síntomas relacionados con EM, farmacológicas (fármacos modificadores y sintomáticos, tiempo hasta discontinuación de TME, persistencia al TME al primer (P1), segundo (P2) y quinto año (P5), causas de su discontinuación y efectos adversos, y rTAB.
Los fármacos modificadores incluidos en la guía farmacoterapéutica del hospital durante el período del estudio fueron: interferón beta (INF-β) y acetato de glatirámero (AG) (inmunomoduladores de primera línea), fingolimod y natalizumab (inmunosupresores de segunda línea).
Se definió “persistencia” como el tiempo transcurrido desde el inicio hasta la discontinuación del TME; y “discontinuación”, la suspensión ó cambio del TME. No se consideró discontinuación la secuenciación de las diferentes dosis de INF-β-1A-subcutáneo.
La rTAB fue calculada en los pacientes con EMRR como la media del número de brotes en el año previo (TABprevia) y posterior (TABposterior) al inicio o cambio del TME.
Las fuentes de información consultadas fueron: historia clínica electrónica (Mambrino®), programa de dispensación a pacientes externos (ATHOS-Prisma®) y entrevista farmacéutica.
Se utilizó un cuestionario para valorar los síntomas relacionados con EM y los resultados en salud (brotes) percibidos por el propio paciente, que incluía preguntas dicotómicas (SI/NO) sobre síntomas en el momento de la entrevista farmacéutica y otras que hacían referencia al número de brotes en el año previo y posterior al inicio o cambio de TME. También recogía datos demográficos y necesidad de tratamientos sintomáticos. Los pacientes cumplimentaron este cuestionario secuencialmente cuando acudían a su visita habitual de SFT en diciembre de 2015 (Figura 1).

Análisis estadístico
Para el análisis descriptivo, las variables cuantitativas se expresaron con la media y desviación estándar (DE); y las cualitativas, con frecuencias absolutas y relativas.
Se empleó la prueba t-Student para contrastar si existían diferencias respecto a TABprevia y TABposterior según fármaco modificador prescrito. Para comparar variables cualitativas, se utilizó la prueba χ² de Pearson o el test exacto de Fisher en el caso de tablas 2×2 en las que el porcentaje de frecuencias esperadas menores de 5 fue superior al 20%.
Se realizó un regresión logística binaria para identificar posibles factores relacionados con P2: sexo, edad, forma evolutiva, duración de EM, TME previo, síntomas relacionados con EM (espasticidad, fatiga, ataxia, temblor, dolor neuropático, disfunción vesical, trastorno cognitivo, depresión) y necesidad de fármacos sintomáticos.
El análisis de supervivencia fue estimado usando el método de Kaplan-Meier. La significación estadística entre los tiempos de supervivencia se determinó con el test de Log-Rank que compara la supervivencia entre los grupos de estudio.
Para todos los análisis, se consideró significativo un valor de p<0,05. El software utilizado fue IBM-SPSS Statistics v.21.0.
Aspectos éticos
Este estudio fue diseñado respetando la confidencialidad de los datos de carácter personal, según la Ley Orgánica 15/1999 de Protección de Datos de Carácter Personal.
RESULTADOS
Se incluyeron 76 pacientes diagnosticados de EM (68,4% mujeres): 59 naive y 17 pretratados; a los que se les realizó un seguimiento medio de 3,5 (1,5) años.
Al inicio del TME, la edad media fue 45 (10,6) años. El 86,8% de las formas evolutivas fueron EMRR y el 13,2%, EMSP. La duración media de EM fue 5,1 (6,7) años. El 21,1% de pacientes presentaron una duración ≥10 años.
En el momento de la entrevista farmacéutica, los síntomas percibidos por el paciente fueron: fatiga (65,3%), espasticidad (44,0%), ataxia (41,3%), trastorno cognitivo (34,7%), dolor neuropático (31,6%), disfunción vesical (31,6%), temblor (25,3%) y depresión (21,1%). El 43,4% de pacientes tomaba fármacos sintomáticos.
Durante el período de estudio, el 64,4% de los pacientes fueron tratados con un solo fármaco modificador; 21,1% con dos fármacos y 14,5% con ≥ tres fármacos.
Se realizaron 115 prescripciones de TME: 59 inicios y 56 cambios. Los fármacos modificadores prescritos fueron: INF-β-1-A-intramuscular (34,8%) y subcutáneo (27,0%), AG (17,4%), fingolimod (10,4%), natalizumab (7,8%) e INF-β-1B-subcutáneo (2,6%). Se pudo realizar seguimiento de todas las prescripciones al primer año, del 82,5% y 33,9% al segundo y quinto. Todas las prescripciones de INF-β-1B-subcutáneo fueron realizadas en pacientes con formas evolutivas secundariamente progresivas.
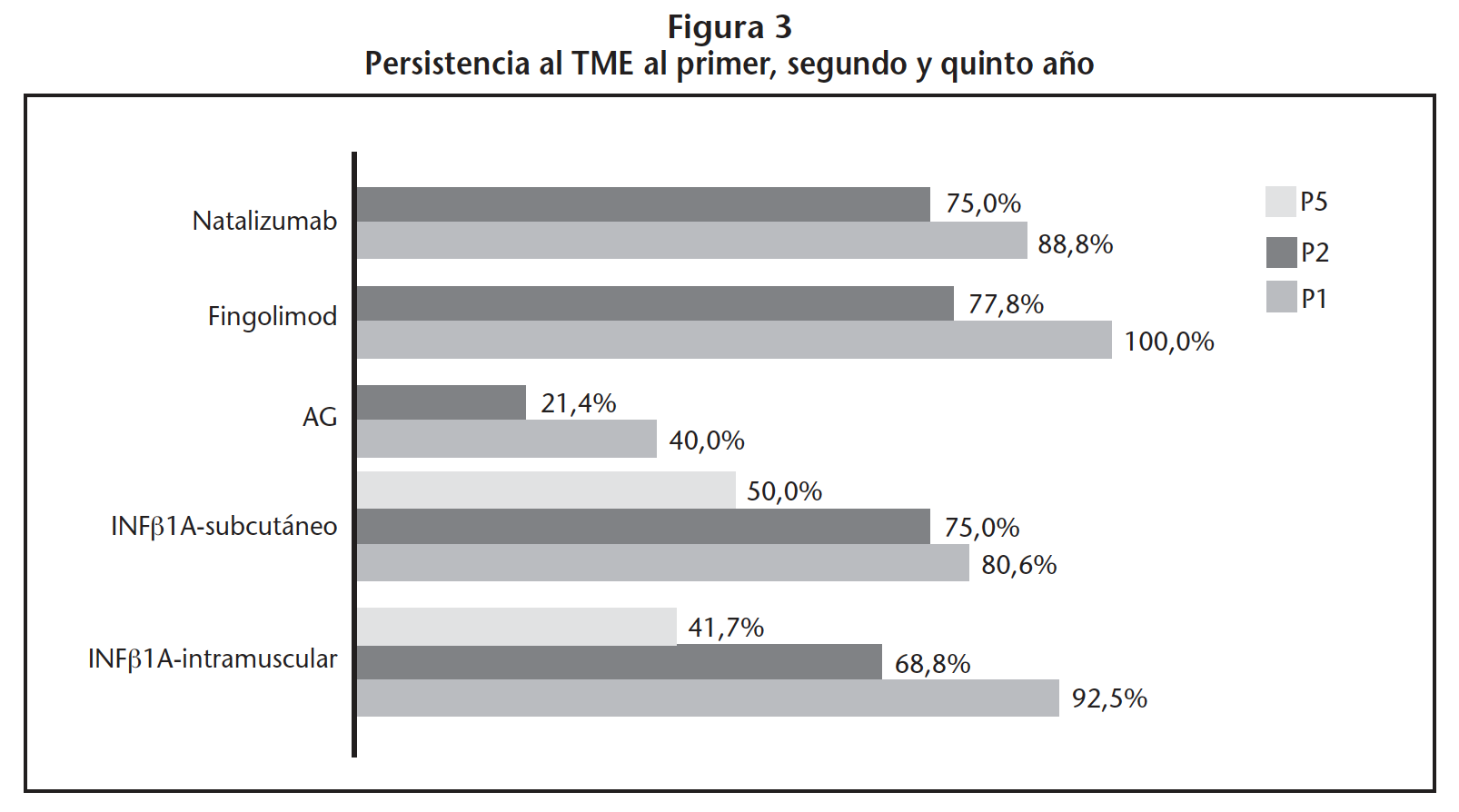
La figura 2 representa la distribución de los inicios y cambios del TME según el fármaco modificador prescrito.

La P1, P2 y P5 fueron respectivamente: 78,3%, 62,1% y 30,8%, siendo mayor para los inicios que los cambios (86,4% vs. 69,6%, p=0,029), (73,5% vs. 50,0%, p=0,018) y (52,5% vs. 10,0%, p=0,004). Al quinto año, el 46,2% de los pacientes discontinuaron el TME bien porque cambiaron a otro fármaco modificador o por suspensión del TME.
Fingolimod e INF-β-1-A-intramuscular fueron los fármacos modificadores con mayor P1 (100,0% y 92,5%, respectivamente); fingolimod mayor P2 (77,8%) e INF-β-1A-subcutáneo mayor P5 (50,0%). Ningún paciente con INF-β-1B-subcutáneo persistió al primer año. Del mismo modo, ningún paciente con AG y natalizumab fue persistente al quinto año (Figura 3). La diferencia en P1 y P2 entre los fármacos modificadores de primera línea INF-β-1A-intramuscular y AG fueron respectivamente 92,5% vs. 40,0% (p=0,001) y 68,8% vs. 21,4%, (p=0,030). No se encontraron diferencias estadísticamente significativas en P1 y P2 entre las vías de administración intramuscular y subcutánea de INF-β-1A, que fueron respectivamente 92,5% vs. 80,6% (p=0,136) y 68,8% vs. 75,0% (p=0,592). Con respecto a los fármacos modificadores de segunda línea, la diferencias en P1 y P2 entre INF-β-1A-intramuscular y fingolimod fueron respectivamente 92,5% vs. 100% (p=0,328) y 68,8% vs. 77,8% (p=0,599); y entre INF-β-1A-intramuscular y natalizumab fueron 92,5% vs. 88,8% (p=0,721) y 68,8% vs. 75,0% (p=0,906).
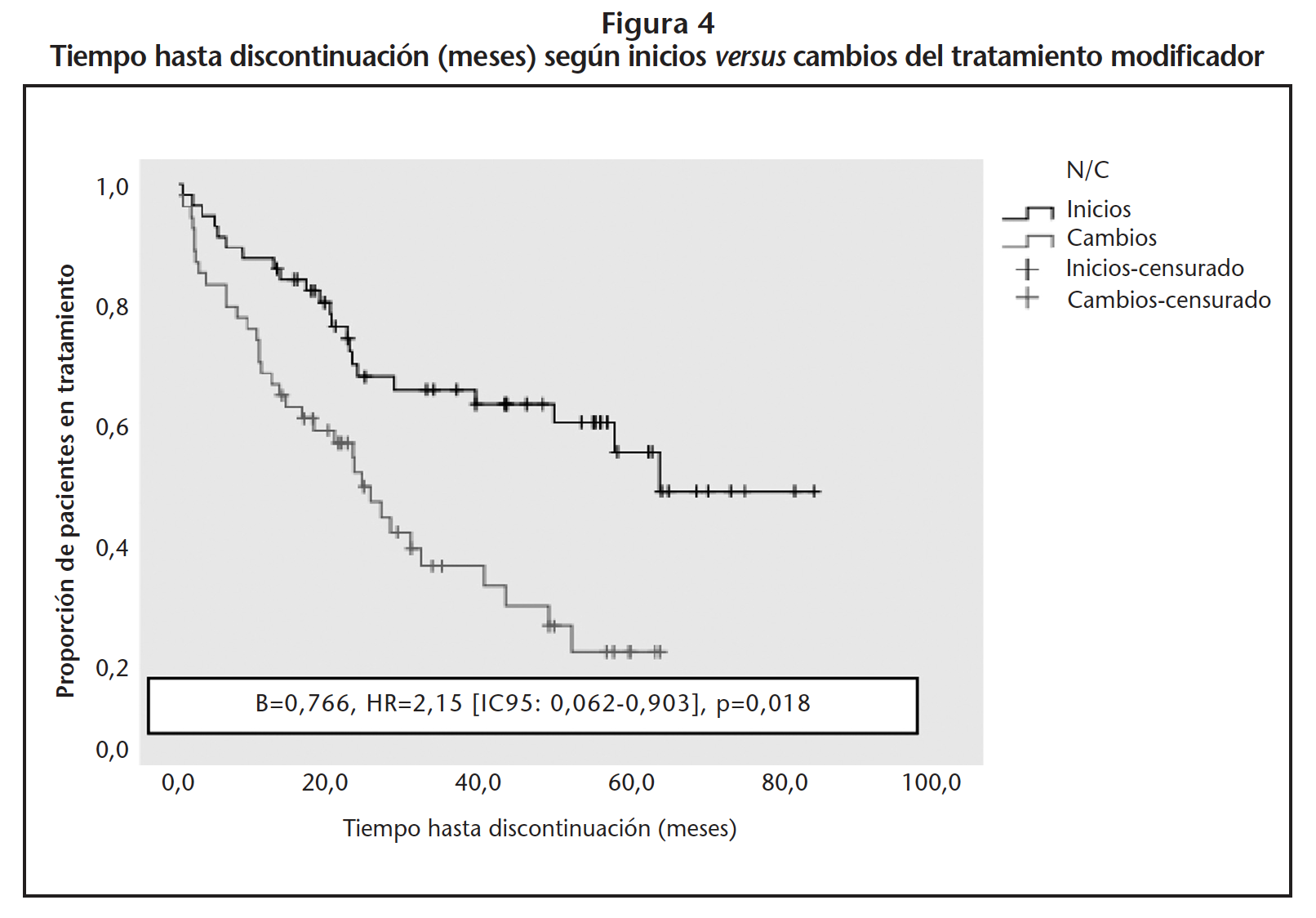
La mediana de tiempo hasta la discontinuación del TME fue de 46,5 meses [IC95%: 39,9-52,9].
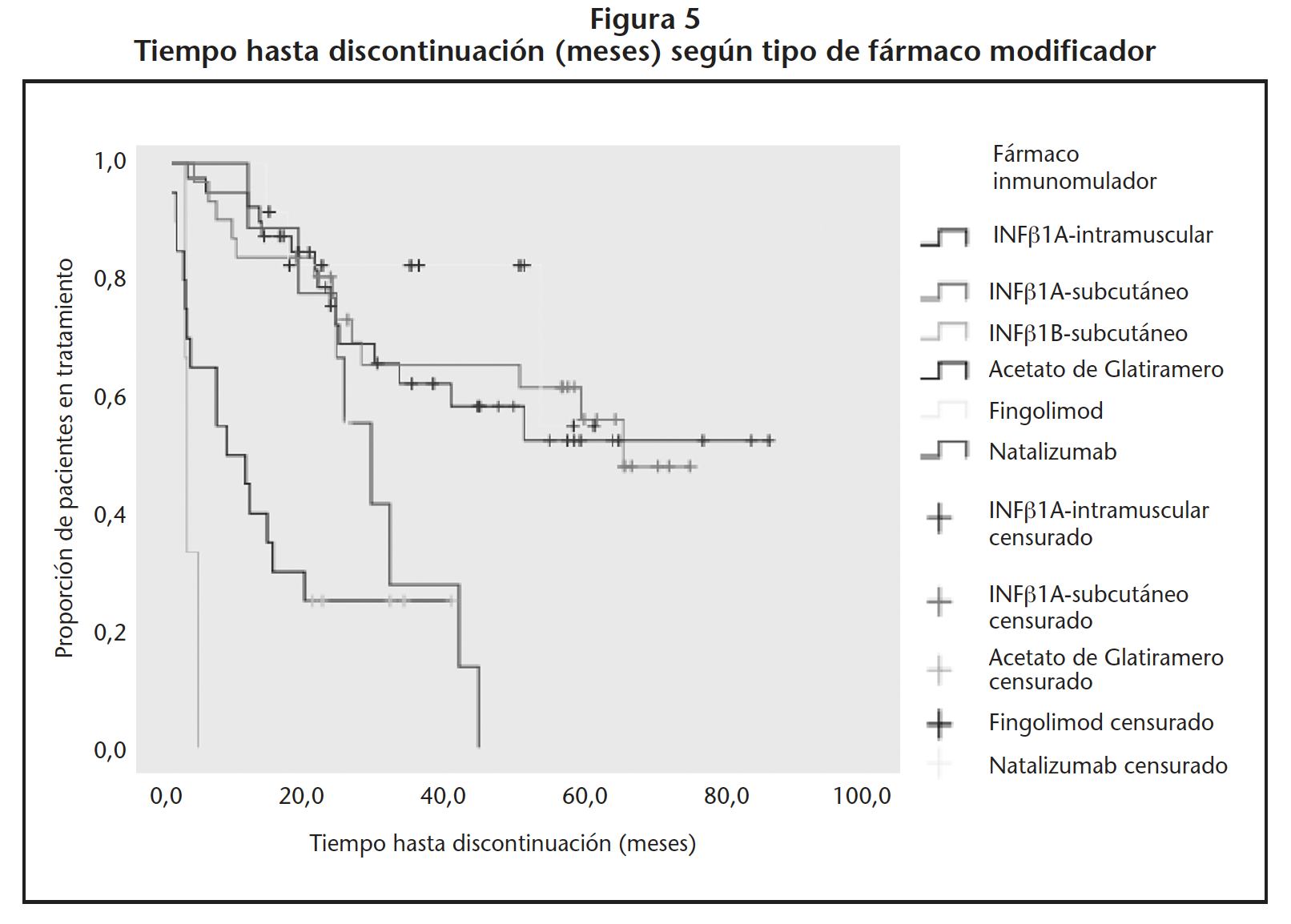
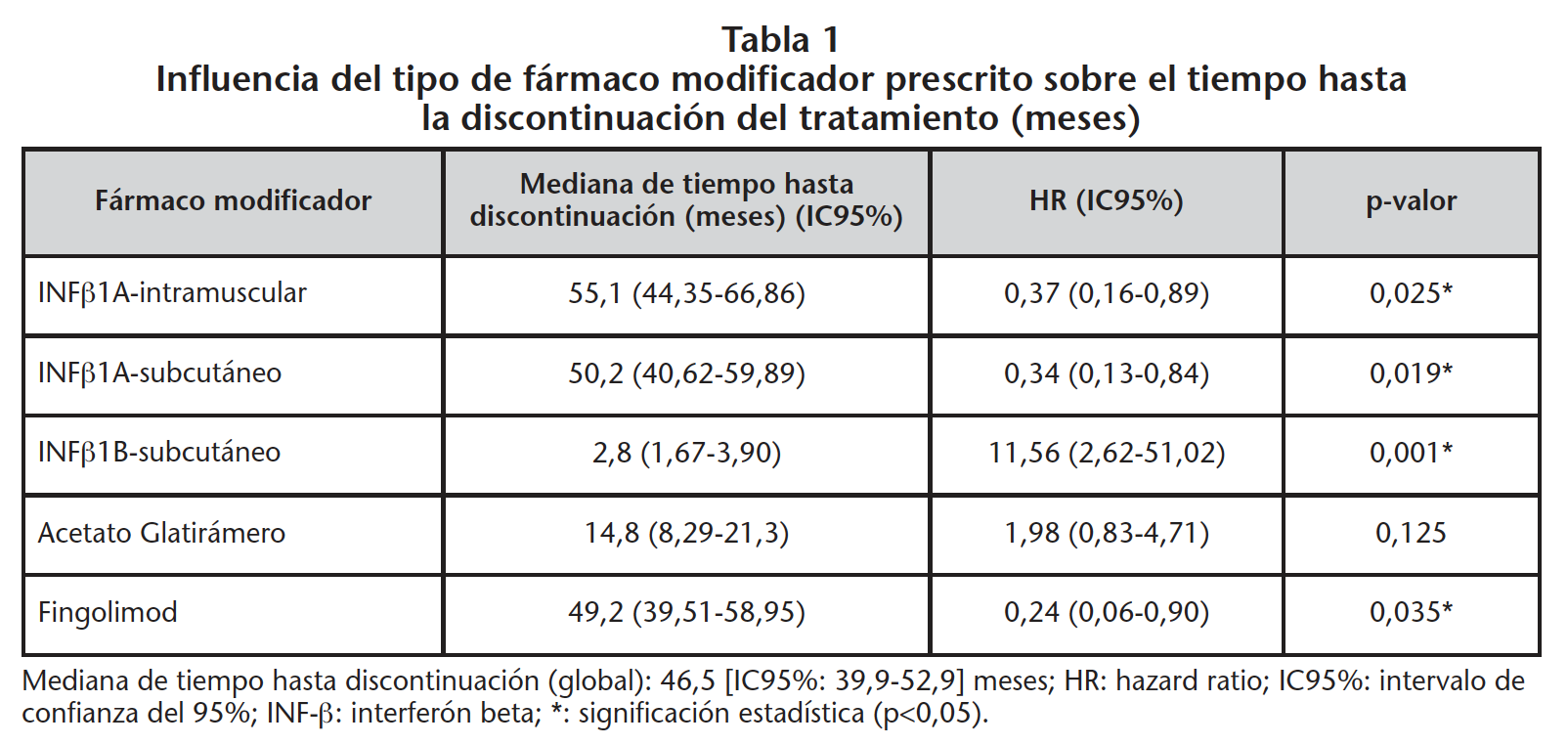
Los pacientes que cambiaron de TME permanecieron menos tiempo en tratamiento (30,8 meses) que los naive (56,0 meses) (B=0,766, HR=2,15 [IC95%: 0,062-0,903], p=0,018) (Figura 4). Los pacientes tratados con INF-β1A-intramuscular, INF-β1A-subcutáneo y fingolimod permanecieron más tiempo en tratamiento: 55,1, 50,2 y 49,2 meses, respectivamente (Figura 5, Tabla 1).
La disfunción vesical y el trastorno cognitivo fueron los síntomas que contribuyeron significativamente a la disminución de la P2 en los pacientes pretratados (Tabla 2).

Los causas de discontinuación del TME fueron: “falta de efectividad” (36,4%), “intolerancia/efecto adverso grave” (36,4%), “embarazo/lactancia” (10,9%), “desarrollo de anticuerpos frente al virus JC” (10,9%) y “contraindicación por enfermedad grave” (5,5%). La figura 6 muestra los motivos de discontinuación por fármaco modificador.

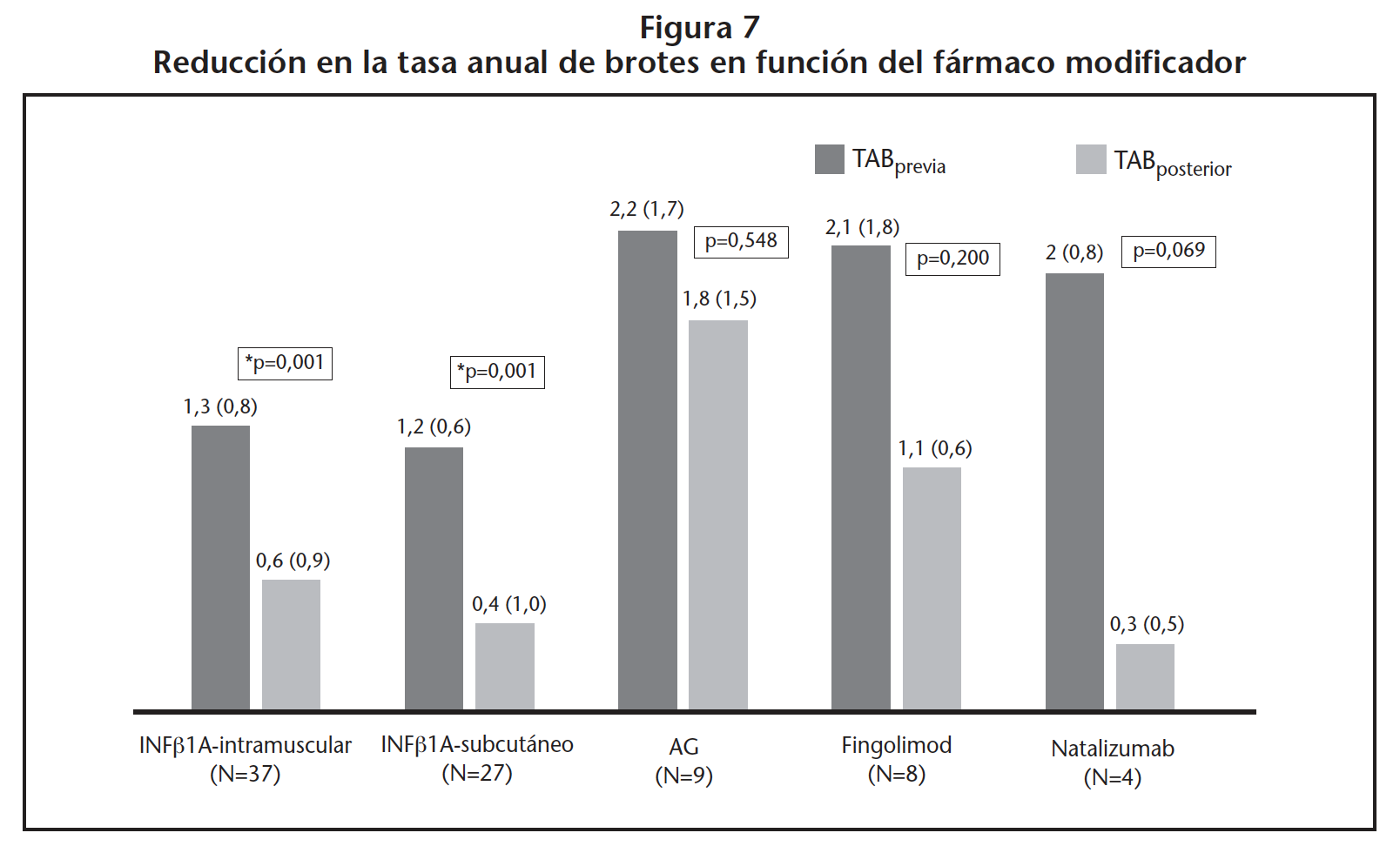
La figura 7 compara la TABprevia y la TABposterior para cada tipo de fármaco modificador prescrito. El INF-β-1A (intramuscular y subcutáneo) presentó una mayor rTAB.
En 55 pacientes, se registraron 95 efectos adversos: síndrome pseudogripal (26,3%), reacción cutánea en lugar de inyección (16,9%), linfopenia (9,3%), cefalea (6,2%), dolor en lugar de inyección (5,3%), ansiedad/depresión (4,2%), astenia (4,2%), alteración tiroidea (4,2%), hepática (4,2%) y digestiva (3,2%), insomnio (3,2%), infección severa (2,1%), alopecia (2,1%), palpitaciones/taquicardias (2,1%), mareo (2,1%), visión borrosa (1,1%), rubor facial (1,1%), sudoración (1,1%) y reacción de hipersensibilidad (1,1%). El síndrome pseudogripal fue mayoritariamente asociado a INF-β-1A-intramuscular (68,0%), la reacción cutánea en el lugar de la inyección a INF-β-1A-subcutáneo (46,7%) y AG (40,0%); y la linfopenia a fingolimod (9,3%).
El tratamiento con INF-β-1A-intramuscular presentó mayor frecuencia de efectos adversos (70,3%) que INFβ-1A-subcutáneo (62,9%) (p=0,289).
DISCUSIÓN
Como sucede en otros estudios realizados en la práctica clínica habitual5-8, nuestros resultados muestran que la persistencia al TME en pacientes con EM se reduce con el tiempo, siendo mayor en los pacientes naive que en los pretratados.
La persistencia al TME en los pacientes naive en el primer año (86,4%) se aproxima a la reportada en los ensayos clínicos, en los que la tasa de discontinuaciones es de 8-15%4. En los pacientes pretratados (69,6%) fue similar a los datos en la práctica clínica real recogidos en la bibliografía consultada (68,3%)5. La P2 fue inferior a la encontrada en estudios similares, así un 73,5% de los pacientes naive continuaban con el TME versus 75-80%6, disminuyendo hasta alcanzar un valor del 50% al cambiar de TME coincidiendo con los RWD (53,9%)5. La P5 en los pacientes que mantuvieron el TME inicial fue inferior (52,5% vs. 66%)7.
Las cifras de persistencia al TME son muy variables entre los diferentes estudios publicados, debido a la heterogeneidad metodológica.
Así, AG presentó valores de P2 en nuestro estudio (21,4%) inferiores a los reportados en la bibliografía (80%)5,7, mientras que esta persistencia fue superior para INF-β-1A (75% para la administración subcutánea y 68,8% para la administración intramuscular) versus la reportada en la práctica clínica real (53,9-68%)5,7. La mayor persistencia al primer y segundo año con INF-β-1A-intramuscular respecto a AG pudo ser debida a que tuvo menos discontinuaciones por efectos adversos, siendo AG peor tolerado, ya que fue utilizado mayoritariamente en pacientes naive de acuerdo con el estudio de Reynolds et al.16. Sin embargo, Oleen-Burkey et al.5 demostraron que los pacientes naive tratados con AG fueron más persistentes que los pacientes tratados con INF-β, otros autores no encontraron diferencias entre ambos fármacos17,18.
Fingolimod fue el fármaco modificador más persistente en los dos primeros años, posiblemente en relación con su administración oral19. El menor tiempo de comercialización de este inmunomodulador de segunda línea motivó que la persistencia no pudiera ser evaluada al quinto año.
Aunque pocos pacientes fueron tratados con INF-β-1B-subcutáneo en nuestro estudio, todos lo discontinuaron en el primer año, relacionado con su uso para la EMSP de acuerdo con la asociación significativa demostrada en algunos estudios entre esta forma evolutiva y la persistencia al TME4,8,16,20.
Al quinto año, casi la cuarta parte de los pacientes (23,1%) suspendieron definitivamente el TME y, aunque no se pudo establecer una relación con la duración de la enfermedad, se estima que tras 10-15 años de evolución, el 50% pasa a presentar un curso secundariamente progresivo (EMSP) con escasas alternativas terapéuticas21.
Las causas de discontinuación del TME fueron diferentes para los distintos fármacos modificadores, siendo las principales: pérdida de efectividad con INF-β-1A (único fármaco modificador que demostró reducir la TAB), y los efectos adversos producidos por INF-β-1B, AG y fingolimod. El embarazo también está descrito como causa de discontinuación de INF-β7,8. Natalizumab fue suspendido principalmente por desarrollo de anticuerpos frente al virus JC que aumentan el riesgo de desarrollar LMP22.
La realización del SFT en los pacientes del estudio permitió conocer las causas de discontinuación del TME, a diferencia de la limitación que para ello presentan los estudios retrospectivos recogidos en la bibliografía que analizan bases de datos de registros electrónicos de prescripción y dispensación4,6,9.
Algunos autores relacionaron la ausencia de síntomas percibidos por los pacientes con EM con peor cumplimiento terapéutico y, por tanto, discontinuación del TME23. Sin embargo, nuestro estudio mostró que la presencia de síntomas percibidos por el paciente, como la disfunción vesical y el trastorno cognitivo, disminuye la persistencia en el segundo año de TME.
Sólo INF-β consiguió reducir significativamente la tasa anual de brotes. Los pacientes con EMRR tratados con INF-β-1-A presentaron una TAB previa (1,2-1,3) superior a la reportada en la bibliografía (0,9)24, lo que ha podido contribuir a este resultado. La rTAB no mostró significación estadística para AG, fingolimod y natalizumab, probablemente porque el número de pacientes fue menor en este subgrupo.
Un número elevado de pacientes mostraron efectos adversos asociados al TME, principalmente pseudogripales y cutáneos. Los efectos adversos fueron un 7,4% más frecuentes en los pacientes tratados con INF-β-1A-intramuscular que INF-β-1A-subcutáneo, aunque esta diferencia no fue estadísticamente significativa. Como sucede en el estudio EVIDENCE25, las reacciones locales en lugar de la inyección fueron más frecuentes con INF-β-1A-subcutáneo, mientras que los síndromes pseudogripales fueron más frecuentes con INF-β-1A-intramuscular.
Limitaciones
El hecho de que la principal fuente de información consultada sea la historia clínica puede ser una limitación del estudio, ya que puede existir un sesgo de infrarregistro. También puede haber sesgos de memoria en la información reportada por el paciente durante la entrevista farmacéutica. El reducido tamaño muestral en los grupos de tratamiento con AG, fingolimod y natalizumab impide tener potencia para obtener resultados estadísticamente significativos en algunas comparaciones. La puntuación en la EDSS no fue analizada en este estudio porque no es recogida de forma homogénea en la historia clínica.
CONCLUSIONES
La persistencia al TME se reduce con el tiempo, siendo mayor en los pacientes que inician el TME que en los previamente tratados. INF-β-1A es el fármaco con el que los pacientes con EMRR más tiempo mantienen el TME, siendo la falta de efectividad su principal causa de discontinuación, aunque es el único que ha demostrado en este estudio reducir el número de brotes en el primer año de tratamiento.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Bártulos Iglesias M, Marzo Sola ME, Estrella Ruiz LA, Bravo Anguiano Y. Epidemiological study of multiple sclerosis in La Rioja. Neurología. 2015;30:552-60.
2. Martínez Férez IM, Flores Moreno S. Eficacia y seguridad de los fármacos inmuno-reguladores, interferón beta y glatiramero, en la esclerosis múltiple remitente recidivante. Sevilla: Agencia de Evaluación de Tecnologías Sanitarias; 2012 [Acceso 30 mayo de 2016]. Disponible en: http://www.juntadeandalucia.es/salud/ servicios/contenidos/nuevaaetsa/up/AETSA_4_2013_InterferonGlatiramero_EM.pdf.
3. World Health Organization (WHO). Adherence to long-term therapies: evidence for action. Ginebra: WHO; 2003. http://www.who.int/chp/knowledge/publications/adherence_introduction.pdf (consultado 31 mayo de 2016).
4. Río J, Porcel J, Téllez N, Sánchez-Betancourt A, Tintoré M, Arévalo MJ, Nos C, Montalban X. Factors related with treatment adherence to interferon beta and glatiramer acetate therapy in multiple sclerosis. Mult Scler. 2005;11:306-9.
5. Oleen-Burkey M, Cyhaniuk A, Swallow E. Retrospective US database analysis of persistence with glatirámero acetate vs. available disease-modifying therapies for multiple sclerosis: 2001-2010. BMC Neurology. 2014;14:11.
6. Kalincik T, Spelman T, Trojano M, Duquette P, Izquierdo G, Grammond P, et al. Persistence on Therapy and Propensity Matched Outcome Comparison of Two Subcutaneous Interferon Beta 1a Dosages for Multiple Sclerosis.2013;PLos ONE. 2013:8: e63480.
7. Zhornitsky S, Greenfield J, Koch MW, Patten SC, Harris C, Wall W, et al. Long-Term Persistence with Inyectable Therapy in Relapsing-Remitting Multiple Sclerosis: An 18-Year Observational Cohort Study. PLos ONE. 2015;10: e0123824.
8. Iturbe V, Ara Callizo JR, Huarte Lacunza R, Navarro Aznárez H, Serrano Mislata N, Rabanaque Hernández MJ. Discontinuación y adherencia a largo plazo en la terapia con interferón beta en pacientes con esclerosis múltiple. Farm Hosp. 2012;36:77-83.
9. Margolis JM, Fowler R, Johnson BH, Kassed CA, Kahler K. Disease-modifying drug initiation patterns in commercially insured multiple sclerosis patients: a retrospective cohort study. BMC Neurology. 2011;11:122.
10. Tremlett HL, Oger J. Interrupted therapy: stopping and switching of the beta-interferons prescribed for MS. Neurology. 2003;61:551-4.
11. Tremlett H, Oger J. Adherence from across the pond: Six years of experience with beta-interferons for multiple sclerosis. Pharm J. 2003;271:649-53.
12. Cox D, Stone J. Managing self-injection difficulties in patients with relapsing-remitting multiple sclerosis. J Neurosci Nurs. 2006,38:167-171.
13. Ruggieri RM, Settipani N, Viviano L, Attanasio M, Gigglia L, Almasio P, et al. Long-term interferon-beta treatment for multiple sclerosis. Neurol Sci. 2003;24-361-364.
14. García López JL, Llano Señarís JE, Diego Salas J, Recalde Manrique JM. Aportación de los “Real World Data” (RWD) a la mejora de la práctica clínica y del consumo de los recursos en los pacientes. 1ª Edición. Madrid: Fundación Gaspar Casal. 2014. http://fgcasal.org/publicaciones/Libro_RWD.pdf (consultado 31 mayo de 2016).
15. Patrick DL., Burke LB, Powers JH, Scott JA., Rock EP, Dawisha S, O’Neill R, Kennedy DL. Patient-Reported Outcomes to Support Medical Product Labeling Claims: FDA Perspective. Value Health. 2007;10:S125-37.
16. Reynolds MW, Stephen R, Seaman C, Rajagopalan K. Persistence and adherence to disease modifying drugs among patients with multiple sclerosis. Curr Med Resp Opin. 2010;26:663-74.
17. Halpern R. Agarwal S, Dembek C, Borton L, Lopez-Bresnahan M. Comparison of adherence and persistence among multiple sclerosis patients treated with disease-modifying therapies: a retrospective administrative claims analysis. Patient Prefer Adherence. 2011;5:7-84.
18. Wong J, Gomes T, Mandani M, Manno M, O’Connor PW. Adherence to multiple sclerosis disease-modifying therapies in Ontario is low. Can J Neurol Sci. 2011; 38:429-33.
19. Warrender-Sparkes M, Spelman T, Izquierdo G, Trojano M, Lugaresi A, Grand’Maison F, et al. The effect of oral immunomodulatory therapy on treatment uptake and persistente in multiple sclerosis. Mult Scler. 2016:22:520-32.
20. O’Rouke KE, Hutchinson M. Stopping beta-interferon therapy in multiple sclerosis: an analysis of stopping patterns. Mult Scler. 2005;11:46-5.
21. Blanco Y, Saiz A, Graus F. Evolución clínica de la resonancia magnética y de las bandas oligoclonales en los pacientes con esclerosis múltiple receptores de un trasplante autólogo de progenitores hematopoyéticos. Revista Española de Esclerosis Múltiple. 2005:0:6-15.
22. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Natalizumab (Tysabri): Nuevas recomendaciones para minimizar el riesgo de leucoencefalopatía multifocal progresiva. Recomendaciones del Comité para la evaluación de Riesgos en Farmacovigilancia Europeo-PRAC. AEMPS: 2016. https://www. aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2016/NI-MUH_FV_01-natalizumab-tysabri.htm (consultado: 19 junio de 2016).
23. Hancock LM, Bruce JM, Lynch SG. Exacerbation history is associated with medication and appointment adherence in MS. J Behav Med. 2011;34:330-8.
24. Carretero Ares JL, Bowakim Dib W, Acebes Rey JM. Actualización: esclerosis múliple. Medifam. 2001;11:30-43.
25. Panitch H, Goodin D, Francis G, Chang P, Coyle P, O’Connor P, et al. Randomized, comparative study of interferon beta-1a treatment regimens in MS: The EVIDENCE Trial. Neurology. 2002;59:1496-506.
____
Descargar artículo en PDF: Persistencia al tratamiento modificador de la enfermedad en pacientes con esclerosis múltiple: seguimiento farmacoterapéutico
