Rev. OFIL 2017, 27;1:11-17
Fecha de recepción: 07/07/2016 – Fecha de aceptación: 25/08/2016
____
Álvarez Martín T1, Ferrando Piqueres R2, Mendoza Aguilera M3, Borrego Izquierdo Y4, Pascual Marmaneu O1, Bellés Medall MD2
1 Graduada/o en Farmacia. Farmacéutico Interno Residente. Servicio de Farmacia.
Hospital General Universitario de Castellón. Castellón (España)
2 Doctor en Farmacia. Facultativo Especialista en Farmacia Hospitalaria. Servicio de Farmacia.
Hospital General Universitario de Castellón. Castellón (España)
3 Licenciada en Farmacia. Farmacéutico Interno Residente. Servicio de Farmacia.
Hospital General Universitario de Castellón. Castellón (España)
4 Facultativo Especialista en Farmacia Hospitalaria. Servicio de Farmacia.
Hospital Universitario Nuestra Señora de Valme. Sevilla (España)
____
Resumen
Objetivo: Conocer las comorbilidades del paciente mayor con infección por VIH, así como tipo de medicación concomitante. Identificar y analizar interacciones clínicamente relevantes.
Metodología: Estudio únicentrico retrospectivo desde 1 enero hasta 30 junio de 2015. Se incluyeron todos los pacientes mayores de 55 años con tratamiento antirretroviral (TAR). Se recogieron las siguientes variables: edad, sexo, comorbilidades, TAR, medicamentos concomitantes, número y tipo de interacción, carga viral y CD4. Para evaluar las interacciones se consultaron la página web:www.hiv-druginteractions.org y Micromedex®. Se realizó el análisis estadístico con el paquete estadístico SPSS19.0.
Resultados: Se incluyeron 60 pacientes mayores de 55 años con TAR activo. Un 93% presentaron comorbilidades: alteraciones digestivas (33%), hipercolesterolemia (28%), hipertensión (27%) y diabetes (22%). El 70% de los pacientes tenían tratamiento asociado al TAR: hipolipemiantes (35%), antihipertensivos (33%), medicación psiquiátrica (27%). Se registraron un total de 83 interacciones relevantes. Se observaron diferencias significativas en la frecuencia de interacciones, siendo mayor en pacientes con 5 o más fármacos no antirretrovirales. También se encontraron diferencias significativas, en aquellos pacientes que en su régimen utilizaban inhibidores de la integrasa (II) presentando un porcentaje de interacciones menor (p=0,01), frente a los que empleaban inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINN) en los que el porcentaje fue mayor (p<0,001).
Conclusiones: Las comorbilidades y fármacos asociados al TAR fueron similares a lo descrito en la literatura. La comedicación aumenta el número de interacciones relevantes, siendo éstas más probables en los regímenes que incluyen ITINN e inhibidores de la proteasa y menos en los que utilizan un II.
Palabras clave: Tratamiento antirretroviral, interacciones medicamentosas, comorbilidades, envejecimiento, VIH.
____
Introducción Y ANTECEDENTES
La introducción del tratamiento antirretroviral de gran actividad (TAR) ha conseguido controlar el virus de la inmunodeficiencia humana (VIH), obteniendo una progresiva reducción de la morbimortalidad asociada al VIH1. El aumento de la esperanza de vida ha convertido esta enfermedad en una patología crónica y por tanto, ha propiciado la aparición en esta población de diferentes comorbilidades relacionadas con la edad (hipertensión, diabetes, hiperlipemias, etc.), otras patologías relacionadas con el VIH (neoplasias) y las propias infecciones oportunistas. Las distintas comorbilidades han llevado al paciente infectado por VIH a requerir múltiples tratamientos, convirtiéndolo en un paciente polimedicado2.
La polifarmacia puede ser simplemente definida como el uso concomitante de múltiples medicamentos; sin embargo, dentro de la literatura científica podemos encontrar otras definiciones, siendo la más comúnmente citada “el uso de cinco o más medicamentos”3.
Se cree que la infección por VIH, y muy posiblemente su tratamiento, puede estar contribuyendo a la aceleración del proceso de envejecimiento cuando se compara con aquellos pacientes que no están infectados4. Este envejecimiento prematuro hace que las diferentes guías establezcan el umbral para pacientes “mayores” infectados por VIH en 50-55 años, haciendo que el uso de múltiples medicamentos sea, sin duda, un tema de gran relevancia en este grupo poblacional5.
El tratamiento de las patologías crónicas añadido al TAR hace que exista un riesgo potencial de desarrollo de problemas relacionados con la medicación, destacando las interacciones de tipo farmacológico. La propia idiosincrasia de los antirretrovirales (inductores o inhibidores enzimáticos) y del resto de medicación concomitantemente prescrita hace que las interacciones farmacológicas puedan ser frecuentes en este tipo de pacientes6. Se estima que las interacciones clínicamente relevantes entre fármacos antirretrovirales y medicación concomitante pueden alcanzar una proporción del 27-40%7.
El riesgo de las interacciones entre medicamentos depende de la farmacocinética y características farmacodinámicas de las clases de medicamentos que se coadministran. La relevancia de estas interacciones se justifica en base al potencial aumento de la toxicidad o disminución de la eficacia de los fármacos implicados que, hablando de antirretrovirales, puede significar el abandono del tratamiento por efectos adversos o la aparición de mutaciones de resistencia que pueden conllevar fracaso terapéutico y pérdidas de opciones terapéuticas para los pacientes8.
El perfil del metabolismo de los antirretrovirales (ART) es complejo, ya que cada fármaco se metaboliza a través de diferentes isoenzimas y es difícil realizar generalizaciones basadas en clases de fármacos. Los inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINN) son inductores moderados de las enzimas CYP3A4 (aunque efavirenz y etravirina pueden ser también inhibidores), y la mayoría puede reducir las concentraciones plasmáticas de inhibidores de la proteasa (IP) u otras clases de fármacos que son sustratos del CYP3A4 reduciendo su eficacia, mientras que los IP son inhibidores potentes del CYP450 y pueden aumentar significativamente las concentraciones de otros fármacos produciendo toxicidad. A diferencia de esta clase de fármacos, los inhibidores de la integrasa (II), como raltegravir y dolutegravir, se metabolizan por glucuronoconjugación principalmente a través de la enzima UGT1A1, con menos potencial de interacciones respecto a IP e ITINN9.
El objetivo del presente trabajo es conocer las comorbilidades y el tipo de medicación concomitante en el paciente mayor VIH, así como identificar las interacciones clínicamente relevantes TAR-medicación concomitante y evaluar qué variables se relacionan con las interacciones y cómo influyen las interacciones en la situación clínica del paciente.
MATERIAL Y MÉTODOS
Estudio unicéntrico retrospectivo en un hospital universitario de tercer nivel desde el 1 enero de 2015 hasta el 30 junio de 2015. Se incluyeron aquellos pacientes VIH con edad superior a 55 años con TAR activo. Se recogieron las siguientes variables relacionadas con el paciente: edad, sexo, coinfección VHC y/o VHB, comorbilidades crónicas, carga viral plasmática (CV) de VIH (copias/mL) y el recuento de linfocitos CD4 (células/µL). Adicionalmente se recogieron variables farmacoterapéuticas como: régimen de TAR, medicación concomitante, número total de fármacos prescritos y número de comprimidos diarios del TAR y no TAR.
Los pacientes se clasificaron según el TAR en aquellos que llevaban una combinación de dos ITIAN (tenofovir/emtricitabina, abacavir/lamivudina u otros) más un tercer fármaco y los que utilizaban no ITIAN en las distintas combinaciones habituales. También se realizó una estratificación de los pacientes según el número de fármacos prescritos, considerándose polimedicados aquellos con un número mayor o igual a 5 fármacos.
Para detectar las interacciones entre fármacos se utilizaron las bases de datos de la Universidad de Liverpool (www.hiv-druginteractions.org)10 y Micromedex®11. Las interacciones se clasificaron según la base de datos de la Universidad de Liverpool en: “contraindicadas” (no debieron ser administradas conjuntamente por la presencia de graves efectos adversos o inefectividad del TAR), “potencial interacción” (la asociación de los fármacos pudo requerir monitorización de los niveles plasmáticos, disminución de dosis o cambio en la pauta de administración) e “interacción sin relevancia clínica” donde no se requirió ninguna actuación. También se clasificaron según el tipo de interacción en farmacocinéticas (aumento, disminución de dosis o ambas) u otras. Se consideraron interacciones entre el TAR y la medicación concomitante clínicamente relevantes, aquellas definidas como contraindicadas o con riesgo potencial de interacción.
Para la medida de la influencia de las interacciones en el estado clínico del paciente, se recogieron los dos últimos valores de los niveles plasmáticos de CD4 y de la CV. Los pacientes se estratificaron según recuento de CD4 en tres categorías <250, 250-500 y >500 células/µl. Se definió como CV indetectable menos de 50 copias/ml.
Los datos se obtuvieron de la historia clínica del paciente, del módulo de dispensación individualizada de los programas Farmasyst® y Abucasis® y los datos de linfocitos CD4 y CV se obtuvieron del programa Igestlab®.
Las variables cuantitativas se resumieron con media y desviación estándar o mediana y percentiles en las variables asimétricas, y las variables cualitativas con porcentajes y frecuencias. Se realizó una descriptiva de los datos demográficos y del TAR y no TAR.
El análisis estadístico se realizó en el grupo de pacientes que tenían prescrito tratamiento concomitante y los pacientes se agruparon según si tenían interacciones TAR-noTAR clínicamente relevantes. Las diferencias en el sexo, el tratamiento concomitante (mayor o menor a 5 fármacos), el TAR utilizado, la carga viral y los CD4 se evaluaron mediante la prueba chi-cuadrado (χ2) o la prueba exacta de Fisher. Con el fin de indicar la fuerza de asociación entre las siguientes covariables (sexo, TAR, tratamiento concomitante mayor a 5 fármacos, recuento de CD4 y CV) y las interacciones clínicamente relevantes se presentaron las odds ratio (OR) y los intervalos de confianza del 95% (IC). Se realizó el análisis estadístico con el paquete estadístico SPSS 19.0 para Windows.
RESULTADOS
Se incluyeron en el estudio un total de 60 pacientes. Las características demográficas y comorbilidades se muestran en la tabla 1. Casi un 93% de los pacientes presentaron comorbilidades. La mayor parte de los pacientes (93%) tenían controlada la enfermedad presentado CV indetectable y casi un 60% recuento de CD4 superior a 500 cel/µL (no se encontraron datos de CV en 3 pacientes y de CD4 en 4 pacientes). Según se puede apreciar en la tabla referida, las comorbilidades más frecuentes fueron molestias gástricas, hipercolesterolemia, hipertensión y diabetes.
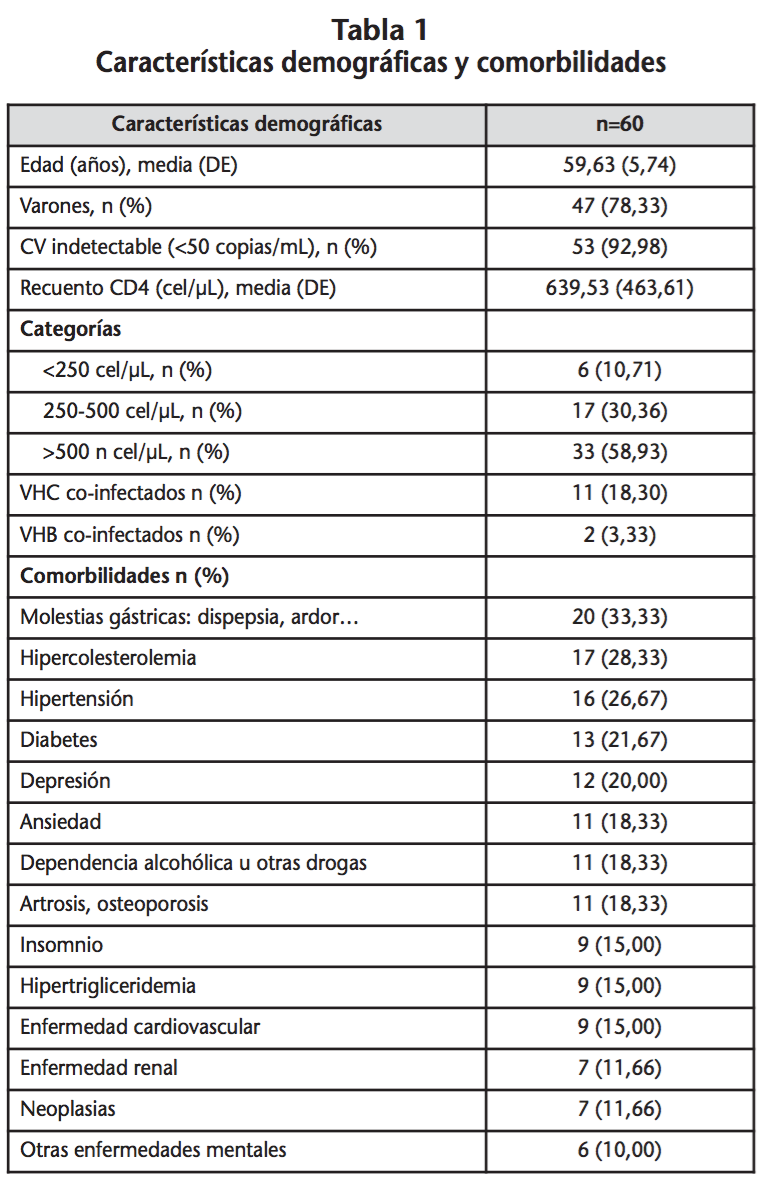
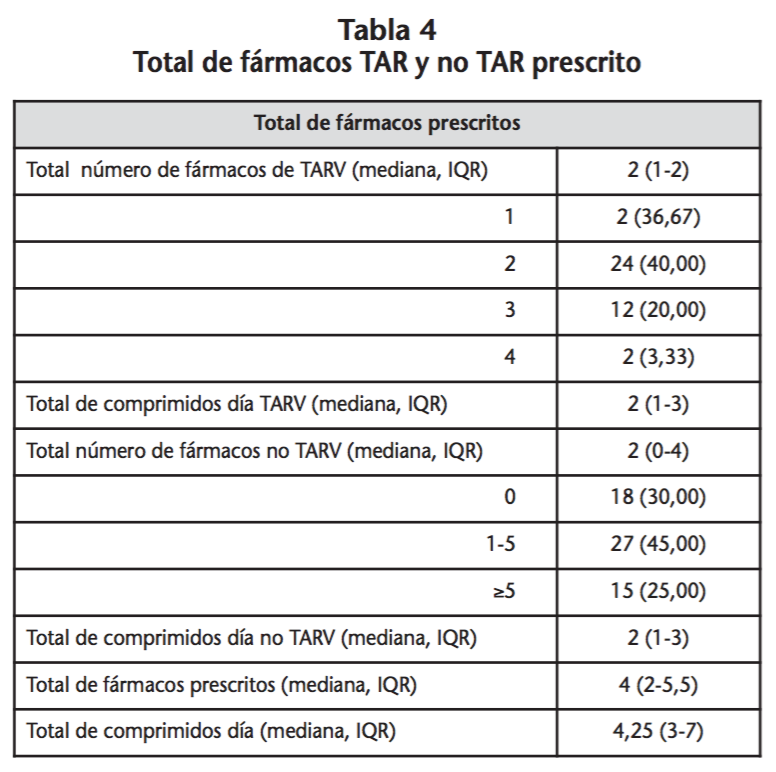
En la tabla 2 se muestran las características del TAR. El 70% de los pacientes tenían medicación asociada al TAR, en la que los fármacos más comúnmente prescritos fueron hipolipemiantes, antihipertensivos y ansiolíticos/hipnóticos/sedantes seguido de inhibidores de la bomba de protones. Los distintos tipos de medicación no TAR prescritos se describen en la tabla 3. En la tabla 4 se muestran las medianas del total de fármacos TAR y no TAR prescritos, así como el número de comprimidos diarios.
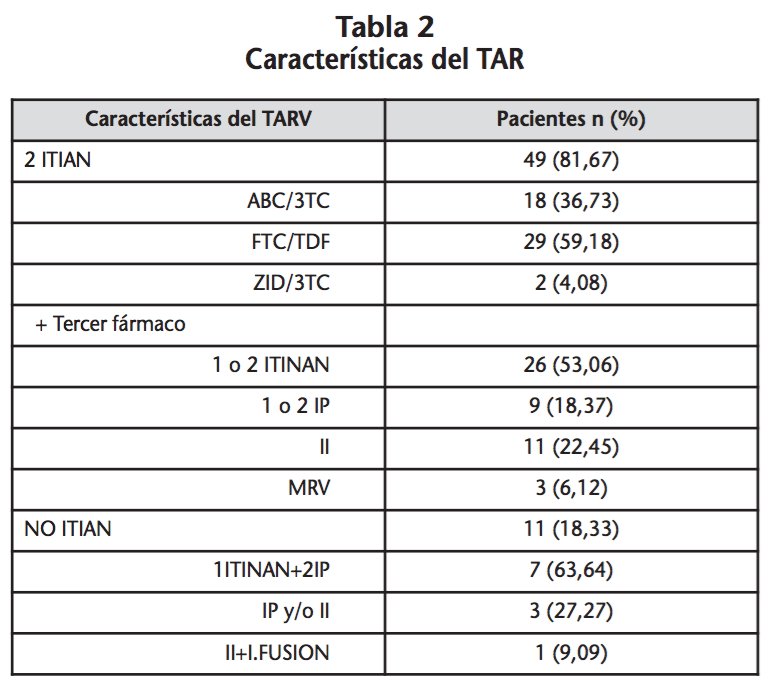
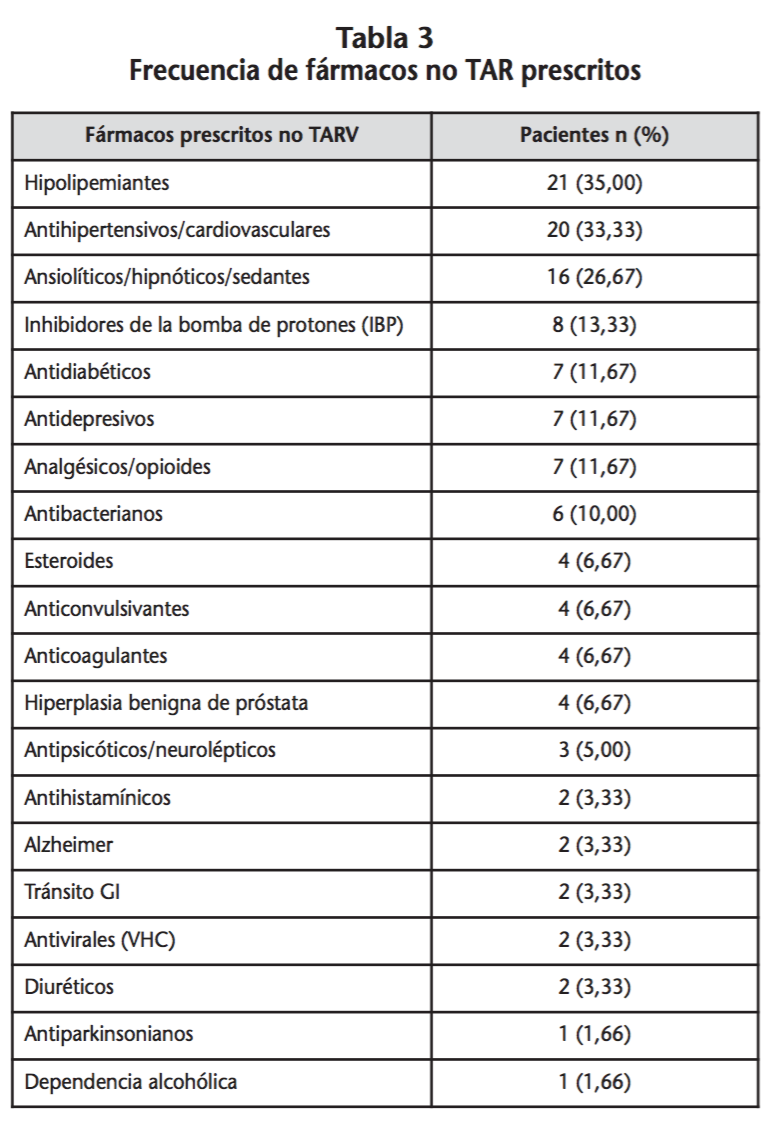
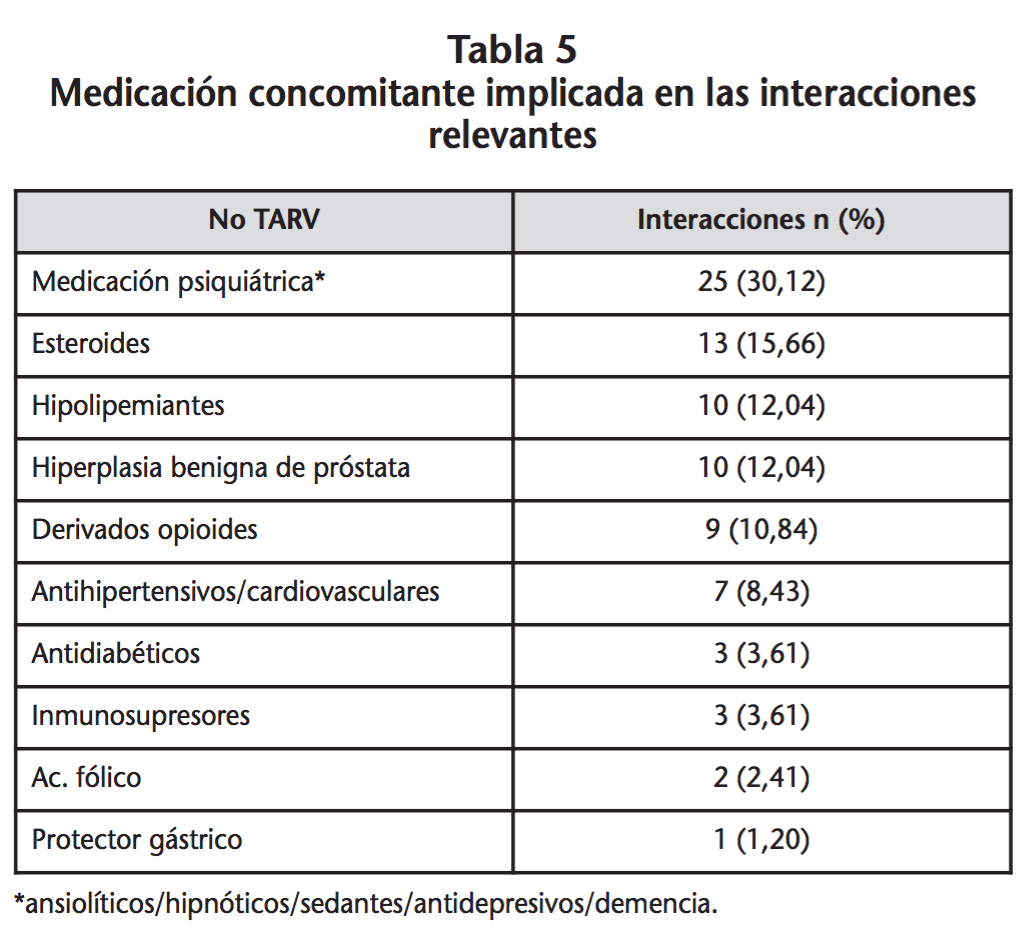
Se registraron 83 interacciones significativas TAR-noTAR, en un total de 27 pacientes, por lo que el riesgo de tener interacción TAR-noTAR en la población de estudio fue de un 64,3%. Del total de interacciones detectadas un 97,6% fueron interacciones potenciales, mientras que la cuantía de interacciones contraindicadas fue de un 2,4%, correspondientes a 2 pacientes en tratamiento concomitante con omeprazol-rilpivirina y quetiapina-atazanavir. La mediana de interacciones fue de 2 (1,0-5,5). Las interacciones casi en su totalidad fueron de tipo farmacocinético (96,4%), de estas el 50% implicaba un posible aumento de las concentraciones de fármaco y un 45% posible disminución, el resto podían producir aumento o disminución. El TAR principalmente implicado en las interacciones clínicamente relevantes fueron IP (49,4%) e ITINN (39,8%). Los fármacos no TAR con mayor número de interacciones fueron medicación psiquiátrica, esteroides e hipolipemiantes, tal como se describe en la tabla 5.
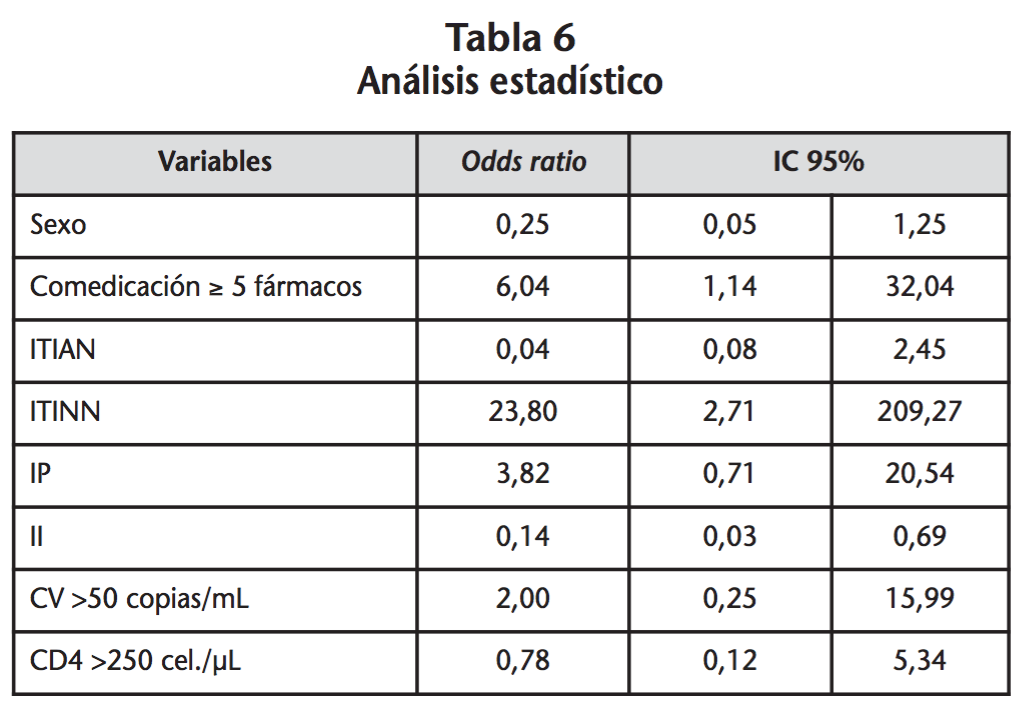
En el análisis estadístico, no hubo diferencias estadísticamente significativas en el número de interacciones respecto al sexo. Si se observaron diferencias en cuanto a la frecuencia de interacciones relevantes entre los pacientes que llevaban menos de 5 fármacos concomitantes e igual o más de 5 fármacos, siendo mayor en aquellos pacientes con más fármacos prescritos (p=0,02). Respecto al TAR utilizado, no se encontraron diferencias significativas salvo en aquellos pacientes que en su régimen utilizaban II, cuyo porcentaje de interacciones fue menor (p=0,01) y en los que llevaban ITINN donde el porcentaje de interacciones fue mayor (p<0,001). En aquellos pacientes para los que estaban disponibles los datos de CV de VIH y el recuento de CD4, no hubo diferencias estadísticamente significativas en la proporción de pacientes con CV >50 copias/mL o CD4 >250 cel/µl entre los que presentaban o no interacciones relevantes.
En la tabla 6 se puede observar como el número de fármacos prescritos y los ITIAN fueron un factor protector para la presencia de interacciones relevantes.
DISCUSIÓN
En el estudio realizado, se observa que casi un 93% de los pacientes presentaba comorbilidades y un 70% tenía medicación asociada al TAR. Se identificaron 83 interacciones en 27 pacientes entre el TAR y la medicación concomitante, lo que supone un riesgo de presentar interacción del 64,3%. La frecuencia de interacciones fue mayor en aquellos pacientes con 5 o más fármacos concomitantes, con ITINN e IP, y menor en los que llevaban II. No influyeron las interacciones en los parámetros clínicos que evalúan la eficacia del VIH (CV y recuento de CD4).
En la población de estudio, tanto el porcentaje de pacientes que presentaban comorbilidades, como el de fármacos asociados fue muy similar a un estudio en el que se investigó a pacientes mayores de 55 años en Nueva York, donde un 89% presentaban comorbilidades y un 81% recibieron fármacos concomitantes7. La comorbilidad más frecuente en este trabajo fueron las molestias gástricas, algunos autores han descrito que existe mayor frecuencia de reflujo a mayor edad12. Las siguientes enfermedades más prevalentes fueron patologías cardiovasculares, hiperlipidemias y diabetes coincidiendo con las descritas por otros autores13,14. En este sentido, se ha observado que el tratamiento prolongado con TAR se asocia con un aumento de la prevalencia de la hipertensión15. El TAR, sobre todo los IP, también se ha relacionado con un aumento de los niveles de colesterol total y triglicéridos16. Esto explica que los fármacos no TAR más prescritos en la población estudiada sean antihipertensivos e hipolipemiantes. A pesar de que la osteoporosis en las personas infectadas por VIH tiene una prevalencia tres veces mayor que en los no infectados, tan sólo un 18,33% presentaron diagnóstico de osteoporosis17.
Respecto al número de comprimidos diarios prescritos en este grupo de pacientes, la mediana de comprimidos del TAR fue la misma que la del no TAR; no obstante, se observó que la media de comprimidos al día era mayor en la medicación concomitante que en el propio TAR (3,7 frente a 2,1 comprimidos/día). Un estudio realizado durante un periodo de 20 años en pacientes VIH observó que el número de comprimidos se incrementaba en los pacientes mayores debido al aumento de la medicación asociada al TAR18.
El trabajo realizado confirma que la medicación concomitante en pacientes VIH con TAR aumenta el riesgo de interacciones de acuerdo con diferentes estudios2,13,19,20. La estimación del riesgo de presentar interacciones clínicamente relevantes entre TAR y no TAR fue superior a lo descrito en la literatura, en otros trabajos realizados en Países Bajos, Estados Unidos y Kenia, el riesgo oscila entre un 14-41% de los pacientes7,21,22.
Los fármacos concomitantes más implicados en las interacciones fueron medicación psiquiátrica (ansiolíticos/hipnóticos/sedantes/demencia), esteroides y derivados opioides, entre los que se encuentra la metadona. Seguido muy de cerca por fármacos hipolipemiantes, antihipertensivos y cardiovasculares. Los resultados son muy similares a lo descrito por Marzollini et al., donde la comedicación con mayor riesgo de interacciones eran fármacos cardiovasculares, los que afectan al sistema nervioso central y la metadona23. Hay que destacar que en un 12% de las interacciones estaban implicados antagonistas alfa-adrenérgicos, ya que la hiperplasia prostática benigna es muy prevalente en los varones de edades comprendidas entre 50-60 años24.
En el presente estudio se detectaron dos interacciones contraindicadas. Una implicaba un IBP (omeprazol-rilpivirina), ya que la rilpivirina necesita para su absorción un medio ácido y si se administran conjuntamente con omeprazol se disminuye la absorción de este. La otra interacción contraindicada detectada incluía un antipsicótico (quetiapina-atazanavir), ya que la quetiapina se metaboliza por CYP3A4 y atazanavir hace que aumenten los niveles del antipsicótico por inhibición del CYP3A4 con riesgo de prolongación del intervalo QT8.
El resto de interacciones detectadas fueron potenciales. Los trastornos depresivos son muy comunes en adultos mayores de 60 años, siendo en la población VIH dos veces más probable que en los no VIH25. Esta situación aumenta el número de interacciones potenciales, como la trazodona junto con los IP, que fue utilizada en algún paciente, pudiendo aumentar los niveles de ésta causando un riesgo para el sistema nervioso central y cardiovascular. En el caso de las benzodiazepinas, como el diazepam y clonazepam que también fueron prescritas en varios pacientes, se metabolizan por el CYP3A4, pudiendo incrementar los niveles con los inhibidores del CYP3A4, como ritonavir, produciendo más sedación y depresión del sistema nervioso central8.
Otras interacciones potenciales en este grupo de pacientes implicaban fármacos esteroideos, como la budesonida junto con IP. Su uso sistémico, intranasal o inhalado no se recomienda en combinación con IP, ya que pude resultar en una disminución de los niveles de estos y aumento de los glucocorticoides pudiendo producir síndrome de Cushing, lo mismo ocurre con la fluticasona inhalada o prednisona. En el caso de la dexametasona pueden disminuir los niveles de IP y también debe usarse con precaución26.
En los pacientes en tratamiento con metadona también existen interacciones potenciales, ya que el uso con IP puede causar abstinencia de opiáceos, pudiendo requerir aumento de dosis de metadona. Así mismo, en aquellos pacientes tratados con oxicodona junto con IP puede ser necesaria una reducción de dosis de esta. En pacientes mayores se aumenta el uso de derivados opiodes para el dolor27, por lo que el riesgo de interacciones con este tipo de fármacos es mayor y debe estar sujeto a una estrecha vigilancia.
El consumo de alcohol y drogas, puede tener influencia en las interacciones, ya que afectan al aclaramiento del fármaco, a los niveles de actividad del hígado y la función renal, con importantes impactos clínicos28.
Diversos estudios tratan de relacionar las interacciones con el grupo de TAR utilizado. Patel et al. encontraron un mayor riesgo en los regímenes que incluían un ITINN o un IP29. En el presente estudio se identificó un mayor riesgo de interacciones significativas en los regímenes que contenían un ITINN y no se revelaron diferencias significativas en las interacciones con el uso de IP, aunque se observó como son el grupo de fármacos ART más implicados en las interacciones (49%). Esto es debido a que ritonavir es un potente inhibidor de CYP3A4 y de la glicoproteína-P e induce glucuronil transferasas, CYP1A2, CYP2B6, CYP2C9, y CYP2C1913. En este trabajo, se asoció el uso de II con una menor probabilidad de interacciones, obteniendo resultados similares a los descritos por otros autores, esto puede ser debido a que los II no presentan ningún efecto inductor o inhibidor sobre el sistema del CYP450, que son los principales mecanismos de las interacciones20.
Existen una serie de limitaciones en este trabajo. En primer lugar la muestra es reducida; no obstante, es la población de pacientes mayores de 55 años con VIH tratados que hay en el área geográfica de estudio. En segundo lugar, al tratarse de un estudio retrospectivo puede haber pérdida de información en las variables recogidas de la historia clínica informatizada y del programa de laboratorio. En tercer lugar, es posible que no estuvieran todas las patologías del paciente registradas o que el tratamiento concomitante en curso no estuviera actualizado. Por último, los índices de interacciones se han subestimado, ya que no se han incluido las interacciones entre los fármacos no ART ni entre los fármacos ART.
CONCLUSIONES
Las comorbilidades y la medicación prescrita asociada al tratamiento antirretroviral en la población de estudio coinciden con lo descrito en la literatura.
Como era de esperar la comedicación hace que aumente el número de interacciones relevantes entre el tratamiento antirretroviral y no antirretroviral, de modo que la presencia de interacciones es elevada siendo casi en su totalidad de tipo farmacocinético.
Tienen más probabilidad de presentar interacciones los regímenes que incluyen ITINN e IP y menos los que incluyen un II.
Aunque no se han encontrado diferencias en los parámetros analíticos que miden el control del VIH con la presencia o no de interacciones, la aparición de estas puede incrementar en los pacientes el riesgo de reacciones adversas que afecten a su calidad de vida. Para minimizar este riesgo, resulta imprescindible la colaboración y comunicación entre los diferentes especialistas implicados en el cuidado del paciente VIH, entre los que se encuentra el farmacéutico de hospital.
En este sentido, aunque las interacciones pueden ser muchas, podrían manejarse con el conocimiento y prevención adecuados, mediante el registro y la evaluación global de la medicación que recibe cada paciente.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía
1. Holtzman C, Armon C, Tedaldi E, Joan S, Buchacz K, Wood K, et al. Polypharmacy and risk of antirretroviral drug interactions among the aging HIV- infected population. J Gen Intern Med. 2013;28(10):1302-10.
2. Seden K, Back D, Khoo S. Antiretroviral drug interactions: often unrecognized, frequently unavoidable, sometimes unmanageable. J Antimicrob Chemother. 2009;64:5-8.
3. Richardson K, Ananou A, Lafortune L, Brayne C, Matthews FE. Variation over time in the association between polypharmacy and mortality in the older population. Drugs Aging. 2011;28(7):547-60.
4. Effros RB, Fletcher CV, Gebo K, Halter JB, Hazzard WR, Horne FM, et al. Aging and infectious diseases: workshop on HIV infection and aging: what is known and future research directions. Clin Infect Dis. 2008;47(4): 542-553.
5. Department of Health and Human Services Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the use of antiretroviral agents in HIV-infected adults and adolescents. Fed Regist. 2013:1-267.5.
6. Serrano JI. Drug interaction of new antiretroviral drugs. Farm Hosp. 2011;35(1):36-43.
7. Tseng A, Foisy M. Important drug-drug interactions in HIV-infected persons on antiretroviral therapy: An update on new interactions between HIV and non-HIV drugs. Curr Infect Dis Rep. 2012;14:67-82.
8. Manzardo C, Tuset M, Miró JM, Gatell JM. Interacciones graves o potencialmente letales entre antirretrovirales y otros medicamentos. Enferme Infecc Microbiol Clin. 2015;33(7):15-30.
9. Dresser GK, Spence JD, Bailey DG. Pharmacokinetic-pharmacodynamic consequences and clinical relevance of cytochrome P450 3A4 inhibition. Clin Pharmacokinet. 2000;38:41-57.
10. Liverpool HIV drug interacctions. Access to: http:// www.hiv-druginteractions.org. [Acceso Julio 2015].
11. Micromedex Healthcare® Series [base de datos en Internet]. Greenwood Village, Colorado: Thomson Micromedex Drugdex® System. 1974-2015. [Acceso Julio 2015].
12. Nkuize M, De Wit S, Muls V, Arvanitakis M, Buset M. Upper gastrointestinal endoscopic findings in the era of highly active antiretroviral therapy. HIV Med. 2010; 11(6):412-417.
13. Buchacz K, Baker RK, Palella FJ, Shaw L, Patel P, Lichtenstein KA, et al. Disparities in prevalence of key chronic diseases by gender and race/ethnicity among antiretroviral-treated HIV-infected adults in the US. Antivir Ther. 2013;18(1):65-75.
14. Hasse B, Ledergerber B, Furrer H, Battegay M, Hirschel B, Cavassini M, et al. Morbidity and aging in HIVinfected persons: the Swiss HIV cohort study. Clin Infect Dis. 2011;53(11):1130-9.
15. Seaberg EC, Muñoz A, Lu M, Detels R, Margolick JB, Riddler SA, et al. Association between highly active antiretroviral therapy and hypertension in a large cohort of men followed from 1984 to 2003. AIDS. 2005;19 (9):953-960.
16. Feeney E, Mallon P. HIV and HAART-Associated Dyslipidemia Open Cardiovasc Med J. 2011;5:49-6.
17. Brown TT, Qaqish RB. Antiretroviral therapy and the prevalence of osteopenia and osteoporosis: a meta-analytic review. AIDS. 2006;20(17):2165-2174.
18. Krentz HB, Cosman I, Lee K, Ming JM, Gill MJ. Pill burden in HIV infection: 20 years of experience. Antivir Ther. 2012;17(5):833-40.
19. Borrego Y, Monje P, Albacete A, Labriola CI, Almeida C, Morillo R, et al. Influence of co-medication on the risk of clinically relevant drug interactions in patients with HIV. Eur J Hosp Pharm. 2013;20:88-92.
20. Evans-Jones J, Cottes LE, Back DJ, Gibbons S, Beeching NJ, Carey PB, et al. Recognition of risk for clinically significant drug interactions among HIV- infected patients receiving antiretroviral therapy. Clinic al Infectious Diseases. 2010;50(10):1419-1421.
21. Miller CD, El-Kholi R, Faragon JJ, Lodise TP. Prevalence and risk factor for clinically significant drug interactions with antiretroviral therapy. Pharmacotherapy. 2007; 27:1379-86.
22. Kigen G, Kimaiyo S, Nyandiko W, Faragher B, Sang E, Jakait B, et al. Prevalence of Potential Drug-Drug Interactions Involving Antiretroviral Drugs in a Large Kenyan Cohort (2011). PLoS ONE 6(2): e16800. doi:10.1371/ journal.pone.001680023.
23. Marzolini C, Back D, Weber R, Furrer H, Cavassini M, Calmy A, et al. Ageing with HIV: Medication use and risk for potential drug-drug interactions. J Antimicrob Chemother. 2011;66:2107-11.
24. Fernández M, Pereira I. Hiperplasia benigna de próstata: una afección de elevada prevalencia en el paciente de edad avanzada Rev Esp Geriatr Gerontol. 2008;43(1):44-51.
25. Ciesla JA, Roberts JE. Meta-analysis of the relationship between HIV infection and risk for depressive disorders. Am J Psychiatry. 2001;158(5):725-730.
26. Frankel JK, Packer CD. Cushing’s syndrome due to antiretroviral-budesonide interaction. Ann Pharmacother. 2011;45(6):823-824.
27. Nieminen TH, Hagelberg NM, Saari TI, Neuvonen M, Neuvonen PJ, Laine K, et al. Oxycodone concentrations are greatly increased by the concomitant use of ritonavir or lopinavir/ritonavir. Eur J Clin Pharmacol. 2010; 66(10):977-985.
28 Jennifer E, Kiersha S, Glover J, McNicholl IR, Fiellin DA, Justice AC. The next therapeutic challenge in hiv: polypharmacy. Drugs aging. 2013.30:613-628.
29. Patel N, Abdelsayed S, Veve M, Miller CD. Predictors of clinically significant drug-drug interactions among patients treated with nonnucleoside reverse transcriptase inhibidor, protease inhibidor and raltegravir based antiretroviral regimens. Ann Pharmacother. 2011;45: 317-24.
___
Descargar archivo en PDF: Polifarmacia y riesgo de interacciones farmacológicas en pacientes adultos con infección VIH
