Fecha de recepción: 16/12/2017 – Fecha de aceptación: 01/02/2018
Gaspar A1, Eusébio I2, Duarte R2, Morgado M2,3, Fonseca O2,4,5
1 Farmacêutica hospitalar nos Serviços Farmacêuticos do Centro Hospitalar Cova da Beira, E.P.E., Covilhã (Portugal)
2 Especialista em Farmácia Hospitalar dos Serviços Farmacêuticos do Centro Hospitalar Cova da Beira,
E.P.E., Covilhã (Portugal)
3 Professor Auxiliar Convidado, Faculdade Ciências da Saúde, Universidade da Beira Interior, Covilhã (Portugal)
4 Diretora dos Serviços Farmacêuticos do Centro Hospitalar Cova da Beira, E.P.E., Covilhã (Portugal)
5 Assistente Convidada, Faculdade Ciências da Saúde, Universidade da Beira Interior, Covilhã (Portugal)
____
Correspondencia:
Manuel Morgado
Centro Hospitalar Cova da Beira
(Serviços Farmacêuticos)
E.P.E. – Quinta do Alvito – 6200-251 Covilhã (Portugal)
Correo electrónico: manuelaugustomorgado@gmail.com
____
Sr. Director:
O tratamento da esclerose múltipla (EM) sofreu uma evolução nos últimos anos face à revisão de critérios de diagnóstico e de terapêutica e à expansão de novas opções farmacológicas, em particular as terapêuticas orais que desencadearam um amplo interesse científico e tecnológico face aos benefícios evidentes no modo de administração e tolerabilidade comparativamente às terapias parenterais. Atendendo que a EM se afigura como uma doença crónica e progressiva e além do benefício clínico comprovado no atraso da progressão da doença e da segurança demonstrada, os fármacos orais contribuíram simultaneamente para uma melhoria significativa na adesão terapêutica do doente e comodidade no modo de administração.
Em Portugal, os fármacos orais modificadores da doença aprovados e disponíveis para prescrição incluem o fingolimod, a teriflunomida e o fumarato dimetilo1. O tratamento com estes fármacos permite reduzir a actividade biológica da doença, prevenindo e reduzindo o número de surtos agudos que ocorrem na EM surto-remissão, prolongar os intervalos de tempo sem perturbações antes da ocorrência de outro surto e podem, ainda, conduzir a uma alteração no decorrer da doença, com redução da sua progressão.
A terapêutica modificadora da EM de primeira linha, segunda linha ou para escalonamento terapêutico deve ser baseada na situação clínica, contexto individual de cada doente, avaliação benefício/risco e de acordo com o tipo de EM2.
No conjunto das terapêuticas sintomáticas, a fampridina (4-aminopiridina) está indicada exclusivamente para administração em doentes adultos com EM, com todos os cursos de doença que apresentem disfunções da marcha, podendo ser usada em monoterapia ou concomitantemente com outras terapêuticas para a EM, incluindo os medicamentos imunomoduladores. Apesar de não pertencer à categoria dos fármacos modificadores da doença apresenta um protocolo de utilização específico e que consta do Formulário Nacional de Medicamentos (FNM), pelo que a sua prescrição se encontra restrita a médicos experientes no tratamento da doença1.
Dos três fármacos orais modificadores da doença, o fingolimod (Gilenya®) foi o primeiro a ser desenvolvido para a EM surto-remissão e aprovado pela U.S. Food and Drug Administration (FDA) e pela Agência Europeia do Medicamento (EMA). Quanto ao seu mecanismo de ação, funciona como modulador do recetor da esfingosina 1-fosfato, presente nas células linfócitas e hemopoiéticas, inibindo a saída de células T e B dos nódulos linfáticos e verificando-se redistribuição dos mesmos, em vez de depleção3. A dose recomendada é uma cápsula de 0,5 mg tomada uma vez por dia, com ou sem alimentos. Os efeitos adversos cardiovasculares dose-dependente são os mais reportados após a primeira administração, originando bradicardia transitória e atrasos na condução auriculo-ventricular, pelo que a primeira administração deve ser realizada em meio hospitalar, sob observação clínica e com monitorização contínua através de electrocardiograma durante 6 horas após a administração da primeira toma3,4. Antes do início do tratamento deverá, também, ser obtido um hemograma e uma contagem dos níveis séricos de transaminases hepáticas com monitorização periódica destes parâmetros durante o tratamento3.
Quanto ao perfil de interações, o cetoconazol, um inibidor CYP4F2, é um dos poucos medicamentos que pode aumentar a exposição do fingolimod, face à sua metabolização maioritária por esta isoenzima4,5. Outros fármacos a serem utilizados com precaução incluem os fármacos com efeitos cronotrópicos negativos (como por exemplo os beta-bloqueadores, a digoxina e os bloqueadores dos canais de cálcio) ou fármacos que prologuem o intervalo QT. O uso concomitante de antiarrítmicos de classe Ia ou III está contraindicado, bem como a sua utilização em doentes imunodeprimidos e em doentes com patologias cardíacas5.
A teriflunomida (Aubagio®) foi o segundo fármaco oral a estar disponível, destacando-se as suas propriedades anti-inflamatórias embora o seu mecanismo exato na EM ainda não se encontre totalmente compreendido, mas é mediado por um efeito citostático nos linfócitos T e B6.
A dose recomendada é 14 mg uma vez por dia, podendo ser tomado com ou sem alimentos6. Os efeitos adversos mais reportados foram as cefaleias, aumento dos níveis de ALT, náuseas, diarreia, parestesias, alopécia e aumento da pressão arterial, sendo recomendado uma monitorização periódica das enzimas hepáticas e medição regular da pressão arterial durante o tratamento5,7.
Em termos de interações farmacológicas destaca-se o uso concomitante com outros imunomoduladores que podem contribuir para um risco de infeção adicional.
Por fim, o terceiro fármaco oral aprovado foi o fumarato de dimetilo (Tecfidera®), exercendo um duplo mecanismo de ação, com efeitos imunomoduladores e antioxidantes conforme indicam os estudos pré-clínicos, embora o seu mecanismo de ação continue ainda sob investigação3,8.
De acordo com a posologia recomendada, a dose inicial é de 120 mg, duas vezes ao dia e após 7 dias, deve ser aumentada para 240 mg, duas vezes ao dia, com alimentos8. Quanto ao perfil de segurança, os efeitos adversos mais comuns incluem flushing (caraterizado por eritema, prurido, calor e sensação de queimadura) e os efeitos gastrointestinais (diarreia, náusea, dor epigástrica e vómitos) que podem ocorrer durante o primeiro mês de tratamento, pelo que a titulação da dose nos primeiros 7 dias permite reduzir a severidade destes sintomas3,5. Na prática clínica revela-se de extrema importância informar os doentes destes sintomas de natureza transitória e fornecer várias recomendações acerca do seu uso, no sentido de evitar o abandono precoce da terapêutica.
O potencial de interações farmacológicas observado é mínimo, afigurando-se como o fármaco oral com o perfil de segurança mais inócuo no tratamento da EM surto-emissão5.
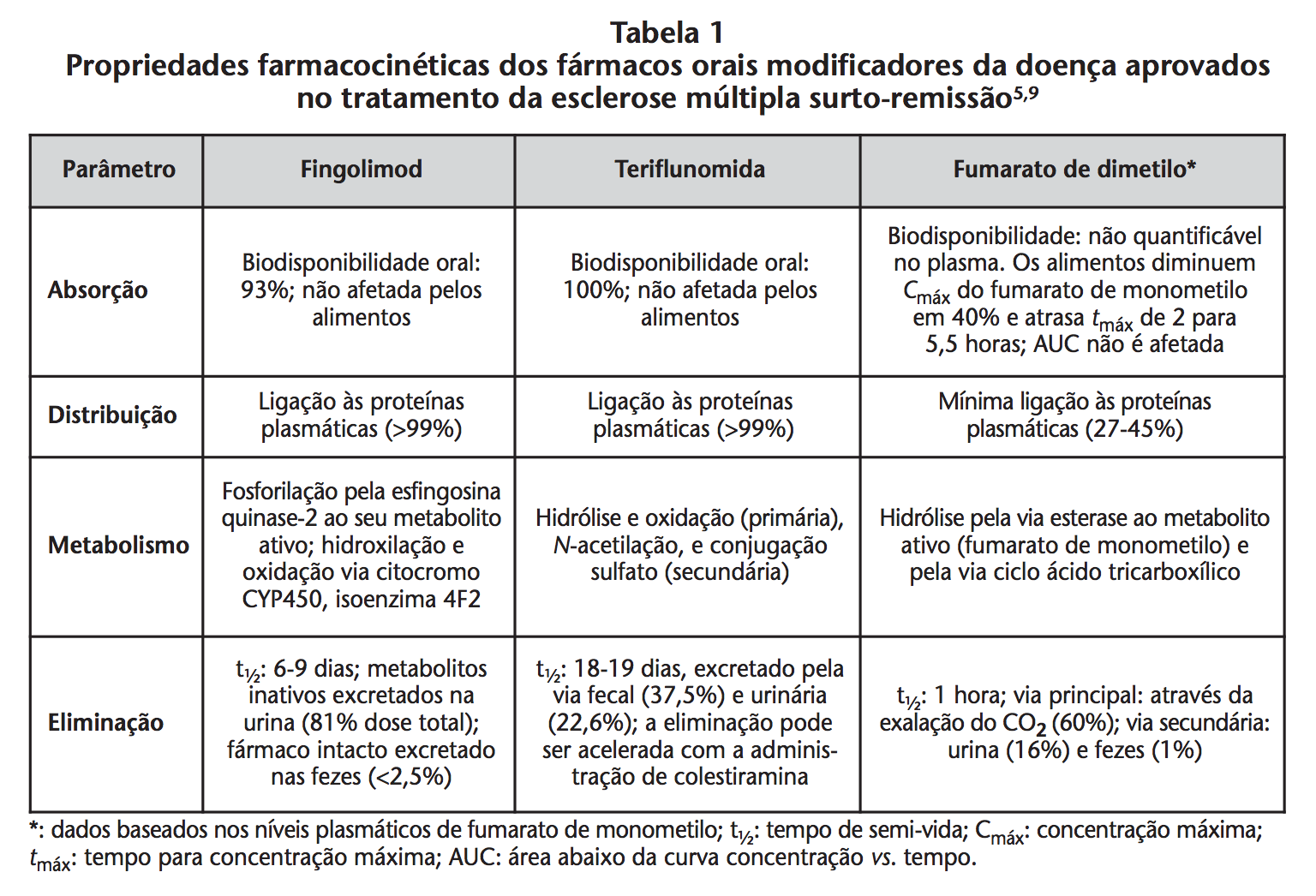
No que concerne à sua utilização durante a gravidez e o período de amamentação, os três fármacos orais descritos devem ser evitados e as mulheres com potencial para engravidar devem utilizar um método de contraceção eficaz. A tabela 1 resume as principais características farmacocinéticas dos três fármacos orais modificadores da doença.
Com a aprovação dos três novos fármacos orais para a EM surto-remissão as estratégias terapêuticas sofreram alterações com o objetivo de incluir opções mais seguras, eficazes e com vantagens relativamente às terapêuticas convencionais.
Não obstante da segurança associada às terapêuticas orais, a monitorização da eficácia e adesão terapêutica revela-se de extrema importância na prevenção de novos surtos e redução na progressão da doença, devendo essa avaliação ser realizada periodicamente por equipas multidisciplinares.
Conflito de interesses: Os autores declaram não haver conflitos de interesse.
BIBLIOGRAFIA
1. Medicamentos para o tratamento da Esclerose Múltipla. Comissão Nacional de Farmácia e Terapêutica.INFARMED. [cited 2017 august 14]. p. 1-6. Available from: http://www.infarmed.pt/documents/15786/17838/Med_tratamento_Esclerose_Multipla.pdf/6d95a901-1a4b-4424-94e4-58eed09da3f6.
2. Orientações da Comissão Nacional de Farmácia e Terapêutica. 2017; no 4:1-6.
3. Lorefice L, Fenu G, Frau J, Coghe GC, Marrosu MG, Cocco E. Oral agents in multiple sclerosis. Antiinflamm Antiallergy Agents Med Chem. 2015;14(1):15-25.
4. EMA. Resumo das Características do Medicamento Gilenya. [cited 2017 august 16]. Available from: http://www.ema.europa.eu/docs/pt_PT/document_library/EPAR_-_Product_Information/human/002202/ WC500104528.pdf.
5. Thomas RH, Wakefield RA. Oral disease-modifying therapies for relapsing-remitting multiple sclerosis. Am J Heal Pharm. 2015;72(1):25-38.
6. EMA. Resumo das Características do Medicamento Aubagio. [cited 2017 august 17]. Available from: http:// www.ema.europa.eu/docs/pt_PT/document_library/EPAR_-_Product_Information/human/002514/ WC500148682.pdf.
7. Torkildsen O, Myhr KM, Bø L. Disease-modifying treatments for multiple sclerosis – a review of approved medications. Eur J Neurol. 2016;23:18-27.
8. EMA. Resumo das Características do Medicamento Tecfidera. [cited 2017 august 18]. Available from: http://www.ema.europa.eu/docs/pt_PT/document_library/EPAR_-_Product_Information/human/002601/ WC500162069.pdf.
9. Guarnera C, Bramanti P ME. Comparison of efficacy and safety of oral agents for the treatment of relapsing–remitting multiple sclerosis. Drug Des Devel Ther. 2017;11:2193-2207.
____
Descargar artículo en PDF: Terapêuticas orais modificadoras da doença na esclerose múltipla disponíveis em Portugal
