Rev. OFIL 2017, 27;2:207-209
Fecha de recepción: 07/06/2016 – Fecha de aceptación: 24/08/2016
Llorente Serrano M1, Valera Rubio M2, Busto Medina MJ3, Barreda Hernández D4
1 Farmacéutico Interno Residente
2 Especialista en Farmacia Hospitalaria
3 Médico Especialista en Hematología
4 Jefe de Servicio de Farmacia
Servicio de Farmacia. Hospital Virgen de la Luz. Gerencia de Atención Integrada de Cuenca (España)
Correspondencia:
Marta Llorente Serrano
C/Hermandad Donantes de Sangre, s/n
16002 Cuenca
Correo electrónico: martallose@gmail.com
____
RESUMEN
Los nuevos fármacos antivirales de acción directa frente al virus de la hepatitis C hacen posible la curación real en la mayoría de los pacientes con hepatitis C crónica (HCC), presentando además un perfil de seguridad favorable.
Se describe el caso de una paciente diagnosticada de HCC que presenta un importante descenso en el recuento de plaquetas tras el inicio del tratamiento con ombitasvir/paritaprevir/ritonavir y dasabuvir, recuperándose de manera precoz al suspender la terapia antiviral.
A pesar de no estar contemplada la trombopenia en ficha técnica como reacción adversa en ninguno de estos fármacos, se establece una relación causal posible entre ambos.
Palabras clave: Hepatitis C, antivirales de acción directa, ombitasvir, paritaprevir, dasabuvir, trombopenia, reacción adversa.
____
INTRODUCCIÓN
La trombopenia es una alteración hematológica común en pacientes infectados por el virus de hepatitis C (VHC). La causa es multifactorial, por hiperesplenismo, por disminución de la producción de trombopoyetina o incluso como consecuencia de los tratamientos antivirales. En fases avanzadas de la enfermedad el recuento de plaquetas puede descender por debajo de 50.000/mm3 [150.000-450.000/mm3] y rara vez presenta sangrado importante1.
La aparición de fármacos antivirales de acción directa (AAD) frente al VHC ha posibilitado la curación de la mayoría de los pacientes2.
Destaca la asociación de tres AAD con diferentes mecanismos de acción y perfiles de resistencia no superponibles: ombitasvir/paritaprevir/ritonavir (Viekirax®) y dasabuvir (Exviera®). Ombitasvir (OBV): inhibidor de la proteína NS5A del VHC, esencial para la replicación viral; paritaprevir (PTV), inhibidor de la serin-proteasa NS3/4A del VHC, necesaria para la escisión proteolítica de la poliproteína codificada e imprescindible para la replicación viral; y ritonavir (r), sin actividad contra VHC pero inhibe el citocromo P450-CYP3A aumentando la exposición sistémica de PTV3,4. Dasabuvir: inhibidor no nucleósido de la polimerasa de ARN, necesario para la replicación del genoma viral4,5.
Ningún sujeto participante en ensayos clínicos suspendió permanentemente el tratamiento o interrumpió el mismo por reacciones adversas (RA). La única RA descrita como frecuente (1-10%) en pacientes tratados con OBV/PTV/r+dasabuvir (sin ribavirina) fue prurito3,5.
Para evaluar seguridad y eficacia en pacientes con genotipo 1b y cirrosis compensada se llevó a cabo un estudio fase 3b, multicéntrico, abierto, de un solo grupo (Turquoise-III) no contemplado actualmente en ficha técnica (FT). Los pacientes recibieron OBV/PTV/r coformulado (25/150/100 mg c/24h) más dasabuvir (250 mg c/12h) durante 12 semanas6.
La eficacia se evaluó mediante la respuesta viral sostenida a 12 semanas y en términos de seguridad se tuvieron en cuenta las RA y alteraciones analíticas en todos los pacientes.
Cabe destacar, a pesar de no ser clínicamente significativa, la alteración del recuento de plaquetas: de los 60 pacientes incluidos, 2 presentaron un empeoramiento de esta anomalía. Estos pasaron de grado 2 (presente al inicio) a grado 3, y no precisaron la suspensión prematura del tratamiento. RA más frecuentes: fatiga, diarrea y cefalea6.
Se describe el caso de una paciente en tratamiento con OBV/PTV/r+dasabuvir que sufrió una caída más severa en el recuento basal de plaquetas.
DESCRIPCIÓN DEL CASO
Mujer de 69 años con cirrosis hepática por VHC, genotipo 1b, grado de fibrosis F4 y estadío funcional A-6 (Child-Pugh), y antecedentes personales de diabetes mellitus tipo 2, hipertensión arterial, anemia multifactorial y esplenomegalia, insuficiencia renal estadio III, insuficiencia cardíaca (IC) descompensada, plaquetopenia (73.000 plaquetas/mm3) y leucopenia (3.400 leucocitos/mm3) [3.600-10.600/mm3].
No respondedora al tratamiento antiviral previo con interferón y ribavirina. Se solicitó en la Comisión de Farmacia y Terapéutica de nuestro hospital el inicio (7/10/15) con OBV/PTV/r y dasabuvir (dosis descrita en FT). Antes de iniciar el tratamiento los parámetros analíticos eran: carga viral 349.000 UI/mL, GOT 19 [2-31 U/L], GPT 13 [2-31 U/L], GGT 40 [7-32 U/L] y bilirrubina total 0,57 [0,10-1,30 mg/dL]. Estos parámetros analíticos se mantuvieron dentro de los límites normales durante todo el periodo de estudio. A los 7 días del inicio del tratamiento acudió inesperadamente a la consulta de Digestivo por dolor abdominal, dolor lumbar derecho, astenia y aumento del perímetro abdominal, presentando en analítica 68.000 plaquetas/mm3. Tras los resultados de las exploraciones (ecografía abdominal, radiografía de tórax y analítica urgente), se consideró que el malestar general no pareció una RA del tratamiento antiviral.
El 21/10/15, a los 14 días del inicio del tratamiento, la paciente volvió al hospital por presentar aumento de disnea basal, palpitaciones, oliguria y aumento de edemas en extremidades inferiores, además de tos productiva con esputo sanguinolento y sangrado activo por nariz y ano. Se evidenció trombopenia severa (7.000 plaquetas/mm3) con manifestaciones hemorrágicas y se decidió ingreso. La paciente presentó clínica compatible con IC, al parecer desencadenada por un episodio de fibrilación auricular autolimitado. Se acordó suspender en ese momento el tratamiento con OMB/PTV/r+dasabuvir y se le transfundió un concentrado de plaquetas. En los días siguientes, las plaquetas aumentaron hasta 49.000/mm3 a las 48 horas y 86.000/mm3 al cuarto día, momento en el que se decidió el alta de la paciente, con controles periódicos posteriores.
En la siguiente gráfica (Figura1) se aprecia la recuperación progresiva en los niveles de plaquetas tras suspender el tratamiento.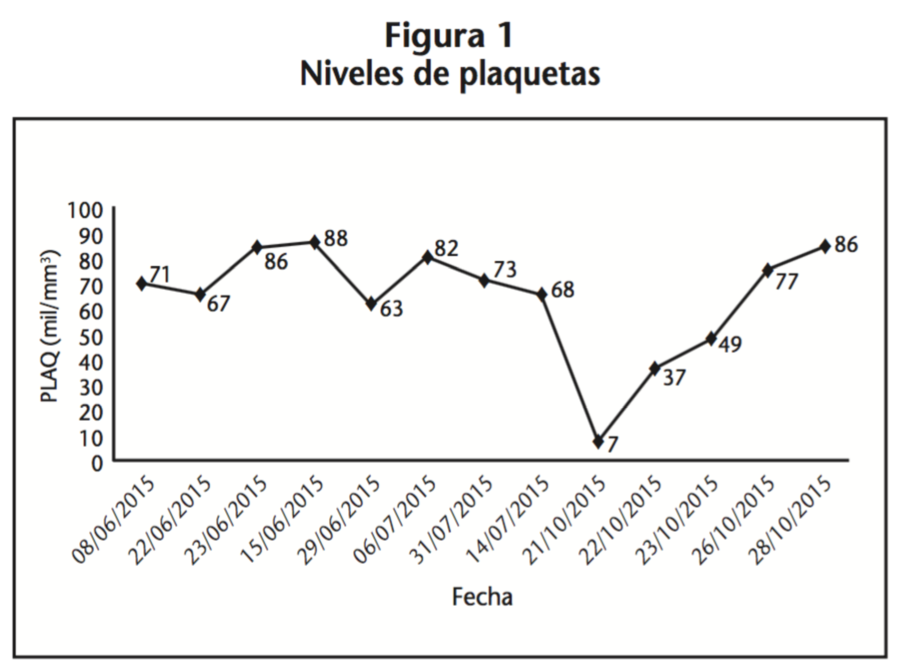
La RA fue notificada al Centro de Farmacovigilancia de Castilla La Mancha.
DISCUSIÓN
Se realizó una búsqueda bibliográfica en las bases de datos Pubmed, UpToDate y Micromedex sobre alteraciones hematológicas en pacientes con este tratamiento y la información disponible fue muy escasa. Se consultaron posibles interacciones farmacológicas7,8 entre la medicación previa que tomaba la paciente (rabeprazol, bicarbonato, insulina, alopurinol, moxonidina, hidroxicina, ácido ibandrónico y darbepoetina) y el tratamiento antiviral, sin obtener resultados determinantes.
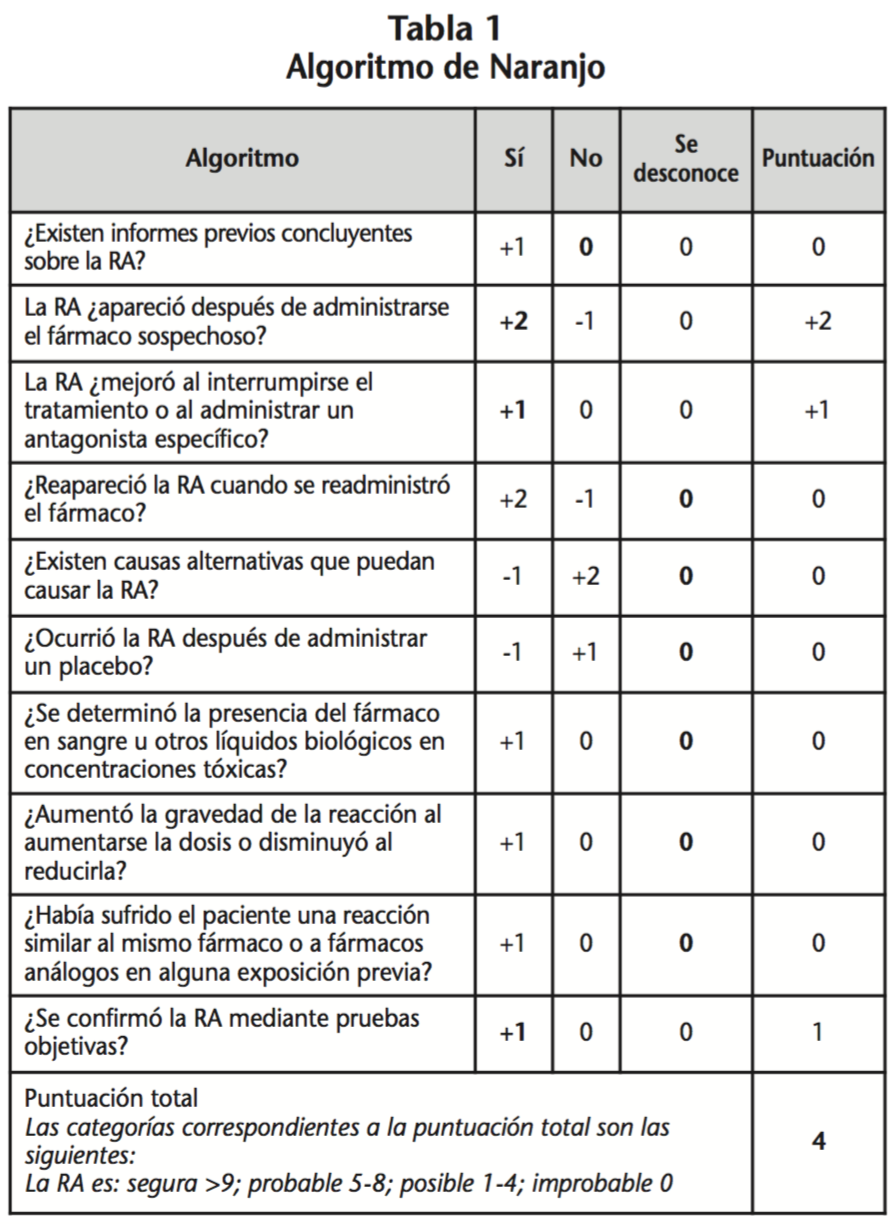 Basándonos en la RA descrita, se aplicó el algoritmo de Naranjo y colaboradores (Tabla 1)9 para realizar un análisis individual de la relación de causalidad entre la administración del tratamiento y la aparición de la RA. De entre las categorías definidas, se presume una relación posible entre el acontecimiento reseñado y la medicación administrada puesto que no se reintrodujo el tratamiento una vez suspendido y no se pudo valorar la reaparición de la RA. La paciente presentaba trombocitopenia, aunque leve, antes de iniciar el tratamiento antiviral, sin embargo existe una relación temporal razonable después de la administración del tratamiento con el agravamiento del descenso de los niveles plaquetarios.
Basándonos en la RA descrita, se aplicó el algoritmo de Naranjo y colaboradores (Tabla 1)9 para realizar un análisis individual de la relación de causalidad entre la administración del tratamiento y la aparición de la RA. De entre las categorías definidas, se presume una relación posible entre el acontecimiento reseñado y la medicación administrada puesto que no se reintrodujo el tratamiento una vez suspendido y no se pudo valorar la reaparición de la RA. La paciente presentaba trombocitopenia, aunque leve, antes de iniciar el tratamiento antiviral, sin embargo existe una relación temporal razonable después de la administración del tratamiento con el agravamiento del descenso de los niveles plaquetarios.
Se solicitó información al Centro de Farmacovigilancia de Castilla La Mancha, de las notificaciones registradas en la base de datos del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano, sin ninguna aportación nueva.
En diciembre/2015, la Agencia Española de Medicamentos y Productos Sanitarios publicó una nota informativa sobre el riesgo de descompensación e insuficiencia hepáticas tras la administración de ombitasvir/paritaprevir/ritonavir con o sin dasabuvir10. En esta nota se mencionó que en pacientes con cirrosis que comenzasen tratamiento con este régimen se debería monitorizar la función hepática especialmente al inicio; y en caso de descompensación hepática clínicamente relevante, debería suspenderse el tratamiento.
Podemos concluir que la RA presentada se definiría como severa: constituye una amenaza para la vida de la paciente, requiere hospitalización y transfusión de plaquetas e implica la suspensión del tratamiento antiviral.
Sería conveniente vigilar estrechamente los parámetros hematológicos en pacientes con bajos niveles de plaquetas al inicio del tratamiento con AAD por la posibilidad del descenso, tal y como ocurre en el caso aquí descrito.
Hemos de destacar, además, que la trombopenia no parece ser de etiología inmune, por lo que es susceptible de ser corregida con transfusión de plaquetas, y es rápidamente reversible tras la suspensión de los fármacos.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía
1. Olariu M, Olariu C, Olteanu D. Thrombocytopenia in Chronic Hepatitis C. J Gastrointestin Liver Dis. 2010 Dec;19(4):381-5.
2. Macías J. Documento de consenso del grupo español para el estudio de la hepatitis (GEHEP) sobre el tratamiento de la hepatitis C. [Citado en Octubre de 2015]. Disponible en: https://www.seimc.org/contenidos/gruposdeestudio/gehep/dcientificos/documentos/gehep-dc-2014-TratamientodelaHepatitisC.pdf.
3. Agencia Española de Medicamentos y Productos Sanitários (AEMPS). Ficha técnica de Viekirax®; AEMPS. [Citado en Octubre de 2015]. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/003839/ WC500183997.pdf.
4. Agencia Española de Medicamentos y Productos Sanitários (AEMPS). Informe de Posicionamiento Terapéutico de Viekirax® (ombitasvir/paritaprevir/ritonavir) y Exviera® (dasabuvir). [Citado en Octubre de 2015]. Disponible en: http://www.aemps.gob.es/ medicamentosUsoHumano/informesPublicos/docs/IPT-viekirax-exviera.pdf.
5. Agencia Española de Medicamentos y Productos Sanitários (AEMPS). Ficha técnica de Exviera®; AEMPS. [Citado en Octubre de 2015]. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/003837/ WC500182233.pdf.
6. Feld JJ, et al. Sustained virologic response of 100% in HCV genotype 1b patients with cirrhosis receiving ombitasvir/paritaprevir/r and dasabuvir for 12 weeks. J Hepatol. (2015). [Citado en Noviembre de 2015]. Disponible en: http://dx.doi.org/10.1016/j.jhep.2015. 10.005.
7. Bases de datos de Food and Drugs Admininistration (FDA), First DataBank and AHFS Drug Information® publicado por The American Society of Health-System Pharmacists. [Citado en Noviembre de 2015]. Disponible en: http://reference.medscape.com/drug-interactionchecker.
8. Web de consulta de interacciones medicamentosas. University of Liverpool website. [Citado en Noviembre de 2015]. Disponible en: http://www.hep-druginteractions.org/ http:// www.hep-druginteractions.org/interactions.aspx.
9. Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts EA, Janecek E. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther. 1981,30:239-45.
10. Agencia Española de Medicamentos y Productos Sanitários (AEMPS). Notas informativas. [Citado en Enero 2016]. Disponible en: http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2015/docs/NI-MUH_FV_13-insuficiencia-hepatica-viekirax.pdf.
____
Descargar PDF: Posible trombopenia por ombitasvir, paritaprevir y dasabuvir en hepatitis C. A propósito de un caso
