Fecha de recepción: 30/08/2017 – Fecha de aceptación: 16/11/2017
Arias Pou P1, Delgado Latorre A1, Aguinagalde Toya A2, Gaspar Carreño M3, Silberberg Muiño JM4, Sobrido Sampedro C5
1 Servicio de Farmacia. Clínica Universidad de Navarra. Madrid (España)
2 Servicio de Farmacia. Hospital Beata María Ana de Jesús. Madrid (España)
3 Servicio de Farmacia. Hospital Intermutual de Levante. Valencia (España)
4 Servicio de Cirugía Ortopédica y Traumatología. Clínica Universidad de Navarra. Madrid (España)
5 Servicio de Radiología. Clínica Universidad de Navarra. Madrid (España)
____
Correspondencia:
Paloma Arias Pou
HM Hospitales (Farmacia Central)
Plaza Conde Valle Suchil, 2
28015 Madrid
Correo electrónico: pariaspo@hotmail.com
____
Resumen
Los objetivos de esta revisión han sido describir las formulaciones de ácido hialurónico (AH) comercializados en España para patologías de reumatología y traumatología y detectar las características similares y diferenciales que permitan una adecuada selección.
Se utilizó la base de datos BotPlus® para identificar las presentaciones comercializadas en España. De las seleccionadas se estudiaron las siguientes propiedades: método de elaboración, composición, indicaciones, vía de administración, posología y características físicas utilizando las monografías y fichas técnicas de los productos. De la base de datos National Center for Biotechnology (NCBI) se seleccionaron las publicaciones de estudios comparativos en humanos de eficacia y seguridad entre varias formulaciones.
En el momento de realizar esta revisión, se encuentran comercializados en España 39 productos de AH autorizados como productos sanitarios y uno como medicamento, el Hyalgan®. Estas presentaciones difieren en cantidades, concentración y peso molecular de AH, volúmenes y número de administraciones. El registro de estos productos como medicamentos en lugar de como productos sanitarios supondría la realización de ensayos clínicos de mayor calidad que permitieran una mejor selección.
La proliferación de estos productos de AH hace más ardua y compleja una adecuada selección. Al no disponer de datos diferenciales concluyentes respecto a su eficacia clínica la elección de unos u otros productos va a depender de diversos factores como la experiencia de los profesionales, los resultados clínicos obtenidos, la articulación a tratar, las preferencias de los pacientes, la oferta comercial u otros. Sería precisa la realización de mayor número de estudios comparativos entre las distintas presentaciones de AH para una mejor selección entre ellas.
Palabras clave: Ácido hialurónico, viscosuplementación, articulación, osteoartritis.
____
Introducción
La osteoartritis (OA) es la enfermedad articular crónica más común a nivel mundial1,2. Sus tasas de prevalencia e incidencia están estrechamente relacionadas con la edad y el sexo. Debido al creciente envejecimiento de la población el número de casos de artrosis se prevé que aumente significativamente3.
Los pacientes presentan síntomas como dolor, inflamación o rigidez en una o varias articulaciones4. Esta patología es responsable de una considerable carga clínica y económica como resultado de la reducción en la calidad de vida, el mayor uso de recursos y la pérdida de productividad4,5. Se produce en cualquier articulación pero es más frecuente en manos y en articulaciones que soportan peso, como cadera y rodillas4.
Las causas de OA pueden ser de tipo mecánico, traumático, metabólico, post-inflamatorio, genético o relacionado con la edad6. Los objetivos del tratamiento de OA son reducir los síntomas y la progresión de la enfermedad para minimizar el impacto de la OA en la movilidad de los pacientes y en su calidad de vida7. Se utilizan diversas estrategias que incluyen acciones farmacológicas y no farmacológicas4,8. Las recomendaciones no farmacológicas están encaminadas a reducir la carga que soporta la articulación mediante la reducción del sobrepeso, el ejercicio regular o la fisioterapia. El tratamiento sintomático incluye el uso de analgésicos, antiinflamatorios no esteroideos (AINEs) e inyecciones intraarticulares (IA) de corticoides4,9,10. Debido a los efectos adversos asociados a estos medicamentos se han ido desarrollando otros tratamientos alternativos4.
El AH es un polímero lineal de alta viscosidad compuesto por unidades repetidas de N-acetil-D-glucosamina y D-glucoronato sódico unidos en posición β-1,3 y β-1,4 por puentes glucosídicos11. En 1986, Balazs et al. propusieron el nombre de “hyaluronan” (hialuronato) para referirse tanto al AH como a su sal (hialuronato sódico). Este término hace referencia por tanto a la molécula independientemente de su estado de disociación12.
El AH se encuentra ampliamente distribuido en los tejidos del cuerpo humano y está presente a elevadas concentraciones en el líquido sinovial, siendo su constituyente mayoritario13-16. Promueve la viscoelasticidad y ayuda a proteger el cartílago articular y los tejidos blandos adyacentes8,13. En la OA el peso molecular (PM) y la concentración de AH están reducidas4,8,13. El concepto de viscosuplementación con AH consiste en la administración de inyecciones IA de soluciones viscoelásticas de hialuronato o sus derivados con el objetivo de restablecer las propiedades reológicas del líquido sinovial alterado en la articulación artrósica4,5,9,12,14.
Las inyecciones IA de AH para el tratamiento del dolor en la OA de rodilla fueron aprobados por primera vez en Japón e Italia en 1987 y en EE.UU. en 199714. Han demostrado ser efectivas en el tratamiento de la OA degenerativa13,14,17,18 y algunos autores las califican como el tratamiento más efectivo y más seguro19.
Se han descrito numerosos mecanismos de acción para el AH exógeno14,18. Entre ellos cabría destacar:
1. Efecto mecánico: actúa como lubricante en la interacción física y mecánica entre tejidos adyacentes, y como soporte viscoelástico manteniendo la separación entre tejidos3.
2. Propiedades antiinflamatorias: inhibe la migración y quimiotaxis leucocitaria, reduce la síntesis de prostaglandinas E2 (PGE2), la producción y actividad de mediadores proinflamatorios y la producción de NO20.
3. Efecto de recubrimiento: protege el cartílago y bloquea la pérdida de proteoglicanos de la matriz del cartílago en el espacio sinovial20, constituye una barrera de filtración y de defensa y reduce los impulsos nerviosos y la sensibilidad asociada al dolor6,14,20-22.
4. Viscoinducción: estimula la síntesis del AH endógeno prolongando el efecto terapéutico más allá de la permanencia del producto en la articulación12,20,23.
Otros mecanismos de acción descritos son participar en la nutrición articular del cartílago y en la eliminación de metabolitos y sustancias nocivas procedentes de la cavidad articular20.
El AH, tras su administración, se distribuye fundamentalmente entre el líquido sinovial, los ligamentos y músculos próximos a la articulación11. Se metaboliza fundamentalmente en el hígado, siendo excretado parcialmente por vía urinaria en forma de N-acetil-D-glucosamina y D-glucosamina. Sin embargo, alrededor del 80% de la dosis administrada por vía IA se excreta como CO2 a través del aparato respiratorio11.
La eficacia de las inyecciones IA de AH ha sido demostrada en diversos estudios y meta-análisis19. También está incluida en las recomendaciones de diversas guías clínicas como OARSI, ESCEO2,7. Tienen un perfil de seguridad muy favorable siendo la AE más común el dolor en el lugar de la inyección. En este sentido, la inyección de IA AH puede ser una buena alternativa para los AINEs especialmente en pacientes ancianos o aquellos con mayor riesgo de reacciones adversas a estos medicamentos7.
Las preparaciones de AH para tratamiento de OA están actualmente autorizadas a nivel mundial23. En el mercado español, existen un número importante de presentaciones de AH disponibles para el tratamiento de la OA. Están compuestas por AH en concentraciones de 0,8 a 2,5% de AH. Según el PM se pueden clasificar en bajo, medio y alto PM (8). Estas presentaciones difieren, además de en la concentraciones y en el PM, en otras características como régimen posológico17, eficacia o seguridad13,23,24.
OBJETIVO
• Describir las presentaciones de AH comercializadas en España para uso en reumatología o cirugía ortopédica y traumatológica.
• Detectar las características similares y diferenciales de estos productos para facilitar su comparativa y selección en la práctica clínica habitual.
MATERIAL Y MÉTODOS
Se realizó una búsqueda de los productos sanitarios y medicamentos de AH comercializados en España. La base de datos utilizada fue el Botplus® del Consejo General de Farmacéuticos. A partir de esta búsqueda se seleccionaron las presentaciones indicadas para OA y por tanto utilizadas por los servicios de reumatología o cirugía ortopédica y traumatológica.
De las presentaciones seleccionadas se estudiaron de manera detallada las siguientes propiedades: método de elaboración, composición, indicaciones, vía de administración, posología y características físicas. Para este estudio se utilizaron las siguientes fuentes de información: monografías y fichas técnicas de los productos y guías de tratamiento de la osteoartritis de las sociedades científicas más destacadas. Por último se realizó una búsqueda bibliográfica en NCBI para detectar estudios en humanos que compararan la eficacia y seguridad de las distintas presentaciones de AH comercializadas.
RESULTADOS
En los últimos años la comercialización de presentaciones de AH ha ido en aumento. En el año 2000 existían en España seis presentaciones12 y en el 2012, doce25. En el estudio actual se encontraron 40 presentaciones de AH de 15 laboratorios distintos3,6,11,20,22,26-51. De todas ellas Hyalgan® es el único autorizado en España como medicamento. El resto se clasifica como productos sanitarios clase III, implante clínico. Adant® fue el primer AH autorizado en España en 1996 para el tratamiento de la artrosis. También es la primera terapia de AH aprobada en EE.UU. para el dolor de rodilla por OA.
Método de obtención
Originalmente se obtenían los preparados de AH de tejidos de origen animal, en concreto de la cresta de gallo15,17, mediante procesos de extracción y purificación. Posteriormente se han desarrollado otras vías de biosíntesis como la biofermentación a partir de cultivos bacterianos de especies de estreptococo.
• De las presentaciones actualmente disponibles tan solo Hyalgan® y Synvisc® se obtienen a partir de la cresta de gallo. Estos productos podrían provocar reacciones de hipersensibilidad en pacientes con alergia a proteínas procedentes de aves, por tanto, están contraindicados en este grupo de pacientes.
• Las presentaciones obtenidas por medios biotecnológicos a partir de bacterias podrían, por su parte, producir infecciones por bacterias Gram positivo, como se describe en la información de algunos de estos productos.
Composición
Algunos preparados poseen algunas peculiaridades en lo que respecta a su composición:
• El Monovisc®, el Fermathron® y el Durolane® son ligeramente reticulados. La técnica por la que se consiguen estos entrecruzamientos difiere de unos productos a otros.
• El Synvisc® está compuesto por hilanos, productos derivados del hialuronato (sal sódica de AH), en concreto por hilano G-F 20. Éste contiene polímeros entrecruzados de hilano A e hilano B producidos a partir de un extracto aviar altamente purificado. El hilano A tiene un PM medio de aproximadamente 6.000 KDa y el hilano B es un gel hidratado12. Esta estructura le confiere una permanencia más prolongada en la articulación, pasando de 72 horas para AH fluidos a 44-58 días.
• Renehavis® es una combinación de un AH de bajo (1.000 KDa) y alto PM (2.000 KDa) que aporta, en una sola inyección, propiedades de viscoinducción y viscosuplementación.
• Hymovis® introduce una mínima modificación química al AH, la adición de una cadena alquílica con grupos amida. Sus cadenas laterales alquílicas y los grupos amida asociados forman interacciones hidrofóbicas reversibles que aumentan la viscosidad y elasticidad del producto. Al contrario que los AH reticulados, con enlaces rígidos, Hymovis puede recuperar completamente su elasticidad tras impactos mecánicos repetidos, mecanismo descrito como tecnología MO.RE®. Además es más resistente a la despolimerización por la hialuronidasa con respecto al AH no modificado lo que le confiere mayor tiempo de permanencia en la articulación22.
• Otras presentaciones combinan AH con otros productos como triamcinolona (Cingal®), sulfato de condroitina (Arthrum HCS®) o sorbitol (Synalis va®). La combinación de un corticoide con AH proporciona un alivio a corto plazo del dolor por la acción del corticoide y un efecto a largo plazo de lubricación y soporte mecánico proporcionado por el AH17.
La mayoría de las presentaciones están diseñadas para su administración por vía intraarticular. En la tabla 1 se resumen las características de las preparaciones con alguna peculiaridad en cuanto a la composición y a la vía de administración.
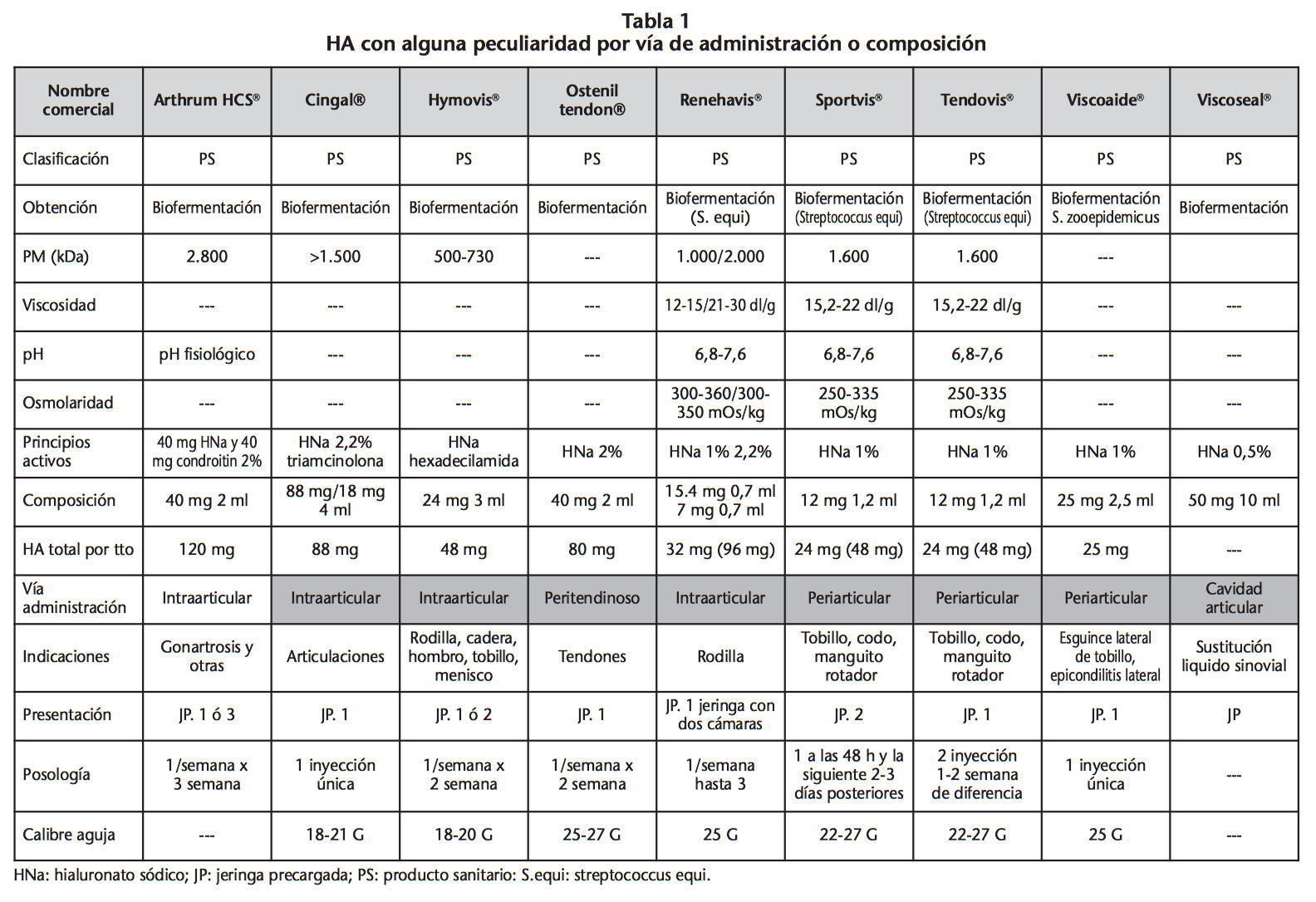
Posología
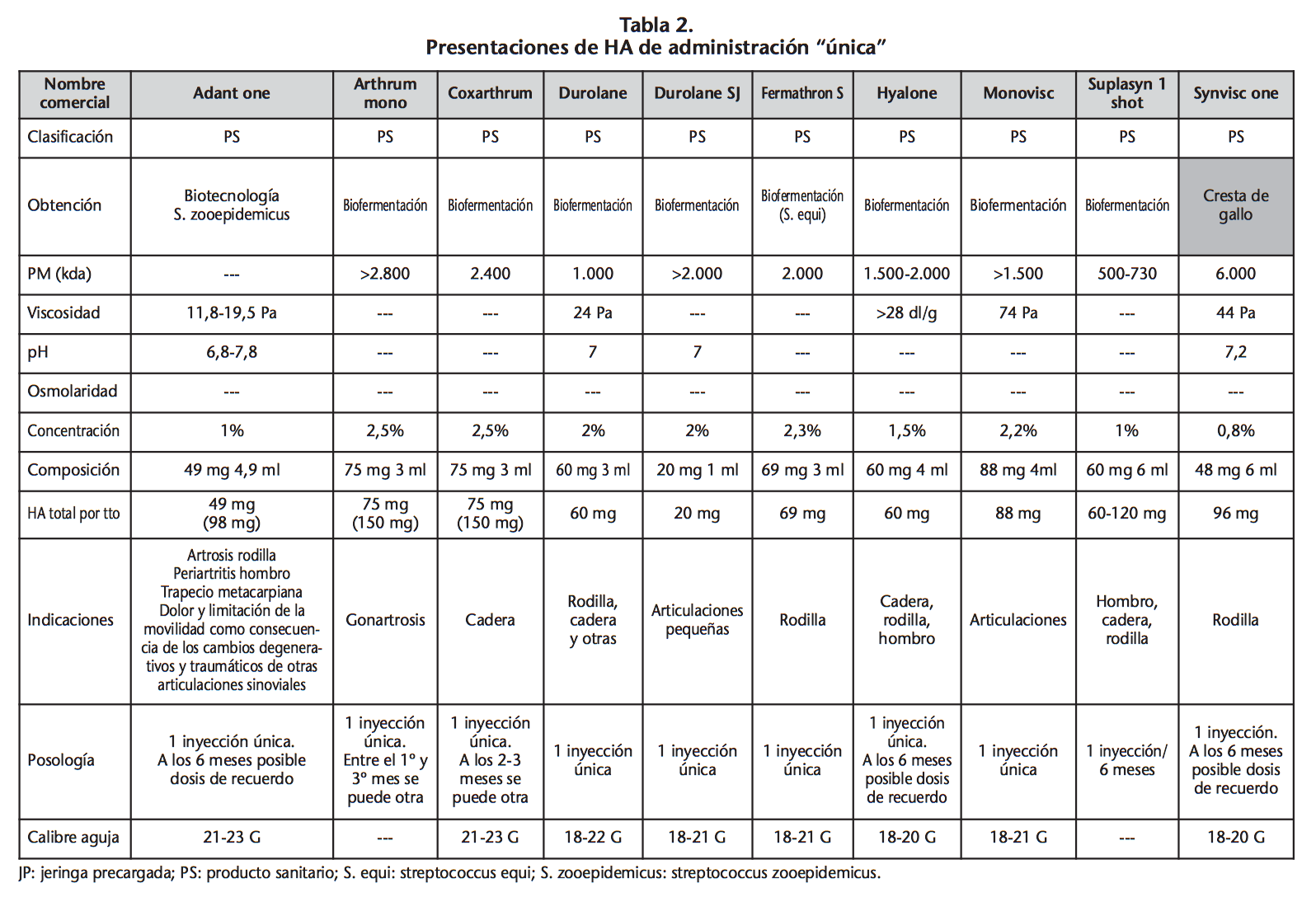
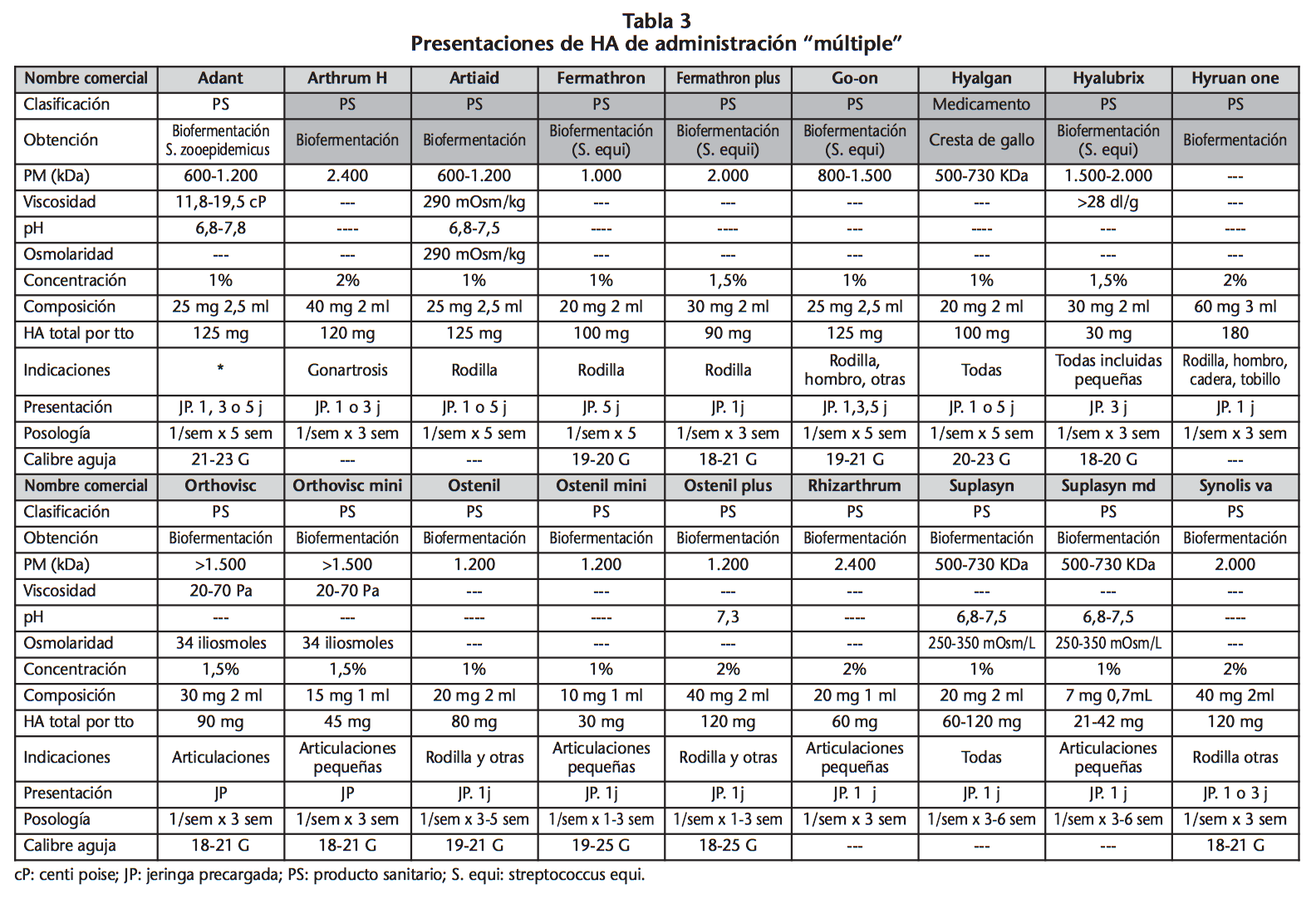
Un ciclo de tratamiento con AH, en general, requiere varias administraciones. Habitualmente se administran una vez a la semana durante 3-5 semanas consecutivas17,23. Sin embargo, ya hay disponibles diez presentaciones de administración única con cantidades de AH que van desde 20 mg en Durolane SJ® a 88 mg en Monovisc® (Tabla 2). Para las articulaciones pequeñas hay presentaciones de bajo volumen (1 mL), Durolane SJ®, Ostenil mini®, Orthovisc mini® o Suplasyn md® de 0,7 mL (Tabla 3). En última instancia, el número de infiltraciones variará según la situación clínica de cada paciente y la evolución de su patología.
Seguridad
Las precauciones son comunes para todas las presentaciones de AH comercializadas. El AH puede precipitar al entrar en contacto con sales de amonio cuaternario, como el cloruro de benzalconio. Éste es un componente habitual de algunos desinfectantes, utilizados tanto para la desinfección tópica previa a la administración como en equipos médicos o quirúrgicos.
Estos productos poseen un perfil de seguridad y tolerancia adecuado. Los efectos adversos más frecuentes están relacionados con el sitio de la inyección y son dolor, hinchazón o derrame, reacciones cutáneas localizadas (eritema, equimosis) y prurito23. Hay casos aislados descritos de artritis pseudogotosa y artritis aguda52.
DISCUSIÓN
La autorización de productos sanitarios de AH para administración IA en el tratamiento de la OA está aumentando de manera exponencial. La diferencia en la autorización de un producto como medicamento o producto sanitario radica en si su mecanismo de acción principal se basa en mecanismos farmacológicos o no farmacológicos (RD 1/2015)53. Aunque el mecanismo de acción exacto del AH exógeno no está del todo claro18, la evidencia actualmente disponible sobre las funciones del AH en la articulación hace que esta clasificación pueda ser discutida, sobre todo, en lo que se refiere al efecto de viscoinducción20. Se sostiene que el AH exógeno presenta algún mecanismo biológico porque el producto desaparece de la articulación en 1-2 días y el efecto dura meses14. Nos encontramos por tanto ante un producto que podríamos clasificar como producto sanitario frontera debido a que no está del todo clara su correcta clasificación dentro de los productos sanitarios.
La diferencia en los métodos de obtención de las preparaciones de AH no tiene repercusión en la eficacia14,54. Respecto al perfil de seguridad han demostrado ser muy bien tolerados durante largos periodo de tiempo de observación, de meses o incluso un año8,14,16. Las preparaciones obtenidas de material biológico o por biosíntesis presentan, en ambos casos, infrecuentes reacciones adversas. La biofermentación tiene la ventaja de que se puede producir de manera ilimitada a gran escala. Al no tener proteínas animales evita la posible transmisión de enfermedades animales o reacciones alérgicas. Algunos estudios obtienen menor número de reacciones adversas con productos obtenidos por biofermentación frente a los obtenidos a partir de material biológico14,16.
Las presentaciones tradicionalmente utilizadas han sido para su administración IA para el tratamiento de OA en diferentes articulaciones. En los últimos años encontramos presentaciones que van incorporando otras indicaciones como patologías periarticulares e incluso del tendón y cuya administración es por vía periarticular. Su estudio detallado sobrepasa el objeto de esta revisión. Los productos disponibles en el mercado español tienen como indicación aprobada gonartrosis en muchos casos, ya que la rodilla es la articulación más afectada en la OA15. Los estudios en otras indicaciones son más escasos55.
La existencia de productos de AH con diferentes PM nos lleva a plantear cuál es la mejor preparación para pacientes con OA8. Se conoce que el mecanismo de acción del AH IA varía según el peso molecular debido a que el tipo de interacción que establece el AH con los receptores de AH en la membrana celular depende del PM4. La estimulación máxima de la síntesis endógena de AH se produce con PM de alrededor de 500 KDa y disminuye con PM alrededor de 3.0004.
Cabría proponer que las presentaciones de peso molecular intermedio sean más adecuadas para los pacientes con bajo grado de degeneración articular donde podría haber respuesta tisular y todavía se podría estimular la reparación4. Las moléculas de bajo PM de AH tienen una débil unión a los receptores para promover la biosíntesis de AH y las de medio PM se unen en mayor medida10.
Se ha barajado la hipótesis de que al aumentar el PM de preparación de AH y prolongar así el tiempo de permanencia del AH en la articulación su eficacia mejoraría, el efecto viscoelástico en el cartílago resultaría más beneficioso1,24,56. A parte de reducir la inflamación de la articulación y la sensibilidad nociceptiva se puede sugerir que la administración de AH de alto PM, tras la despolimerización en el líquido sinovial en moléculas de medio PM, pueda tener efecto de viscoinducción en la membrana del cartílago4. También se podría plantear como una desventaja la mayor viscosidad de las preparaciones con entrecruzamientos por la mayor resistencia a la administración pero en el estudio de Diracoglu et al. no hubo inconvenientes en este sentido15. En referencia a la viscosidad no se han encontrado, por tanto, resultados concluyentes.
Algunos estudios dan resultados a favor de las presentaciones de alto PM24,57,58 y otros no muestran diferencias8,9,10,14,23,55,56,59,60,61. Al comparar presentaciones de medio PM frente a bajo PM encontramos estudios que no muestran diferencias10,14,54 y otros que muestran superioridad con las presentaciones de medio peso molecular16. También se ha sugerido que la concentración del AH puede ser más importante respecto al efecto clínico que el peso molecular10.
Por otro lado Synvisc®, preparado de alto peso molecular, fue inferior a Renehavis®, en el estudio de Petrella 200813, y a otros productos no comercializados en España (Hyajoint plus®, Hydros TA®, Variofill®)5,17,62. Mientras que un preparado concreto tiene un PM determinado, ya sea alto, medio y bajo, no hay un producto diseñado con una composición que mimetice las necesidades de la articulación artrítica13. El Renehavis® al presentar dos PM distintos en la misma administración permite aportan tanto propiedades de viscosuplementación como de viscoinducción según los resultados de este estudio13.
La combinación del AH con corticioides tiene la ventaja de presentar el efecto sinérgico de ambos tratamientos en una sola inyección. La viscosuplementación tiene un alivio del dolor retardado con poco efecto observado en las dos primeras semanas tras la inyección5,15. Sin embargo su efecto es más duradero que el de los corticoides5,13,16. Los corticoides proporcionan una reducción del dolor muy rápida que dura unas 2-3 semanas5,19,63. Son eficaces en los episodios de dolor agudo y en las exacerbaciones de OA5. A día de hoy encontramos una presentación comercializada en España que presenta esta combinación, Cingal®39.
A parte del PM de las presentaciones hay otras variables menos estudiadas que pueden influir en el perfil de eficacia y seguridad de estos productos como el número de inyecciones a administrar, la dosis y volumen por inyección, la estructura del AH linear o entrecruzada y sobre las que tampoco hay consenso9,15. Algunas presentaciones indican que el volumen a administrar varía según la articulación a tratar por lo que una misma presentación serviría para distintas patologías o distintos puntos de administración. En el estudio de Diracoglu et al. se obtuvieron mejores resultados con la administración de Adant® tres inyecciones semanales frente a Monovisc® en inyección única. Los autores sugieren que las presentaciones que requieren varias administraciones permiten que la exposición de la superficie articular al AH aumente15.
Wobig et al., Atamaz et al. y Berenbaum et al. obtienen mejores resultados con productos de alto o medio PM frente a otros de bajo PM16,57,58. Sin embargo, utilizan para estos últimos un esquema de administración de tres semanas cuando lo recomendado por el fabricante son cinco semanas8. Berenbaum et al., observan superioridad de Go-on® a partir del sexto mes cuando el producto de bajo PM ya ha perdido su eficacia16. Sun et al. argumentan que uno de los motivos para obtener mejores resultados con Hyalpoint® se debe a su menor volumen frente a Synvisc one®17. También en relación con el entrecruzamiento o los HA lineares hay estudios que dan resultados similares15.
La gama de productos disponibles permite su elección en base a aspectos técnicos farmacéuticos y a preferencias del propio paciente. Al seleccionar el tratamiento, el criterio clínico debería tener en cuenta consideraciones como la forma posológica, la facilidad de uso, la seguridad de la administración repetida, las alergias de los pacientes entre otros14.
Las presentaciones que requieren una inyección única pueden ser más cómodas para el paciente ya que reducen el número de visitas a un centro hospitalario y el número de inyecciones, con el consiguiente menor riesgo asociado14. Por otra parte las presentaciones de varias administraciones pueden ser elegidas por el profesional sanitario para hacer un seguimiento más estrecho de la evolución del paciente54. Al elegir entre una única administración o administraciones múltiples se deben tener en cuenta los efectos adversos de la inyección, la dificultad de acudir al hospital, la pérdida de días de trabajo, los costes asociados y las preferencias de los pacientes15.
La duración de la eficacia del HA en las articulaciones depende en cierta medida de sus características de PM, cantidad y concentración pero no solo de éstas ni en relación proporcional con las mismas. Sin embargo, la bibliografía analizada no permite discernir cuales son las características determinantes para la eficacia de estos productos, la cantidad de AH, el volumen, el PM, la concentración o el número de enlaces cruzados53.
CONCLUSIONES
El registro de estos productos como medicamentos en lugar de como productos sanitarios supondría la realización de ensayos clínicos de mayor calidad que permitieran una correcta valoración de su eficiencia y seguridad. Además, los datos actuales apoyan la hipótesis de que el AH tiene no solo efectos no farmacológicos, como lubricante y mecánico, si no también efectos farmacológicos, como antiinflamatorios o de viscoinducción.
Existen un abanico de presentaciones comercializadas con diferentes cantidades, concentración y PM de AH, volúmenes y número de administraciones, que permiten realizar una terapia individualizada por paciente. La proliferación de estos productos sanitarios de AH hace más ardua y compleja una adecuada selección. Al no disponer de datos diferenciales concluyentes respecto a su eficacia clínica la elección de unos u otros productos va a depender de diversos factores como la experiencia de los profesionales, los resultados clínicos obtenidos, las preferencias de los pacientes, la oferta comercial u otros. Se han barajado distintas propiedades como condicionantes para los resultados de eficacia, como el peso molecular y la viscosidad sin resultados esclarecedores.
La selección de una u otra presentación de AH dependerá también de la articulación a tratar. Para las articulaciones pequeñas se utilizaran las presentaciones de bajo volumen. También hay que tener en cuenta las preferencias del paciente, como la preferencia a recibir menor número de inyecciones, eligiendo en este caso las presentaciones de una sola administración. Sería preciso la realización de mayor número de estudios comparativos entre las distintas presentaciones de AH para una mejor selección entre ellas.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Bibliografía
1. Chou CW, Lue KH, Lee HS, Lin RC, Lu KH. Hylan G-F 20 has better pain relief and cost-effectiveness than sodium hyaluronate in treating early osteoarthritic knees in Taiwan. J Formos Med Assoc. 2009;108(8):663-72.
2. McAlindon TE, Bannuru RR, Sullivan MC, Arden NK, Berenbaum F, Bierma-Zeinstra SM, et al. OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthritis Cartilage. 2014;22(3):363-88. doi: 10.1016 /j.joca.2014.01.003. Epub 2014 Jan 24.
3. http://www.asnl.es/monovisc.html.
4. Guidolin D, Franceschi F. Viscosupplementation with high molecular weight native hyaluronan. Focus on a 1500-2000 KDa fraction (Hyalubrix®). European Review for medical and pharmacological sciencies. 2014;18:3326-38.
5. Petrella RJ, Emans PJ, Alleyne J, Dellaert F, Gill DP, Maroney M. Safety and performance of Hydros and Hydros-TA for knee osteoarthritis: a prospective, multicenter, randomized, double-blind feasibility trial. BMC Musculoskelet Disord. 2015 Mar 18;16:57. doi: 10.1186/s12891-015-0513-6.
6. http://www.asnl.es/orthovisc.html.
7. Bruyère O, Cooper C, Pelletier JP, Maheu E, Rannou F, Branco J, et al. A consensus statement on the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) algorithm for the management of knee osteoarthritis-From evidence-based medicine to the real-life setting. Semin Arthritis Rheumm. 2016;45(4 Suppl):S3-11. doi: 10.1016/j.semarthrit.2015.11.010.
8. Gigis I, Fotiadis E, Nenopoulos A, Tsitas K, Hatzokos I. Comparison of two different molecular weight intra-articular injections of hyaluronic acid for the treatment of knee osteoarthritis. Hippokratia. 2016;20(I):26-31.
9. Van den Bekerom MP, Rys B, Mulier M. Viscosupplementation in the hip: evaluation of hyaluronic acid formulations. Arch Orthop Trauma Surg. 2008 Mar;128(3):275-80.
10. Maheu E, Zaim M, Appelboom T, Jeka S, Trc T, Berenbaum F, Maasalu K, et al. Comparative efficacy and safety of two different molecular weight (MW) hyaluronans F60027 and Hylan G-F20 in symptomatic osteoarthritis of the knee (KOA). Results of a non inferiority, prospective, randomized, controlled trial. Clin Exp Rheumatol. 2011 May-Jun;29(3):527-35. Epub 2011 Jun 29.
11. http://www.tedecmeiji.com/adant.
12. Polache Vengud J, Selva Otaolaurruchi J, Cortés Botella J, García Salom P, García Monsalve A. Viscosuplementación: revisión de los diferentes hialuronatos en España. Farmacia Hospitalaria. 2000;24(6):371-6.
13. Petrella RJ, Cogliano A, Decaria J. Combining two hyaluronic acids in osteoarthritis of the knee: a randomized, double-blind, placebo-controlled trial. Clin Rheumatol. 2008;27:975-981.
14. Xin Y, Jianhao L, Tiansheng S, Yongqiang H, Weimin F, Ming C, et al. The efficacy and safety of sodium hyaluronate injection (Adant®) in treating degenerative osteoarthritis: a multi-center, randomized, double-blind, positive-drug parallel-controlled and non-inferiority clinical study. Int J Rheum Dis. 2016 Mar;19(3):271-8. doi: 10.1111/1756-185X.12782. Epub 2015 Nov 11.
15. Dıraçoğlu D, Tunçay TB, Şahbaz T, Aksoy CJ. Single versus multiple dose hyaluronic acid: Comparison of the results. Back Musculoskelet Rehabil. 2016;21;29(4):881-886.
16. Berenbaum F, Grifka J, Cazzaniga S, D’Amato M, Giacovelli G, Chevalier X, et al. A randomised, double-blind, controlled trial comparing two intra-articular hyaluronic acid preparations differing by their molecular weight in symptomatic knee osteoarthritis. Ann Rheum Dis. 2012;71(9):1454-60. doi: 10. 1136/annrheumdis-2011-200972. Epub 2012 Jan 31.
17. Sun SF, Hsu CW, Lin HS, Liou IH, Chen YH, Hung CL. Comparison of Single Intra-Articular Injection of Novel Hyaluronan (HYA-JOINT Plus) with Synvisc-One for Knee Osteoarthritis: A Randomized, Controlled, Double-Blind Trial of Efficacy and Safety. J Bone Joint Surg Am. 2017 Mar 15;99(6):462-471. doi: 10.2106/JBJS.16.00469.
18. Maheu E, Rannou F, Reginster JY. Efficacy and safety of hyaluronic acid in the management of osteoarthritis: Evidence from real-life setting trials and surveys. Semin Arthritis Rheum. 2016;45(4):28-33. doi: 10.1016/j.semarthrit. 2015.11.008. Epub 2015 Dec 2.
19. Bannuru RR, Ntov NS, Schmid CH, McAlindon TE. Therapeutic trajectory following intra-articular hyaluronic acid injection in knee osteoarthritis-meta-analysis. Osteoarthritis and Cartilage. 2011.19:611-619.
20. http://www.laboratoriosrubio.com/productos/suplasyn/.
21. Karatay S, Kiziltunc A, Yildirim K, Karanfil RC, Senel K. Effects of different hyaluronic acid products on sinovial fluid NO levels in knee osteoarthritis. Clin Rheumatol. 2005;24:497-501.
22. http://www.fidiapharma.es/hymovis-2/.
23. Kirchner M, Marshall D. A doublé-blind randomized controlled trial comparing alternate forms of high molecular weight hyaluronan for the treatment of osteoarthritis of the knee. Osteoarthritis and Cartilage. 2006;14:154-162.
24. Raman R, Dutta A, Day N, Sharma HK, Shaw CJ, Johnson GV. Efficacy of Hylan G-F 20 and Sodium Hyaluronate in the treatment of osteoarthritis of the knee — a prospective randomized clinical trial. Knee. 2008 Aug;15(4):318-24. doi: 10.1016/ j.knee.2008.02.012. Epub 2008 Apr 21.
25. Aguinagalde Toya A, Gaspar Carreño M, Múgica Goicoechea A, Jiménez Torres J, Marco Garbayo JL, Selva Otaolarruchi J. Viscosuplementación: revisión de productos con ácido hialurónico y sus características. El farmacéutico Hospitales. 2012;200:5-15.
26. http://www.tedecmeiji.com/adant-one.
27. http://www.tedecmeiji.com/viscoaide.
28. http://www.lca-pharma.com/rhumato/index-produits-rhumato.php?LG=Esp&produit=1&PHPSESSID=302c29af31219a3472946fc5ff11daaf.
29. http://www.lca-pharma.com/rhumato/index-produits-rhumato.php?LG=Esp&produit=2&PHPSESSID=302c29af31219a3472946fc5ff11daaf.
30. http://www.lca-pharma.com/rhumato/index-produits-rhumato.php?LG=Esp&produit=3&PHPSESSID=302c29af31219a3472946fc5ff11daaf.
31. http://www.lca-pharma.com/rhumato/index-produits-rhumato.php?LG=Esp&produit=4&PHPSESSID=302c29af31219a3472946fc5ff11daaf.
32. http://www.farma5.es/renehavisinfo/.
33. http://www.farma5.es/sportvisinfo/.
34. http://www.farma5.es/tendovis/.
35. http://www.zambon.es/profesionales-sanitarios/ %C3%A1rea-dolor/#ancor491.
36. http://www.fidiapharma.es/hyalgan/.
37. http://www.fidiapharma.es/hyalone-2/.
38. http://www.fidiapharma.es/hyalubrix/.
39. http://www.asnl.es/cingal.html.
40. http://www.asnl.es/orthoviscmini.html.
41. http://www.opkoeurope.com/producto/ostenil/.
42. http://www.opkoeurope.com/producto/ostenil-plus/.
43. http://www.opkoeurope.com/producto/ostenil-mini/.
44. http://www.opkoeurope.com/producto/viscoseal/.
45. http://www.opkoeurope.com/etiqueta/ostenil-tendon/.
46. http://products.sanofi.ca/en/synvisc-information-for-use.pdf.
47. http://www.synviscone.com/.
48. http://nl.biomet.be/viewversion.cfm?contentversionid=16826&sc=1.
49. http://www.hospitrauma.com/download/HOSPITRAUMA_Biomet_Fermathron_Plus.pdf.
50. http://www.medifix.it/brochure/Fermathron/Brochure%20Fermathron%20S%20ital.pdf.
51. http://www.synolis.com/.
52. De Campos GC, Rezende MU, Pailo AF, Frucchi R, Camargo OP. Adding triamcinolone improves viscosupplementation: a randomized clinical trial. Clin Orthope Relat Res. 2013:417:613-620.
53. Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios.
54. Zhang H, Zhang K, Zhang X, Zhu Z, Yan S, Sun T, et al. Comparison of two hyaluronic acid formulations for safety and efficacy (CHASE) study in knee osteoarthritis: a multicentre, randomized, double blind, 26-week non-inferiority trial comparing Durolane to Artz. Arthritis Res Ther. 2015 Mar 10;17:51. doi: 10.1186/s13075-015-0557-x.
55. Tikiz C, Unlü Z, Sener A, Efe M, Tüzün C. Comparison of the efficacy of lower and higher molecular weight viscosupplementation in the treatment of hip osteoarthritis. Clin Rheumatol. 2005 Jun;24(3):244-50.
56. Jüni P, Reichenbach S, Trelle S, Tschannen B, Wandel S, Jordi B, et al. Swiss Viscosupplementation Trial Group. Efficacy and safety of intraarticular hylan or hyaluronic acids for osteoarthritis of the knee: a randomized controlled trial. Arthritis Rheum. 2007;56(11):3610-9.
57. Wobig M, Bach G, Beks P, Dickhut A, Runzheimer J, Schwieger G, et al. The role of elastoviscosity in the efficacy of viscosupplementation for osteoarthritis of the knee: a comparison of hylan G-G 20 and a lower-molecular-weight hyaluronan. Clinical Therapeutics. 21.9.1999: 1549-62.
58. Atamaz F, Kirazli Y, Akkoc Y. A comparison of two different intra-articular hyaluronan drugs and physical therapy in the management of knee osteoarthritis. Rheumatol Int. 2006;26:873-878.
59. Pavelka K, Uebelhart D. Efficacy evaluation of highly purified intra-articular hyaluronic acid (Sinovial(®)) vs hylan G-F20 (Synvisc(®)) in the treatment of symptomatic knee osteoarthritis. A double-blind, controlled, randomized, parallel-group non-inferiority study. Osteoarthritis Cartilage. 2011 Nov;19(11):1294-300. doi: 10.1016/j.joca.2011. 07.016. Epub 2011 Aug 16.
60. Kotevoglu N, Iyibozkurt PC, Hiz O, Toktas H, Kuran B. A prospective randomised controlled clinical trial comparing the efficacy of different molecular weight hyaluronan solutions in the treatmente of knee osteoarthritis. Rheumatol Int. 2006;26:325-330.
61. Karatosun V, Unver B, Gocen Z, Sen A. Comparison of two hyaluronan drugs in patients with advanced osteoarthritis of the knee. A prospective, randomized, double-blind study with long term follow-up. Clin Exp Rheumatol. 2005;23(2):213-8.
62. Iannitti T, Rottigni V, Palmieri B. A pilot study to compare two different hyaluronic acid compounds for treatment of knee osteoarthritis. Int J Immunopathol Pharmacol. 2012 Oct-Dec;25(4):1093-8.
63. Bellamy N, Campbell J, Welch V, Gee TL, Bourne R, Wells GA. Viscosupplementation for the treatment of osteoarthritis of the knee. Cochrane Database of Systematic Reviews 2006, Issue 2. Art. No.: CD005321. DOI: 10.1002/ 14651858.CD005321.pub2.
____
Descargar artículo en PDF: Presentaciones de ácido hialurónico ¿son realmente diferentes?t
