Gil-Sierra MD1,2, Moreno-Ramos C1, Ríos-Sánchez E1, Pedrosa-Martínez M3, Armario-Hita J4, Ceballos-Cauto C4, Gómez-Rodríguez F5, Borrero-Rubio JM1
1 Servicio de Farmacia. Hospital Universitario de Puerto Real. Puerto Real (España)
2 Departamento de Farmacología. Facultad de Farmacia. Universidad de Sevilla. Sevilla (España)
3 Servicio de Farmacología. Hospital Universitario de Puerto Real. Puerto Real (España)
4 Servicio de Dermatología. Hospital Universitario de Puerto Real. Puerto Real (España)
5 Servicio de Medicina Interna. Hospital Universitario de Puerto Real. Puerto Real (España)
Fecha de recepción: 22/02/2022 – Fecha de aceptación: 21/03/2022
Correspondencia: Manuel David Gil Sierra – Calle Playa de Bolonia, 10 – 11406 Jerez de la Frontera, Cádiz (España)
mangilsie@yahoo.com
____
Resumen
Objetivo: La artritis reumatoide (AR), espondilitis anquilosante, psoriasis (Ps), artritis psoriásica (APs) están mediadas por factor de necrosis tumoral (TNF). El objetivo es el diseño multidisciplinar de un protocolo personalizado de agentes biológicos en enfermedades reumáticas y dermatológicas.
Métodos: Se seleccionaron pacientes con AR, APs, espondiloartritis y Ps que recibían etanercept o adalimumab durante al menos 6 meses ininterrumpidamente. La monitorización terapéutica consideró criterios bioquímicos y criterios clínicos. Rangos terapéuticos óptimos de adalimumab: 5-8 μg/mL para AR y APs, 3.2-7 μg/mL para Ps y 4.6-12 μg/mL para espondiloartritis. Rangos óptimos de etanercept fueron: 2-3 μg/mL para AR y espondiloartritis, y 2-7 μg/mL para Ps y APs.
Resultados: Se realizaron propuestas de optimización del tratamiento en pacientes con adecuada respuesta clínica y niveles de fármaco biológico superiores al rango terapéutico óptimo. Si la propuesta de optimización fue aceptada por facultativo, se valoró percepción de la enfermedad del paciente al primer y tercer mes. Los pacientes con niveles plasmáticos de fármaco inferiores al rango terapéutico óptimo, ausencia de anticuerpos anti-fármaco y adecuada respuesta clínica fueron propuestos a optimización de tratamiento mediante discontinuación o espaciamiento de administración. Los pacientes con niveles plasmáticos de fármaco inferiores al rango óptimo y anticuerpos anti-fármaco fueron propuestos a cambio de tratamiento o discontinuación, si se pudiera alcanzar control de enfermedad.
Conclusiones: Este protocolo permite la personalización terapéutica de etanercept y adalimumab para enfermedades inflamatorias inmunomediadas en áreas de dermatología y reumatología. La implantación del protocolo podría mejorar la eficacia, seguridad, conveniencia y eficiencia de etanercept y adalimumab.
Palabras clave: Etanercept, adalimumab, protocolo, eficiencia, artritis.
Protocol for optimization of the use of biological drugs in immune-mediated inflammatory diseases
Summary
Objective: Rheumatoid arthritis (RA), ankylosing spondylitis, psoriasis (Ps), psoriatic arthritis (PAs) are mediated by tumor necrosis factor (TNF). The objective is the multidisciplinary design of a personalized protocol of biological agents in rheumatic and dermatological diseases.
Methods: Patients with RA, PAs, spondyloarthritis and Ps receiving etanercept or adalimumab for at least 6 months uninterruptedly were selected. Therapeutic monitoring considered biochemical criteria and clinical criteria. Optimal therapeutic ranges of adalimumab were: 5-8 μg/mL for RA and APs, 3.2-7 μg/mL for Ps and 4.6-12 μg/mL for spondyloarthritis. Optimal ranges of etanercept were: 2-3 μg/mL for RA and spondyloarthritis, and 2-7 μg/mL for Ps and APs.
Results: Proposals were elaborated to optimize treatment in patients with adequate clinical response and levels of biological drug higher than the optimal therapeutic range. If the optimization proposal was accepted by the physician, the patient’s perception of disease was evaluated at the first and third months. Patients with plasma drug levels below the optimal therapeutic range, absence of anti-drug antibodies and adequate clinical response were proposed for treatment optimization by discontinuation or spacing of administration. Patients with plasma drug levels below the optimal range and anti-drug antibodies were proposed in exchange for treatment or discontinuation -if disease control could be achieved-.
Conclusions: This protocol allows the therapeutic personalization of etanercept and adalimumab for immune-mediated inflammatory diseases in areas of dermatology and rheumatology. Implementation of the protocol could improve the efficacy, safety, convenience and efficiency of etanercept and adalimumab.
Key words: Etanercept, adalimumab, protocol, efficiency, arthritis.
____
Introducción
Las enfermedades inflamatorias inmunomediadas son patologías originadas por una inflamación crónica sistémica que puede afectar a diversos órganos. Ejemplos de este tipo de enfermedades son la artritis reumatoide, psoriasis o colitis ulcerosa. Debido a la naturaleza inflamatoria, existen pacientes que incluso presentan varios de estos desórdenes a la vez1.
Parte de las enfermedades como artritis reumatoide (AR), espondilitis anquilosante y patologías cutáneas están mediada por moléculas proinflamatorias ligadas a una red controlada por el factor de necrosis tumoral (TNF). Etanercept es un anticuerpo compuesto por el receptor p75 del TNF y la porción Fc de la IgG1 humana, indicado en AR, psoriasis (Ps), artritis psoriásica (APs) y espondiloartritis. Adalimumab es un anticuerpo que se une específicamente al TNF y neutraliza su interacción con los receptores p55 y p75 de la superficie celular3. Ambos son denominados como fármacos anti-TNF por su mecanismo de acción.
El efecto de los medicamentos biológicos anti-TNF puede ser influenciado por diversos factores. Las características propias del paciente, la pauta de administración, el rango terapéutico plasmático y la existencia de anticuerpos pueden ser factores esenciales4. Por una parte, la presencia de anticuerpos neutralizantes y niveles bajos de fármaco podrían ser predictores de una escasa eficacia del agente biológico5,6. Por otra parte, unos niveles excesivos de agente biológico podrían contribuir a la aparición de efectos adversos, aumento de inmunogenicidad e incremento de gastos innecesarios en estas terapias7,8.
Existen protocolos de monitorización de fármacos biológicos en enfermedades inflamatorias digestivas que han sido implantados con notables beneficios clínicos9. La aplicación de protocolos considerando valores analíticos, el criterio clínico del facultativo y las preferencias de los pacientes puede ser una herramienta considerable para la optimización de los tratamientos. La discontinuación temporal del tratamiento anti-TNF en pacientes con enfermedades inflamatorias inmunomediadas con niveles bajos de fármaco –sin anticuerpos antifármaco– y respuesta clínica adecuada puede reportar también beneficios desde el punto de vista de la conveniencia del paciente.
Teniendo en cuenta todo lo anterior, la implantación de algoritmos de decisión basados en la monitorización de agentes biológicos y respuesta clínica del paciente podría proporcionar mejores resultados de eficacia, seguridad y conveniencia para los pacientes, además de contribuir a la sostenibilidad del sistema nacional de salud como medida de eficiencia. El objetivo de este trabajo es el diseño de un protocolo personalizado de agentes biológicos en enfermedades reumáticas y dermatológicas, basado en la monitorización de niveles plasmáticos y respuesta clínica de los pacientes.
Métodos
Población diana
El protocolo de optimización del uso de medicamentos biológicos fue desarrollado para pacientes con AR, APs, espondiloartritis y Ps que recibían etanercept o adalimumab durante al menos 6 meses de tratamiento de forma ininterrumpida.
Rangos terapéuticos
La monitorización terapéutica desde el punto de vista bioquímico de estos fármacos consideró los niveles plasmáticos y la presencia de anticuerpos anti-fármaco. Se consideraron como rangos terapéuticos de efecto clínico óptimo de adalimumab a 5-8 μg/mL para AR y APs10,11, 3.2-7 μg/mL para Ps12,13 y 4.6-12 μg/mL para espondiloartritis14-16. Los rangos terapéuticos de etanercept considerados como óptimos fueron 2-3 μg/mL para AR y espondiloartritis17,18. Aunque no se dispuso de bibliografía concluyente, se consideró un rango apropiado de etanercept en Ps y APs de 2-7 μg/mL19-21.
Solicitud de pruebas bioquímicas y tratamiento de las muestras
Tras consenso con los facultativos de los Servicios de Medicina Interna (SM) y Dermatología (SD), el Servicio de Farmacia (SFarmacia) fue designado para la entrega a los pacientes de solicitudes de pruebas bioquímicas de medidas de niveles plasmáticos de agentes biológicos y sus anticuerpos anti-fármacos. Estas pruebas fueron entregadas en el acto de dispensación de la medicación en el Área de Pacientes Externos de SFarmacia.
Se proporcionó a los pacientes la posibilidad de extracción de sangre en su centro ambulatorio o en el centro hospitalario. La extracción de sangre se llevó a cabo un día antes de la administración de etanercept o adalimumab. En caso de que la administración del agente biológico fuera los lunes, se recomendó al paciente que la toma de la muestra fuera el viernes anterior o la mañana del lunes, posponiendo la administración del fármaco a la tarde de ese mismo día. Las muestras fueron trasladadas al Servicio de Farmacología (SFarmacología) para su análisis. La determinación de los niveles de medicamento biológicos y anticuerpos anti-fármaco se realizó mediante técnica ELISA (acrónimo del inglés Enzyme-Linked ImmunoSorbent Assay) con el analizador de inmunología automático Triturus® de Grifols Diagnostic Solutions. Los resultados de niveles plasmáticos de los fármacos y presencia de anticuerpos anti-fármaco fueron remitidos al SFarmacia posteriormente.
Monitorización terapéutica
La monitorización terapéutica se desarrolló teniendo en cuenta criterios bioquímicos y clínicos. A los pacientes que hayan recibido un tratamiento con los agentes biológicos seleccionados de forma continuada durante al menos 6 meses se les extrajo la prueba analítica para medir los niveles plasmásticos de fármaco biológico, y la presencia de anticuerpos anti-fármaco. En el mismo acto de consulta en el que se entregó la solicitud de prueba analítica al paciente, se realizó una entrevista para registrar su estado clínico. Se formularon dos preguntas para valorar la evolución de la enfermedad (con respuestas de “buena”, “regular” y “mala” según apreciación del paciente), y la sospecha de mala respuesta desde el inicio de tratamiento (con respuestas de “Sí” y “No” según valoración del paciente).
Diseño del algoritmo de decisión clínica
Se consultaron protocolos de monitorización terapéutica de medicamentos biológicos que han sido publicados previamente22. Los datos bioquímicos y clínicos fueron usados para la toma de decisiones clínicas. Las propuestas de optimización en pacientes con adecuada respuesta pueden ser de dos tipos: espaciamiento de administración y discontinuación de tratamiento. El intervalo de tiempo mínimo entre dos optimizaciones de tratamiento fue de 6 meses. Las optimizaciones de tratamiento fueron propuestas en pacientes con “buena” evolución de la enfermedad y sin mala respuesta desde el inicio de tratamiento, para minimizar el riesgo de aparición de reacciones adversas, formación de anticuerpos anti-fármaco y mejorar la eficiencia. No se realizaron propuestas desde el SFarmacia en aquellos pacientes que no mostraron respuesta clínica al tratamiento con etanercept o adalimumab, independientemente de los niveles plasmáticos del fármaco. Se solicitó la prueba bioquímica de niveles plasmáticos de fármaco y presencia de anticuerpos anti-fármaco en pacientes que refirieron “regular” o “mala” evolución de la enfermedad (independientemente de la respuesta al inicio de tratamiento) para la detección de inmunogenicidad del paciente al tratamiento recibido y facilitar la decisión facultativa del cambio de terapia. Los cambios de tratamientos que involucran a agentes biológicos siguieron los protocolos de eficiencia establecidos en el centro hospitalario.
Secuencia de optimización
Las optimizaciones de espaciamiento de administración del tratamiento biológico se aplicaron teniendo en cuenta la pauta de partida, que puede ser la pauta estándar o una pauta ya optimizada, y el fármaco biológico. Las pautas estándar recomendadas por ficha técnica para las enfermedades inflamatorias inmunomediadas seleccionadas fueron: etanercept 50 mg cada 7 días y adalimumab 40 mg cada 14 días2,3. Cuando se alcanzó la máxima optimización de espaciamiento de dosis se consensuó la discontinuación de tratamiento con el facultativo. La tabla 1 resume las pautas de optimización que se aplicaron a etanercept y adalimumab en las sucesivas optimizaciones.
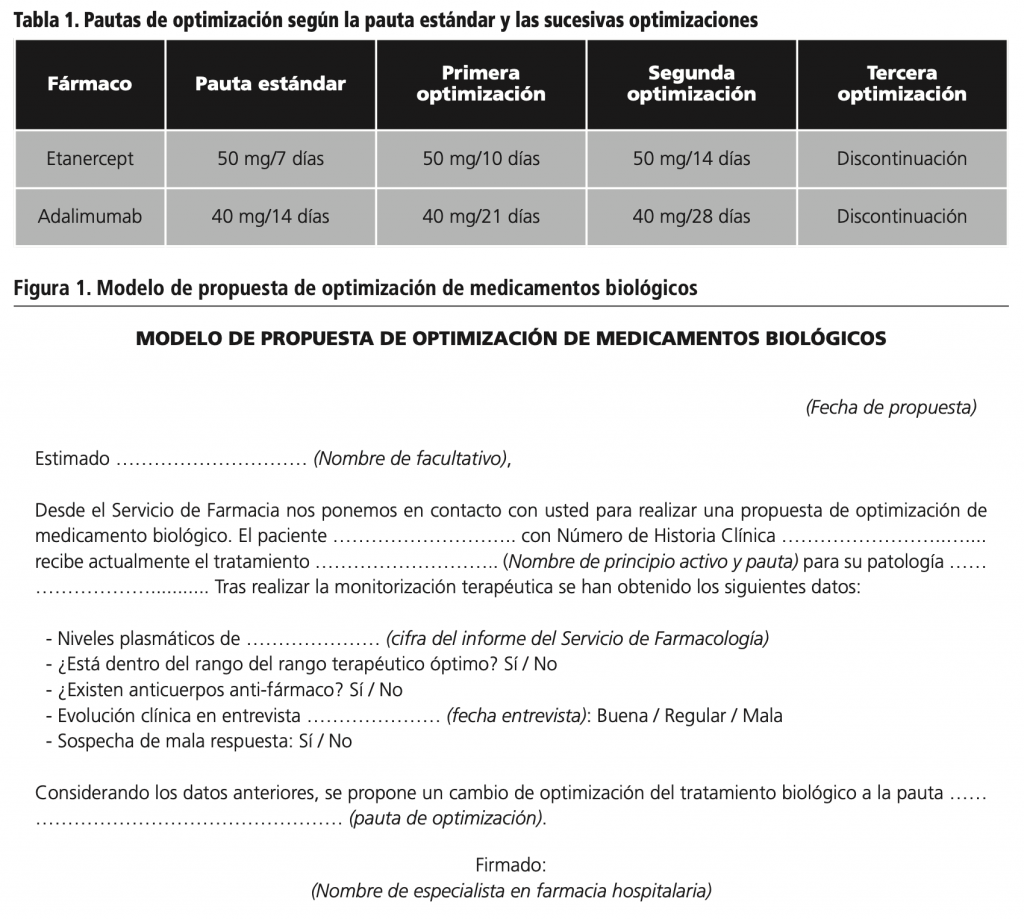
Circuito de actuación
Las propuestas de optimización por el SFarmacia fueron comunicadas a los facultativos de los pacientes a través de un formulario en reuniones multidisciplinares de los servicios implicados (figura 1). El formulario contenía datos del paciente (nombre, número de historia clínica y patología), tratamiento (fármaco y pauta), niveles plasmáticos del fármaco y situación con respecto al rango terapéutico óptimo, presencia de anticuerpos anti-fármaco, resultados de la entrevista farmacéutica y propuesta de SFarmacia. Si estas propuestas de optimización fueron aceptadas por los facultativos, el cambio de la pauta de medicamento biológico fue transmitida al paciente en la consulta médica. Tras la conformidad del paciente del cambio de pauta, se valoró al paciente al primer y tercer mes mediante entrevista farmacéutica, de acuerdo al algoritmo de decisión descrito anteriormente. Ante una respuesta clínica adecuada frente a la nueva pauta de optimización, el paciente esperó a la siguiente consulta médica y/o monitorización terapeutica por el SFarmacia para su re-evaluación. Ante una respuesta clínica inadecuada, el paciente se puso en contacto con su médico o el SFarmacia para que facilitara la información al facultativo.
Valoración clínica de los pacientes por los facultativos
Las propuestas de optimización de los agentes biológicos del SFarmacia fueron valoradas por los facultativos tras la consideración de los niveles plasmáticos de etanercept y adalimumab, resultados de la entrevista clínica reportados por el SFarmacia e información obtenida de las consultas médicas de las diferentes especialidades involucradas. Durante las consultas médicas para la valoración de los pacientes se usaron las variables de efectividad de los fármacos empleadas en la práctica clínica habitual del centro, como Psoriasis Area Severity Index (PASI) para Ps23.
Registro de datos
Se registró en un documento Excel® la información relativa al nombre y número de historia clínica de los pacientes incluidos, tratamiento biológico involucrado, fecha de entrega de solicitud de prueba analítica y entrevista, resultados de la prueba analítica, cumplimiento del rango óptimo considerado, datos recogidos en entrevista clínica (evolución clínica, sospecha de mala repuesta), propuesta de optimización al facultativo, conformidad del paciente, respuesta clínica a la optimización y el tiempo durante el que se usó la pauta de optimización.
Resultados
La figura 2 muestra un esquema del algoritmo de decisión diseñado para llevar a cabo el proceso de optimización de los tratamientos de agentes biológicos. Se realizaron propuestas de optimización de espaciamiento de administración por parte del SFarmacia en pacientes que presentaron niveles de fármaco biológico superiores al rango terapéutico considerado según la patología y con adecuada respuesta clínica. Si la propuesta de optimización fue aceptada por el facultativo, se llevó a cabo una valoración de la percepción del paciente al mes de la propuesta de optimización (presencial o telemática). Si el paciente refirió empeoramiento de la situación clínica, se re-introdujo la pauta de agente biológico de partida. Si se mantuvo respuesta clínica adecuada tras un mes de la propuesta de optimización, se realizó otra entrevista farmacéutica a los 3 meses desde la optimización del tratamiento para re-evaluación (presencial o telemática). Si los resultados clínicos fueron satisfactorios, se mantuvo la pauta de optimización. Si no se obtuvo adecuada respuesta clínica, se re-introdujo la pauta anterior a la optimización.
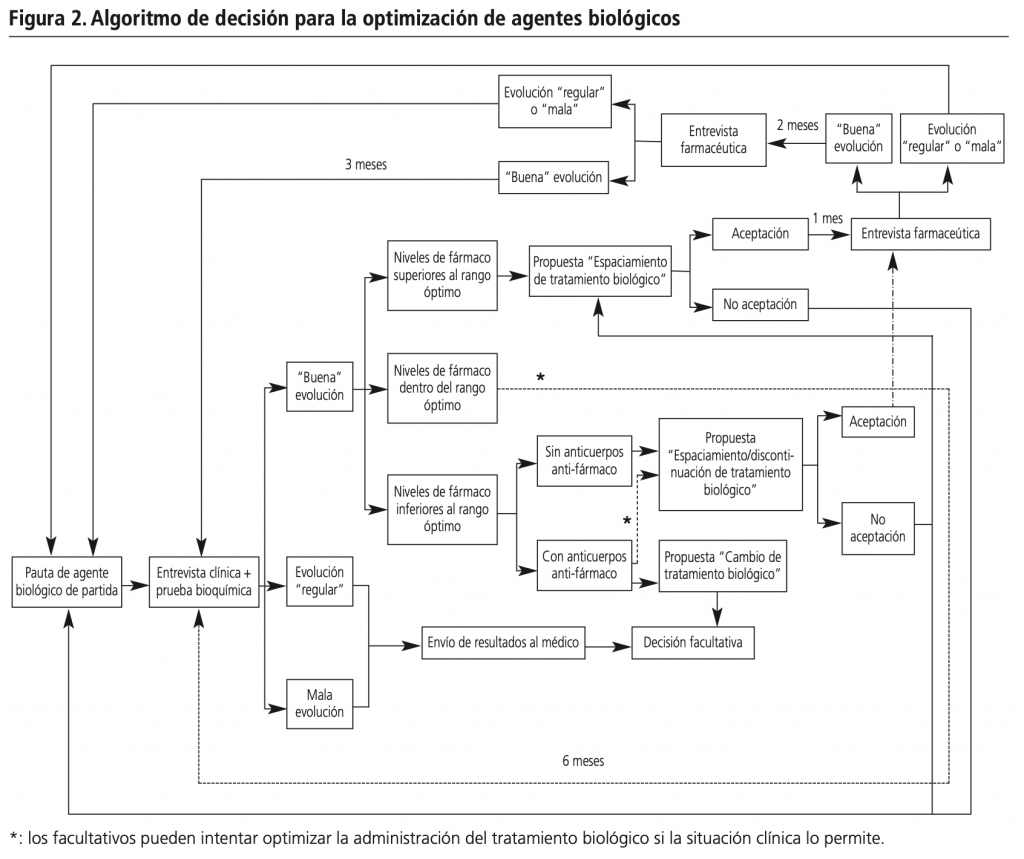
Aquellos pacientes que presentaron niveles de medicamento biológico dentro del rango terapéutico establecido como óptimo y adecuada respuesta clínica fueron sometidos a una re-evaluación 6 meses después. Si la situación clínica lo permite, el facultativo puede intentar optimizar el tratamiento mediante espaciamiento de administración del medicamento biológico. Si esta optimización fuera aplicada por el facultativo, se volvieron a realizar entrevistas farmacéuticas al primer y tercer mes tras el cambio a la pauta de optimización del agente biológico. Se mantuvo la pauta de optimización ante respuesta clínica satisfactoria o se re-introdujo la anterior ante empeoramiento clínico.
La presencia de anticuerpos anti-fármaco fue considerada en los pacientes con niveles plasmáticos del fármaco por debajo del rango terapéutico establecido. El SFarmacia propuso optimización de tratamiento mediante discontinuación (o espaciamiento de administración en su defecto) si el paciente presentó niveles plasmáticos de fármaco inferiores al rango terapéutico considerado como óptimo según la patología, ausencia de anticuerpos anti-fármaco y adecuada respuesta clínica. Si la propuesta de optimización fue aceptada por el médico, se volvió a realizar entrevista farmacéutica tras el primer y tercer mes. Se mantuvo la pauta de optimización ante adecuada respuesta clínica o se re-introdujo la pauta de partida ante empeoramiento clínico. Si el paciente mostró niveles plasmáticos de fármaco inferiores al rango terapéutico y se detectaron anticuerpos anti-fármaco, el SFarmacia propuso cambio de tratamiento biológico o discontinuación de tratamiento si el facultativo considera que el paciente pudiera presentar control de la enfermedad sin tratamiento biológico.
Tras 6 meses de la optimización de la terapia, se re-evaluó al paciente mediante nueva prueba bioquímica de niveles plasmáticos de medicamento biológico y entrevista farmacéutica. De esta manera, se reinició el proceso de optimización.
Discusión
El diseño de este protocolo supone el primer paso en nuestro centro sobre la formalización del proceso de personalización terapéutica de los agentes biológicos para enfermedades inflamatorias inmunomediadas en las áreas de dermatología y reumatología. Este proyecto presenta un notable carácter multidisciplinar, implicando a los SFarmacia, SFarmacología, SM y SD.
Este tipo de procedimientos permiten al farmacéutico integrarse con el resto de facultativos, y actuar como facilitador de la comunicación entre pacientes y diferentes especialistas. En nuestro algoritmo de decisión, el farmacéutico aparece como nexo en varios puntos ante la dificultad de contacto de los pacientes con sus facultativos. Actualmente, esto podría tener un importante impacto en el seguimiento de los pacientes, ya que la limitación de recursos del sistema sanitario y la dificultad de acceso a los profesionales han sido barreras importantes para los pacientes más dependientes en la crisis sanitaria del COVID-1924. En muchas ocasiones, los pacientes con enfermedades autoinmunes reumatológicas y dermatológicas forman parte de esta población dependiente. La combinación de estrategias como la telemedicina y la protocolización de la monitorización terapéutica de los agentes biológicos podría ser una solución a este problema. En nuestro protocolo se lleva a cabo un seguimiento de las optimizaciones de tratamientos mediante vía telemática en los casos que lo requieran.
Estudios previos han demostrado que los protocolos de personalización de tratamientos biológicos basados en niveles séricos son costo-efectivos22. Además, con esta monitorización también se consigue optimizar la eficacia y seguridad de estas terapias, ya que se podría reducir la aparición de reacciones adversas importantes. Se ha notificado un incremento de enfermedades neoplásicas malignas en pacientes tratados con anticuerpos anti-TNF3. Por otra parte, nuestro protocolo establece los pasos a seguir con dos fármacos en cuatro patologías distintas, demostrando una considerable predisposición al entendimiento entre los diferentes componentes del equipo multidisciplinar. De esta manera, muchos más pacientes podrían beneficiarse de este trabajo.
La relevancia del empoderamiento de los pacientes ha crecido en los últimos años, ya que se ha observado que podría fomentar conceptos tan claves como la adherencia25. Nuestro proyecto no sólo tiene en cuenta los niveles plasmáticos de los fármacos y anticuerpos anti-fármaco en los pacientes, sino que usa la apreciación subjetiva de los pacientes como cribado de las propuestas de optimización de los agentes biológicos. El SFarmacia sólo realizará propuestas en aquellos pacientes que muestren un estado clínico satisfactorio, que además debe ser valorado posteriormente por el facultativo prescriptor tras cotejarlo con las escalas de valoración habituales de su práctica clínica. De esta manera, sólo se aplicarán las propuestas de optimización de los medicamentos biológicos a aquellos casos en los que tanto pacientes como médicos estén de acuerdo. Finalmente, este protocolo de personalización de tratamientos biológicos en enfermedades inmunomediadas reumatológicas y dermatológicas podría optimizar el uso racional de estos fármacos de forma considerable.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Fu Y, Lee C, Chi C. Association of psoriasis with inflammatory bowel disease: A systematic review and meta-analysis. JAMA Dermatol. 2018;154(12):1417 1423. Doi: 10.1001/jamadermatol.2018.3631.
2. Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica de Benepali® 25 mg. 2016 (acceso 10 de agosto de 2021). Disponible en: https://cima.aemps.es/cima/pdfs/ft/1151074001/FT_1151074001.pdf.
3. Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica de Amgevita® 40 mg. 2017 (acceso 10 de agosto de 2021). Disponible en: https://cima.aemps.es/cima/pdfs/ft/1161164002/FT_1161164002.pdf.
4. García Ruiz de Morales JM, Pascual-Salcedo D, Llinares Tello F, Valor Méndez L. Anti-tumor necrosis factor drug therapy: the usefulness of monitoring drug levels and anti-drug antibodies in clinical practice. Med Clin (Barc). 2016;147(9): 410-416. Doi: 10.1016/j.medcli.2016.04.002.
5. Pascual-Salcedo D, Plasencia C, Ramiro S, Nuño L, Bonilla G, Nagore D, et al. Influence of immunogenicity on the efficacy of long-term treatment with infliximab in rheumatoid arthritis. Rheumatology (Oxford). 2011;50(8):1445-52. Doi: 10.1093/rheumatology/ker124.
6. Bartelds GM, Krieckaert CLM, Nurmohamed MT, Schouwenburg PA, Lems WF, Twisk JWR, et al. Development of antidrug antibodies against adalimumab and association with disease activity and treatment failure during long-term follow-up. JAMA. 2011;305(14):1460-8. Doi: 10.1001/jama.2011.406.
7. Aikawa NE, Freire de Carvalho J, Almeida Silva CA, Bonfá E. Immunogenicity of anti-TNF-alpha agents in autoimmune diseases. Clin Rev Allergy Immunol. 2010;38(2-3):82-9. Doi: 10.1007/s12016-009-8140-3.
8. Radstake TRDJ, Svenson M, Eijsbouts AM, van den Hoogen FHJ, Enevold C, van Riel PLCM, et al. Formation of antibodies against infliximab and adalimumab strongly correlates with functional drug levels and clinical responses in rheumatoid arthritis. Ann Rheum Dis. 2009;68(11):1739-45. Doi: 10.1136/ard. 2008.092833.
9. Fernandes SR, Bernardo S, Simões C, Gonçalves AR, Valente A, Baldaia C, et al. Proactive Infliximab drug monitoring is superior to conventional management in inflammatory bowel disease. Inflamm Bowel Dis. 2020;26(2):263-270. Doi: 10.1093/ibd/izz131.
10. Pouw MF, Krieckaert CL, Nurmohamed MT, van der Kleij D, Aarden L, Rispens T, et al. Key findings towards optimising adalimumab treatment: the concentration- effect curve. Ann Rheum Dis. 74, 513-518 (2015). Doi: 10.1136/annrheumdis-2013-204172.
11. Vogelzang EH, Kneepkens EL, Nurmohamed MT, van Kuijk AWR, Rispens T, Wolbink G, et al. Anti-adalimumab antibodies and adalimumab concentrations in psoriatic arthritis; an association with disease activity at 28 and 52 weeks of follow-up. Ann. Rheum. Dis. 73, 2178-2182 (2014). Doi: 10.1136/annrheumdis-2014-205554.
12. Menting SP, Coussens E, Pouw MF, van den Reek JMPA, Temmerman L, Boonen H, et al. Developing a therapeutic range of adalimumab serum concentrations in management of psoriasis: a step toward personalized treatment. JAMA Dermatol. 151,616-622 (2015). Doi: 10.1001/jamadermatol.2014.5479.
13. Wilkinson N, Tsakok T, Dand N, Bloem K, Duckworth M, Baudry D, Pushpa-Rajah A, et al. Defining the therapeutic range for adalimumab and predicting response in psoriasis: a multicenter prospective observational cohort study. J. Invest. Dermatol. 139,115-123 (2019). Doi: 10.1016/j.jid.2018.07.028.
14. Senabre Gallego JM, Rosas J, Marco-Mingot M, Garcia-Gomez JA, Santos-Soler G, Salas-Heredia E, et al. Clinical relevance of monitoring serum adalimumab levels in axial spondyloarthritis. Rheumatol Int. 2019;39(5):841-849. Doi: 10.1007/s00296-019-04288-7.
15. Kneepkens EL, Cheng-Chung Wei J, Nurmohamed MT, Yeo KJ, Chen CY, van der Horst-Bruinsma IE, et al. Immunogenicity, adalimumab levels and clinical response in ankylosing spondylitis patients during 24 weeks of follow-up. Ann Rheum Dis. 2015;74(2):396-401. Doi: 10.1136/annrheumdis-2013-204185.
16. Ding X, Zhu R, Wu J, Xue L, Gu M, Miao L. Early Adalimumab and anti-adalimumab antibody levels for prediction of primary nonresponse in ankylosing spondylitis patients. Clin Transl Sci. 2020;13(3):547-554. Doi: 10.1111/cts.12738.
17. Kneepkens EL, Krieckaert CL, van der Kleij D, Nurmohamed MT, van der Horst-Bruinsma IE, Rispens T, et al. Lower etanercept levels are associated with high disease activity in ankylosing spondylitis patients at 24 weeks of follow-up. Ann Rheum Dis. 2015;74(10):1825-9. Doi: 10.1136/annrheumdis-2014-205213.
18. Jamnitski A, Krieckaert CL, Nurmohamed MT, Hart MH, Dijkmans BA, Aarden L, et al. Patients non-responding to etanercept obtain lower etanercept concentrations compared with responding patients. Ann Rheum Dis. 2012;71(1):88-91. Doi: 10.1136/annrheumdis-2011-200184.
19. Elberdín L, Outeda M, Salvador P, Paradela S, Fernández-Torres RM, Iglesias R, et al. Positive correlation between etanercept concentration and the decrease in Psoriasis Area and Severity Index scale value. Int J Clin Pharm. 2016;38(5): 1142-8. Doi: 10.1007/s11096-016-0343-0.
20. Manriquez J, Alsina-Gibert M. Determination of adalimumab and etanercept trough levels and drug antibodies in long-term psoriasis treatment: a single-centre cohort study. Clin Exp Dermatol. 2017;42(1):14-20. Doi: 10.1111/ced.12947.
21. Mahil SK, Arkir Z, Richards G, Lewis CM, Barker JN, Smith CH. Predicting treatment response in psoriasis using serum levels of adalimumab and etanercept: a single-centre, cohort study. Br J Dermatol. 2013;169(2):306-13. Doi: 10.1111/bjd.12341.
22. Krieckaert CLM, Nair SC, Nurmohamed MT, van Dongen CJJ, Lems WF, Lafeber FPJG, et al. Personalised treatment using serum drug levels of adalimumab in patients with rheumatoid arthritis: an evaluation of costs and effects. Ann Rheum Dis. 2015;74(2):361-8. Doi: 10.1136/annrheumdis-2013-204101.
23. Sawyer LM, Cornic L, Levin LA, Gibbons C, Møller AH, Jemec GB, et al. Long-term efficacy of novel therapies in moderate-to-severe plaque psoriasis: a systematic review and network meta-analysis of PASI response. J Eur Acad Dermatol Venereol. 2019;33(2):355-366. Doi: 10.1111/jdv.15277.
24. Annaswamy TM, Verduzco-Gutierrez M, Frieden L. Telemedicine barriers and challenges for persons with disabilities: COVID-19 and beyond. Disabil Health J. 2020;13(4):100973. Doi: 10.1016/j.dhjo.2020.100973.
25. Náfrádi L, Nakamoto K, Schulz PJ. Is patient empowerment the key to promote adherence? A systematic review of the relationship between self-efficacy, health locus of control and medication adherence. PLoS One. 2017;12(10):e0186458. Doi: 10.1371/journal.pone.0186458.
____
