Villaverde Piñeiro L1, Cachafeiro Pin AI2, Pérez Castro A3, Otero Logilde A2
- Servicio de Farmacia. Hospital Público de Monforte de Lemos (Lugo, España)
- Servicio de Farmacia. Hospital Público de la Mariña (Lugo, España)
- Servicio de Análisis Clínicos. Hospital Universitario Lucus Augusti (Lugo, España)
Fecha de recepción: 07/09/2022 – Aceptación: 10/10/2022
Correspondencia: Laura Villaverde Piñeiro · Hospital Público de Monforte de Lemos. Rúa Corredoira S/N. CP: 27400.Monforte de Lemos (Lugo)· lvillaverdepineiro@gmail.com
____
Resumen
Objetivos. La prescripción frecuente de antibióticos, incluyendo su uso combinado, plantea la necesidad de conocer los posibles efectos adversos derivados de su utilización. Nuestro objetivo es realizar una revisión bibliográfica, no sistemática, para conocer los casos de rabdomiólisis asociados al tratamiento con antimicrobianos en pacientes adultos; así como las características individuales de los pacientes y factores concomitantes implicados en la misma.
Métodos. Mediante la metodología PRISMA se seleccionaron artículos publicados hasta el 26 de diciembre de 2021, sobre las rabdomiólisis asociadas al uso de antibióticos en pacientes adultos disponibles en inglés, castellano, francés, alemán e italiano. Las bases de datos consultadas fueron Medline, Embase y Web Of Science. Se eligieron como términos para realizar la búsqueda: «Rhabdomyolysis/chemically induced», «Anti-Bacterial Agents» y “Drug induced».
Resultados. Se seleccionaron para revisión 34 casos de las 899 referencias recuperadas. La mayoría incluyeron mujeres (58.8%). 16 pacientes (47%) tenían prescritos tratamientos concomitantes, de los cuales 5 (14.7%) eran estatinas. Los antibióticos asociados de forma mayoritaria a rabdomiólisis fueron: quinolonas en 13 casos (38.1%), daptomicina en 8 (14%) y trimetoprim-sulfametoxazol en 5 (14%).
Conclusiones. Los resultados de nuestra revisión de casos evidencian la importancia de los factores individuales del paciente, así como tratamientos concomitantes, que justifican el realizar una monitorización estrecha de signos y/o síntomas, valores analíticos previos al inicio del tratamiento antibiótico y de forma periódica durante el mismo; con independencia de que esta reacción se encuentre, o no, descrita en ficha técnica.
Palabras claves: antimicrobianos, rabdomiólisis, reacción adversa, causalidad, factores de riesgo
Antibiotic induced rhabdomyolysis: case literature review
Summary
Objectives. Frequent prescription of antibiotics, including their combined use, raises the need for knowledge of the possible adverse effects of their use. The aim of this non-systematic literature review is to analyze the available literature about the cases of rhabdomyolysis associated with antimicrobials in adult patients, their individual characteristics and the concomitant factors involved in it.
Methods. Based on PRISMA methodology, articles published until December 26, 2021, on rhabdomyolysis associated with the use of antibiotics in adult patients available in English, Spanish, French, German and Italian were selected. Databases consulted were Medline, Embase and Web Of Science. Search terms used were: «Rhabdomyolysis/chemically induced», «Antibacterial agents» and «Drug induced».
Results. 34 cases of the 899 retrieved references were selected for review. Most were women (58.8%). 16 patients (47%) had prescribed concomitant treatments, statins in 5 (14.7%). The antibiotics most commonly associated with rhabdomyolysis were quinolones in 13 (38.1%), daptomycin in 8 (14%), and trimethoprim-sulfamethoxazole in 5 (14%).
Conclusions. The results of our review of cases show the importance of individual patient factors and concomitant treatments that justify close monitoring of signs and/or symptoms, analytical values prior to the start of antibiotic treatment as well as periodically during treatment regardless of whether this reaction was found or not described in the summary of product characteristics.
Keywords: Anti-Bacterial Agents, Rhabdomyolysis, Drug-Related Side Effects and Adverse Reactions, causality, risk factors
____
Introducción
La rabdomiólisis es un síndrome caracterizado por la rotura de fibras del músculo esquelético, con la consecuente liberación de sus componentes al torrente circulatorio (mioglobina, creatinin-fosfokinasa-CPK ,aldolasa, lactato deshidrogenasa y electrolitos). La elevación de CPK puede cursar de forma asintomática o derivar en diversas complicaciones, entre las que destacan la insuficiencia renal aguda, síndrome compartimental, hipovolemia, hipocalcemia, hipercalcemia tardía, hiperfosfatemia, hiperpotasemia y coagulación intravascular diseminada. 1
Los criterios diagnósticos incluyen la mioglobinemia, mioglobinuria y elevación de CPK igual o superior a cinco veces el límite superior de normalidad 1. Sus causas pueden ser hereditarias (asociadas a deficiencias enzimáticas) o adquiridas.
Dentro de las causas adquiridas se encuentran el abuso de alcohol, ejercicio físico intenso, compresión muscular, infecciones, drogas de abuso así como las asociadas a la utilización de medicamentos2,con una incidencia estimada de 1 por cada 100.000 habitantes3.
Entre los medicamentos más conocidos en la práctica clínica asociados a la misma destacan las estatinas4-5.En España, 6 casos de rabdomiolisis asociada a cerivastatina de un total de 80 resultaron mortales, lo que motivó su retirada del mercado en el año 20016 .
Menos conocida es la rabdomiólisis asociada a otras clases de medicamentos. Con respecto a los antibióticos, su prescripción frecuente e inclusive su uso combinado, plantean la necesidad de conocer los posibles efectos adversos derivados de su utilización para poder realizar una detección precoz de los mismos y tratar de minimizarlos. Este objetivo se engloba en los Programas de Optimización de Uso de Antimicrobianos (PROA)7.
Nuestro objetivo es realizar una revisión bibliográfica, no sistemática, con la finalidad de identificar los casos reportados de rabdomiólisis asociada a la administración de antimicrobianos en pacientes adultos; así como conocer los posibles determinantes individuales o condiciones concomitantes asociados a la aparición de esta reacción adversa.
Métodos
Estrategia de búsqueda y selección de artículos:
Se realizó una revisión bibliográfica no sistemática, basada en Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA)8, de artículos relacionados con la rabdomiólisis y los antimicrobianos; disponibles en inglés, castellano, francés, italiano y alemán publicados hasta el 26 de diciembre de 2021.
Se eligieron los siguientes términos como descriptores más adecuados para realizar la búsqueda:»Rhabdomyolysis/chemically induced»; «Anti-Bacterial Agents» y “Drug induced».
Se realizó la estrategia de búsqueda restringida en Medline, utilizando la ecuación final de búsqueda derivada de la combinación de los siguientes operadores booleanos y descriptores: «Rhabdomyolysis/chemically induced» AND «Anti-Bacterial Agents».
Se replicó la búsqueda en Embase y Web Of Science sin encontrar resultados, por lo que se utilizó como ecuación final: «Rhabdomyolysis» AND “Drug induced».
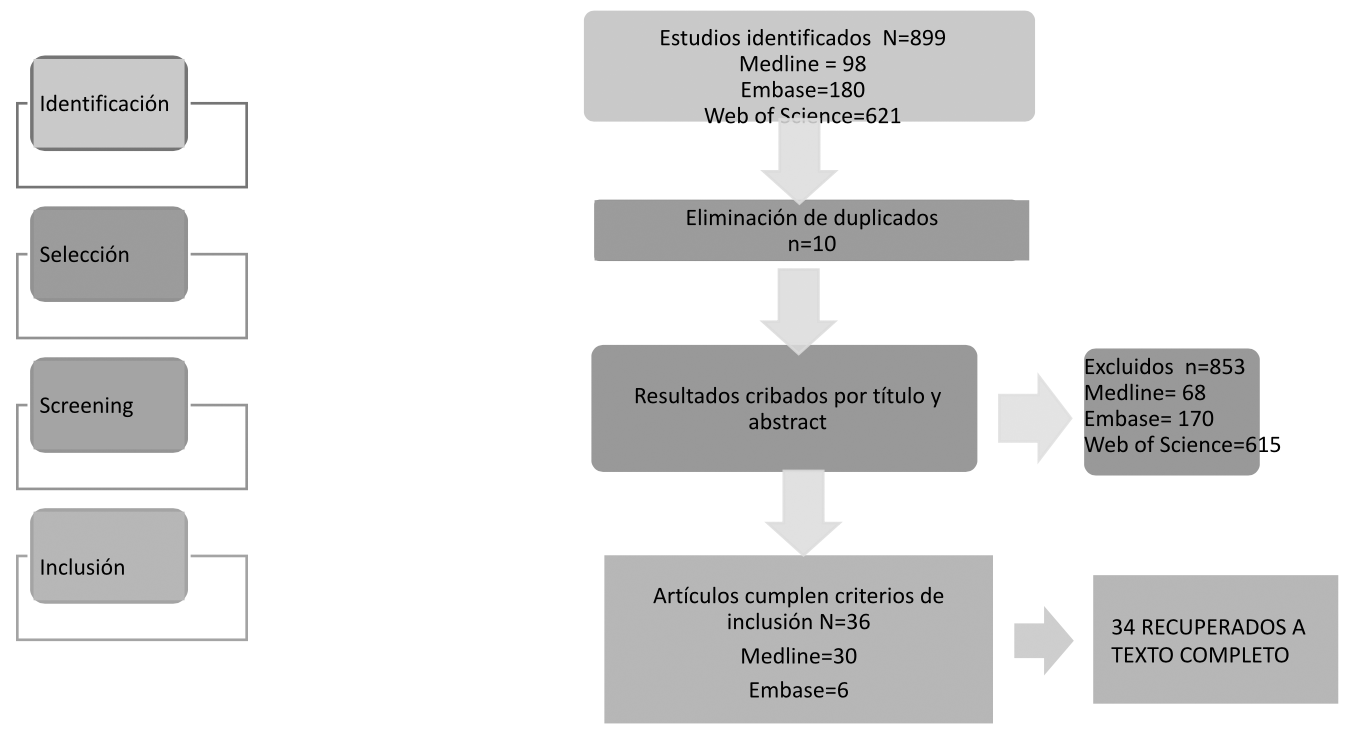
Fueron incluídas aquellas referencias bibliográficas que cumpliesen los siguientes criterios (tabla 1):
La selección de artículos fue realizada por dos revisores independientes, resolviendo las diferencias por consenso.
De las referencias incluídas, se extrajeron los siguientes datos: localización geográfica, características de los pacientes (sexo, edad y antecedentes de interés), características del tratamiento antibiótico (motivo de prescripción, pauta posológica y vía de administración), tratamiento domiciliario u otros tratamientos relevantes recibidos durante proceso agudo, características de la reacción adversa (secuencia temporal en días desde el inicio del tratamiento antibiótico hasta la aparición del efecto adverso, efecto de retirada del medicamento y desenlace), algoritmo de causalidad aplicado y su resultado, descripción de la reacción adversa en la ficha técnica del medicamento y, por último, un apartado de observaciones donde se incluyeron aspectos diferenciales de cada caso.
Resultados:
Siguiendo la estrategia de búsqueda en Medline, se localizaron un total de 98 publicaciones, se examinaron los títulos y resúmenes de todas ellas. Finalmente se incluyeron 30 (30.6%) y se excluyeron 68 (69.4%).La búsqueda en Embase arrojó 180 resultados. Tras cribar por su título y resumen, se incluyeron 10 (5.5 %) y excluyeron 170 (94.5 %). Al replicar la estrategia en Web Of Science, se localizaron 621 resultados de los cuales se incluyeron 6, que resultaron ser duplicados, excluyendo el resto.
Tras la lectura del título y resumen de los casos localizados, se excluyeron 853 por diferentes motivos: rabdomiólisis asociada a otros medicamentos diferentes de antibióticos (n=417), rabdomiólisis derivada de interacciones de antibióticos con otros medicamentos (n=261), rabdomiólisis asociada a otras causas (ejercicio físico, patologías y procedimientos n= 81),rabdomiólisis asociada al uso de sustancias no medicamentosas (n= 52) y la asociada a intoxicaciones medicamentosas (n= 42).
Un total de 36 casos cumplieron los criterios de inclusión (figura 1), pudiendo recuperarse 34 a texto completo, cuyas principales características se resumen en la tabla 2. La concordancia obtenida entre los revisores en la selección de casos a texto completo obtuvo un índice kappa de 0,90.
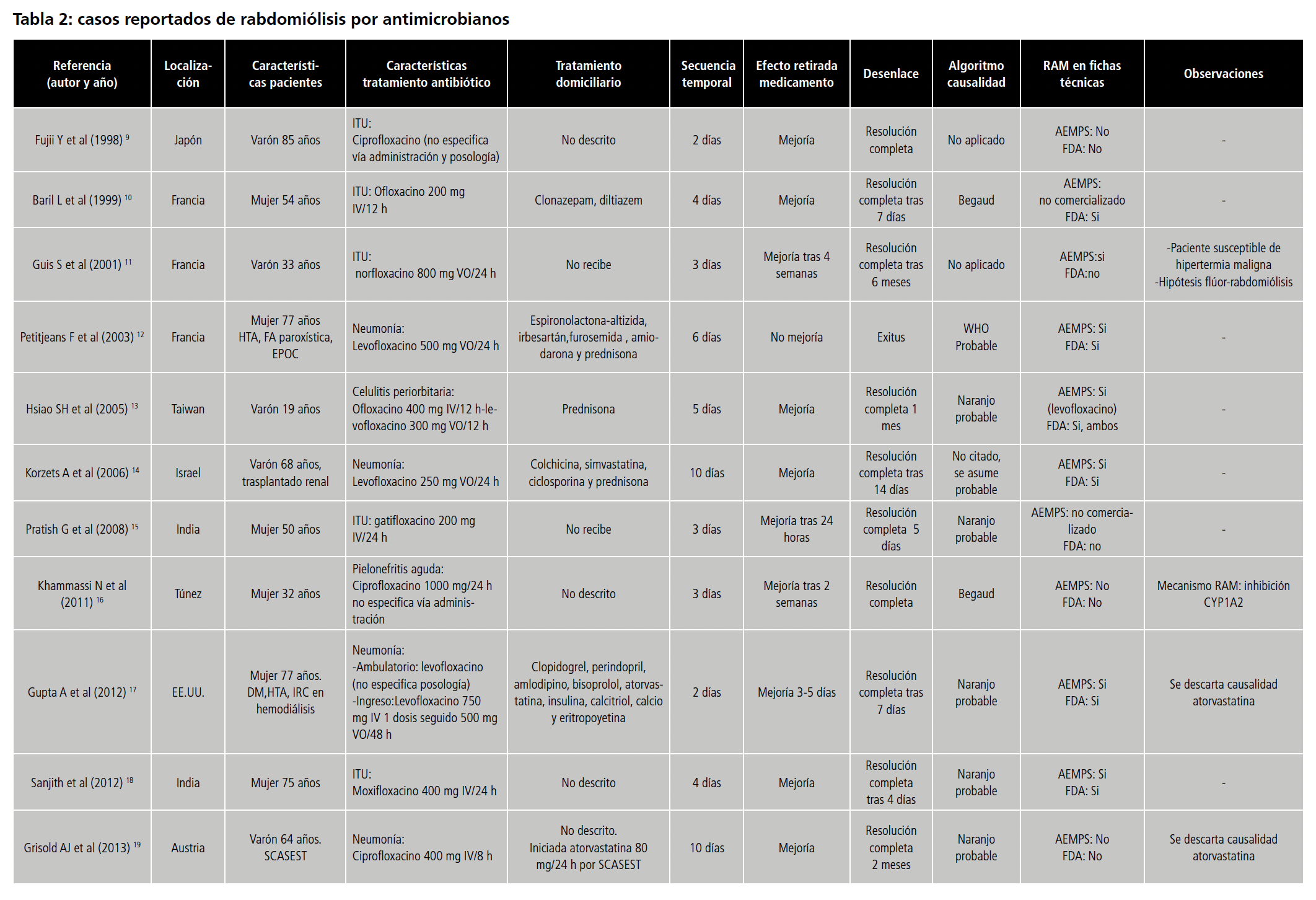

En los 34 casos individuales analizados, la mediana de edad de los pacientes fue de 46 años (33.5-64).La mayoría fueron mujeres (58.8%). 16 (47%) tenían prescritos tratamientos domiciliarios concomitantes (un 5.8% polifarmacia, definida por más de 5 medicamentos). Entre los tratamientos concomitantes destacaron las estatinas en 5 (14.7%) pacientes, corticoides en 3 (8.8%) y IECA y/o ARAII en 3 (8.8%).
La distribución de casos por antibióticos fue la siguiente: 13 casos (38.1 %) correspondieron a quinolonas, 8 (23.5%) a daptomicina, 5 (14 %) trimetoprim-sulfametoxazol, 3 (8.7%) polimixinas, 2 (5.8%) macrólidos, 2 (5.8%) linezolid y 1 (2,9 %) tetraciclinas.
En cuanto al tipo de infección a tratar, el diagnóstico mayoritario fue la neumonía en 10 pacientes (29.4%) seguido de osteomielitis en 9 (26.5%). La vía de administración mayoritaria fue la intravenosa en 14 pacientes (41.2%).
Respecto al establecimiento de la relación de causalidad se especificó la aplicación de algoritmo de causalidad en 15 casos (44.1%), siendo el más utilizado el de Naranjo en 11 (22.3%) seguido del de Begaud en 2 (5.8%). La mediana de secuencia temporal hasta la aparición del efecto adverso fue de 5 días (3-10) experimentando 33 pacientes (97.1%) resolución completa del cuadro clínico en una mediana de 14 días (7-20.5).
La reacción adversa se encontraba descrita en ficha técnica de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y/o en la de la Food And Drug Administration (FDA) para todos los antibióticos con la excepción de ciprofloxacino, gatifloxacino y linezolid.
Con respecto a las quinolonas, se incluyeron un total de 13 casos independientes 9-21. 7 pacientes recibieron tratamientos concomitantes: estatinas en 4 pacientes (30.7%) y corticoides en 3 (23 %).
Se propusieron 4 mecanismos explicativos para esta RAM: teoría de la hiperpermeabilidad vascular mediada por TNFα, IL-1, histamina y fibronectina20, degradación muscular en consecuencia de la reducción umbral convulsivo20, inhibición del CYP1A2 por ciprofloxacino16 así como el posible papel del flúor en esta RAM, no observada para quinolonas no fluoradas11.
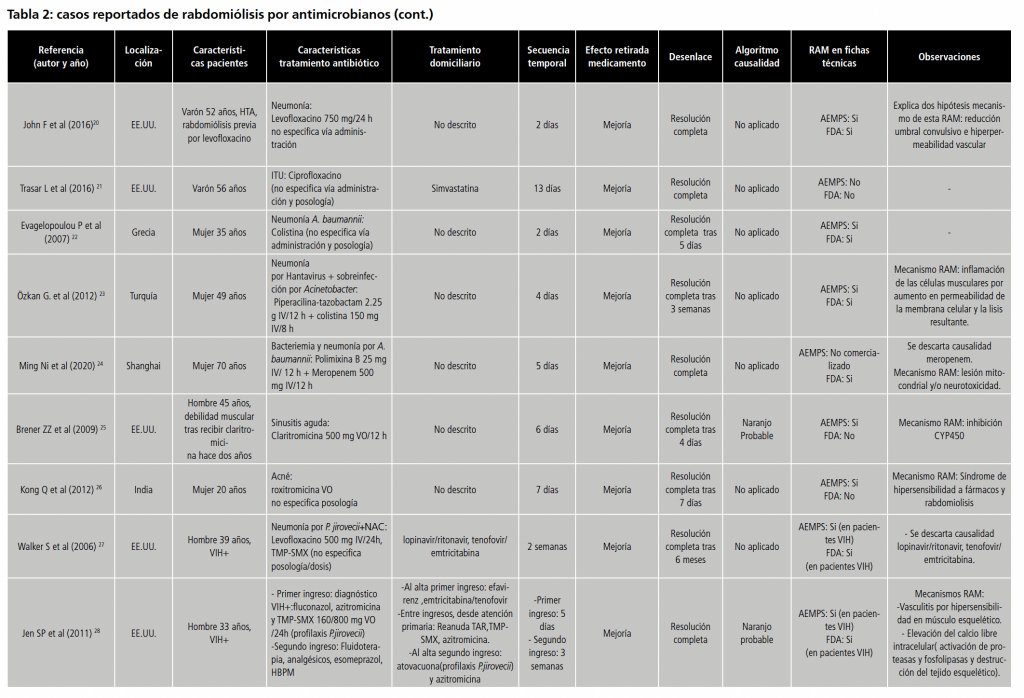
Para las polimixinas, se hallaron 3 casos independientes 22-24. Se expusieron un total de 4 mecanismos explicativos: teoría de la lesión mitocondrial y/o neurotoxicidad23 e inflamación de las células musculares por el aumento de la permeabilidad de la membrana celular y la lisis resultante24.
En cuanto a los macrólidos, se incluyeron 2 casos25-26 proponiendo dos mecanismos: inhibición de isoenzimas del CYP45025 y desarrollo del síndrome de hipersensibilidad a fármacos concomitante a rabdomiólisis 26 .
Sobre trimetoprim-sulfametoxazol, localizamos 5 casos independientes27-31.La RAM rabdomiólisis consta registrada en la ficha técnica de la AEMPS y FDA para pacientes VIH pero no en inmunocompetentes. Bujji A et al 29 describen el primer caso de rabdomiólisis por trimetoprim-sulfametoxazol en un paciente inmunocompetente.
Se sugirieron 2 mecanismos explicativos: teoría de la inducción de vasculitis por hipersensibilidad en músculo esquelético27 y elevación del calcio libre intracelular (activación de proteasas y fosfolipasas y destrucción del tejido esquelético)27.
En relación a linezolid, se incluyeron 2 casos 32-33. Se propuso como mecanismo la presencia de disfunción mitocondrial secundaria a Síndrome de Leigh (mutación 13513G > A en el gen MT-ND5)33.
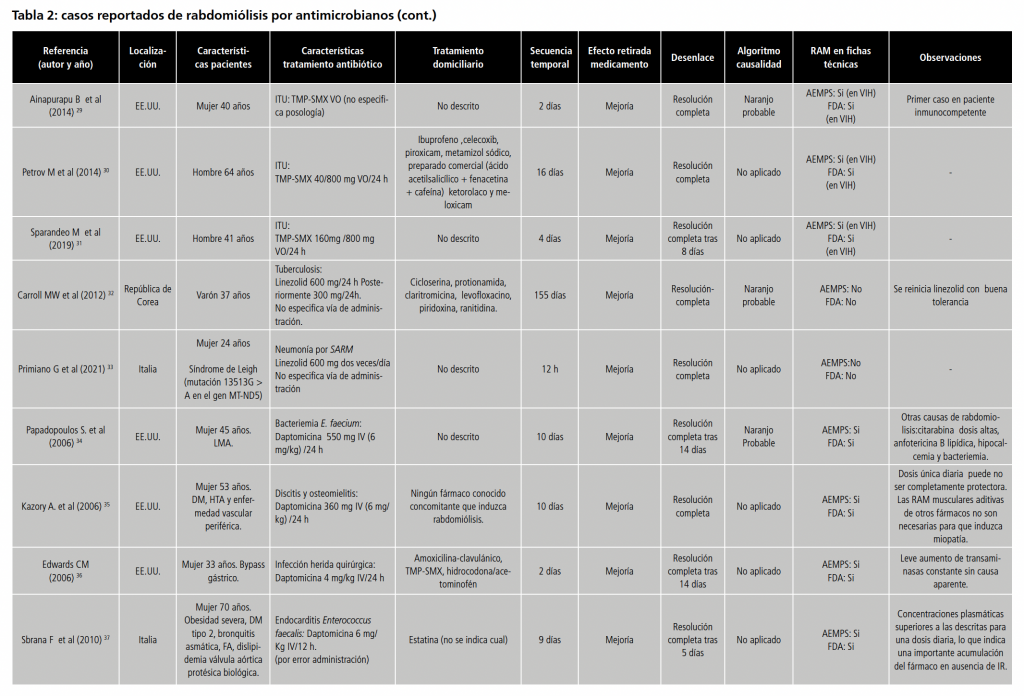
Referente a daptomicina, se incluyeron un total de 8 casos independientes 34-41 en los que la posología más frecuente fue 6 mg/kg vía intravenosa (IV) cada 24h. No constan mecanismos explicativos de la RAM.
Con respecto a las tetraciclinas, se incluyó un sólo caso 42 de una mujer de 20 años con acné tratada con minociclina vía oral, sin posología especificada. No recibió tratamientos concomitantes. La duración de exposición hasta el comienzo de los síntomas fue de 42 días.
Se suspendió minociclina, iniciando tratamiento con dexametasona y antihistamínico, con mejoría de síntomas hasta resolución completa. No se aplicó algoritmo de causalidad.
Esta RAM no figuraba ni en la ficha técnica de la AEMPS ni FDA.
Se propuso un mecanismo explicativo de la misma la realización de actividad física intensa en el contexto de un síndrome de hipersensibilidad no resuelto.
Discusión
Nuestra revisión aporta evidencia sobre la existencia de ciertos antibióticos asociados a este efecto adverso, a priori no tan conocidos. Para daptomicina, en la que el riesgo de rabdomiólisis está establecido, según su ficha técnica43 , el nivel de CPK debe controlarse al iniciar el tratamiento y semanalmente mientras se mantenga. La contribución al campo de los resultados de nuestra revisión subrayan la necesidad de aumentar la frecuencia de monitorización en pacientes críticos y/o aquellos que no puedan informar síntomas de miopatía y/o con deterioro de la función renal. Es necesario vigilar signos y/o síntomas de miopatía diariamente durante el tratamiento y monitorizar las transaminasas por el papel que la daptomicina podría jugar en el daño hepático.
Para las quinolonas no se recoge recomendación de monitorización en su ficha técnica. Si bien, ante la sospecha de rabdomiólisis, debe realizarse una valoración individualizada de la necesidad de monitorización de CPK, función renal y transaminasas en pacientes con factores riesgo adicionales de rabdomiólisis (medicamentos concomitantes,insuficiencia renal, edad avanzada, bajo peso, género femenino, entre otros) ya que podría resultar de utilidad para anticipar nuestras actuaciones valorando reducir la dosis o seleccionando un tratamiento antibiótico alternativo.
El perfil de pacientes que padecieron esta RAM en los casos localizados pertenecieron en su mayoría al género femenino destacando a mayores la prescripción de estatinas en un porcentaje no despreciable de los mismos.
Los resultados de nuestra revisión indican que, con el objetivo de minimizar los factores relacionados con la rabdomiólisis por antimicrobianos, se debe prestar especial atención a: tratamientos concomitantes (domicilio e ingreso), alteraciones en la función renal, dosis diaria e intervalo administración, condiciones concomitantes y alteraciones electrolíticas34. Este trabajo contribuye a incrementar el conocimiento sobre posibles factores de riesgo que podrían jugar un papel en la causalidad o desarrollo de esta reacción adversa. De todos modos,se precisan más estudios para establecer un perfil individualizado de los factores de riesgo para cada antimicrobiano de forma análoga a los ya descritos para las miopatías por estatinas (edad avanzada, género femenino, complexión delgada, historia de elevación de CPK,antecedentes familiares de miopatía, altas dosis de estatinas,metabolismo e interacciones, entre otros)44.
La precaución debe incrementarse al combinarse varios medicamentos que produzcan rabdomiólisis por su efecto aditivo. En este sentido, son diversas las publicaciones sobre rabdomiólisis derivadas de combinación de antibióticos con otros medicamentos45-49. Además, para daptomicina se han publicado casos asociados a su uso concomitante con otros medicamentos, entre los que destacan las estatinas 50-51.
Por ello, cobra especial relevancia registrar todo el tratamiento del paciente, tanto domiciliario como administrado durante el ingreso, con el objetivo de detectar nuevas interacciones medicamentosas relevantes que no hayan sido descritas con anterioridad como inductoras de rabdomiólisis. En este marco, la educación sanitaria se posiciona como una importante herramienta de prevención frente a la automedicación, incluyendo los antibióticos por el riesgo de interacciones graves.
Destacamos una interesante herramienta de ayuda al profesional sanitario, un atlas de rabdomiólisis inducida por medicamentos “Drug-Induced Rhabdomyolysis Atlas (DIRA)” 52 , que incluye un listado de medicamentos autorizados por la FDA clasificados en 4 niveles de severidad según su potencial para producir rabdomiólisis teniendo en cuenta las propiedades del medicamento y los datos recogidos postcomercialización. A la hora de generar nuevas evidencias se hace imprescindible recordar la obligatoriedad de notificación de los efectos adversos por parte de los profesionales sanitarios en la fase de postcomercialización, así como la necesidad de difundir a la comunidad científica nuestras experiencias con el objetivo de generar nuevas evidencias.
Respecto al establecimiento de la relación causal, en la actualidad, no existen algoritmos específicos para el diagnóstico de rabdomiólisis medicamentosas. Entre los más aceptados se encuentra el de Naranjo, especialmente si se trata de reacciones adversas no conocidas 53.Los resultados de nuestra revisión ponen de manifiesto una falta de uniformidad en la aplicación dealgoritmos de causalidad siendo el de Naranjo el más utilizado. Si bien, el desarrollo de guías por parte de equipos de trabajo multidisciplinar, se posiciona como una valiosa estrategia a la hora de definir algoritmos diagnósticos entre los que se puede incluír la detección de polimorfismos genéticos por jugar un papel importante en el desarrollo de esta RAM.
Por otro lado, se fomentaría la detección precoz de este efecto adverso reduciendo su morbimortalidad, no obstante, son precisos más estudios que confirmen esta hipótesis. Asimismo, la incorporación del farmacéutico al equipo asistencial constituye una práctica fundamental para asegurar una adecuada monitorización de los efectos adversos de los medicamentos así como realizar una valoración individualizada de la necesidad de interrupción y/o modificación de los tratamientos debido a condiciones clínicas intercurrentes o interacciones medicamentosas concomitantes.
Conflictos de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía
1.- Torres PA, Helmstetter JA, Kaye AM, Kaye AD. Rhabdomyolysis: pathogenesis, diagnosis, and treatment. The Ochsner journal.2015;15(1): 58–69.
2.- Cortés R, Kleinsteuber K, Paz Vargas C,Avaria MA. Rabdomiólisis metabólica: actualización. REV. MED. CLIN. CONDES.2018; 29(5): 553-559.doi:10.1016/j.rmclc.2018.08.003
3.-Wen Z, Liang Y, Hao Y, Delavan B, Huang R, Mikailov M,et al. Drug-Induced Rhabdomyolysis Atlas (DIRA) for idiosyncratic adverse drug reaction management. Drug discovery today.2019:24(1), 9–15. doi:10.1016/j.drudis.2018.06.006
4.- Mendes P, Robles PG, Mathur S. Statin-induced rhabdomyolysis: a comprehensive review of case reports. Physiother Can. 2014 Spring;66(2):124-32. doi: 10.3138/ptc.2012-65
5.-Safitri N, Alaina MF, Pitaloka DAE, Abdulah R. A Narrative Review of Statin-Induced Rhabdomyolysis: Molecular Mechanism, Risk Factors, and Management. Drug Healthc Patient Saf. 2021;13:211-219. doi: 10.2147/DHPS.S333738
6.-García-Sabina A, Gulín-Dávila J, Sempere-Serrano P, González-Juanatey C, Martínez-Pacheco R. Consideraciones específicas en la prescripción e intercambio terapéutico de estatinas. Farm Hosp. 2012;36(2):97-108. doi: 10.1016/j.farma.2011.02.010
7.-Rodríguez-Baño J, Paño-Pardo JR, Alvarez-Rocha L, Asensio A, Calbo E, Cercenado E et al.Programas de optimización de uso de antimicrobianos (PROA) en hospitales españoles: documento de consenso GEIH-SEIMC, SEFH y SEMPSPH.Enfermedades Infecciosas y Microbiología Clínica.2012; 30 (1):22.e1-22.e23. doi:10.1016/j.eimc.2011.09.018
8.-Page MJ, Moher D, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. PRISMA 2020 explanation and elaboration: updated guidance and exemplars for reporting systematic reviews. BMJ. 2021; 372: n160. doi: 10.1136/bmj.n160
9.-Fujii Y , Higashi K, Enomoto S, Okada M, Yamane H, Tsujiuchi K. A case of rhabdomyolysis apparently induced by ciprofloxacin hydrochloride, complicated by acute renal failure.和歌山医学. 1998; 49 (3):361-366.
10.-Baril L, Maisonobe T, Jasson-Molinier M, Haroche J, Bricaire F, Caumes E. Acute rhabdomyolysis during treatment with ofloxacin-a case report. Clin Infect Dis. 1999 ;29(6):1598-9. doi: 10.1086/313551
11.-Guis S, Jouglard J, Kozak-Ribbens G, Figarella-Branger D, Vanuxem D, Pellissier JF, et al. Malignant hyperthermia susceptibility revealed by myalgia and rhabdomyolysis during fluoroquinolone treatment. J Rheumatol. 2001 ;28(6):1405-6.
12.-Petitjeans F, Nadaud J, Perez JP, Debien B, Olive F, Villevieille T,et al. A case of rhabdomyolysis with fatal outcome after a treatment with levofloxacin. Eur J Clin Pharmacol. 2003 ;59(10):779-80. doi: 10.1007/s00228-003-0688-x
13.-Hsiao SH, Chang CM, Tsao CJ, Lee YY, Hsu MY, Wu TJ. Acute rhabdomyolysis associated with ofloxacin/levofloxacin therapy. Ann Pharmacother. 2005 Jan;(1):146-9. doi: 10.1345/aph.1E285
14.-Korzets A, Gafter U, Dicker D, Herman M, Ori Y. Levofloxacin and rhabdomyolysis in a renal transplant patient. Nephrol Dial Transplant. 2006;21(11):3304-5. doi: 10.1093/ndt/gfl396
15.-George P, Das J, Pawar B, Badyal D. Gatifloxacin-induced rhabdomyolysis. J Postgrad Med. 2008 ;54(3):233-4. doi: 10.4103/0022-3859.41813
16.-Khammassi N, Abdelhedi H, Mohsen D, Ben Sassi M, Cherif O. Rhabdomyolyse et insuffisance rénale aiguë sous traitement par ciprofloxacine [Rhabdomyolysis and acute renal failure secondary to ciprofloxacin therapy]. Therapie. 2012;67(1):67-8. doi: 10.2515/therapie/2012005
17.-Gupta A, Guron N, Harris M, Bell R. Levofloxacin-induced rhabdomyolysis in a hemodialysis patient. Hemodial Int. 2012;16(1):101-3. doi: 10.1111/j.1542-4758.2011.00592.x
18.-Sanjith S, Raodeo A, Clerk A, Pandit R, Karnad DR. Moxifloxacin-induced rhabdomyolysis. Intensive Care Med. 2012 ;38(4):725. doi: 10.1007/s00134-012-2502-7
19.-Grisold AJ, Hoenigl M, Ovcina I, Valentin T, Fruhwald S. Ventilator-associated pneumonia caused by OXA-48-producing Escherichia coli complicated by ciprofloxacin-associated rhabdomyolysis. J Infect Chemother. 2013;19(6):1214-7. doi: 10.1007/s10156-013-0628-3
20.-John F, Oluronbi R, Pitchumoni CS. Levofloxacin-induced rhabdomyolysis: a case report. J Med Case Rep. 2016;10(1):235. doi: 10.1186/s13256-016-1004-6
21.-Trasar L, Mirza N, Lisawat P, Raut R, Shih W.Thrombotic thrombocytopenic purpura and rhabdomyolysis associated with ciprofloxacin use. Am J Kidney Dis.2016;67(5):A1-A118.
22.-Evagelopoulou P, Katsaros A, Myrianthefs P, Karatzas S, Boutzouka E, Fildissis G, et al. Colistin and rhabdomyolysis: a causative agent or an innocent bystander? Intensive Care Med. 2007;33(3):556-7. doi: 10.1007/s00134-006-0515-9
23.-Özkan G, Ulusoy Ş, Gazioğlu S, Cansız M, Kaynar K, Arı D. Rhabdomyolysis and severe muscle weakness secondary to colistin therapy. Ren Fail. 2012;34(7):926-9. doi: 10.3109/0886022X.2012.684513
24.-Ni M, Meng X, Wang L, Zhao Y, Yu M, Shi S. Polymyxin B-induced rhabdomyolysis: A case report. Medicine (Baltimore).2020;23;99(43):e22924. doi: 10.1097/MD.0000000000022924
25.-Brener ZZ, Bilik I, Khorets B, Winchester JF, Bergman M. Rhabdomyolysis following clarithromycin monotherapy. Am J Med Sci. 2009;338(1):78. doi: 10.1097/MAJ.0b013e31819e221f
26.-Kong Q, Sang H, Zhang M, Zeng M, Hu WX, Deng DQ, et al. Rhabdomyolysis associated with roxithromycin hypersensitivity syndrome. Indian J Dermatol Venereol Leprol. 2012;78(2):197-9. doi: 10.4103/0378-6323.93645
27.-Walker S, Norwood J, Thornton C, Schaberg D. Trimethoprim-sulfamethoxazole associated rhabdomyolysis in a patient with AIDS: case report and review of the literature. Am J Med Sci. 2006;331(6):339-41. doi: 10.1097/00000441-200606000-00011
28.-Jen SP, Sharma R. Trimethoprim-sulphamethoxazole-associated rhabdomyolysis in an HIV-infected patient. Int J STD AIDS. 2011;22(7):411-2. doi: 10.1258/ijsa.2009.009516
29.-Ainapurapu B, Kanakadandi UB. Trimethoprim-sulfamethoxazole induced rhabdomyolysis. Am J Ther. 2014;21(3):e78-9. doi: 10.1097/MJT.0b013e31824567fe
30.-Petrov M, Yatsynovich Y, Lionte C. An unusual cause of rhabdomyolysis in emergency setting: challenges of diagnosis. Am J Emerg Med. 2015;33(1):123.e1-3. doi: 10.1016/j.ajem.2014.05.041
31.-Sperandeo M, Pantic D, Army J. Acute Toxin-mediated Rhabdomyolysis During Treatment With Trimethoprim-sulfamethoxazole. Clin Pract Cases Emerg Med. 2019;3(4):357-360. doi: 10.5811/cpcem.2019.7.42688
32.-Carroll MW, Choi H, Min S, Hwang S, Park H, Song T, et al. Rhabdomyolysis in a patient treated with linezolid for extensively drug-resistant tuberculosis. Clin Infect Dis. 2012 ;54(11):1624-7. doi: 10.1093/cid/cis293
33.-Primiano G, Servidei S. A severe linezolid-induced rhabdomyolysis and lactic acidosis in Leigh syndrome. J Inherit Metab Dis. 2021;44(1):4-5. doi: 10.1002/jimd.12328.
34.-Papadopoulos S, Ball MA,Liewer SE, Martin CA, Winstead PS, Murphy BS. Rhabdomyolysis during Therapy with Daptomycin.Clinical Infectious Diseases.2006;42(12): e108–e110. doi: 10.1086/504379
35.- Kazory A, Dibadj K, Weiner ID. Rhabdomyolysis and acute renal failure in a patient treated with daptomycin. The Journal of antimicrobial chemotherapy.2006 57(3):578–579. doi:10.1093/jac/dki476
36.-Edwards CM, King K, Garcia RJ.Early-onset rhabdomyolysis associated with daptomycin.Infectious Diseases in Clinical Practice.2006; 14(5): 327-328.
37.-Sbrana F, Di Paolo A, Pasanisi EM, Tagliaferri E, Arvia C, Puntoni M,et al. Administration interval and daptomycin toxicity: a case report of rhabdomyolysis.J Chemother. 2010;22(6):434-5. doi: 10.1179/joc.2010.22.6.434
38.-Ferrera C, Vilacosta I, Vivas D, Olmos C. Miopatía grave por daptomicina [Severe daptomycin-induced myopathy]. Med Clin (Barc). 2012;139(3):138-139. doi:10.1016/j.medcli.2011.12.001
39.-King ST, Walker ED, Cannon CG, Finley RW. Daptomycin-induced rhabdomyolysis and acute liver injury. Scand J Infect Dis. 2014;46(7):537-540. doi:10.3109/00365548.2014.901555
40.-Greco CS, Velidi S. Rhabdomyolysis and drug-induced liver injury secondary to daptomycin use.Infectious Diseases in Clinical Practice.2016; 24(3): e11-e12.
41.-Ramírez-Martín R, Pérez-Rodríguez P, Rico-Nieto A, Mauleón-Ladrero C. Rabdomiólisis de inicio precoz e insuficiencia renal aguda asociadas a daptomicina. Caso clínico y revisión de la literatura [Early onset rhabdomyolysis and acute renal failure associated with the administration of daptomycin. A Case report and literature review]. Rev Esp Geriatr Gerontol. 2018;53(6):362-363. doi:10.1016/j.regg.2018.05.008
42.-Rahman Z, Weinberg J, Scheinfeld N. Minocycline hypersensitivity syndrome manifesting with rhabdomyolysis. Int J Dermatol. 2002;41(8):530-1. doi: 10.1046/j.1365-4362.2002.15636.x
43.-Ficha técnica AGEMED de Cubicin ® Disponible en: https://cima.aemps.es/cima/dochtml/ft/05328002/FT_05328002.html [Consultado 2/01/2022]
44.-Forcadell-Peris MJ, Diego-Cabanes C. Rabdomiólisis secundaria a simvastatina y fenofibrato. Semergen. 2014;40(4):91-4. doiI: 10.1016/j.semerg.2014.01.007
45.-Bouchard J, De La Pena N, Oleksiuk LM. Levofloxacin-induced rhabdomyolysis in a patient on concurrent atorvastatin: Case report and literature review. J Clin Pharm Ther. 2019 Dec;44(6):966-969. doi: 10.1111/jcpt.13010
46.-Sawant RD. Rhabdomyolysis due to an uncommon interaction of ciprofloxacin with simvastatin. Can J Clin Pharmacol. 2009 Winter;16(1):e78-9.
47.-Bataillard M, Beyens MN, Mounier G, Vergnon-Miszczycha D, Bagheri H, Cathebras P. Muscle Damage Due to Fusidic Acid-Statin Interaction: Review of 75 Cases From the French Pharmacovigilance Database and Literature Reports. Am J Ther. 2019;26(3):e375-e379. doi: 10.1097/MJT.0000000000000679
48.-Patel AM, Shariff S, Bailey DG, Juurlink DN, Gandhi S, Mamdani M, et al. Statin toxicity from macrolide antibiotic coprescription: a population-based cohort study. Ann Intern Med. 2013 ;158(12):869-76. doi: 10.7326/0003-4819-158-12-201306180-00004
49.-Fernández-Ferreiro A, Pose-Reino A, Martinez-Bahamonde F, Paris M, Guemas E, González-Barcia M, Lamas MJ. Serotonin syndrome, rhabdomyolysis and convulsion associated with drug interaction between venlafaxine and amoxicillin/clavulanic acid. Actas Esp Psiquiatr. 2016 Sep;44(5):193-202.
50.- Dare RK, Tewell C, Harris B, Wright PW, Van Driest SL, Farber-Eger E, et al. Effect of Statin Coadministration on the Risk of Daptomycin-Associated Myopathy. Clin Infect Dis. 2018;67(9):1356-1363. doi: 10.1093/cid/ciy287
51.-Bland CM, Bookstaver PB, Thomas S. Successful re-challenge of daptomycin therapy after initial rhabdomyolysis with co-administration of simvastatin. Int J Antimicrob Agents. 2011;38(6):549-50. doi: 10.1016/j.ijantimicag.2011.08.003
52.-Wen Z, Liang Y, Hao Y, Delavan B, Huang R, Mikailov M, Tong W, Li M, Liu Z.Drug-Induced Rhabdomyolysis Atlas (DIRA) for idiosyncratic adverse drug reaction management.Drug Discov Today. 2019;24(1), 9-15. doi: 10.1016/j.drudis.2018.06.006
53.-Kyonen M, Briones I, Lagos X, Vargas S.Comparación de dos métodos de evaluación de causalidad de sospechas de reacciones adversas a medicamentos (RAM). 2003-2009.Rev Med Chile. 2015; 143(7): 880-886. doi:10.4067/S0034-98872015000700009
____

