Fecha de recepción: 05/05/2017 – Fecha de aceptación: 25/01/2018
Bento Martins CM
Centro Hospitalar do Algarve, E.P.E. Faro (Portugal)
____
Correspondencia:
Carminda Maria Bento Martins
Centro Hospitalar do Algarve, E.P.E.
Rua Leão Penedo
8000-386 Faro (Portugal)
Correo electrónico: carmindamartins@chalgarve.min-saude.pt
____
Resumo
Objectivo: O principal objectivo deste trabalho baseou-se na análise das normativas emanadas pelo Despacho conjunto nº 1051/2000, a sua exequibilidade e adequabilidade às necessidades reais através da implementação de protocolos, de modo a que se dê cumprimento ao referido despacho sem que se verifiquem constrangimentos no momento da disponibilidade dos medicamentos, para que em tempo útil, estejam disponíveis para o tratamento dos doentes seguidos na instituição hospitalar onde o estudo foi efectuado.
Metodologia: Análise e descrição das metodologias implementadas no que concerne à rastreabilidade de medicamentos hemoderivados tendo como base o Despacho conjunto nº 1051/2000, bem como as normativas e protocolos implementados na referida instituição de modo a ser exequível o objectivo proposto de rastreabilidade destes medicamentos.
Resultados: Descrevem-se as normas e procedimentos implementados os quais seguem os padrões de qualidade exigidos e permitem a acessibilidade imediata aos referidos medicamentos sempre que prescritos, mas dando cumprimento à legislação em vigor. Igualmente são apresentados os consumos qualitativos e quantitativos referentes ao ano de 2016, com um total de 9.109 unidades de diferentes medicamentos hemoderivados dispensados pelos Serviços Farmacêuticos, correspondente a 1.572 registos de distribuição.
Conclusões: Apesar dos elevados consumos de medicamentos hemoderivados e as regras rígidas que estão implementadas, podemos concluir que é possível em qualquer momento aceder a informação de quais os doentes aos quais foi administrado um determinado lote de medicamento, bem como o tipo de fármaco e em que contexto clinico o mesmo foi prescrito e administrado.
Palavras chave: Medicamentos hemoderivados, rastreabilidade, monitorização de hemoderivados.
____
Introdução
Os medicamentos hemoderivados são especialidades farmacêuticas obtidas a partir do plasma humano de dadores, os quais são, submetidas a processos de industrialização e normalização que lhes conferem qualidade, estabilidade e especificidade, sendo os principais fármacos utilizados: albumina humana, imunoglobulinas e factores da coagulação1,2.
A produção industrial de hemoderivados iniciou-se na década de 40 nos Estados Unidos com a produção de albumina. Na década de 80 com o surgimento da Síndrome da Imunodeficiência Adquirida (SIDA) e a comprovação da sua transmissão pela utilização de hemoderivados, a indústria viu-se obrigada a implementar métodos de inactivação viral na produção destes medicamentos.
As principais características deste grupo de fármacos advêm do facto de serem constituídos por uma estrutura proteica complexa, o que obriga a que a sua administração seja exclusivamente por via parentérica, intravenosa na maioria das situações. Atendendo à sua origem plasmática, encontram-se implícitos os riscos de que possa ocorrer transmissão de infecções aquando da sua administração1,2.
Deste modo, torna-se imprescindível uma correcta monitorização dos hemoderivados desde a sua produção, libertação do lote, prescrição e registo da administração, sendo de primordial importância a identificação de todos os doentes aos quais foi administrado um lote de um medicamento com uma suspeita de problema de fabrico, conservação ou estabilidade.
O Laboratório do Infarmed integra a Rede Europeia dos Laboratórios Oficiais de Comprovação da Qualidade dos Medicamentos, competindo-lhe, neste âmbito, proceder à libertação oficial de lotes de medicamentos de origem biológica. Nestes medicamentos incluem-se os Hemoderivados, de acordo com o Estatuto do Medicamento (n.º 135 do Decreto -lei n.º 176/2006, de 30 de agosto), bem como as normas europeias aplicáveis “EC Administrative Procedure For Official Control Authority Batch Release” PA/PH/OMCL(09) 103 DEF3.
Relativamente à administração, recomenda-se um controlo minucioso e personalizado por lote (registo lotes/doente). Esta recomendação advém das próprias características dos hemoderivados: a maior variabilidade inter lote (1-20 por 100) e a identificação do aparecimento de reacções adversas a determinados lotes recomendam esta metodologia1.
Tendo como objectivo a identificação e registo dos medicamentos hemoderivados administrados aos doentes, como metodologia adequada à investigação de eventual relação de causalidade entre a administração terapêutica daqueles medicamentos e a detecção de doença infecciosa transmissível pelo sangue, o despacho nº 11 291/97, do Secretário do Estado da Saúde, de 27 de Outubro, publicado no Diário da República, 2ª série, nº 267, de 18 de Novembro de 1997, estabeleceu um procedimento uniforme de registo de todos os actos de requisição clinica, distribuição aos serviços e administração aos doentes dos medicamentos derivados do plasma humano4.
O estudo apresentado reporta-se a dados obtidos na principal unidade hospitalar do Centro Hospitalar do Algarve, E.P.E. (CHAlgarve, E.P.E.); Unidade de Faro, com um total de 666 camas e uma elevada variabilidade de especialidades médicas e cirúrgicas.
O CHAlgarve, E.P.E. assegura a prestação de cuidados de saúde em toda a extensão da região do Algarve (16 concelhos) a uma população de cerca de 450.000 habitantes, número que pode triplicar na época alta do turismo.
O principal objectivo deste trabalho baseou-se na análise, interpretação e verificação das normativas emanadas pelo Despacho conjunto nº 1051/2000, a sua exequibilidade e adequabilidade às necessidades reais através da implementação de protocolos, de modo a que se dê cumprimento ao referido despacho sem que se verifiquem constrangimentos no momento da disponibilidade dos medicamentos.
De modo a certificar o objectivo primordial, nomeadamente a rastreabilidade de medicamentos hemoderivados, foram analisados qualitativa e quantitativamente as existências e consumos destes medicamentos, o que nos permitiu validar a exequibilidade dos procedimentos implementados.
Métodos
Análise e descrição das metodologias implementadas no que concerne à rastreabilidade de medicamentos hemoderivados tendo como base o Despacho conjunto nº 1051/2000, bem como as normativas e protocolos implementados na unidade de Faro do CHAlgarve, E.P.E. de modo a permitir a exequibilidade do objectivo proposto, ou seja “rastreabilidade de medicamentos hemoderivados”.
Colheita da informação necessária por consulta das folhas de Requisição/Distribuição/Administração de Medicamentos Hemoderivados (anexo do referido Despacho), bem como utilização do programa informático GHAF (Gestão Hospitalar de Armazém e Farmácia), de modo a obter os dados em termos qualitativos e quantitativos referentes a medicamentos hemoderivados adquiridos e dispensados pelos Serviços Farmacêuticos e o Serviço de Imuno-hemoterapia do hospital, no período do ano de 2016.
Apresentação de dados referentes à variabilidade de medicamentos hemoderivados disponíveis nos Serviços Farmacêuticos e no Serviço de Imuno-hemoterapia, bem como os elevados consumos destes fármacos de modo a consolidar o objectivo primordial que é a rastreabilidade de medicamentos hemoderivados, de modo a garantir a eficácia e segurança dos mesmos.
Resultados
O Despacho nº 11 291/97 de 27 de Outubro, estabeleceu um procedimento uniforme de registo de todos os actos de requisição clinica, distribuição aos serviços e administração aos doentes, dos medicamentos derivados do plasma humano.
Tendo-se verificado que o sistema de registo implementado por aquele despacho não respondia cabalmente a todos os objectivos que se pretendiam atingir, foi criado um grupo interdisciplinar com a incumbência de rever o despacho nº 11 291/97 e propor as regras tidas por mais apropriadas a um registo rigoroso.
Na sequência do referido trabalho surgiu o Despacho conjunto nº 1051/2000 de 30 de Outubro, onde se encontram definidos os procedimentos de registo da requisição, distribuição e administração dos medicamentos hemoderivados, sendo de salientar os seguintes pontos:
1. Devem ser registados todos os actos de requisição clinica, distribuição aos serviços e administração aos doentes de todos os medicamentos derivados do plasma humano utilizados nos estabelecimentos de saúde públicos e privados.
2. Os actos de requisição, distribuição e administração são registados em ficha de modelo anexo ao referido despacho.
2.1. A ficha referida no ponto nº 2 é de formato A4, constituída por duas vias, «via farmácia» e «via serviço», e impressão no rosto, sendo a via farmácia autocopiativa e contendo as instruções relativas ao preenchimento, circuito e arquivo (Anexos 1 e 2).
3. Excepcionalmente e sem prejuízo das regras de registo da requisição, distribuição e administração dos medicamentos hemoderivados constantes do anexo do referido despacho, a distribuição e registo do plasma fresco congelado inactivo, bem como o arquivo da documentação (via farmácia) relativo àqueles actos, poderá ser feito pelos serviços de imuno-hemoterapia.
De modo a dar-se cumprimento ao determinado no Despacho nº 11 291/97 de 27 de Outubro com as alterações aprovadas no Despacho conjunto nº 1051/200 de 30 de Outubro e às normativas implementadas no Hospital de Faro, sempre que é prescrito um hemoderivado, seguem-se os seguintes procedimentos:
1. O médico deve preencher o Quadro A e Quadro B da ficha modelo.
2. O enfermeiro responsável pelo doente dirige-se aos S.F. com o referido documento.
3. O farmacêutico preenche o Quadro C da ficha modelo, identificando cada unidade de medicamento fornecida com etiqueta onde deve constar a identificação do doente, do serviço requisitante, bem como as condições de acondicionamento do medicamento.
4. Durante o acto de dispensa o farmacêutico deve ter em consideração que devido ao limite de linhas de registo de administração, só pode fornecer medicamento para um máximo de 13 administrações. Sendo que, quando surgir a necessidade de continuar o tratamento deverá iniciar-se um novo processo com uma nova ficha modelo.
5. O farmacêutico deve assinar no Quadro C o confirmativo da dispensa.
6. O enfermeiro deve confirmar a recepção do medicamento através de assinatura no campo onde é requerido o serviço requisitante.
7. A “via farmácia”, após o débito no sistema informático por doente, deve ser arquivada por ordem de registo da distribuição.
8. A “via serviço” será utilizada pelo enfermeiro para proceder ao registo das administrações do medicamento, sendo posteriormente arquivada no processo do doente.
Atendendo aos procedimentos descritos, e à legislação em vigor, não é permitido a existência de stock de medicamentos hemoderivados nos serviços clínicos.
Após a implementação das normativas legislativas descritas, constatou-se a necessidade de que fossem elaborados alguns protocolos internos de modo a colmatar as dificuldades encontradas, mantendo-se os objectivos primordiais: dispensa atempada do medicamento prescrito e rastreabilidade de todos os medicamentos hemoderivados prescritos e administrados na unidade hospitalar.
Tendo-se constatado a necessidade de que dois dos medicamentos hemoderivados (Factores da coagulação do sangue, cola de tecidos frs; 2 ml, 4 ml e 10 ml; bem como Fibrinogénio humano 5,5 mg/cm2 + Trombina 2 U.I./cm2), a utilizar em contexto de emergência no Blocos Operatórios, deveriam estar disponíveis nos referidos serviços, procedeu-se à elaboração de um protocolo o qual foi assinado pela Direcção dos Serviços Farmacêuticos e aprovado pelo Conselho de Administração, permitindo colocar uma unidade de cada um dos medicamentos nos referidos serviços, seguindo-se os procedimentos de dispensa que se detalham:
1. A dispensa pelos S.F. é efectuada perante o preenchimento do campo destinado à farmácia (excepto a data), ficando arquivado nestes serviços uma fotocópia do documento.
2. Quando da administração do medicamento, os campos destinados ao médico e ao registo da administração é preenchido de imediato, deslocando-se aos S.F. o enfermeiro com o impresso, sendo então numerado e datado pelo farmacêutico o qual arquiva a “via farmácia” em pasta própria, sendo a “via serviço” arquivada no processo do doente.
Posteriormente com a introdução do medicamento Fibrinogénio Humano no CHAlgarve, e de modo a promover uma utilização eficaz e eficiente do fármaco houve a necessidade de elaboração e aprovação de um protocolo de aquisição, utilização e dispensa do referido medicamento.
Assim, a aquisição do medicamento é da responsabilidade dos S.F., que é igualmente responsável pela manutenção de um stock de reserva de 4 frascos de Fibrinogénio Humano de 1.000 mg.
A dispensa do medicamento é efectuada perante o preenchimento adequado do impresso de requisição/ distribuição/administração de hemoderivados (referido em detalhe anteriormente), sendo a dispensa efectuada única e exclusivamente pelo Serviço de Imuno-hemoterapia uma vez cumprido o protocolo aprovado e validada a prescrição pelo médico imunohemoterapêuta.
Já previsto no Despacho conjunto nº 1051/2000, o plasma fresco congelado inactivado é adquirido pelos S.F., sendo o seu acondicionamento e dispensa única e exclusivamente da responsabilidade do serviço de imuno-hemoterapia.
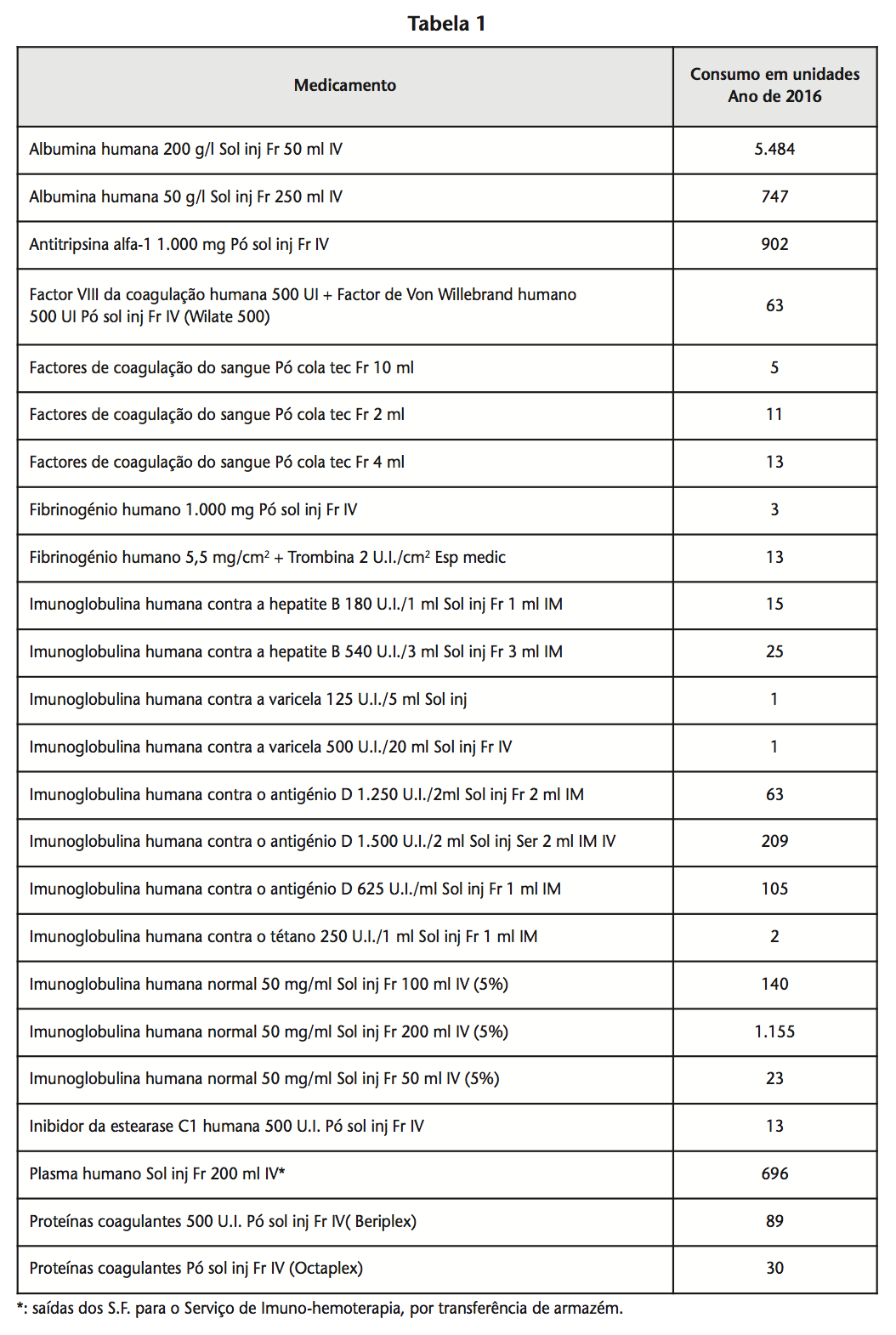
Com o objectivo de demonstrar o volume de trabalho inerente ao cumprimento de todos os procedimentos descritos, sendo que tal implica a ocupação de um farmacêutico em cerca de 75% do seu tempo de trabalho diário, apresentam-se os consumos dos diferentes medicamentos hemoderivados referentes ao ano de 2016, os quais correspondem ao preenchimento e dispensa pelos Serviços Farmacêuticos de 1.572 registos de distribuição (Tabela 1).
Discussão
Dada a especificidade do hospital onde se efectuou o estudo, com um elevado número de valências médicas e cirúrgicas, um serviço de urgência a funcionar 24 horas por dia, dando cobertura a uma população de cerca de 450.000 habitantes, seria de esperar uma elevada variabilidade qualitativa e quantitativa de medicamentos hemoderivados que com frequência e critério clinico são utilizados.
A implementação dos procedimentos descritos iniciaram-se em 1997 por imperativos da lei, e por se ter constatado a enorme importância da execução de um processo de rastreabilidade dos medicamentos hemoderivados sem descurar a sua disponibilidade em tempo útil.
Para a concretização de todos estes resultados, é de salientar o papel dos Serviços Farmacêuticos da Unidade de Faro, que estão em funcionamento, com presença do farmacêutico 24 horas por dia os 365 dias do ano. Igualmente de salientar, o acordo existente entre a direcção destes serviços e o Conselho de Administração de modo a permitir que em todas as situações o medicamento esteja disponível em tempo real sem qualquer prejuízo para os doentes, tendo sempre como objectivo primordial uma melhoria dos procedimentos previamente determinados e garantido a qualidade dos mesmos.
De referir o número de doentes que no ano de 2016 foram tratados com medicamentos hemoderivados, em particular os fármacos que pela sua especificidade e pelos consumos em termos de unidades e regime posológico serão de destacar (Figura 1):
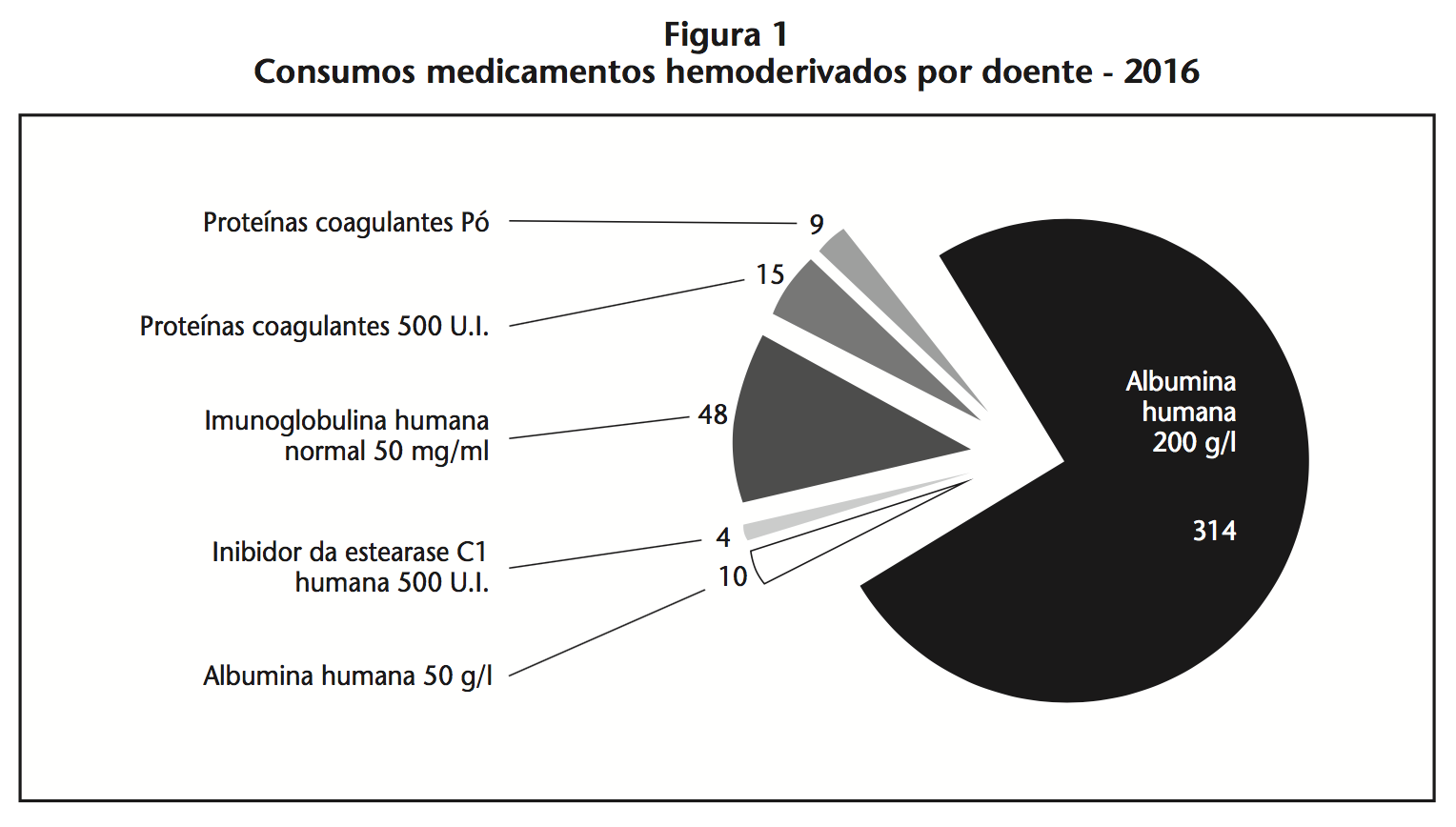
• Albumina humana 200 g/l Sol inj Fr 50 ml IV – 314 doentes.
• Albumina humana 50 g/l Sol inj Fr 250 ml IV – 10 doentes.
• Inibidor da estearase C1 humana 500 U.I. Pó sol inj Fr IV – 4 doentes.
Imunoglobulina humana normal 50 mg/ml Sol inj Fr – 48 doentes.
• Proteínas coagulantes 500 U.I. Pó sol inj Fr IV( Beriplex) – 15 doentes**.
• Proteínas coagulantes Pó sol inj Fr IV (Octaplex) – 9 doentes**.
• **A diferença de consumos entre estes dois fármacos, no período em análise, deve-se única e exclusivamente à adjudicação em concurso, sendo que o factor de adjudicação, por lei, é o de custo mais económico.
Conclusões
Atendendo à experiência documentada no presente trabalho e vivenciada na unidade hospitalar de Faro, do Centro Hospitalar do Algarve, podemos concluir que a rastreabilidade de medicamentos hemoderivados é uma realidade exequível.
Apesar dos elevados consumos de medicamentos hemoderivados e as regras rígidas que estão implementadas, podemos concluir que é possível em qualquer momento aceder a informação de quais os doentes aos quais foi administrado um determinado lote de medicamento, bem como o tipo de fármaco e em que contexto clinico o mesmo foi prescrito e administrado. Ou seja, com a rastreabilidade de medicamentos hemoderivados é possível detectar defeitos de qualidade, efeitos adversos com imputabilidade causal que pode ser devidamente documentada.
Com a publicação do Despacho nº 10286/2017 de 27 de Novembro, o qual determina o registo informático de todos os actos, referentes à prescrição, dispensa e administração dos medicamentos hemoderivados, surge uma nova temática para análise nomeadamente, os procedimentos e metodologias a implementar de modo a concretizar o objectivo desta nova normativa em que o objectivo final é a garantia de qualidade da rastreabilidade dos medicamentos hemoderivados.
Conflito de interesses: O autor declara não haver conflito de interesses.
Bibliografia
1. Hemoderivados (Editorial Tecnico). Farm. Hosp. 1995; 19(5):299-301
2. Blood safety and availability. WHO, Fact sheet nº 279, jun 2012.
3. Braga F. Medicamentos Derivados do Plasma Humano 2013; Boletim do CIM, ROF 107 Abr/Jun.
4. Despacho conjunto nº 1051/2000; Diário da República-II série nº251 de 30 de Outubro de 2000: 17584-17585.
____


____
Descargar artículo en PDF: Rastreabilidade de medicamentos hemoderivados. Legislação e procedimentos
