Pinilla-Rello A1, Huarte-Lacunza R1, Vicente-Iturbe C1, Claraco-Vega LM2
1 Servicio de Farmacia
2 Servicio de Medicina Intensiva
Hospital Universitario Miguel Servet. Zaragoza (España)
Fecha de recepción: 11/01/2022 – Fecha de aceptación: 24/02/2022
Correspondencia: Andrea Pinilla Rello – Hospital Universitario Miguel Servet (Servicio de Farmacia Hospitalaria) – Paseo Isabel la Católica 1-3 – 50009 Zaragoza (España)
anpire.1993@gmail.com
____
RESUMEN
Introducción: Existe bastante evidencia sobre la reactivación del citomegalovirus (CMV) en pacientes críticos y se ha planteado que pueda ser una de las coinfecciones que puedan aumentar la morbimortalidad en pacientes con infección severa por COVID-19. Por ello, se plantea un estudio para analizar las características de los pacientes COVID-19 que recibieron tratamiento anticitomegalovirus en la Unidad de Ciudados Intensivos (UCI).
Material y métodos: Estudio multidisciplinar, observacional, retrospectivo, unicéntrico que incluyó todos los pacientes con COVID-19 en UCI que fueron tratados con ganciclovir o foscarnet entre marzo-2020 y abril-2021 en un hospital terciario. Variables: demográficas, relacionadas con el tratamiento para CMV, tratamiento recibido para COVID-19, estancia hospitalaria, mortalidad intrahospitalaria y al alta.
Resultados: En el período de estudio, 26 pacientes críticos con COVID-19, recibieron algún tratamiento anticitomegalovirus (69,2% hombres, mediana de edad 64 años). En 15 (57,7%) se confirmó la reactivación microbiológicamente, y estos pacientes tuvieron estancias más prolongadas que los tratados sin confirmación. La mortalidad en el grupo tratado fue del 84,6% (80,0% en los que se confirmó reactivación), frente al 43,0% de mortalidad en el global de 300 pacientes COVID-19 que requirieron UCI en ese período. La tasa de infección demostrada de CMV fue del 5,0%.
Conclusiones: Aunque existen publicaciones que sugieren un mayor riesgo de reactivación de CMV en pacientes COVID-19, la incidencia en nuestro estudio fue inferior a la descrita en pacientes críticos COVID. Hay que destacar la elevada mortalidad en los pacientes del estudio frente al global de pacientes atendidos en UCI por COVID-19.
Palabras clave: Citomegalovirus, COVID-19, infecciones, Unidad de Cuidados Intensivos, mortalidad.
Cytomegalovirus reactivation in critically ill patients with COVID-19 infection
SUMMARY
Introduction: There is considerable evidence on the reactivation of cytomegalovirus (CMV) in critically ill patients and it has been suggested that it may be one of the co-infections that may increase morbidity and mortality in patients with severe COVID-19 infection. Therefore, a study was proposed to analyze the characteristics of COVID-19 patients who received anti-cytomegalovirus treatment in the Intensive Care Unit (ICU).
Material and methods: Multidisciplinary, observational, retrospective, single-center study that included all patients with COVID-19 in ICU who were treated with ganciclovir or foscarnet between March-2020 and April-2021 in a tertiary hospital. Variables: demographic, related to treatment for CMV, treatment received for COVID-19, hospital stay, in-hospital mortality and at discharge.
Results: In the study period, 26 critically ill patients with COVID-19 received some anti-cytomegalovirus treatment (69.2% men, median age 64 years). In 15 (57.7%) reactivation was confirmed microbiologically, and these patients had longer stays than those treated without confirmation. Mortality in the treated group was 84.6% (80.0% in those with confirmed reactivation), compared to 43% mortality in the overall of 300 COVID-19 patients who required ICU in that period. The demonstrated infection rate of CMV was 5.0%.
Conclusions: Although there are publications that suggest a higher risk of CMV reactivation in COVID-19 patients, the incidence in our study was lower than that described in critical COVID patients. It should be noted the high mortality in the study patients compared to the overall number of patients seen in the ICU for COVID-19.
Key words: Cytomegalovirus, COVID-19, infections, Intensive Care Unit, mortality.
____
INTRODUCCIÓN
La infección por SARS-CoV-2 presenta una evolución clínica muy heterogénea. El riesgo de mortalidad parece aumentado en personas mayores con comorbilidades, aunque la respuesta inmune también desempeña un papel fundamental en la aceleración de la progresión de la enfermedad en personas de edad avanzada infectadas con SARS-CoV-2. La explicación de estas asociaciones no está todavía clara pero la desregulación en la función inmunológica con la edad puede ser un fenómeno que lo justifique y esto se conoce como senescencia inmune1, que consiste en la disminución de los mecanismos inespecíficos de defensa como la inmunidad adaptativa e implica cambios característicos en las células T1,2.
El CMV es un herpesvirus humano que mantiene un estado de latencia de por vida dentro del huésped tras la infección primaria. Es muy prevalente y las tasas de infección aumentan con la edad, con una seropositividad estimada del 50-95% en los mayores de 5 años. La replicación viral está controlada por una fuerte respuesta inmunitaria celular y humoral específica del CMV y esta debe mantenerse durante toda la vida para prevenir episodios de reactivación viral clínicamente significativa2.
Existe la preocupación de que la infección por CMV pueda acelerar el desarrollo de la senescencia inmunitaria y varios estudios han demostrado que la seropositividad al CMV se asocia con una variedad de problemas clínicos y un mayor riesgo de mortalidad en las personas mayores2, además, puede reducir la respuesta inmunitaria frente a nuevas infecciones virales como el SARS-CoV-23.
La infección por CMV se produce en el 0-36% de los pacientes críticos inmunocompetentes, siendo el factor común más frecuente la presencia de sepsis. El efecto de la sepsis sobre la infección por CMV puede deberse a sus efectos pleiotrópicos sobre el sistema inmunológico mediante la producción de citokinas proinflamatorias4.
Durante la pandemia por COVID-19, distintos estudios han evidenciado que el COVID-19 puede activar respuestas inmunitarias desreguladas del huésped, en las que los niveles de interleucina-6 (IL-6) están elevados en casos graves, siendo los anticuerpos monoclonales anti-receptor de IL-6 una de las dianas del tratamiento. La IL-6 tiene propiedades proinflamatorias y antivirales, pudiéndose reactivar infecciones latentes, como CMV, en pacientes tratados con antagonistas de la IL-65,6.
Existe evidencia de casos aislados de infecciones y enfermedad por CMV en pacientes COVID-19 tratados con antagonistas de IL-67-9. Incluso en pacientes sin infección por COVID-19, hay casos publicados de infecciones complicadas por CMV incluyendo neumonía tras tocilizumab10.
Por otra parte, existe una gran heterogeneidad de publicaciones que plantean el papel de los corticoides en la reactivación del CMV, al ser inmunosupresores. Por eso, es fundamental estar alerta ante signos y síntomas de reactivación de CMV y otras infecciones oportunistas en pacientes COVID-19. Hoy en día no se realiza un cribado de infecciones oportunistas en pacientes inmunocompetentes y una parte de la mortalidad atribuida al COVID-19 podría ser imputable a esas coinfecciones no diagnosticadas. Existe cierta evidencia de aspergilosis en estos pacientes, pero otras como la reactivación del CMV pueden estar infraestimadas6.
El reconocimiento precoz de la infección por CMV y el inicio del tratamiento temprano evitarían casos potencialmente mortales. En nuestro centro durante estos meses, se detectó cierto incremento del uso de fármacos antivirales antiCMV en pacientes críticos COVID-19.
Por eso, el objetivo de nuestro estudio fue describir y analizar las características de los pacientes críticos COVID-19 que recibieron tratamiento antiCMV para tratar de dilucidar si la reactivación de la infección por CMV pudiese ser una consecuencia de los tratamientos utilizados y si el CMV justifica una peor evolución en pacientes críticos COVID-19.
MATERIAL Y MÉTODOS
Estudio multidisciplinar, observacional, retrospectivo, unicéntrico de todos los pacientes COVID-19 ingresados en la Unidad de Cuidados Intensivos (UCI) de un hospital terciario, que fueron tratados con antiCMV (ganciclovir o foscarnet) desde marzo de 2020 hasta abril de 2021.
En todos ellos se solicitaron pruebas microbiológicas para el diagnóstico de infección por CMV, aunque ante el empeoramiento clínico y solo por la sospecha se inició tratamiento en todos. Para el estudio se definió como reactivación a aquellos casos en los que hubo confirmación microbiológica, y se consideró tratamiento empírico en los que la prueba fue negativa. No se definió un punto de carga viral previo para inicio de tratamiento y se trataron todos los pacientes con sospecha de infección independientemente de la positividad o del nivel de carga viral.
Se recogieron variables demográficas, comorbilidades, índice de Charlson y escala APACHE.
En cuanto al tratamiento antiCMV se detalló dosis total, dosis por peso, carga inicial de CMV, tipo de muestra en la que se aisló, fecha del aislamiento, días hasta negativización de carga de CMV tras tratamiento, tipo de tratamiento, duración y motivo de suspensión.
Para valorar la toxicidad renal de ganciclovir, se detalló si se ajustó función renal según ficha técnica y se aplicaron criterios RIFLE11,12. Para ello se recogió creatinina y filtración glomerular pre y post-tratamiento antiviral.
Respecto a infección por COVID-19, en función de si se reactivó CMV, se recogieron: fecha de PCR positiva para COVID-19 y tratamientos recibidos para esta enfermedad, sobreinfección bacteriana y/o fúngica con su foco de infección, sepsis/shock séptico, días desde COVID-19 positivo hasta solicitar carga CMV y hasta inicio de tratamiento.
También se recogió necesidad de ventilación mecánica (VM), sistema de oxigenación por membrana extracorpórea (ECMO) y técnicas continuas de reemplazamiento renal (TCRR), IL-6 previa a tocilizumab, estancia en UCI, estancia hospitalaria, mortalidad intrahospitalaria, mortalidad a los 30 y a los 90 días del alta hospitalaria.
El número de pacientes que ingresaron en UCI en el periodo de estudio y el número de pacientes que fallecieron también se recogieron, para comparar mortalidad y calcular la tasa de infección por CMV.
Las variables fueron recogidas de la historia clínica electrónica, incluyendo informes de Microbiología y Medicina Intensiva, y del programa informático del Servicio de Farmacia (Farmatools®). Se recopilaron en Microsoft Excel® y el análisis estadístico se realizó con SPSS Statistics22®. En las variables cualitativas se detallaron porcentajes y se realizó Chi-Cuadrado o Test exacto de Fisher. En las variables cuantitativas se proporcionan medidas de tendencia central, se estudió si las variables seguían o no distribución normal (Test de Kolgomorov-Smirnov o Shapiro-Wilk) y según normalidad se realizó T-Student o U-Mann Whitney.
El estudio fue aprobado por el Comité Ético de Investigación Clínica de Aragón (CEICA) (referencia PI 21/206).
RESULTADOS
Se incluyeron 26 pacientes ingresados en UCI con COVID-19, que recibieron durante su estancia tratamiento para CMV.
En la tabla 1 se detallan las características demográficas de los pacientes y sus comorbilidades.
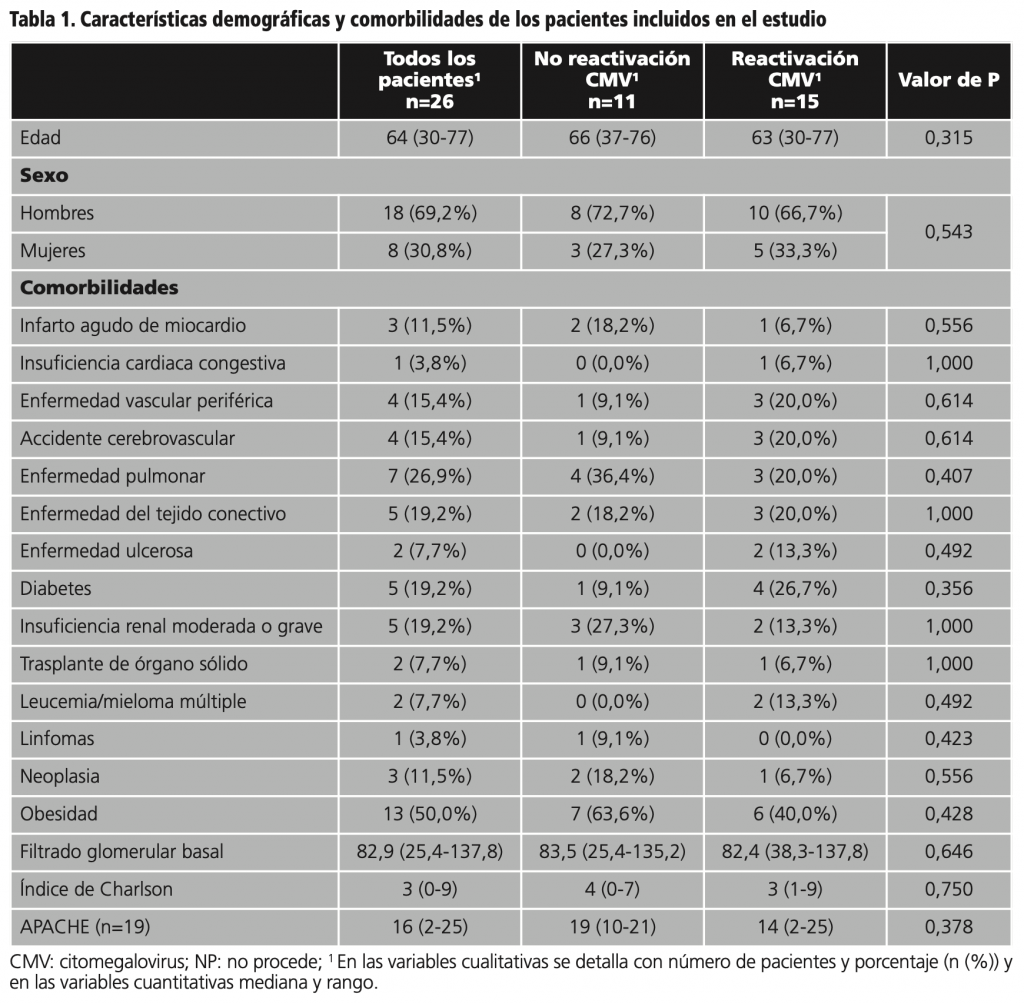
Para la infección por CMV, todos los pacientes recibieron tratamiento con ganciclovir y uno de ellos, recibió además tratamiento combinado con foscarnet durante 6 días a dosis de 8g cada 12h hasta la negativización de la carga viral del CMV. En la tabla 2 se detallan todas las características del tratamiento con ganciclovir según reactivación de CMV.
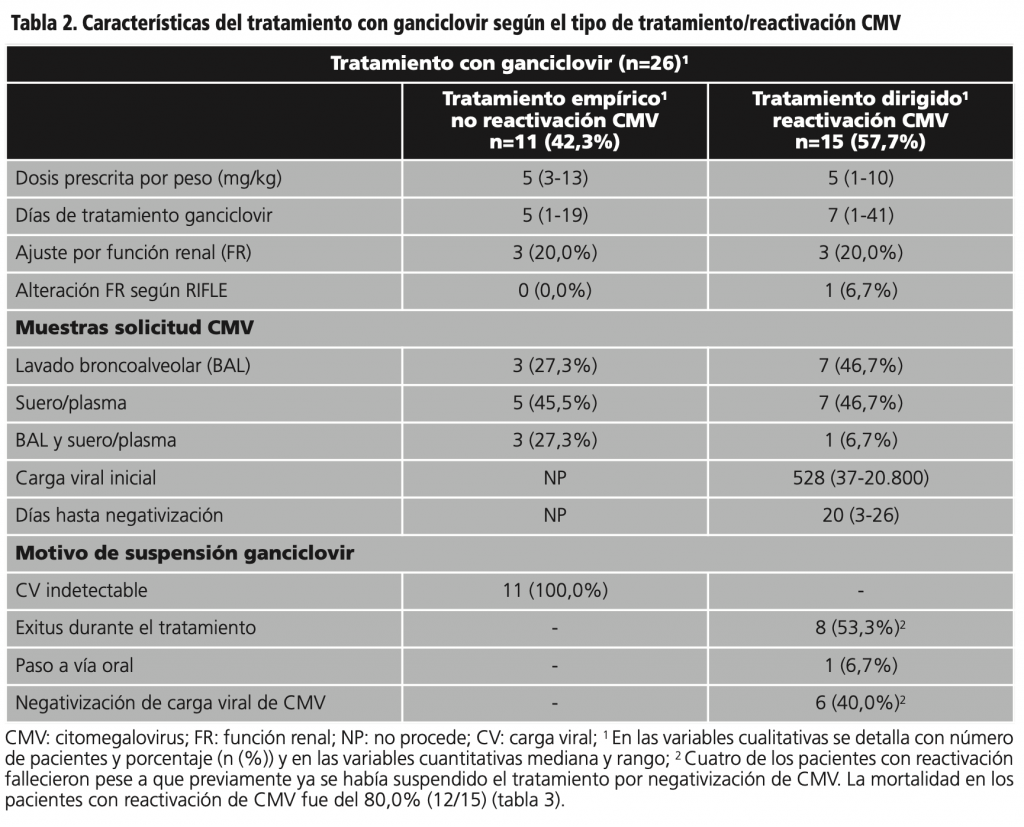
En 15 pacientes (57,7%) se diagnosticó reactivación de CMV por presencia de carga viral en lavado broncoalveolar y/o suero/plasma.
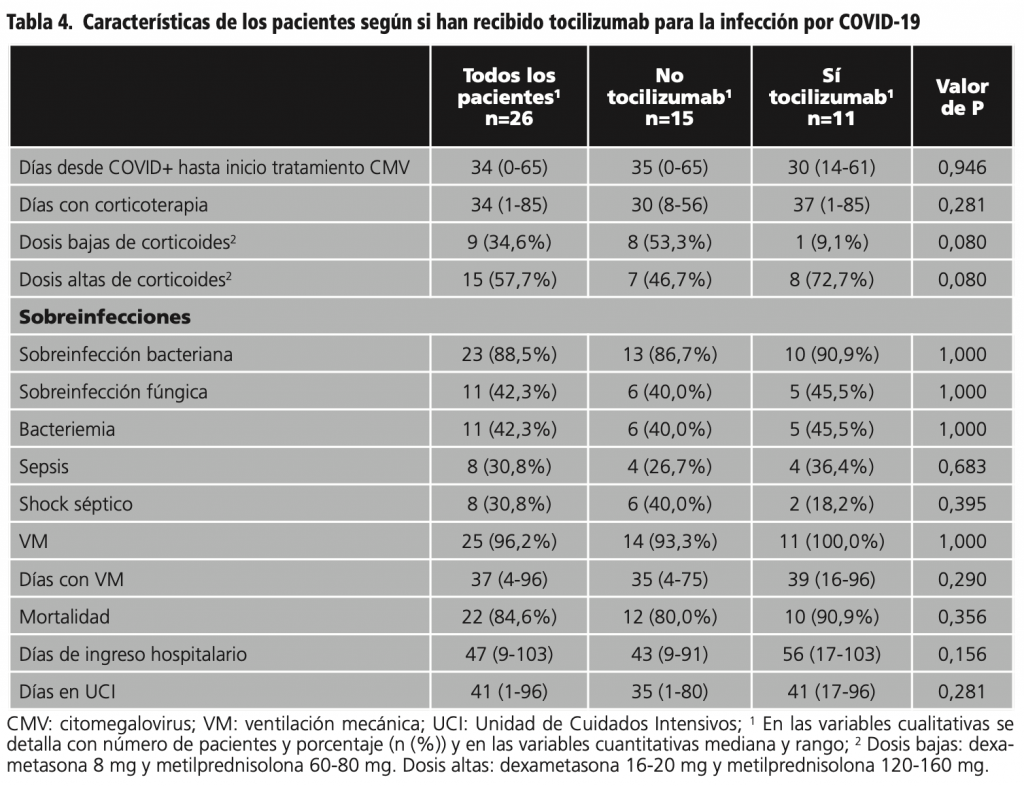
En cuanto a la infección por COVID-19, todos los pacientes recibieron corticoterapia y 11 pacientes (42,3%) recibieron tratamiento específico con tocilizumab. En la tabla 3 se expone el tratamiento recibido para COVID-19 y las sobreinfecciones de los pacientes, y en la tabla 4 se exponen las características de estos pacientes según si recibieron tocilizumab para el tratamiento de la infección por COVID-19.
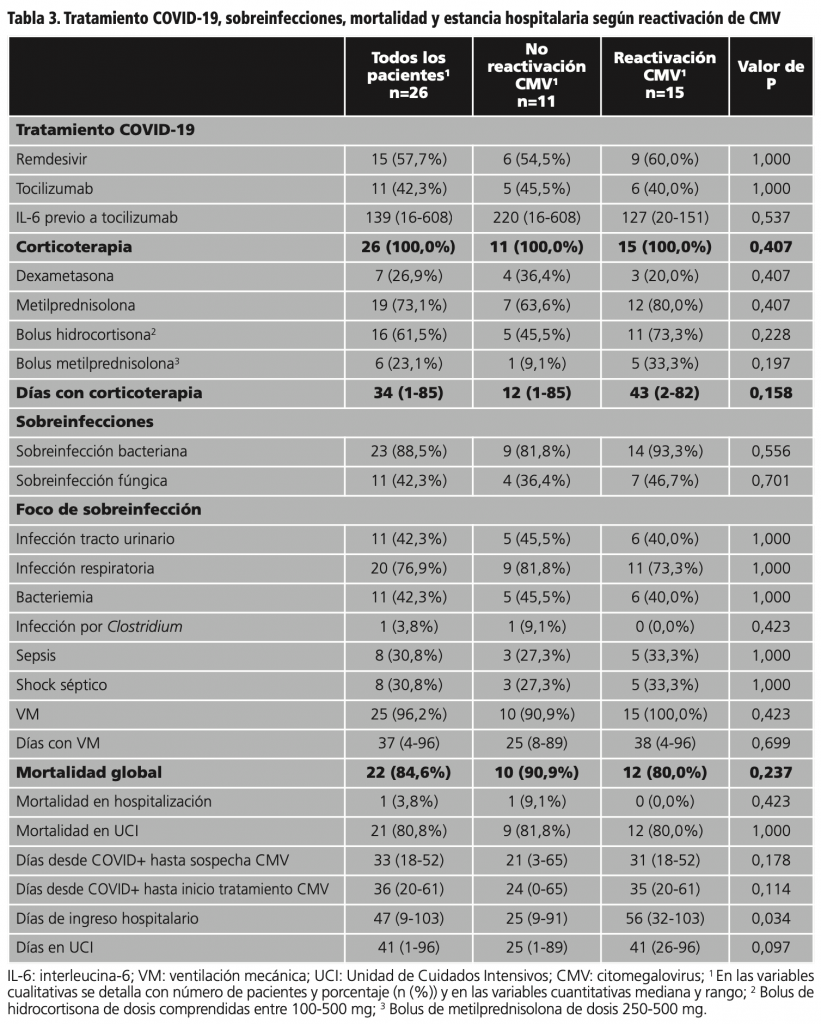
Mencionar que 6 pacientes (23,1%) precisaron ECMO y 5 (19,2%) fueron sometidos a TCRR en UCI.
La mortalidad global de los pacientes que recibieron tratamiento para CMV fue del 84,6% (22/26 pacientes), tal y como se detalla en la tabla 3 junto con la estancia hospitalaria y la estancia en UCI. Los 4 pacientes (15,4%) que no fallecieron durante el ingreso, tampoco fallecieron a los 30 ni a los 90 días tras el alta. Destacar que la mortalidad de los pacientes con reactivación confirmada de CMV fue del 80,0% (12/15 pacientes).
Los pacientes con reactivación de CMV confirmada microbiológicamente estuvieron más días hospitalizados que los pacientes sin reactivación siendo esta diferencia estadísticamente significativa (p=0,034) (tabla 4). En el resto de variables, no se observaron diferencias estadísticamente significativas (p>0,05) entre los pacientes con reactivación y sin reactivación de CMV (tabla 1 y 3). Tampoco se observaron diferencias estadísticamente significativas (p>0,05) en las variables estudiadas según si recibieron o no tocilizumab para COVID-19 (tabla 4).
En el periodo de estudio (marzo 2020-abril 2021) ingresaron en UCI 300 pacientes, de los cuales 129 fallecieron durante su estancia en UCI siendo la mortalidad del 43,0%. El 8,7% de los pacientes ingresados en UCI en ese periodo recibieron tratamiento para CMV, pero la tasa de infección demostrada de CMV fue del 5,0% (15/300).
DISCUSIÓN
La infección por CMV está latente en el 50-70% de la población y puede ser reactivada durante procesos inflamatorios. En pacientes críticos, la incidencia de reactivación de CMV es del 30-35%, duplicándose la tasa de mortalidad en este grupo de pacientes13,14. En nuestro estudio, observamos una tasa demostrada de infección por CMV del 5,0%, tasa muy baja en comparación con la literatura. En cambio, la mortalidad en los pacientes con reactivación de CMV (mediana de índice de Charlson 3 (1-9)) es muy elevada (80,0%), mientras que la mortalidad global en UCI durante el periodo de estudio fue del 43,0%; siendo estas cifras difícilmente comparables al no disponer de datos sobre el estado basal de los pacientes y es posible que los pacientes que recibieron tratamiento anti-CMV estuvieran más graves, ya que en nuestro estudio sólo nos centramos en los pacientes que recibieron tratamiento para CMV y no en todos los pacientes que ingresaron en UCI. Por eso, a pesar de observar una mortalidad global menor, el hecho de desconocer su estado basal es una limitación para comparar la mortalidad.
En los pacientes críticos con COVID-19, la reactivación de CMV está impulsada por la activación inmunitaria del sistema inmune innato y la inflamación, siendo la inmunosupresión un factor de riesgo para desarrollar enfermedad clínica por CMV en órganos como los pulmones, principal reservorio de CMV. En relación a la inmunosupresión, según los estudios realizados por Amiya et al.14 y Honore et al.15, el uso de corticoides a largo plazo también se ha identificado como factor de riesgo de coinfección, concretamente, candidemia y neumonía por CMV. En nuestro estudio, aunque no hubo diferencias estadísticamente significativas, se observa que los pacientes con reactivación de CMV recibieron para el tratamiento de COVID-19 más bolus tanto de hidrocortisona como de metilprednisolona que los pacientes sin reactivación (73,3% frente 45,5%, y 33,3% frente 9,1%). Además, los pacientes con reactivación de CMV, estuvieron más días en tratamiento con corticoides (mediana de 43 días pacientes con reactivación frente a 12 días pacientes sin reactivación).
Por otro lado, en distintos estudios varios autores describen que los factores de riesgo más frecuentes para la reactivación de los virus herpesviridae (CMV y Virus Herpes Simple) en pacientes críticos son sepsis, linfopenia y VM prolongada14-17. En pacientes con sepsis se puede reactivar el CMV en 4-7 días por la potente reacción inflamatoria que se desencadena en el organismo13,18 y en este grupo de pacientes la incidencia de reactivación de CMV es el doble que en pacientes sin sepsis (p=0,011) según el estudio de Heininger et al.8,19. En la revisión de Osawa et al.4, de infección por CMV en pacientes críticos, detallan que la duración de la VM en pacientes con CMV estaba comprendida entre 21-38 días frente a 13-24 en pacientes sin CMV (p<0,05). En nuestro estudio, el porcentaje de pacientes con sepsis fue ligeramente superior en los pacientes con reactivación de CMV (33,3% frente a 27,3%) y la duración de la VM fue superior en este grupo de pacientes (mediana de 38 días frente a 25), aunque las diferencias no fueron estadísticamente significativas.
La inmunosupresión de los pacientes COVID-19 y la sepsis asociada al proceso, favorece tanto la reactivación de infecciones virales como sobreinfecciones bacterianas y micóticas18. En la revisión de Osawa et al.4, describen que la infección nosocomial, tanto bacteriana como fúngica, fue más frecuente en pacientes con CMV que en pacientes sin infección (75% y 50% respectivamente, p=0,04). En nuestro estudio, observamos que la sobreinfección tanto bacteriana como fúngica fue superior en los pacientes con reactivación de CMV (bacteriana 93,3% frente 81,8%, fúngica 46,7% frente 36,4%). Comparando con el estudio de Osawa et al.4, obtuvimos un porcentaje superior de sobreinfección bacteriana y similar en sobreinfección fúngica, pero no fue estadísticamente significativo (p=0,556 y p=0,701, respectivamente).
En cuanto a la duración de la estancia hospitalaria, en nuestro estudio se observó que en los pacientes con reactivación de CMV la duración del ingreso hospitalario era mayor que en los pacientes sin reactivación, siendo esta diferencia estadísticamente significativa (56 días de mediana frente a 25, p=0,034), en cambio, no se observaron diferencias estadísticamente significativas en la estancia en UCI pero sí se observa una mediana de tiempo en UCI mayor en los pacientes con reactivación de CMV (41 días en UCI frente a 25, p=0,097). En la revisión de Osawa et al.4, también observaron mayor estancia en UCI en los pacientes con infección por CMV (rango de días en UCI 33-69 días pacientes con CMV frente a 22-48 sin CMV, p<0,05). Este hecho también se ve apoyado por el estudio de Le Balc’h et al.18, al observar una mayor estancia en UCI en los pacientes con reactivación de Herperviridae (mediana de 29 días frente 16, p=0,0001).
Por otro lado, los niveles de TNF-α y de IL-6 elevados en pacientes con COVID-19 grave también pueden favorecer la reactivación del CMV13. A pesar de no observarse diferencias estadísticamente significativas, se observó en nuestro estudio que los pacientes que recibieron tocilizumab para COVID-19, tuvieron una estancia hospitalaria y una estancia en UCI superior a los pacientes que no recibieron tocilizumab (tabla 4). Además, la presencia de sobreinfecciones, bacteriemia, sepsis y mortalidad fue ligeramente superior en este grupo de pacientes (tabla 4).
Existe cierta controversia sobre la decisión de tratamiento de las reactivaciones de CMV en pacientes de UCI y la elección de puntos de corte en los niveles de carga viral. En el estudio retrospectivo de Chiche et al.20 se hacía una búsqueda activa de infección en pacientes de UCI inmunocompetentes, y se describían datos sobre tratamiento antiviral en pacientes con reactivación, observando que los pacientes con reactivación tratados (54%), presentaban una tasa de mortalidad superior a los no tratados, aunque la decisión de tratar dependía del criterio del médico y podía estar sesgada al haber tratado a los pacientes más graves; por eso, los estudios observacionales no pueden resolver la cuestión sobre si CMV es un mero “espectador” y su reactivación solo indica un peor estado del paciente o si es causa activa de un peor pronóstico.
Para solventar dudas, se plantearon algunos ensayos clínicos aleatorizados como el de Cowley et al.21, que pretendía evaluar si era eficaz y segura la profilaxis de la reactivación en pacientes críticos con VM, aleatorizando a los pacientes a recibir valaciclovir, valganciclovir a dosis bajas (o ganciclovir si no se podía utilizar la vía oral) o grupo control; y observaron una mayor tasa de reactivación en los no tratados, pero el ensayo se paró por mayor mortalidad en el brazo de valaciclovir sin especificar las causas. En el ensayo clínico realizado por Luyt et al.22, trataron de evaluar si la terapia antiviral anticipada podía disminuir la mortalidad en pacientes críticos, aunque por el momento, solo se han publicado datos sobre el efecto de tratamiento de la reactivación del herpes simple pero aún no se conocen los del CMV.
En relación a los niveles de IL-6, el ensayo de Limaye et al.23 trató de evaluar si la prevención de la reactivación de CMV con ganciclovir podría disminuir los niveles de IL-6 en pacientes seropositivos para CMV con sepsis o trauma y fallo respiratorio, y observaron que se consiguió disminuir el grado de replicación viral en los pacientes tratados. Además, se disminuía el número de días de ventilación, pero no hubo diferencias en los niveles de IL-6 por lo que sugieren que no es un buen indicador subrogado.
La principal limitación de nuestro estudio es el pequeño tamaño muestral, lo que justifica que no se observen diferencias estadísticamente significativas en los resultados obtenidos.
Otra limitación del estudio es su carácter retrospectivo y que se incluyeron todos los pacientes tratados pese a que en la mitad de ellos no hubo una confirmación diagnóstica. Como se ha comentado y pese a las numerosas publicaciones comentadas, no está claro el papel que pueda jugar la reactivación del CMV en pacientes críticos y si la profilaxis o el manejo preventivo con antivirales podrían mejorar la evolución de los pacientes. Aunque ya se han realizado algunos ensayos clínicos, serían necesarios estudios adicionales para determinar por un lado, el papel del CMV como responsable de mayor mortalidad tras su reactivación o si en realidad la reactivación se da en pacientes con un peor estado general; por otro lado, determinar si determinados parámetros como los niveles de linfocitos T o de IL-6 pudieran servir como indicadores subrogados de riesgo para el paciente, y por último, el papel que puedan tener los tratamientos antivirales y los puntos de corte de carga viral que pudieran sugerir que un paciente deba ser tratado o no.
CONCLUSIONES
Aunque hay publicaciones que apuntan un mayor riesgo de reactivación de CMV en pacientes COVID-19, y especialmente en los tratados con fármacos antiIL-6 o con inmunosupresores, los datos de incidencia en nuestro estudio son inferiores en porcentaje a lo descrito en la literatura en pacientes críticos. Hay que destacar la elevada mortalidad en los pacientes del estudio frente al global de pacientes atendidos en UCI por COVID-19, pero posiblemente se trate de pacientes con mayor gravedad de base y además es similar en el grupo de pacientes tratados solo por empeoramiento y sospecha de reactivación, que en los que presentaron una reactivación documentada microbiológicamente.
Financiación: Los autores declaran no haber recibido financiación para este estudio.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Moss P. “The ancient and the new”: is there an interaction between cytomegalovirus and SARS-CoV-2 infection? Immun Ageing. 2020;17(1):14. doi: 10.1186/s12979-020-00185-x.
2. Parry HM, Zuo J, Frumento G, Mirajkar N, Inman C, Edwards E, et al. Cytomegalovirus viral load within blood increases markedly in healthy people over the age of 70 years. Immun Ageing. 2016;13(1):1. doi: 10.1186/s12979-015-0056-6.
3. Kadambari S, Klenerman P, Pollard AJ. Why the elderly appear to be more severely affected by COVID‐19: The potential role of immunosenescence and CMV. Rev Med Virol. 2020;30(5). doi: 10.1002/rmv.2144.
4. Osawa R, Singh N. Cytomegalovirus infection in critically ill patients: a systematic review. Crit Care. 2009;13(3):68. doi: 10.1186/cc7875.
5. Fajgenbaum DC, June CH. Cytokine Storm. N Engl J Med. 2020;383(23): 2255-73. doi: 10.1056/NEJMra2026131.
6. Webb BJ, Peltan ID, Jensen P, Hoda D, Hunter B, Silver A, et al. Clinical criteria for COVID-19-associated hyperinflammatory syndrome: a cohort study. Lancet Rheumatol. 2020;2(12):754-63. doi: 10.1016/S2665-9913(20) 30343-X.
7. Khatib MY, Shaik KS, Ahmed AA, Alwraidat MA, Mohamed AS, Abou Kamar MR, et al. Tocilizumab‐induced cytomegalovirus colitis in a patient with COVID‐19. Clin Case Reports. 2021;9(1):148-52. doi: 10.1002/ccr3.3487.
8. Leemans S, Maillart E, Van Noten H, Oliveira Dos Santos L, Leahu LM, Kamgang P, et al. Cytomegalovirus haemorrhagic colitis complicating COVID‐19 in an immunocompetent critically ill patient: A case report. Clin Case Reports. 2021;9(5):1-4. doi: 10.1002/ccr3.3600.
9. D’Ardes D, Boccatonda A, Schiavone C, Santilli F, Guagnano MT, Bucci M, et al. A Case of Coinfection with SARS-COV-2 and Cytomegalovirus in the Era of COVID-19. Eur J Case Reports Intern Med. 2020;7(5):1. doi: 10.12890/2020_001652.
10. Van Duin D, Miranda C, Husni E. Cytomegalovirus Viremia, Pneumonitis, and Tocilizumab Therapy. Emerg Infect Dis. 2011;17(4):754-6. doi: 10.3201/ eid1706.101057.
11. Williams L-M. Criterios RIFLE para la lesión renal aguda. Nursing (Lond). 2015;32(2):22-7.
12. Carrillo Esper R, Castro Padilla JF. Escala RIFLE. Fundamentos y su impacto en el diagnóstico, pronóstico y manejo de la lesión renal aguda en el enfermo grave. Rev Asoc Mex Med Crit y Ter Int. 2009;23(4):241-4.
13. Söderberg-Nauclér C. Does reactivation of cytomegalovirus contribute to severe COVID-19 disease? Immun Ageing. 2021;18(1):1-7. doi: 10.1186/s12979-021-00218-z.
14. Amiya S, Hirata H, Shiroyama T, Adachi Y, Niitsu T, Noda Y, et al. Fatal cytomegalovirus pneumonia in a critically ill patient with COVID-19. Respirol Case Reports. 2021;9(7):1-3. doi: 10.1002/rcr2.801.
15. Honore PM, Barreto Gutierrez L, Kugener L, Redant S, Attou R, Gallerani A, et al. SARS-CoV-2 infection as a risk factor for herpesviridae reactivation: consider the potential influence of corticosteroid therapy. Crit Care. 2020;24(1):623. doi: 10.1186/s13054-020-03349-9.
16. Coisel Y, Bousbia S, Forel J-M, Hraiech S, Lascola B, Roch A, et al. Cytomegalovirus and Herpes Simplex Virus Effect on the Prognosis of Mechanically Ventilated Patients Suspected to Have Ventilator-Associated Pneumonia. PLoS One. 2012;7(12):51340. doi: 10.1371/journal.pone.0051340.
17. Al-Omari A, Aljamaan F, Alhazzani W, Salih S, Arabi Y. Cytomegalovirus infection in immunocompetent critically ill adults: literature review. Ann Intensive Care. 2016;6(1):110. doi: 10.1186/s13613-016-0207-8.
18. Le Balc’h P, Pinceaux K, Pronier C, Seguin P, Tadié JM, Reizine F. Herpes simplex virus and cytomegalovirus reactivations among severe COVID-19 patients. Crit Care. 2020;24(1):1-3. doi: 10.1186/s13054-020-03252-3.
19. Heininger A, Jahn G, Engel C, Notheisen T, Unertl K, Hamprecht K. Human cytomegalovirus infections in nonimmunosuppressed critically ill patients. Crit Care Med. 2001;29(3):541-7. doi: 10.1097/00003246-200103000-00012.
10. Chiche L, Forel J-M, Roch A, Guervilly C, Pauly V, Allardet-Servent J, et al. Active cytomegalovirus infection is common in mechanically ventilated medical intensive care unit patients. Crit Care Med. 2009;37(6):1850-7. doi:10.1097/ CCM.0b013e31819ffea6.
21. Cowley NJ, Owen A, Shiels SC, Millar J, Woolley R, Ives N, et al. Safety and Efficacy of Antiviral Therapy for Prevention of Cytomegalovirus Reactivation in Immunocompetent Critically Ill Patients. JAMA Intern Med. 2017;177(6):774. doi: 10.1001/jamainternmed.2017.0895.
22. Luyt C-E, Forel J-M, Hajage D, Jaber S, Cayot-Constantin S, Rimmelé T, et al. Acyclovir for Mechanically Ventilated Patients With Herpes Simplex Virus Oropharyngeal Reactivation. JAMA Intern Med. 2020;180(2):263. doi: 10.1001/jamainternmed.2019.5713.
23. Limaye AP, Stapleton RD, Peng L, Gunn SR, Kimball LE, Hyzy R, et al. Effect of Ganciclovir on IL-6 Levels Among Cytomegalovirus-Seropositive Adults With Critical Illness. JAMA. 2017;318(8):731. doi: 10.1001/jama.2017.10569.
____
