Magallón Martínez A1, Pinilla Rello A1, Casajús Navasal A1, Romero Salas Y2
1 Servicio de Farmacia. Hospital Universitario Miguel Servet. Zaragoza (España)
2 Unidad de Nefrología Pediátrica. Servicio de Pediatría. Hospital Universitario Miguel Servet. Zaragoza (España)
Fecha de recepción: 02/08/2022 – Fecha de aceptación: 01/09/2022
Correspondencia: Andrea Pinilla Rello – Hospital Universitario Miguel Servet (Servicio de Farmacia) – Paseo Isabel la Católica, 1-3 – 50009 Zaragoza (España)
anpire.1993@gmail.com
____
Resumen
Introducción: La interrupción del tratamiento con eculizumab debe ser contemplada de manera individualizada valorando el balance beneficio-riesgo de mantener o retirar el tratamiento.
Pacientes y método: Descripción un caso clínico de un paciente que sufrió una recaída de síndrome urémico hemolítico atípico (SUHa) tras la retirada del tratamiento con eculizumab.
Resultados: Paciente de 7 años que, tras cinco años de tratamiento con eculizumab se decide interrupción del tratamiento. Seis semanas tras la interrupción ingresa con febrícula, astenia, trombopenia, anemia con signos de hemólisis y deterioro de la función renal que precisó administración de furosemida y restricción hídrica con mejoría clínica. Reinicia del tratamiento con eculizumab con mejora en los parámetros bioquímicos a partir de la primera semana de tratamiento, normalizándose y manteniéndose constante a partir de la sexta semana.
Conclusiones: La experiencia clínica limitada sobre la duración de tratamiento con eculizumab representa un desafío en los pacientes con SUHa. Nuestro caso representa un ejemplo de recaída tras la discontinuación de tratamiento. El tratamiento con eculizumab puede retirarse de forma segura en algunos pacientes, pero es necesario realizar un seguimiento estrecho y reiniciarlo ante una recaída.
Palabras clave: Eculizumab, sindrome urémico hemolítico atípico, pediatría.
Relapse of hemolytic uremic syndrome after discontinuation of eculizumab treatment in a pediatric patient
Summary
Introduction: The interruption of treatment with eculizumab should be considered individually, assessing the benefit-risk balance of maintaining or withdrawing treatment.
Patients and method: Description of a clinical case of a patient who suffered a relapse of Atypical Hemolytic Uremic Syndrome (aHUS) after withdrawal of treatment with eculizumab.
Results: A 7-year-old patient who, after five years of treatment with eculizumab, decided to interrupt the treatment. Six weeks after the interruption, the patient was admitted with low-grade fever, asthenia, thrombopenia, anemia with signs of hemolysis and deterioration of renal function that required administration of furosemide and fluid restriction with clinical improvement. Eculizumab treatment restarted with improvement in biochemical parameters from the first week of treatment, normalizing and remaining constant from the sixth week.
Conclusions: Limited clinical experience on the duration of treatment with eculizumab represents a challenge in patients with a HUS. Our case represents an example of relapse after discontinuation of treatment. Eculizumab treatment can be safely withdrawn in some patients, but requires close monitoring and reinitiation in the event of relapse.
Key words: Eculizumab, hemolytic-uremic syndrome, pediatrics.
____
INTRODUCCIÓN
El síndrome urémico hemolítico atípico (SUHa) es una enfermedad ultrarara y potencialmente mortal, causada por la desregulación de la vía alternativa del complemento, debido a mutaciones en genes que codifican proteínas reguladoras1, y caracterizada por anemia hemolítica microangiopática, insuficiencia renal aguda y trombocitopenia. Afecta principalmente a niños y adultos jóvenes, con una incidencia de 1/1.000.000 habitantes/año2. La tasa de mortalidad es de hasta el 10% y al menos 1/3 progresa a enfermedad renal terminal en el primer episodio3.
El tratamiento incluye plasmaféresis con terapia inmunosupresora y restablecimiento del complemento con eculizumab4. Eculizumab es un anticuerpo monoclonal humanizado que se une a la proteína C5 del complemento, inhibiendo su escisión en C5a y C5b e impidiendo la generación del complejo C5b-9, demostrando una mejora significativa en la función renal, parámetros hematológicos y síntomas sistémicos5. Tras la estabilización, su interrupción debe ser contemplada individualmente en función de la mutación y la evolución clínica, valorando el beneficio-riesgo de mantener/retirar el tratamiento.
Presentamos el caso de un paciente pediátrico que experimentó recaída subclínica de SUHa tras la discontinuación de eculizumab.
DESCRIPCIÓN DEL CASO
Paciente de 7 años, ingresado al nacimiento en la Unidad de Cuidados Intensivos (UCI). A las 48h de ingreso: deterioro progresivo de la función renal, trombopenia y anemia hemolítica, diagnosticándose SUHa a los 8 días de vida. El paciente necesitó plasmaféresis e infusión de concentrados de hematíes, iniciándose tratamiento con eculizumab, y observando mejoría clínica y analítica tras la primera dosis. El análisis genético descartó mutaciones en los genes CFH y MCP, factor H, I y MCP. La actividad de ADAMTS-13 era normal. El paciente se mantuvo clínicamente estable recibiendo eculizumab 300 mg/3 semanas, con presión arterial normal y proteinuria residual, por lo que recibió tratamiento con enalapril.
En noviembre de 2018, cinco años desde el inicio de eculizumab y estando con 300 mg/2 semanas, se decide debido al buen estado del paciente y test genético negativo, interrumpir el tratamiento gradualmente, escalando primero a cada 3 semanas durante 4 ciclos y posteriormente cada 6 semanas. En marzo de 2019, 6 semanas después de iniciar eculizumab cada 6 semanas, acude a urgencias con febrícula (37,6º), astenia, tensión arterial >p95 para edad talla, pero sin clínica urinaria ni otra clínica asociada. En la analítica inicial se objetiva trombopenia (42×103/μl), sin anemia (hemoglobina 12,6 g/dl), pero con signos de hemólisis: lactato deshidrogenasa (LDH): 925 U/l, haptoglobina <15 g/l, bilirrubina total 2,87 mg/dL y bilirrubina directa 0,65 mg/dL; presentando deterioro de la función renal con respecto a analíticas previas al ingreso, con creatinina sérica 0,95 mg/dL (filtrado glomerular 44.3 ml/min/1.73 m2) y urea 70 mg/100 ml, ingresando en UCI para monitorización y reinicio de eculizumab a dosis de inducción, 600 mg, continuando con 300 mg/2 semanas. El paciente presentaba oliguria acompañada de edemas, precisando administración de furosemida y restricción hídrica con mejoría clínica, proteinuria en rango nefrótico, y microhematuria que persistió durante el ingreso. A nivel hematológico presentó signos de hemolisis, con anemia a las 48h, y trombopenia mantenida acompañada de exantema micropetequial generalizado que no precisó transfusión de hemoderivados. Durante el ingreso recibió tratamiento profiláctico contra el meningococo con ampicilina. Las figuras 1 y 2 muestran una mejora en los parámetros bioquímicos a partir de la primera semana de tratamiento, normalizándose y manteniéndose constantes a partir de la sexta semana. Tras 1 año y 10 meses de tratamiento desde la reintroducción de eculizumab a 300 mg/2 semanas el paciente se encuentra estable, destacando como único dato la aparición en el último mes de descensos progresivos del recuento leucocitario (hasta 2800/mm3), que no requirieron manejo terapéutico, presentando valores normales en últimos controles. Además, precisa enalapril y amoxicilina como profilaxis.
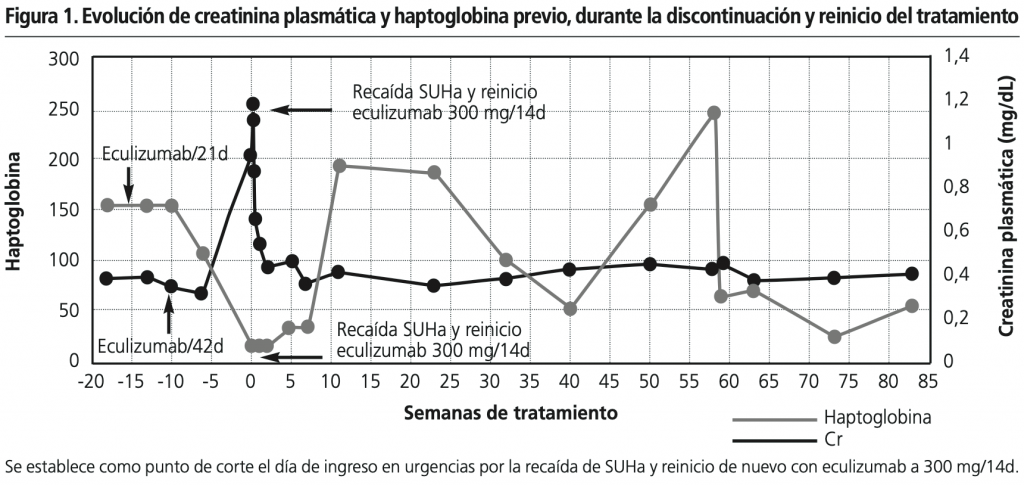
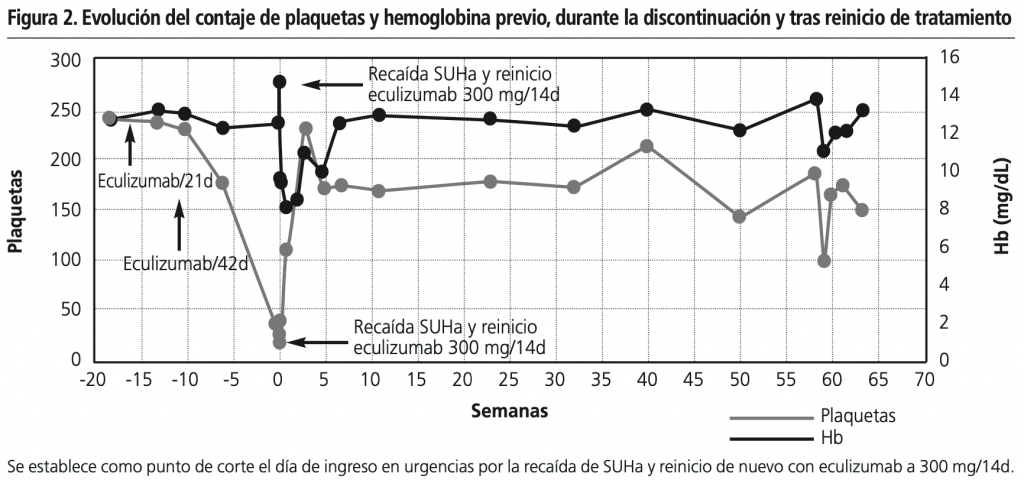
DISCUSIÓN
La duración óptima del tratamiento y el riesgo de recaída al interrumpir eculizumab siguen siendo en gran parte desconocidos. El consenso internacional del SUHa en niños elaborado por el grupo de expertos “HUS international”, recomiendan considerar la suspensión de eculizumab caso por caso tras al menos 6-12 meses de tratamiento y al menos 3 meses de normalización de la función renal6.
No existen estudios prospectivos sólidos que definan criterios claros de discontinuación, aunque son cada vez más los casos documentados sobre resultados de desescalado e interrupción del tratamiento. Ardissino et al. describieron 16 pacientes que discontinuaron eculizumab, de los cuales 5 recayeron, la mayoría poco tiempo después de la interrupción del tratamiento, en forma de deterioro de la función renal, que se recuperó tras reintroducir eculizumab. Cuatro de estos cinco pacientes presentaban mutación CFH7. Wijnsma et al. describieron 20 pacientes (6 niños) con SUHa, en quienes se redujo eculizumab gradualmente, interrumpiéndose en 178. Cinco pacientes sufrieron recurrencia, todos ellos con variantes patogénicas CFH o CFB.
Se dispone de otro estudio, que engloba 9 artículos, con pacientes adultos y pediátricos, donde eculizumab se redujo gradualmente o se retiró en 171 pacientes tras una mediana de tratamiento de 6 meses (0,5-50). Con una mediana de seguimiento de 12 meses (0-47), 44 (27%) pacientes presentaron recaída, siendo la mediana del tiempo hasta recaída de 3 meses (1-29,5). Debido al seguimiento estrecho (detección de proteinuria y hematuria y control riguroso de presión arterial) y reinicio rápido de eculizumab en el momento de la recaída, las secuelas crónicas pudieron prevenirse9.
Los datos publicados en el Registro Global de SUHa (NCT01522183) demostraron que, los pacientes que permanecieron con eculizumab tuvieron una tasa de microangiopatía trombótica menor que los que interrumpieron el tratamiento (3,6 años frente 10,7 por 100 pacientes, n=1147)10.
Sin embargo, todos los estudios mencionados podrían estar sesgados, ya que eculizumab puede retirarse en pacientes seleccionados y no por protocolo en todos ellos.
En nuestro paciente, la ausencia de mutaciones acompañado del buen estado general, condujeron a la discontinuación gradual de tratamiento. Sin embargo, durante la reducción, experimentó recaída clínica y analítica que mejoró progresivamente tras reintroducir eculizumab. La experiencia clínica limitada sobre la duración de tratamiento con eculizumab representa un desafío en los pacientes con SUHa. El tratamiento puede retirarse de forma segura en algunos pacientes, incluso en los de alto riesgo, pero es necesario realizar un seguimiento estrecho y reiniciar eculizumab si se sospecha recaída. Ante la escasez de datos publicados, nuestro caso podría servir como ejemplo de recaída tras la discontinuación de eculizumab en el SUHa pediátrico.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Dragon-Durey M-A, Sethi SK, Bagga A, et al. Clinical Features of Anti-Factor H Autoantibody-Associated Hemolytic Uremic Syndrome. J Am Soc Nephrol. 2010;21(12):2180-7. doi: 10.1681/ASN.2010030315.
2. Taylor CM, Machin S, Wigmore SJ, et al. Clinical practice guidelines for the management of atypical haemolytic uraemic syndrome in the United Kingdom. Br J Haematol. 2010;148(1):37-47. doi: 10.1111/j.1365-2141.2009.07916.
3. Loirat C, Saland J, Bitzan M. Management of hemolytic uremic syndrome. Presse Med. 2012;41(3 Pt 2):e115-35. doi: 10.1016/j.lpm.2011.11.013.
4. Talarico V, Aloe M, et al. Hemolytic uremic syndrome in children. Minerva Pediatr. 2016;68(6):441-455. PMID: 27768015.
5. Agencia Española del Medicamento y Productos Sanitarios. Ficha técnica de eculizumab. 2012; Disponible en: https://cima.aemps.es/cima/dochtml/ft/ 07393001/FT_07393001.html.
6. Ardissino G, Possenti I, Tel F et al. Discontinuation of eculizumab treatment in atypical hemolytic uremic syndrome: an update. Am J Kidney Dis. 2015;66 (1):172-3. doi: 10.1053/j.ajkd.2015.04.010.
7. Wijnsma KL, Duineveld C, Volokhina E, van den Heuvel LP, van de Kar N, Wetzels J. Safety and effectiveness of restrictive eculizumab treatment in atypical haemolytic uremic syndrome. Nephrol Dial Transplant. 2018; 33:635-645. doi: 10.1007/s00467-018-4091-3.
8. Ariceta G, Ardissino G, Sartz L, Fakhouri F, Gasteyger C, Al-Dakkak I. Thrombotic microangiopathy frequency in patients with atypical HUS: discontinuing vs remaining on eculizumab treatment. Kidney Week, ASN J Am Soc Nephrol.2018; 29:44 (abstract). Disponible en: https://www.asn-online.org/education/kidneyweek/2018/program-abstract.aspx?controlId=3011169.
9. Kioa L. Wijnsma, Caroline Duineveld, Jack F. M. Wetzels, Nicole C. A. J. van de Kar. Eculizumab in atypical hemolytic uremic syndrome: strategies toward restrictive use. Pediatric Nephrology. 2019;34:2261-2277. doi: 10.1007/ s00467-018-4091-3.
10. Loirat C, Fakhouri F, Ariceta G, Besbas N, Bitzan M, Bjerre A et al. An international consensus approach to the management of atypical hemolytic uremic syndrome in children. Pediatr Nephrol. 2016;31:15-39. doi: 10.1007/s00467-015-3076-8.
____
