Rev. OFIL 2017, 27;2:121-150
Fecha de recepción: 23/01/2017 – Fecha de aceptación: 08/03/2017
____
Achau Muñoz R1, Gaspar Carreño M1, Andrés Avilés S1, Torrico Martín F1, Beltrán Daudén G2, Sánchez Santos JC3
1 Servicio de Farmacia
2 Supervisión de Enfermería
3 Dirección Médica
Hospital Intermutual de Levante. Valencia. (España)
Con la colaboración del grupo de trabajo de la Sociedad Valenciana de Farmacia Hospitalaria (SVFH)
___
Correspondencia:
Rubén Achau Muñoz
Hospital Intermutual de Levante
(Servicio de Farmacia)
Autovía CV-35 Valencia a Ademuz – Km 11,7 – Salida nº 12
46184 San Antonio de Benageber (Valencia)
Correo electrónico: rachau@hilevante.com
___
Resumen
Objetivo: Identificar aquellos medicamentos con principios activos fotosensibles incluidos en la guía farmacoterapéutica (GFT) del Hospital Intermutual de Levante (HIL), para establecer las medidas de protección que se deban implantar en cada caso, y así asegurar la adecuada conservación de los mismos, garantizando su efectividad y seguridad.
Métodos: Se consultaron datos de las fichas técnicas, información solicitada al laboratorio fabricante o distribuidor y fuentes de información secundarias y terciarias. Se elaboraron tablas en función de la vía de administración donde se ordenaron los medicamentos por orden alfabético de su principio activo. En las tablas se recogieron los datos sobre: principio activo, medicamento, tipo de acondicionamiento primario, laboratorio, recomendaciones sobre protección de la luz, observaciones y bibliografía.
Resultados: Se revisaron 734 medicamentos incluidos en la GFT del hospital (segunda edición; 2013). Del total de medicamentos, 225 (30,7%) contenían principios activos fotosensibles, en 165 (22,5%) no se encontraron datos, por lo que se les dio el mismo trato que a los medicamentos con principios activos fotosensibles y 344 (46,8%) no contenían principios activos fotosensibles.
Conclusiones: La no obligatoriedad de los laboratorios de especificar en ficha técnica si un medicamento debe protegerse de la luz, hace necesaria la realización de revisiones periódicas para mantener actualizada la información disponible y garantizar la adecuada conservación, almacenamiento, distribución, acondicionamiento y administración de los medicamentos.
Palabras clave: Fotosensibilidad, estabilidad, medicamento, revisión, luz.
____
INTRODUCCIÓN
La fotosensibilidad es un factor limitante de la vida útil de un fármaco. Los medicamentos pueden ser expuestos a la luz, ya sea a la luz solar directa o a fuentes de luz artificial, en diferentes situaciones durante su elaboración, distribución, almacenamiento, preparación y administración1-6.
La eficacia y seguridad del fármaco puede verse afectada de manera negativa por la interacción entre los principios activos y la luz, dando lugar a la degradación de los mismos y a la formación de otros productos. Como resultado de este proceso se puede producir una pérdida de la potencia del fármaco, e incluso a la aparición de efectos adversos derivados de los productos de degradación generados1,3,4,6.
La descomposición fotoquímica se puede producir mediante diferentes tipos de reacciones entre las que se incluyen: reducción, N-desalquilación, hidrólisis, oxidación, isomerización y polimerización3. Como consecuencia de estas reacciones, se puede producir la alteración de las propiedades fisicoquímicas de la formulación, como puede ser: la viscosidad, el tamaño de partícula, la velocidad de disolución, formación de precipitados y el color3. El cambio en la coloración es la observación más común, aunque no siempre se produce, y no tiene por qué estar necesariamente correlacionado con el grado de degradación química del fármaco6.
En el caso de las formas orales sólidas, el proceso fotoquímico tiene lugar en la superficie del producto. La velocidad de degradación en la capa superficial depende de factores que influyen en la profundidad de penetración de la luz, como, por ejemplo, el tamaño de partícula o el color3. Por este motivo, muchas preparaciones sólidas están dotadas de un recubrimiento externo que las protege de la luz.
Por otro lado, las formas farmacéuticas orales líquidas y para administración parenteral son particularmente susceptibles a la degradación en presencia de luz cuando se encuentran en solución o suspensión4, por lo que en muchas ocasiones se comercializan en polvo liofilizado para su reconstitución y dilución en el momento de su uso.
En las farmacias de los hospitales, los medicamentos con principios activos fotosensibles se deben proteger de la luz una vez fuera de su embalaje original. Para ello, las formas orales sólidas se pueden reenvasar con materiales opacos a la luz7, mientras que los preparados parenterales se deben proteger en bolsas opacas8, tanto durante el almacenamiento de la presentación comercial (ampolla, vial, etc.) como tras su dilución en frascos o bolsas de fluido para su administración, ya que el material de estos últimos no protege de la luz9. Además, en el caso de aquellos fármacos que se degradan rápidamente en presencia de luz, puede ser necesario incluso la utilización de sistemas de administración opacos.
Tras la publicación del artículo “Revisión de la estabilidad de los medicamentos fotosensibles”8, nos planteamos la necesidad de realizar la actualización de los medicamentos del listado con la nueva información publicada y su ampliación con los medicamentos incluidos en la Guía Farmacoterapéutica (GFT) de nuestro hospital.
OBJETIVO
Identificar aquellos medicamentos con principios activos fotosensibles incluidos en la GFT del Hospital Intermutual de Levante (HIL), y desarrollar un procedimiento normalizado de trabajo que establezca las medidas de protección que se deben implantar en cada caso, para establecer la adecuada conservación de los mismos, garantizando su efectividad y seguridad.
MATERIAL Y MÉTODOS
Se realizó una revisión de todos los medicamentos incluidos en la GFT del hospital para identificar aquellos con principios activos fotosensibles, y establecer las medidas de protección de la luz necesarias en función de la información disponible, forma farmacéutica y acondicionamiento primario (envase o cualquier otra forma de acondicionamiento que se encuentre en contacto directo con la forma farmacéutica). Los datos se obtuvieron mediante consulta de la ficha técnica, información solicitada al laboratorio fabricante o distribuidor, y fuentes de información secundarias y terciarias. La recogida de información se inició en agosto de 2015 y finalizó en agosto de 2016.
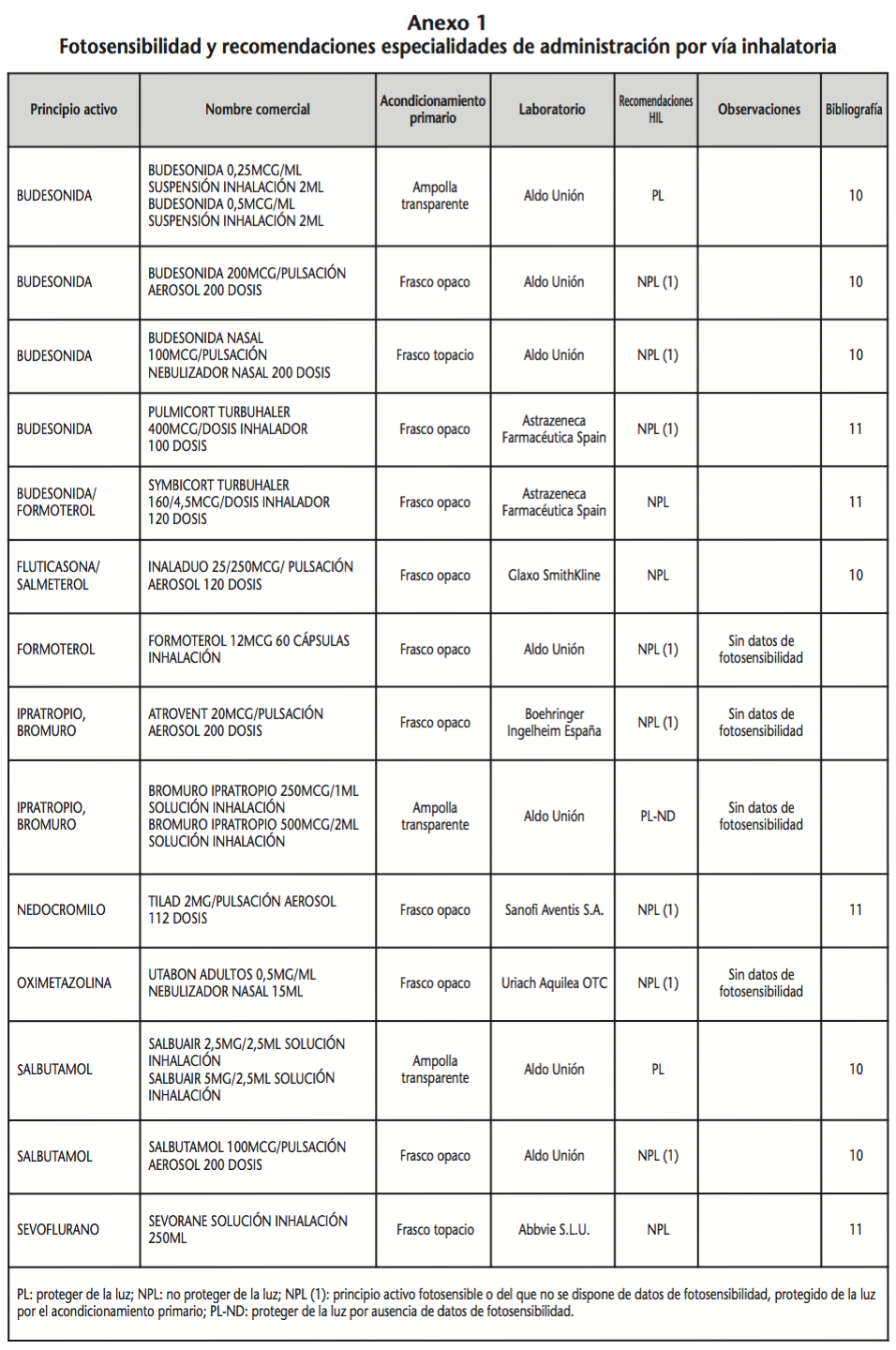
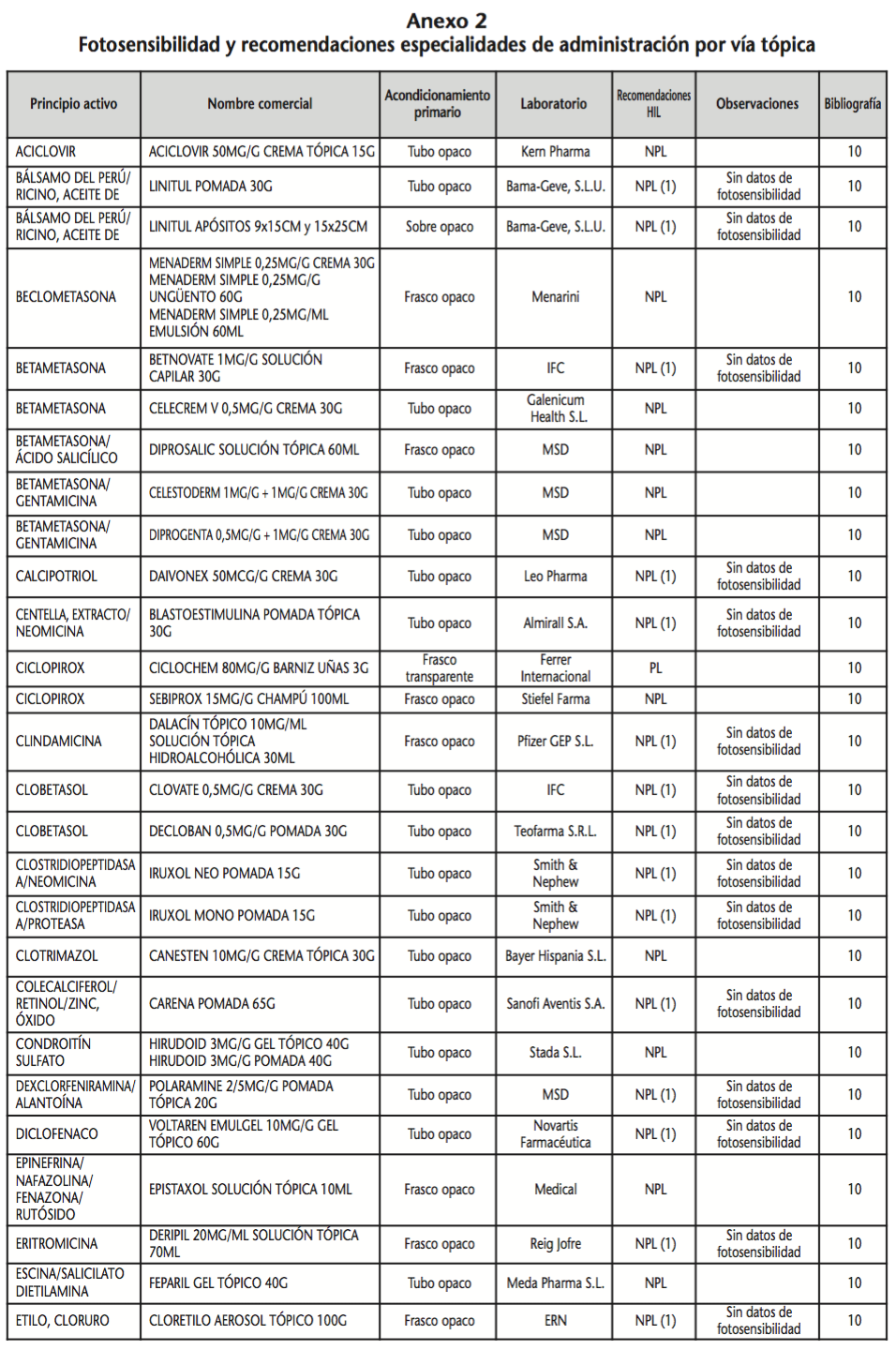
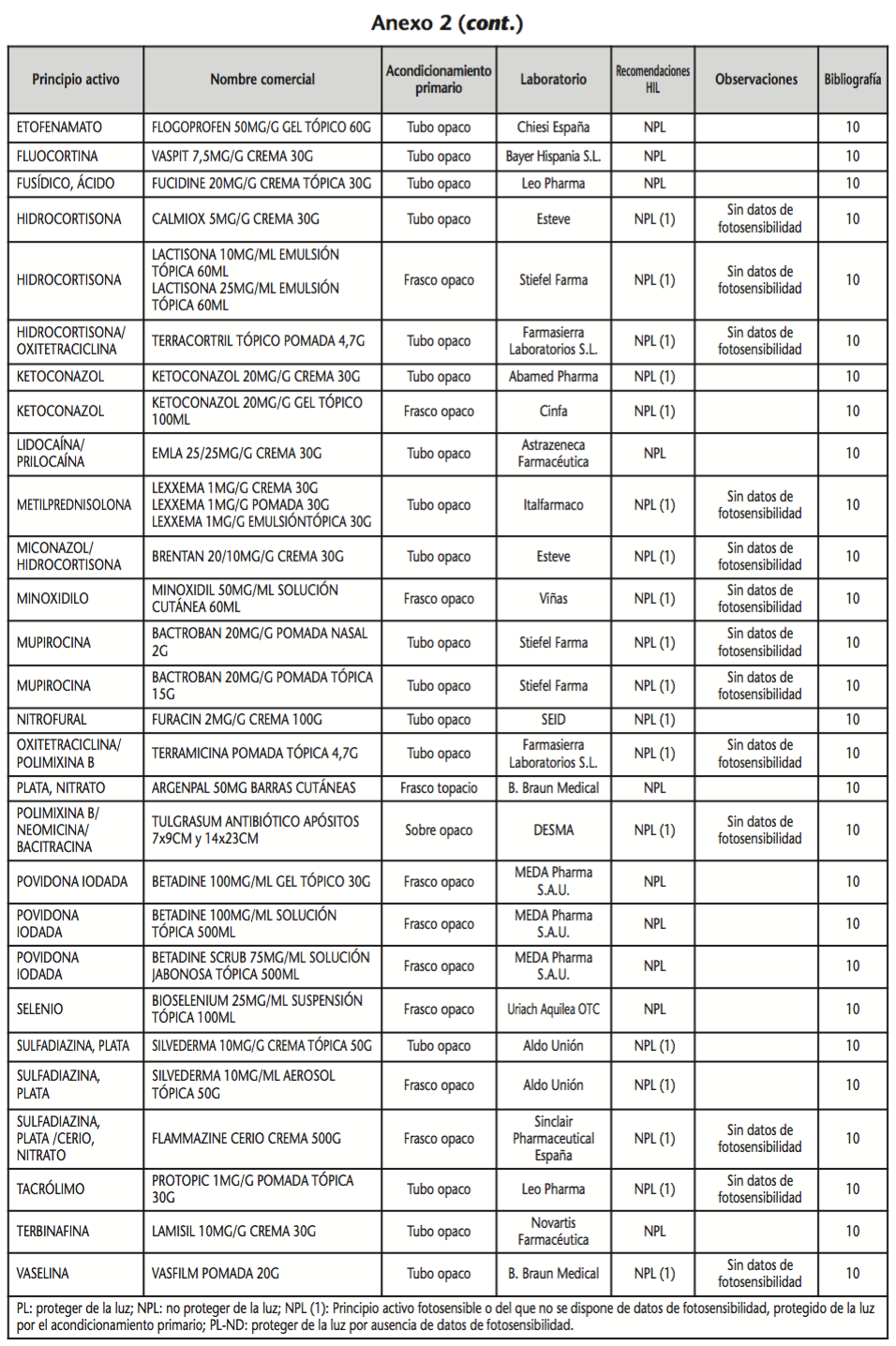
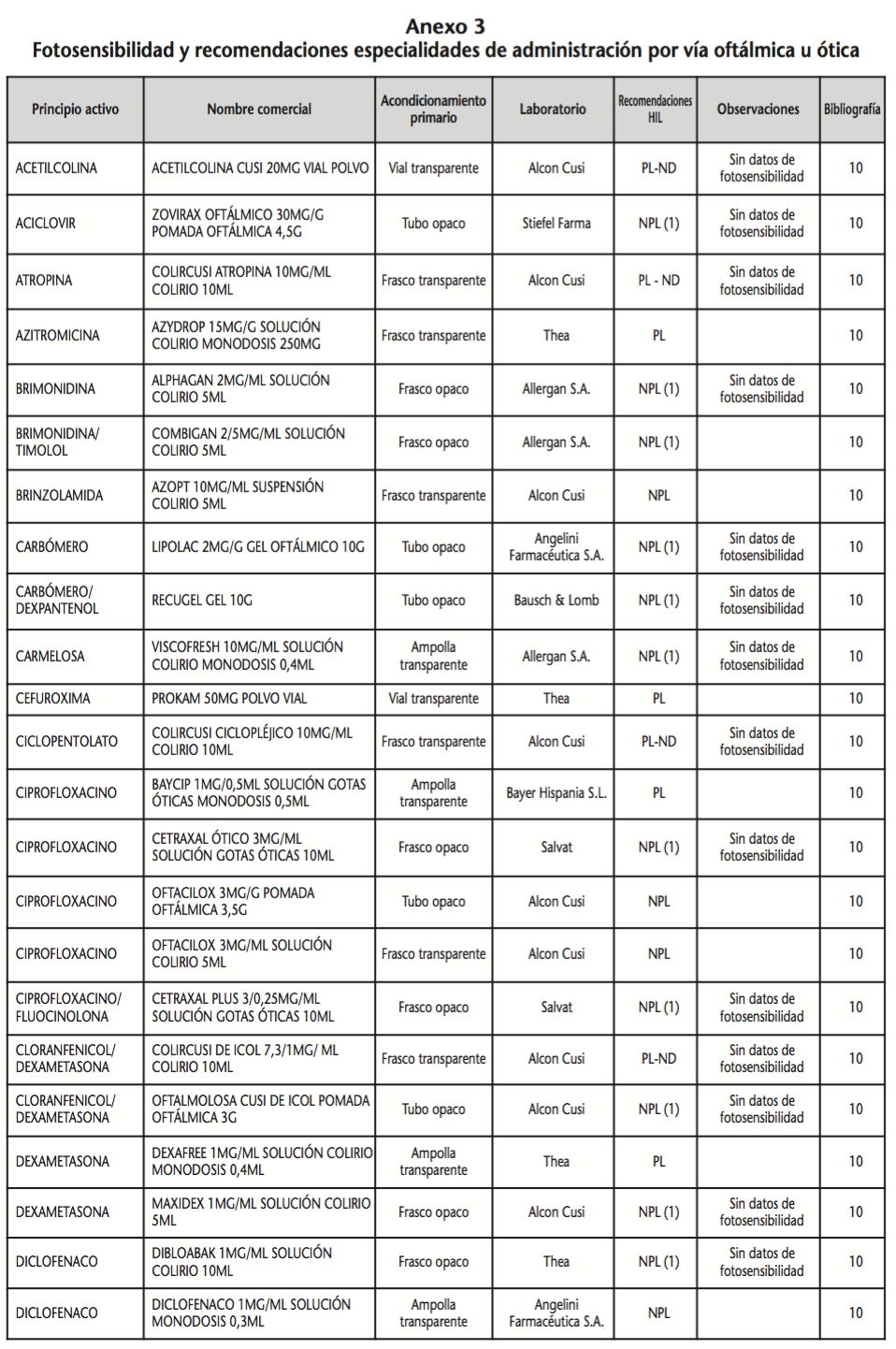
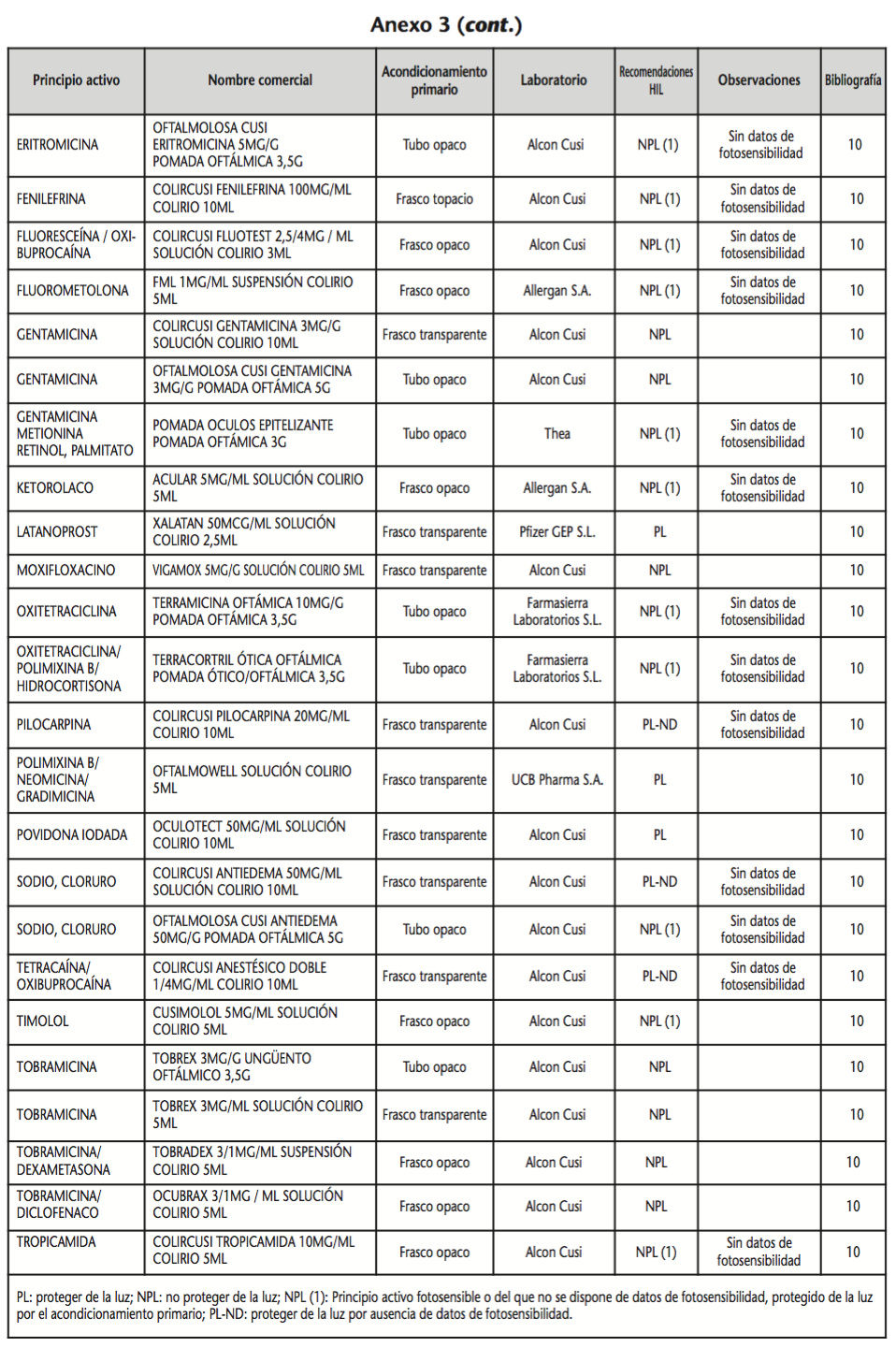
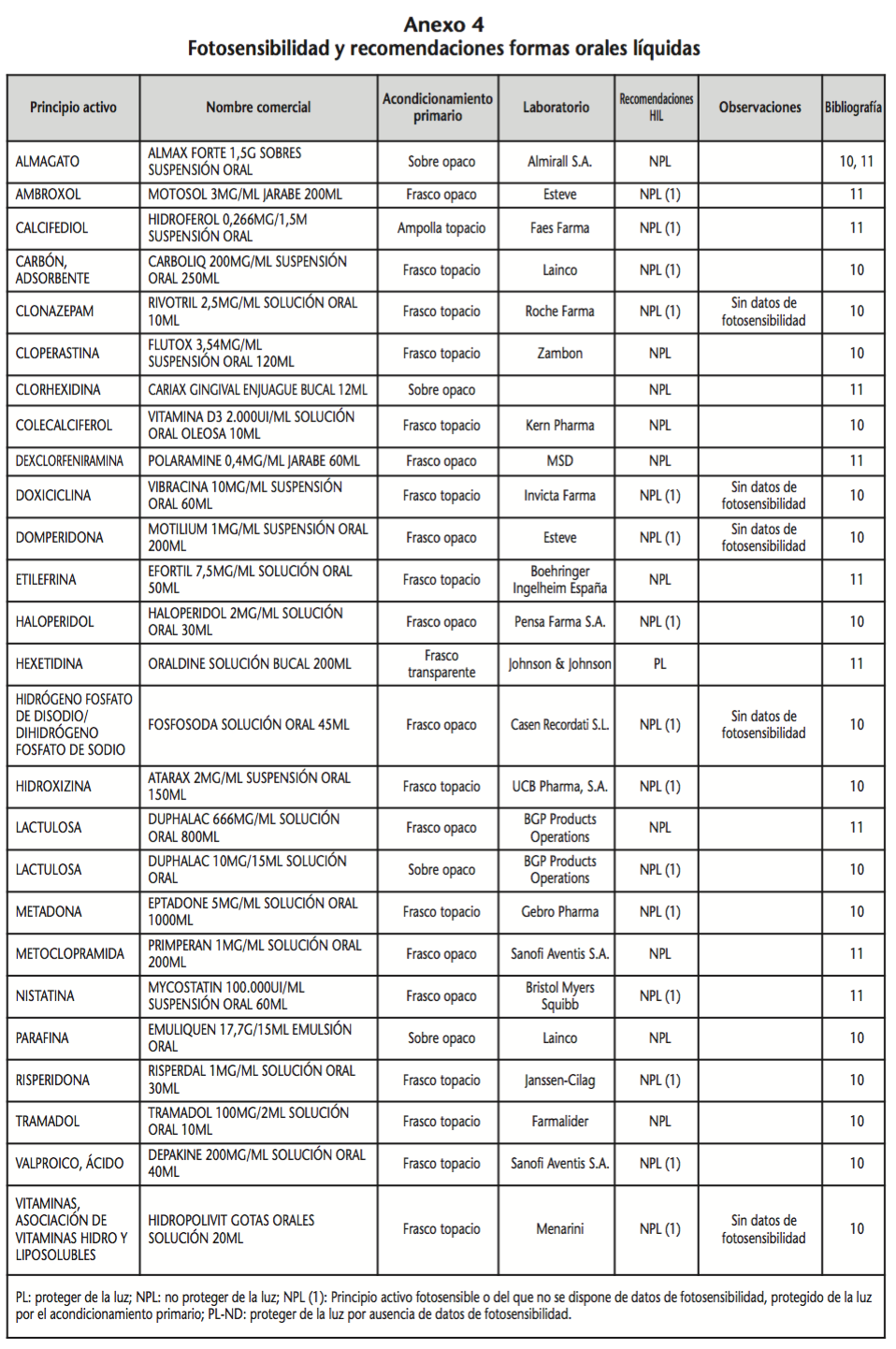
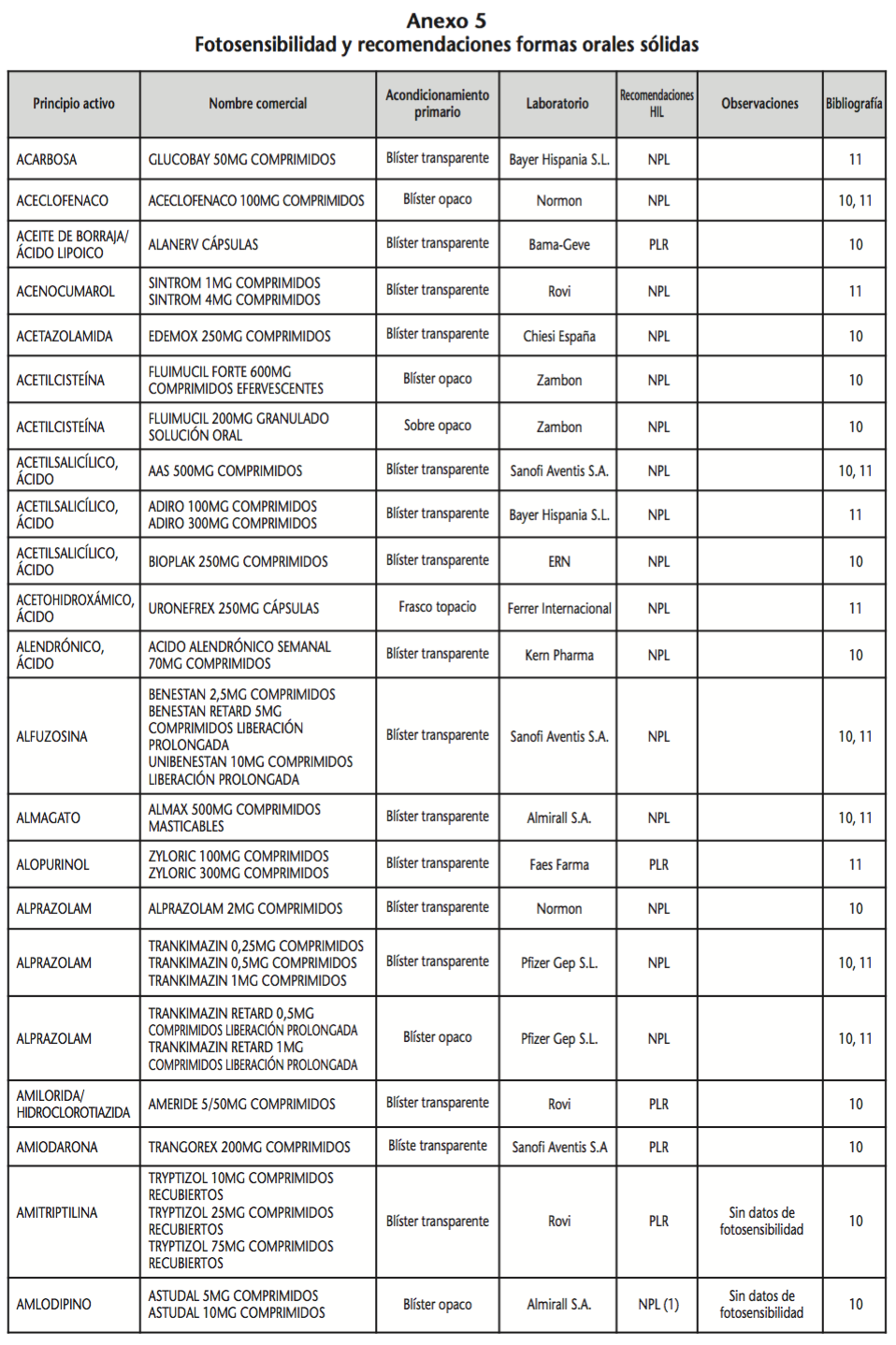
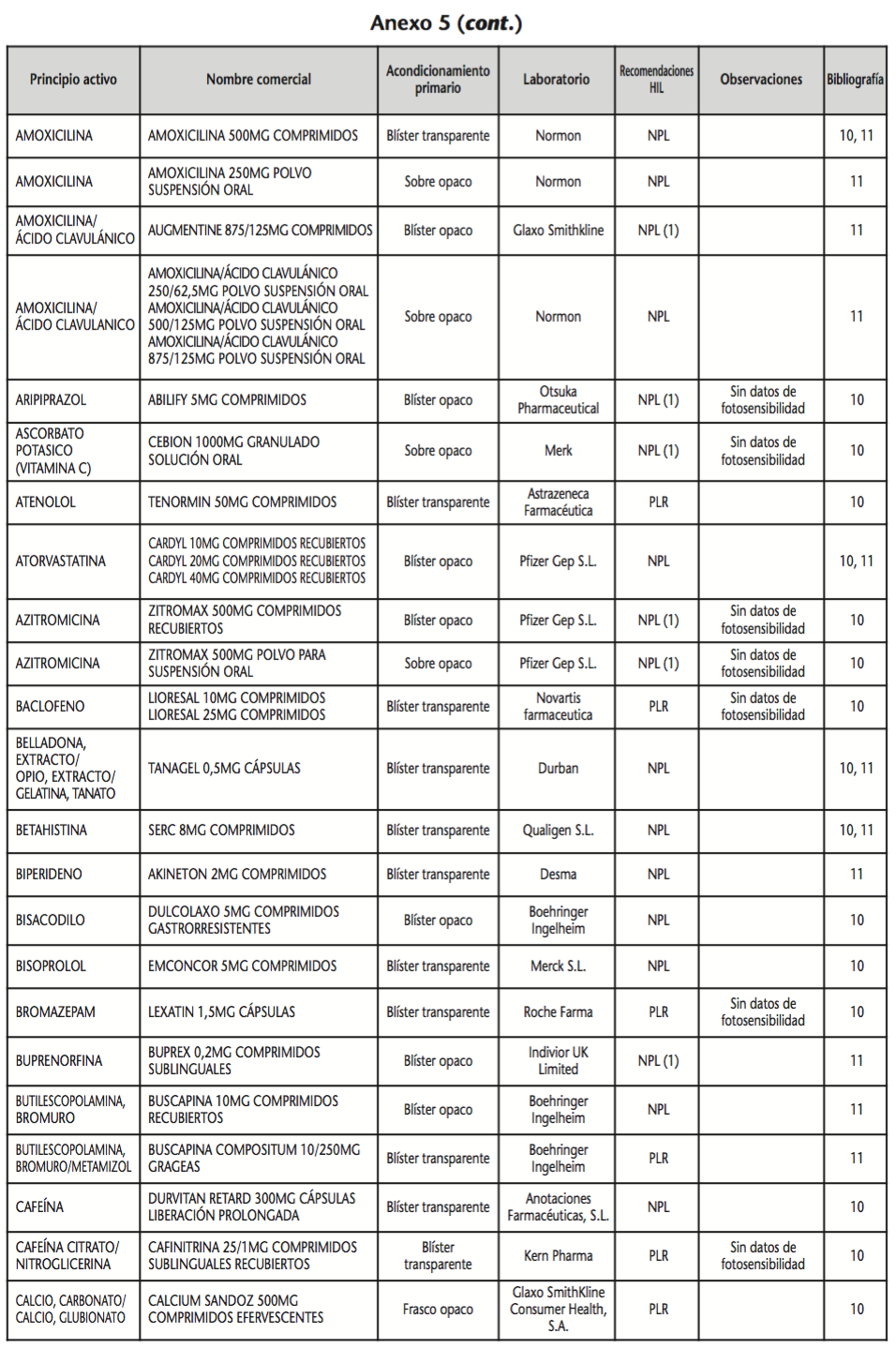
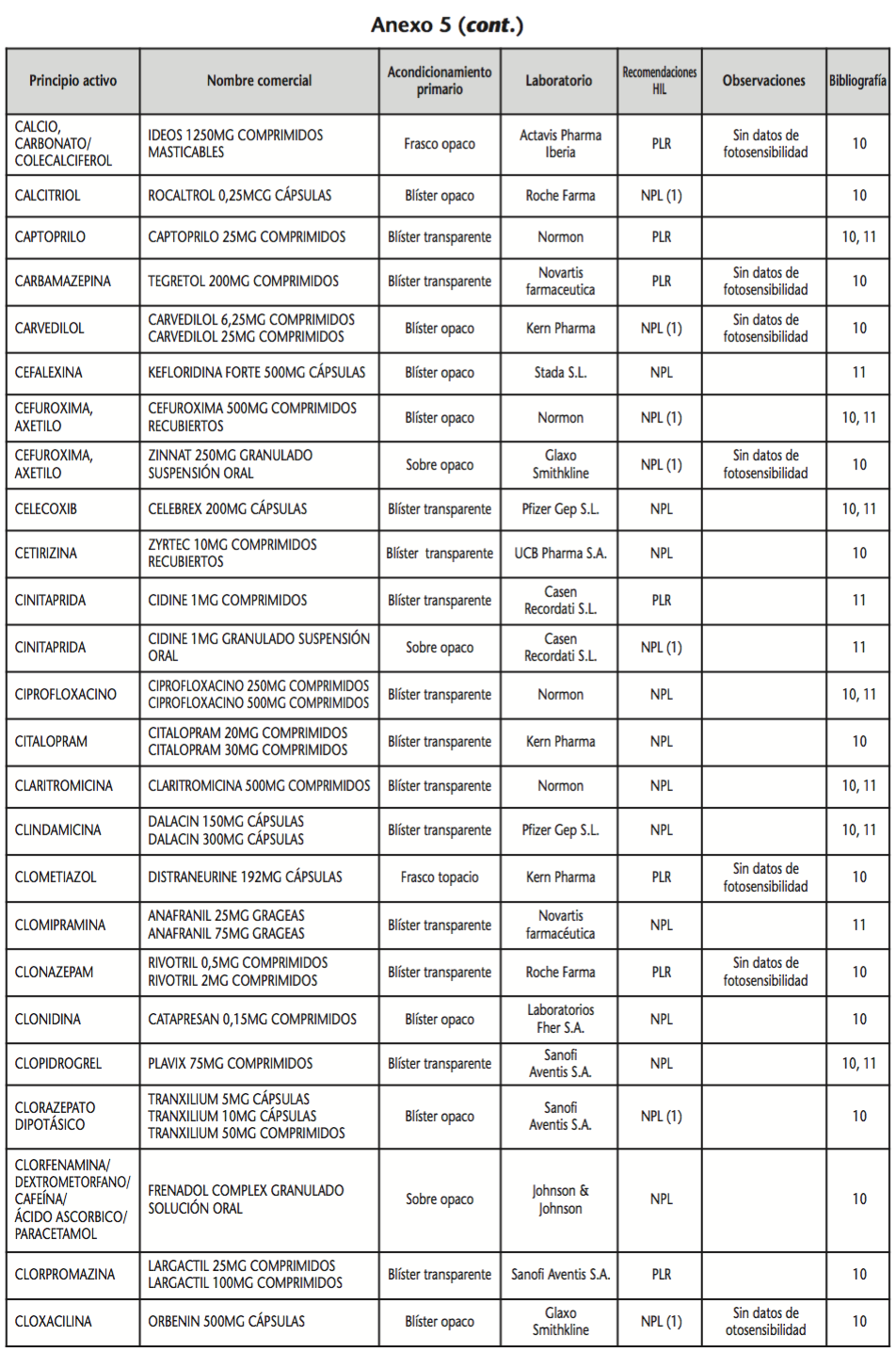
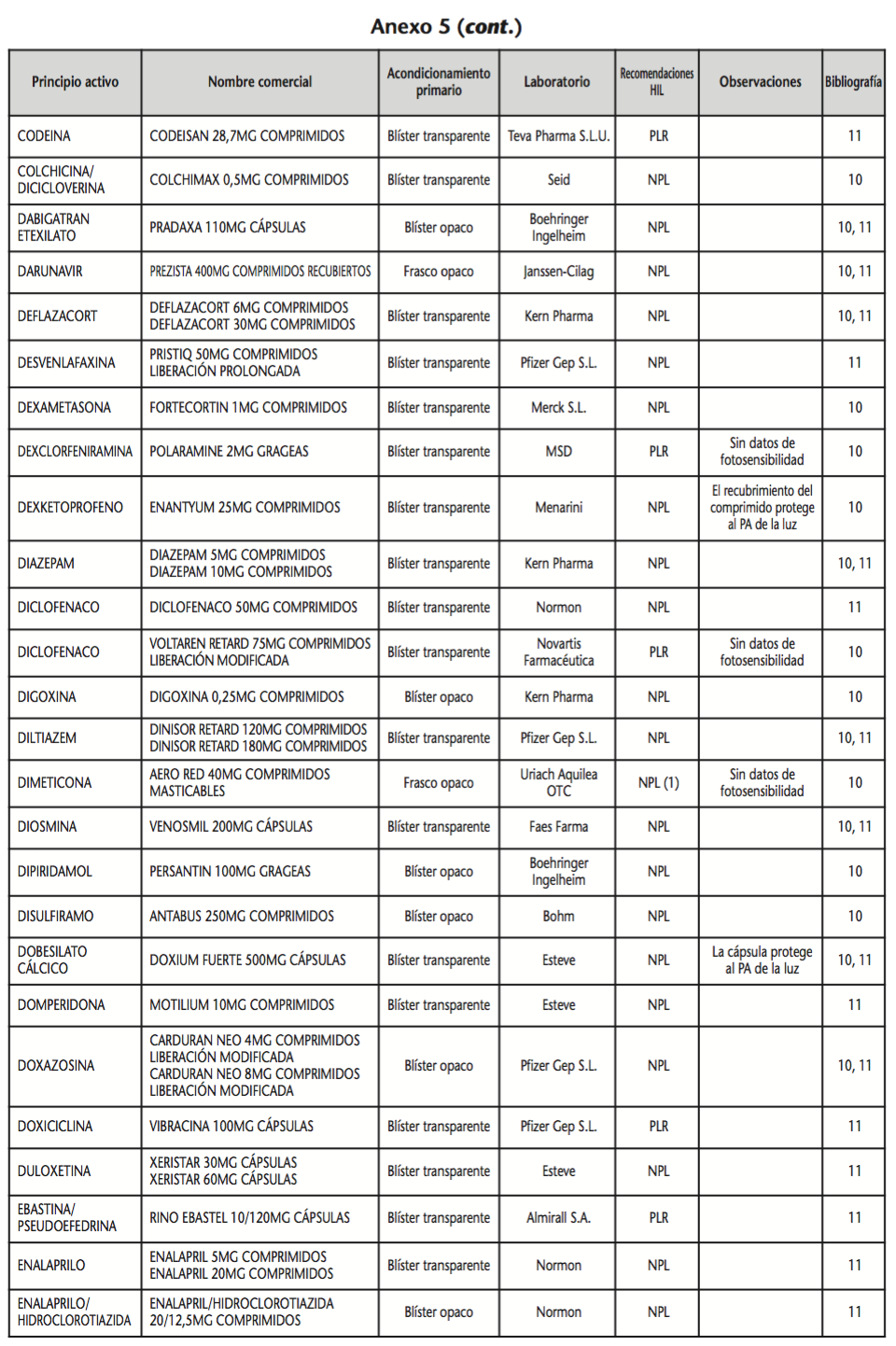
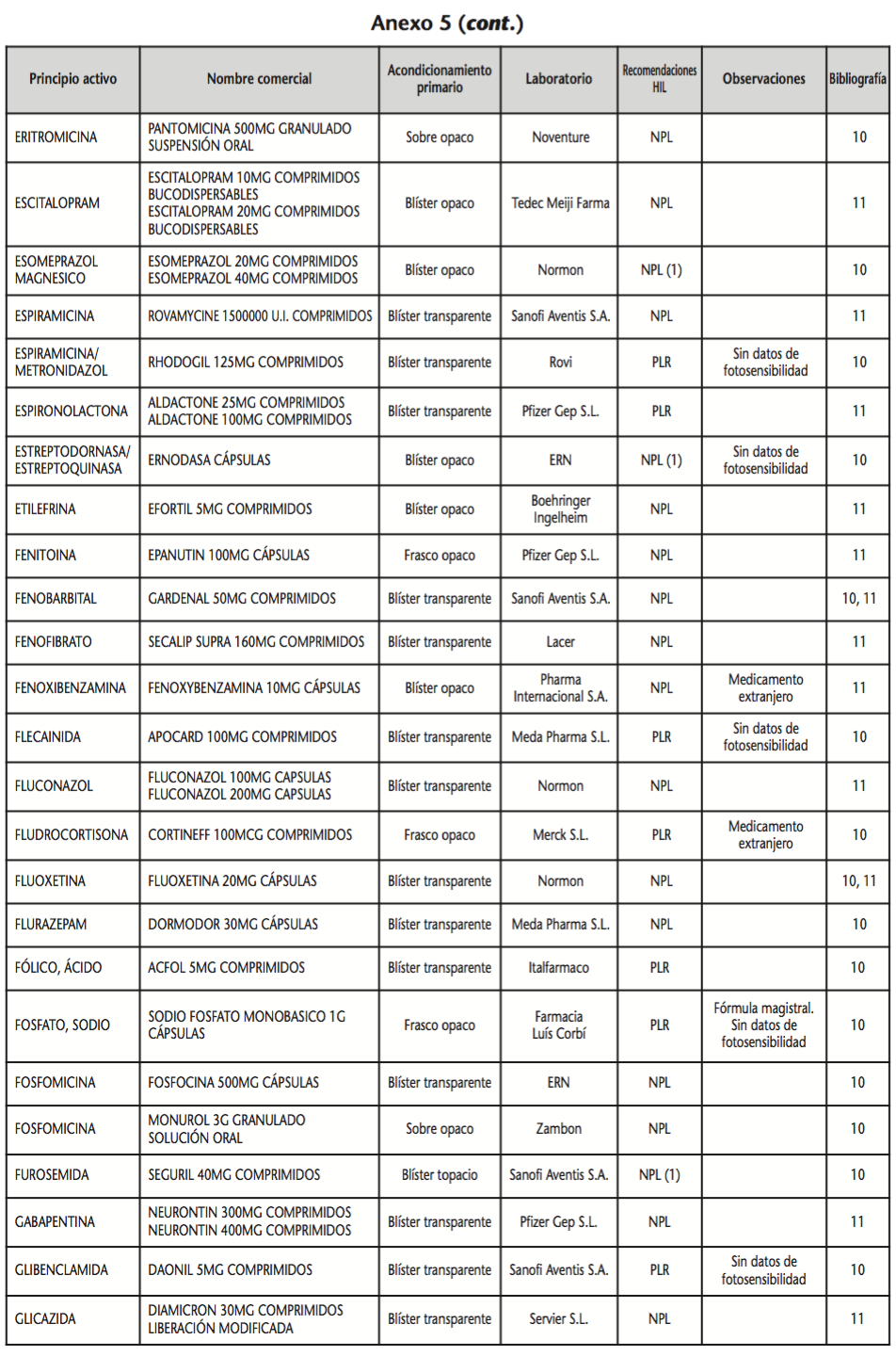
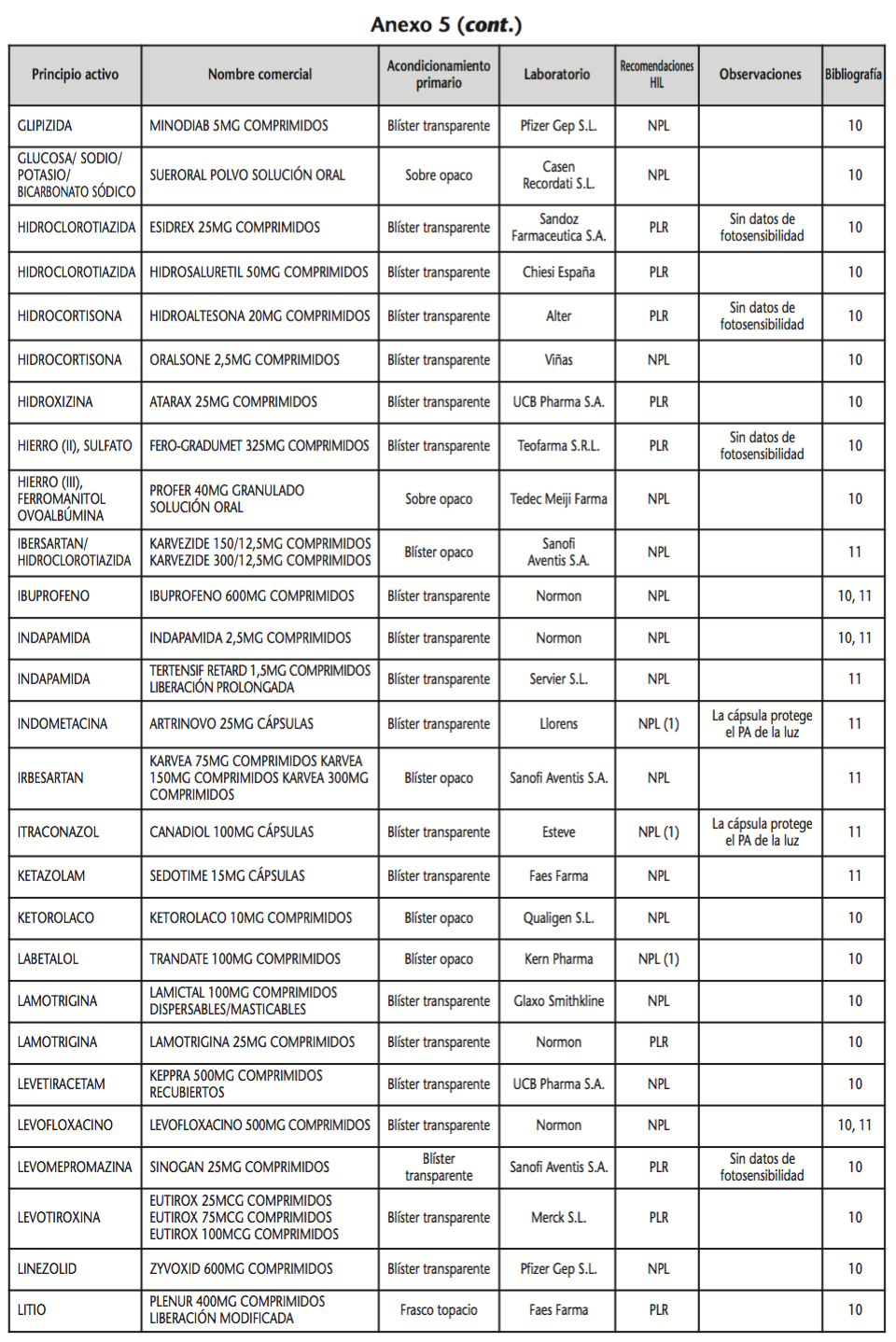
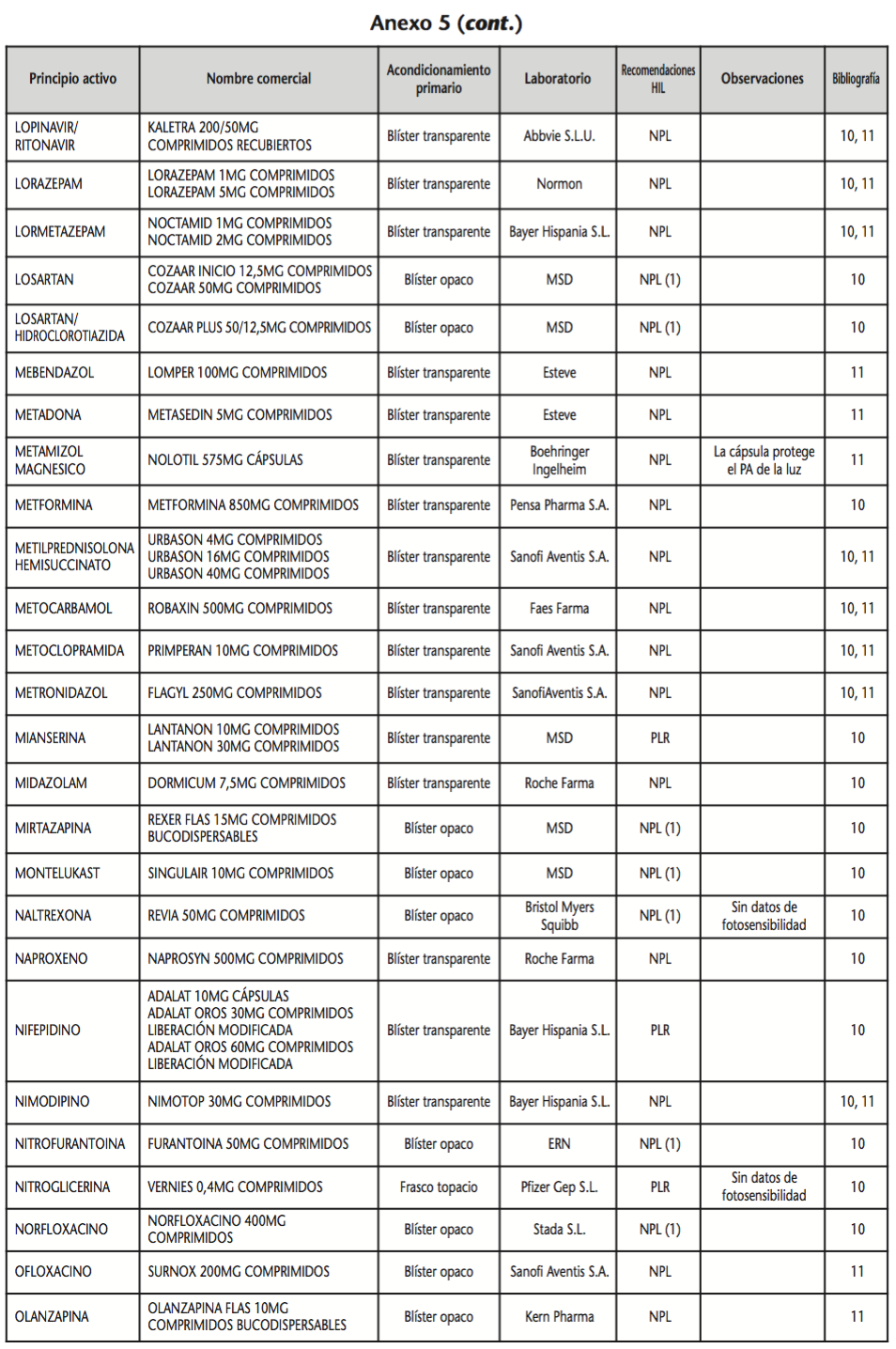
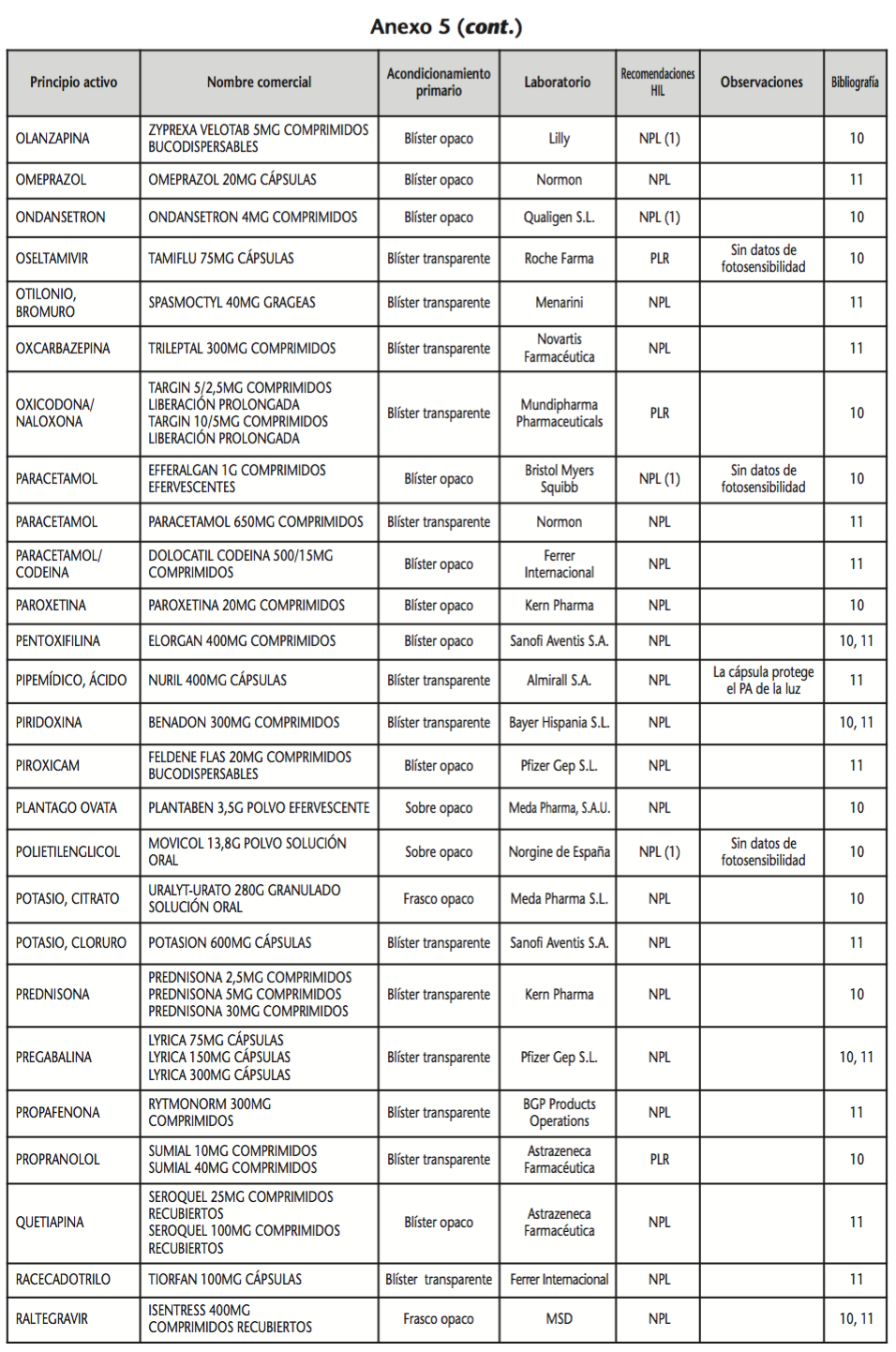
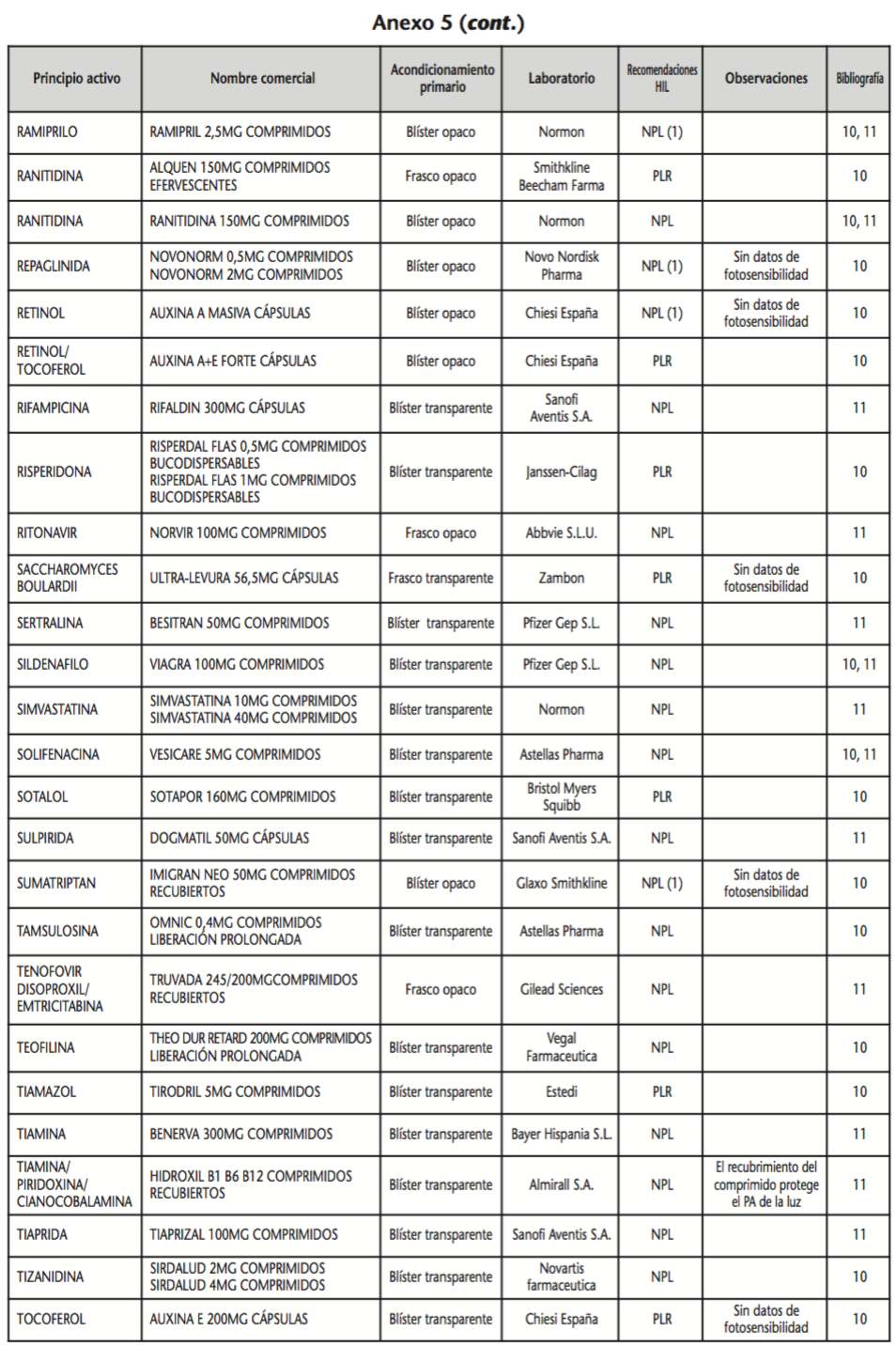
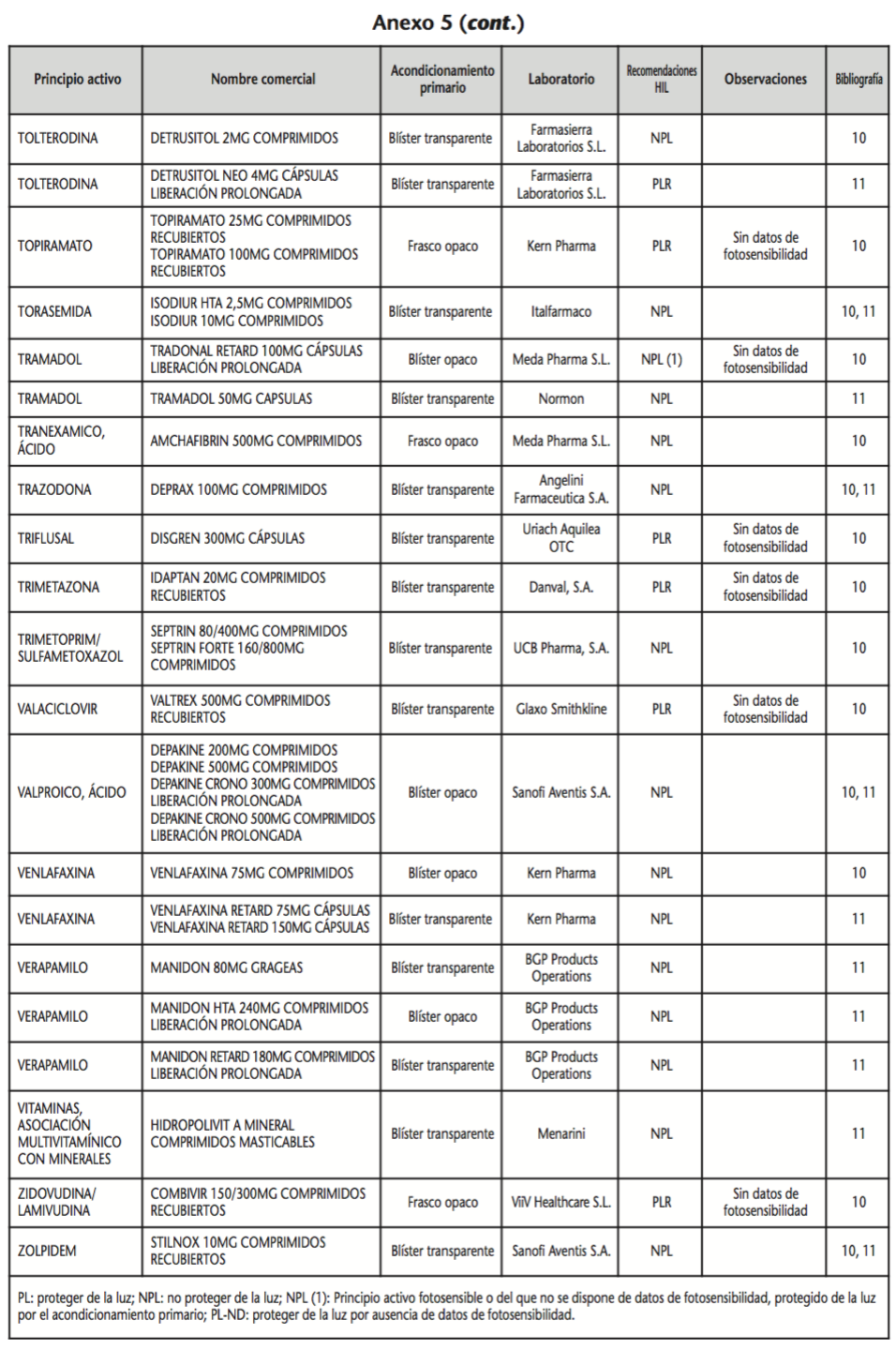
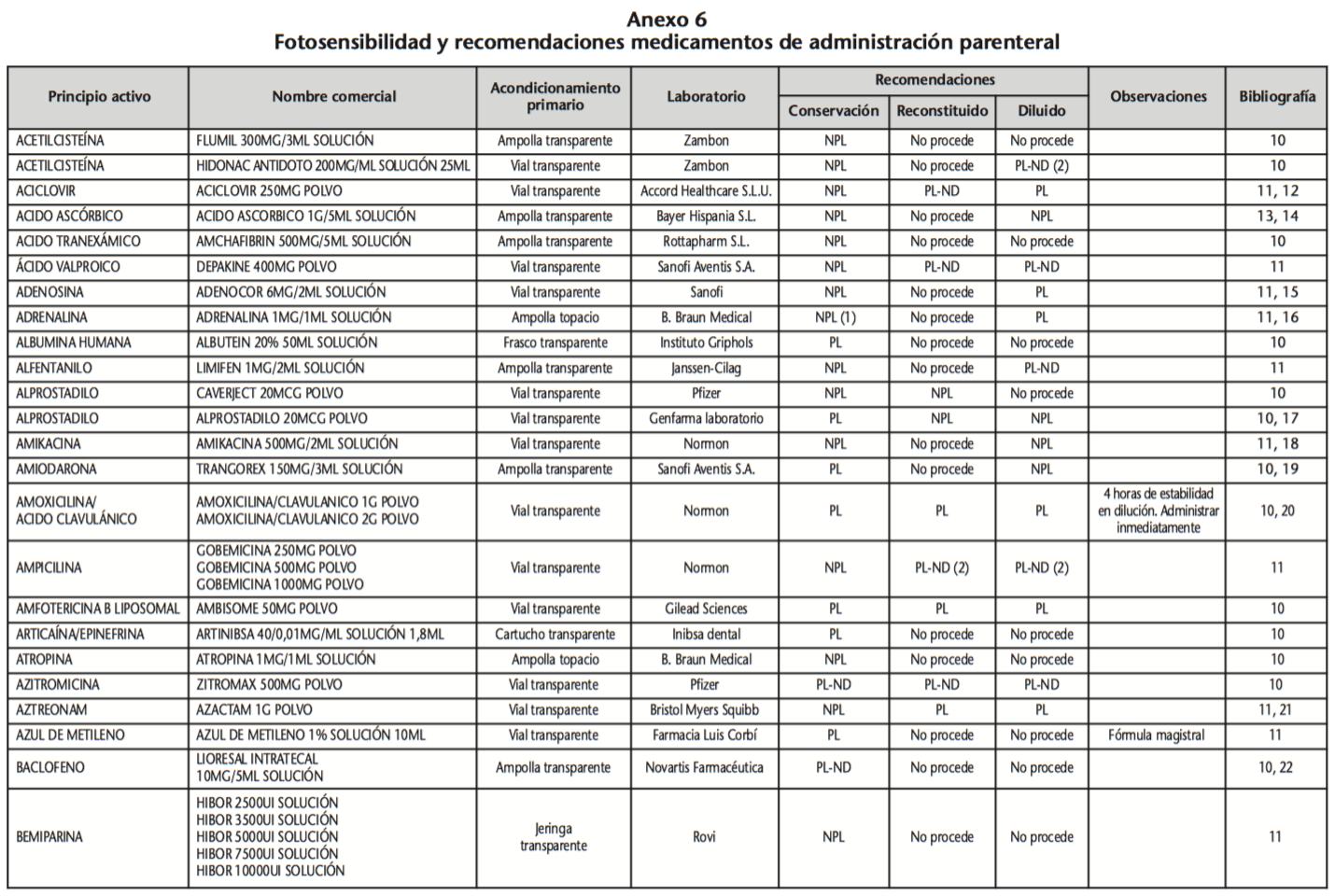
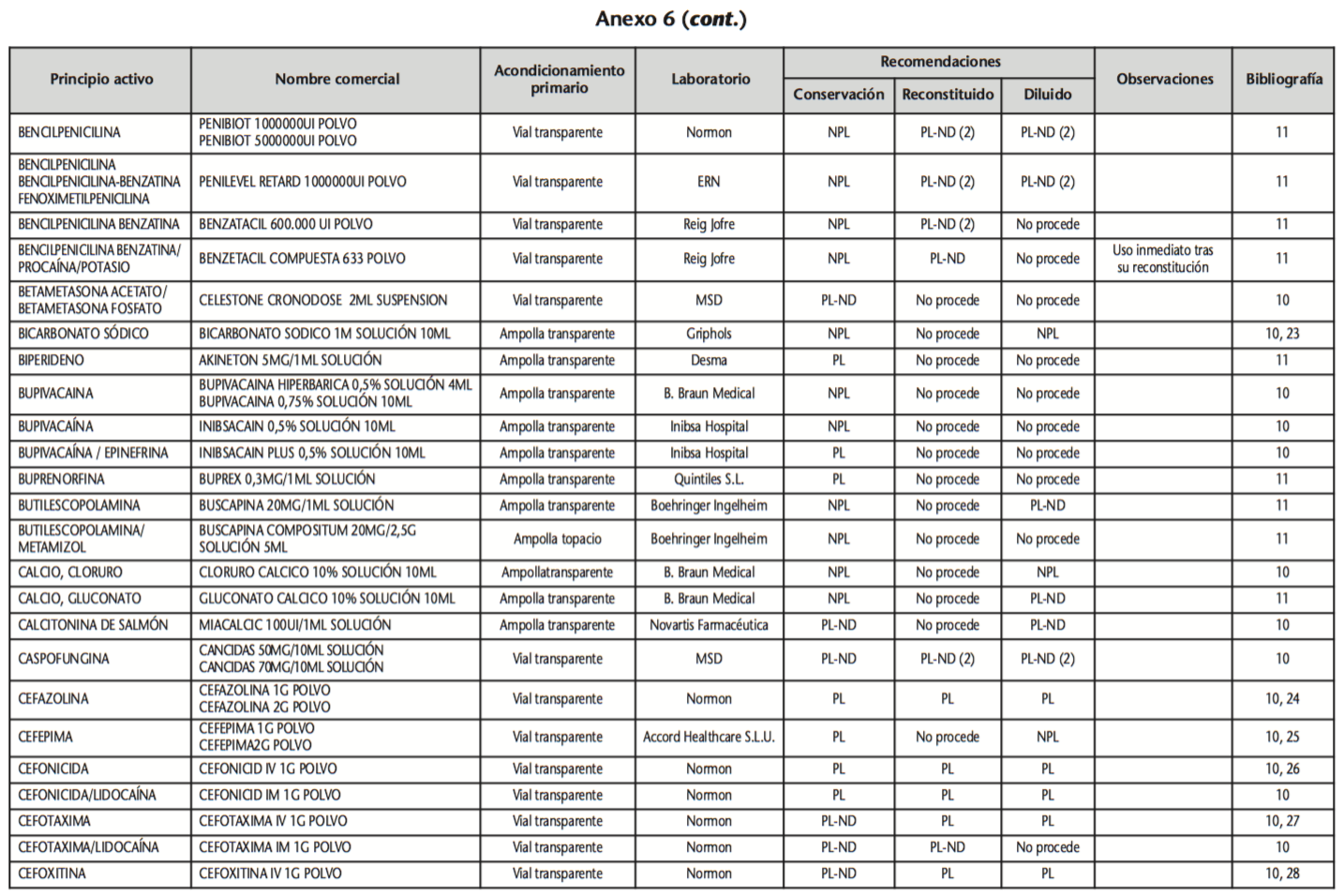
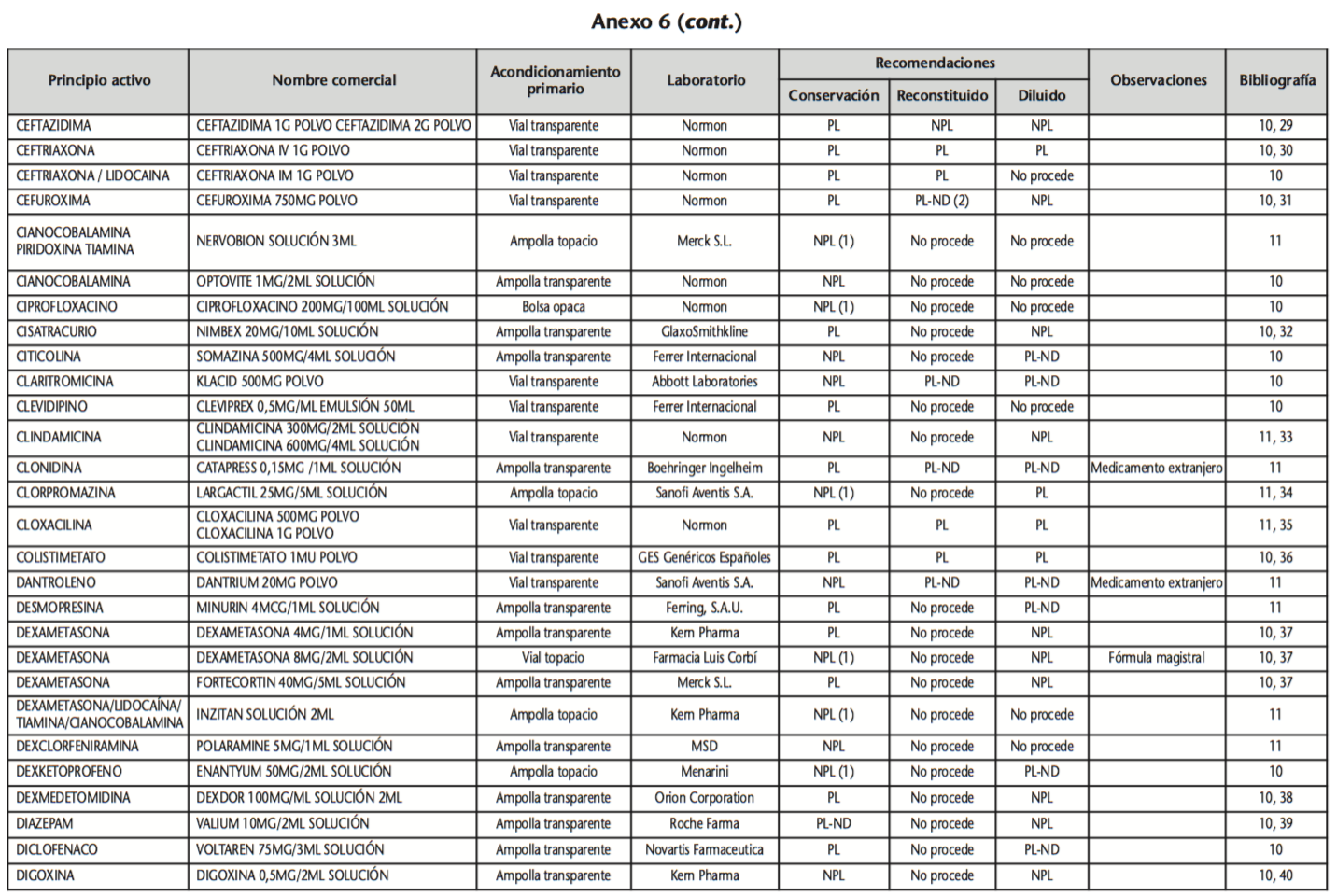
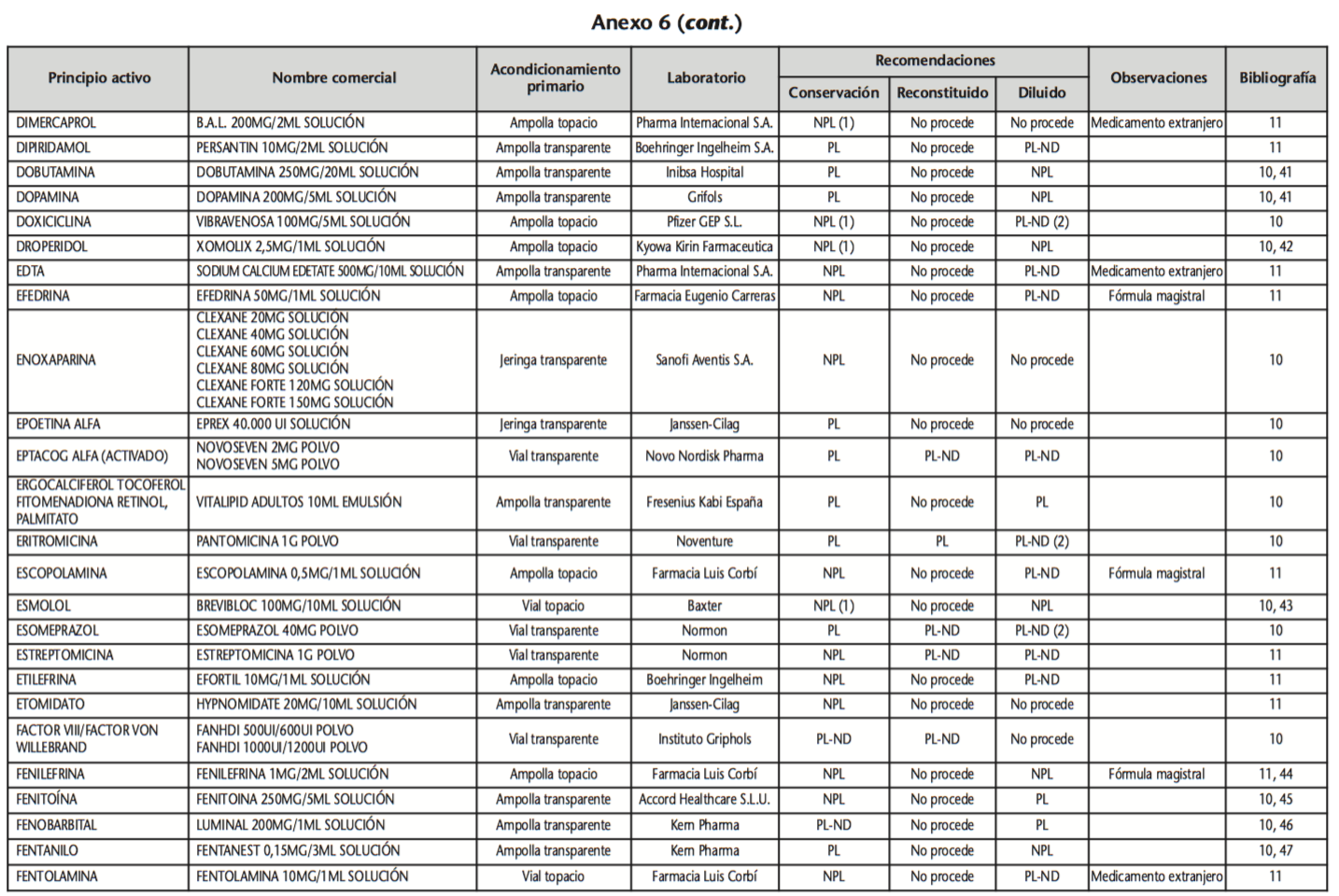
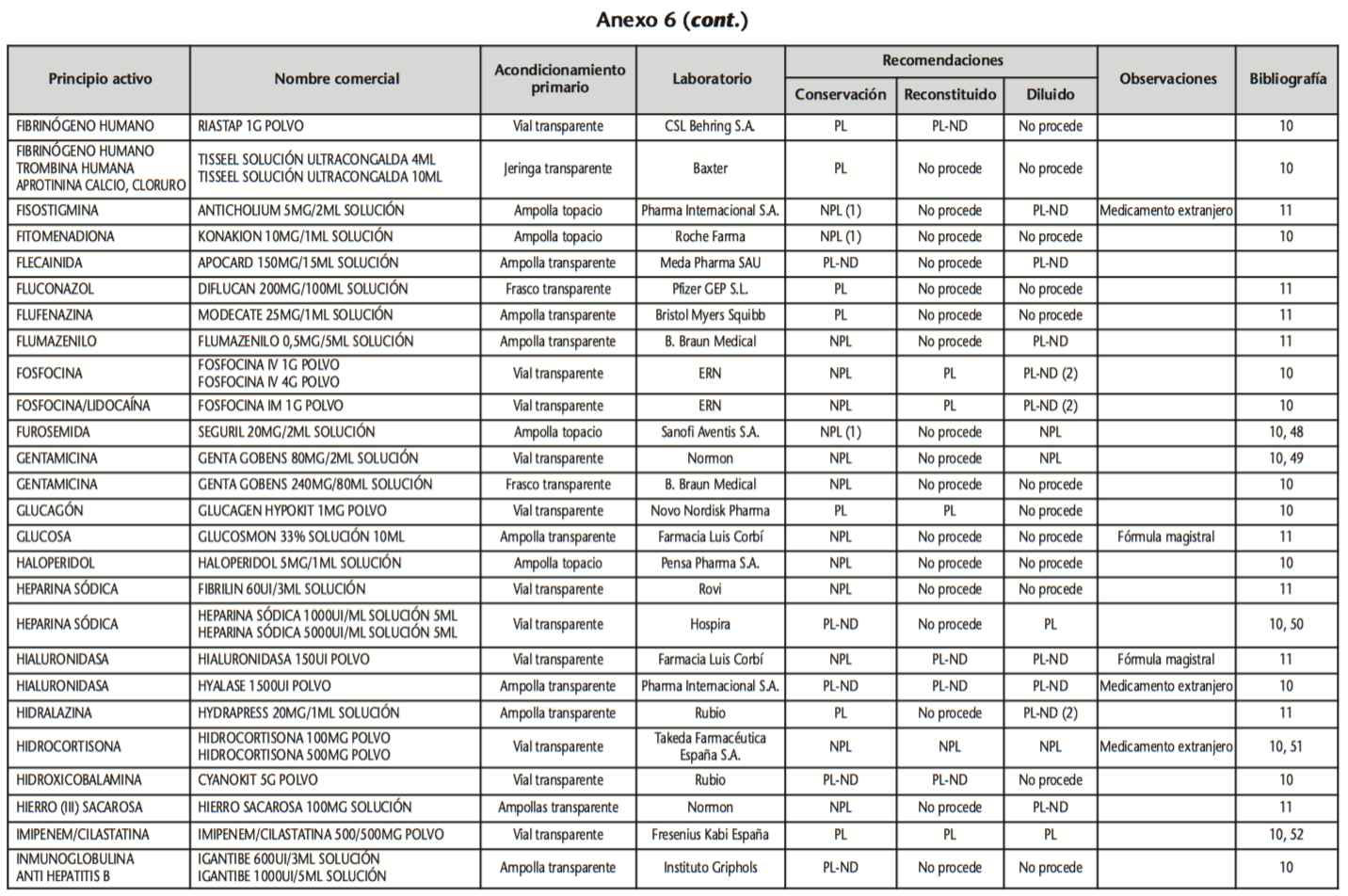
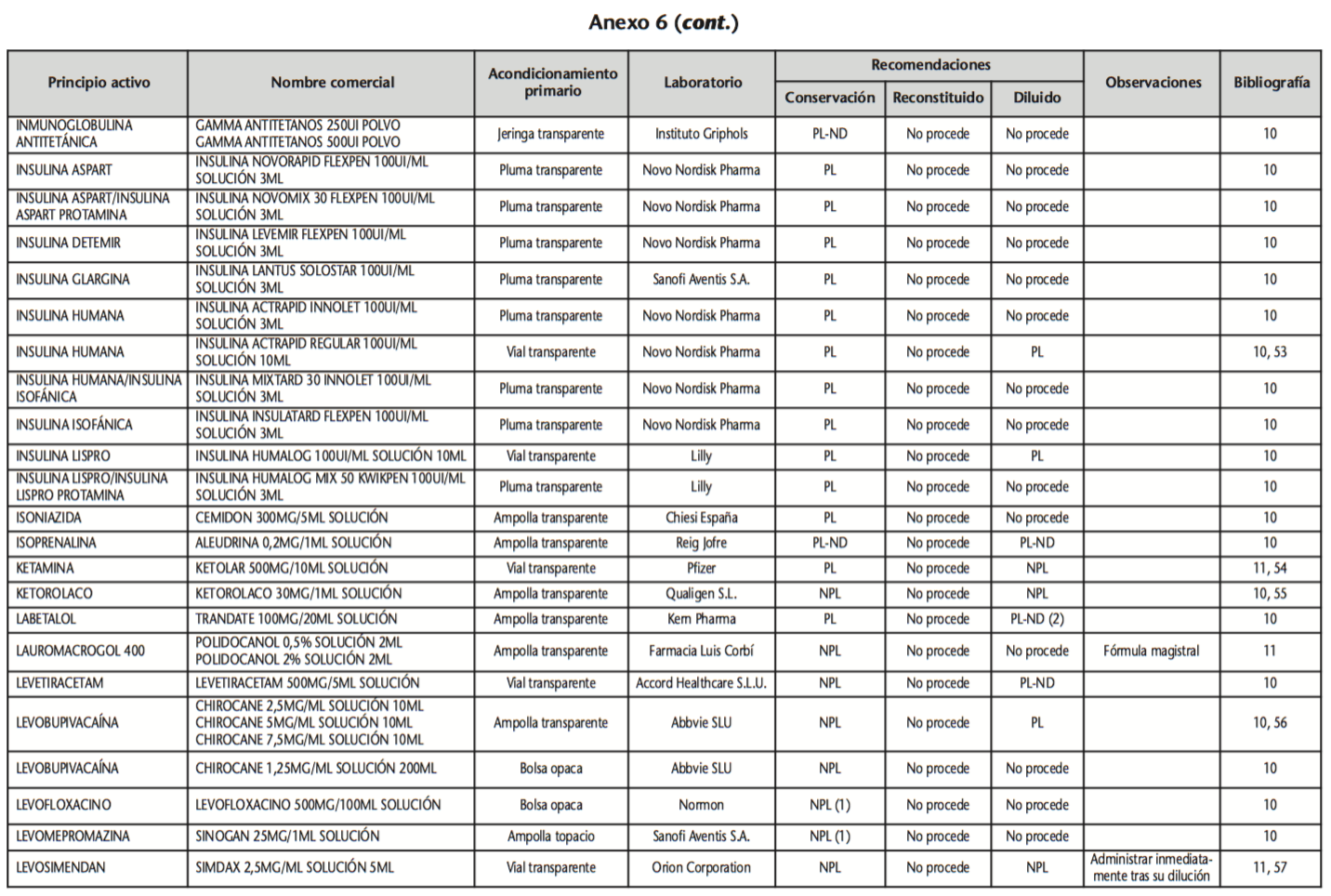
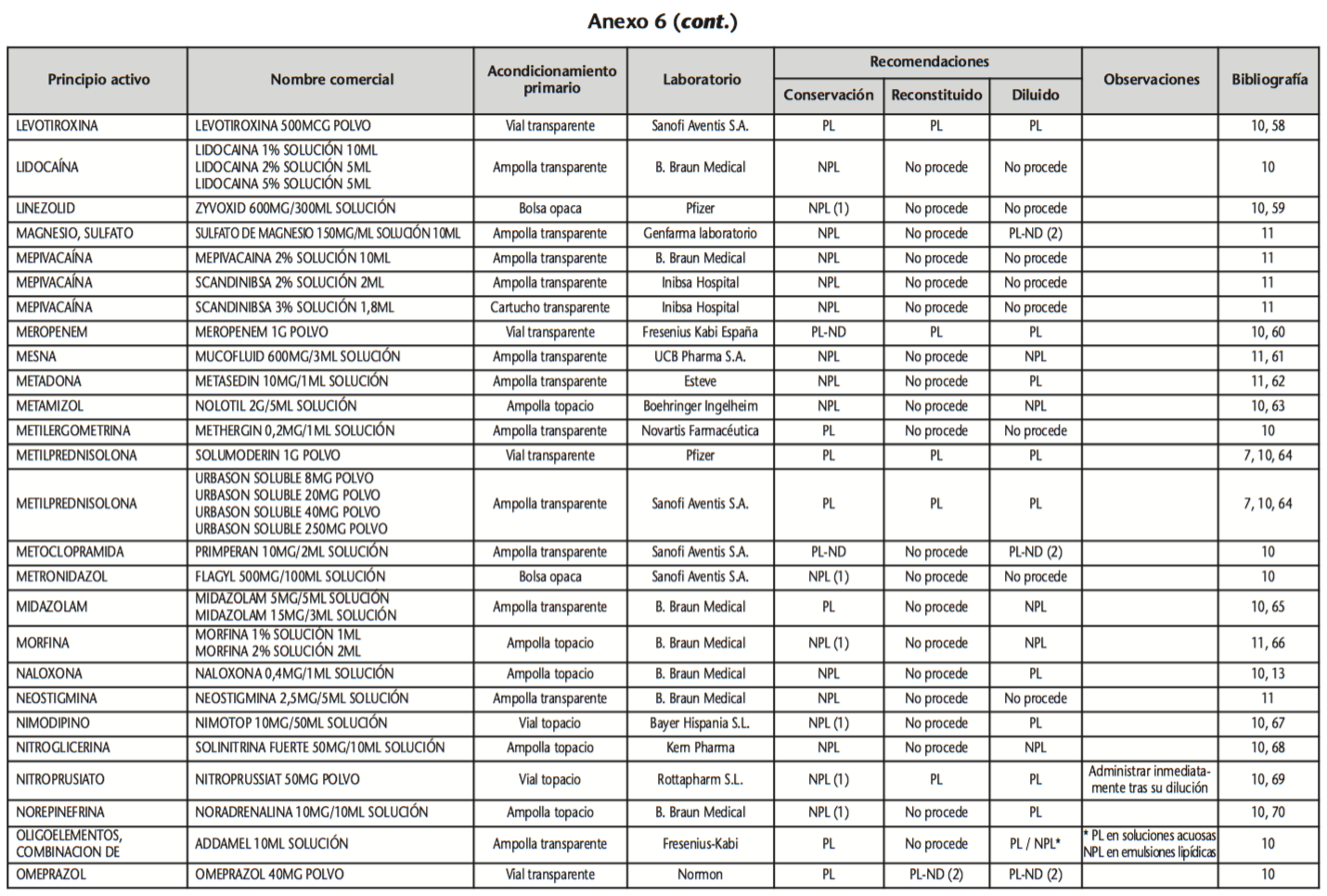
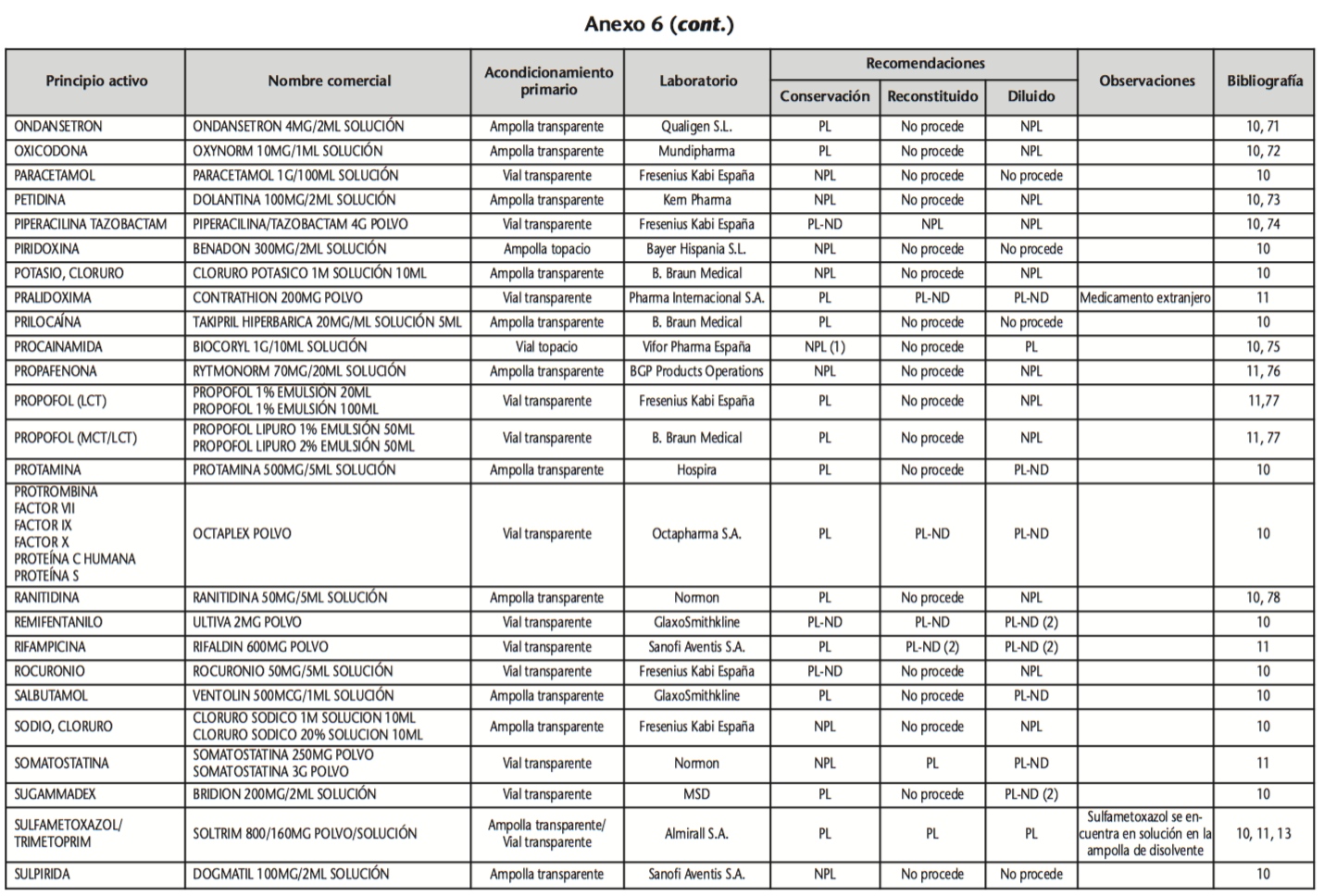
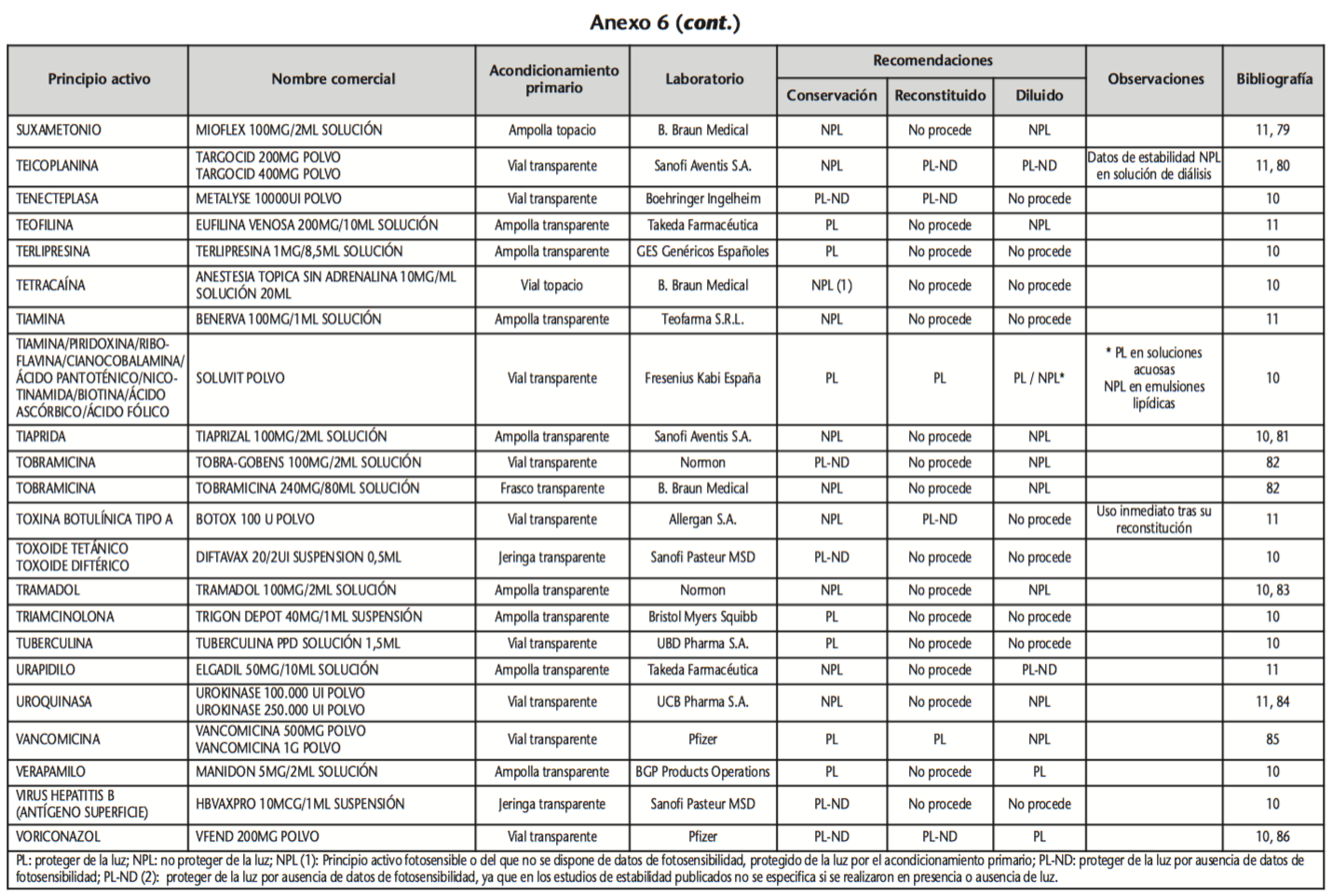
La información recopilada se recogió en seis tablas (Anexos): medicamentos de administración por vía inhalatoria (Anexo 1), tópica (Anexo 2), oftálmica y ótica (Anexo 3), formas orales líquidas (Anexo 4), formas orales sólidas (Anexo 5) y medicamentos de administración parenteral (Anexo 6). En ellas se ordenaron los medicamentos alfabéticamente por principio activo. En los Anexos 1-5 se recogió la información sobre: principio activo, nombre comercial, acondicionamiento primario, laboratorio, recomendaciones sobre protección de la luz en nuestro hospital, observaciones y bibliografía. En el Anexo 6, además, las condiciones de protección de la luz se dividieron en: conservación del medicamento en su envase original, reconstituido (si procede) y diluido (si procede).
En el caso de los medicamentos administrados por vía inhalatoria, tópica, oftálmica y ótica, y de las formas orales líquidas y los medicamentos de administración parenteral (Anexos 1-4, 6), las medidas de protección de la luz para cada medicamento se clasificaron de la siguiente manera:
– NPL (No proteger de la luz): incluye medicamentos con principios activos NO fotosensibles y medicamentos, bien con principios activos fotosensibles, o bien sin datos de fotosensibilidad protegidos por un acondicionamiento primario opaco a la luz (frasco opaco, ampolla topacio, etc.).
– Proteger de la luz (PL): incluye medicamentos con principios activos fotosensibles cuyo acondicionamiento primario no protege de la luz.
– Proteger de la luz por ausencia de datos de fotosensibilidad (PL-ND): incluye medicamentos con principios activos de los cuales no se dispone de datos de fotosensibilidad y cuyo acondicionamiento primario no protege de la luz.
En el caso de las formas orales sólidas (Anexo 5), las medidas de protección de la luz para cada medicamento se clasificaron de la siguiente manera:
– No proteger de la luz (NPL): incluye medicamentos con principios activos NO fotosensibles y medicamentos, bien con principios activos fotosensibles, o bien sin datos de fotosensibilidad protegidos por un acondicionamiento primario opaco a la luz.
– Proteger de la luz mediante reenvasado con materiales opacos (PLR): incluye medicamentos con principios activos fotosensibles o de los que no se dispone de información sobre su fotosensibilidad, y cuyo acondicionamiento primario no protege de la luz.
RESULTADOS
Se revisaron 734 medicamentos incluidos en la GFT del hospital: 17 (2,3%) medicamentos de administración por vía inhalatoria, 61 (8,3%) por vía tópica, 44 (6,0%) por vía oftálmica, 3 por vía ótica (0,4%), 26 (3,6%) formas orales líquidas, 315 (42,9%) formas orales sólidas y 268 (36,5%) medicamentos de administración parenteral. Del total de medicamentos, 225 (30,7%) contenían principios activos fotosensibles, en 165 (22,5%) no se encontraron datos, por lo que se les dio el mismo trato que a los medicamentos con principios activos fotosensibles y 344 (46,8%) no contenían principios activos fotosensibles. En cuanto a los medicamentos de administración parenteral que requieren reconstitución (80) y/o dilución (172): 73 (91,3%) y 108 (62,8%), respectivamente, precisan medidas de protección de la luz.
Como ya se apuntó en otras publicaciones, como la de Sánchez-Quiles I, et al.8, un porcentaje importante de medicamentos fotosensibles o de los que no se dispone de datos de fotosensibilidad (229; 58,6%), están comercializados con un acondicionamiento primario no adecuado que permite la exposición del fármaco a la luz.
En cuanto a las medidas de protección de la luz, para la conservación y distribución de los medicamentos se utilizan: reenvasado con materiales opacos a la luz en el caso de formas orales sólidas y bolsas opacas a la luz en el resto de formas farmacéuticas; y para la protección de la luz de mezclas intravenosas diluidas se utilizan bolsas y sistemas de administración opacos a la luz.
CONCLUSIONES
Debido a que la Ley de Garantías y Uso Racional de Medicamentos y Productos Sanitarios de 200686 no obliga a los laboratorios a realizar estudios de fotosensibilidad, estos no siempre aportan la información necesaria para la adecuada conservación de los medicamentos. Por lo tanto, y como ya se inició en una publicación anterior8, debe ser un objetivo de los servicios de farmacia realizar revisiones periódicas para mantener actualizada la información disponible y garantizar la adecuada conservación, almacenamiento, distribución, acondicionamiento y administración de los medicamentos.
Agradecimientos: A la Sociedad Valenciana de Farmacia Hospitalaria (SVFH).
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
BIBLIOGRAFÍA
1. Sammartino MP, Castrucci M, Ruiu D, Visco G, Campanella L. Photostability and toxicity of finasteride, diclofenac and naproxen under simulating sunlight exposure: evaluation of the toxicity trend and of the packaging photoprotection. Chem Cent J. 2013; 7(1):181.
2. University of Illinois at Chicago College of Pharmacy, Drug Information Group. Light-sensitive injectable prescription drugs. Hosp Pharm. 2014;49(2):136-63.
3. Tonnesen HH. Formulation and stability testing of photolabile drugs. Int J Pharm. 2001;225(1-2):1-14.
4. Baertschi SW, Clapham D, Foti C, Jansen PJ, Kristensen S, Reed RA, Templeton AC, Tønnesen HH. Implications of in-use photostability: proposed guidance for photostability testing and labeling to support the administration of photosensitive pharmaceutical products, part 1: drug products administered by injection. J Pharm Sci. 2013;102(11):3888-99.
5. ICH, Q1B. Stability testing: Photostability testing of new drug substances and products. 1996. [Accedido: 24 de Febrero de 2016] Disponible en: http://www.fda.gov/RegulatoryInformation/Guidances/.
6. Tonnesen HH. Photoreactivity of drugs. Solar Radiation and Human Health. The Norwegian Academy of Science and Letters, 2008.
7. King AR. Light-Sensitive Oral Prescription Drugs. Hosp Pharm. 2009;44(12):1112-14.
8. Sánchez-Quiles I, Nájera-Pérez MD, Espuny-Miró A, Titos-Arcos JC. Revisión de la estabilidad de los medicamentos fotosensibles. Farm Hosp. 2011;35(4):204-215.
9. Tovsen ML, Smistad G, Bjerke TM, Tønnesen HH, Kristensen S. Physicochemical Stability of Emulsions and Admixtures for Parenteral Nutrition during Irradiation by Glass-Filtered Daylight at Standardized Conditions. PDA J Pharm Sci Technol. 2015;69(3):346-54.
10. Ficha técnica. [Consultadas en el periodo: agosto 2015 – agosto 2016].
11. Información aportada por el laboratorio. [Consultadas en el periodo: agosto 2015 – agosto 2016].
12. Zhang Y, Trissel LA, Martinez JF, Gilbert DL. Stability of acyclovir sodium 1, 7, and 10 mg/ml in 5% dextrose injection and in 0.9% sodium chloride injection. Am J Health-Syst Pharm. 1998;55:574-577.
13. Trissel L. Handbook on Injectable Drugs. Publisher: American Society of Health System Pharmacist. 12th ed. 2003.
14. Chin A, Liu S, Ting-Chan J, Gill MA. Extended stability of ascorbic acid in 5% dextrose injection and 0.9% sodium chloride injection. Am J Health-Syst Pharm. 2005; 62:1073-1074.
15. Kektar VA, Kolling WM, Nardviriyakul N, VanDer Kamp K, Wurster DE. Stability of undiluted and diluted adenosine at three temperatures in syringes and bags. Am J Health-Syst Pharm. 1998;55:466-470.
16. Carr R.R, Decarie D, Ensom M.H.H. Stability of Epinephrine at Standard Concentrations. Can J Hosp Pharm. 2014;67,3:179-202.
17. Chavan E. Etude de la stabilité de solutions de prostaglandine E1 à 48 et 72 heures en vue d’une administration parentérale en continu à des patients de néonatalogie. Master en pharmacie – University of Geneva 2014.
18. Goodwin SD, Nix DE, Heyd A, Wilton JH. Compatibility of ciprofloxacin injection with selected drugs and solutions. Am J Hosp Pharm. 1991;48:2166-2171.
19. Trissel LA, Xu QA, Baker M. Drug compatibility with new polyolefin infusion solution containers. Am J Health-Syst Pharm. 2006;63:2379-2382.
20. Kambia N, Merite N, Dine T, Dupin-Spriet T, Gressier B, Luyckx M, Watinne C, Brunet C. Stability studies of amoxicillin/clavulanic acid combinaison in polyolefin infusion bags. EJHP. 2010;16,30-37.
21. Marble DA, Bosso JA, Townsend RJ. Compatibility of clindamycin phosphate with aztreonam in polypropylene syringes and with cefoperazone sodium, cefonicid sodium, and cefuroxime sodium in partial-fill glass bottles. Drug Intell Clin Pharm. 1988;22:54-57.
22. Godwin DA, Kim NH, Zuniga R. Stability of a baclofen and clonidine hydrochloride admixture for intrathecal administration. Hosp Pharm. 2001;36:950-954.
23. Sayre B.E, Prettyman T, Kaushal G. Extended Stability of Sodium Bicarbonate Infusions Prepared in Polyolefin Bags. Hosp Pharm. 2012;47,7:538-543.
24. Xu QA, Trissel LA, Saenz CA et al. Stability of three cephalosporin antibiotics in autodose infusion system bags. J Am Pharm Assoc. 2002;42:428-431.
25. Rabouan-Guyon M, Guet AF, Courtois PY, Barthes DMC. Stability study of cefepime in different infusion solutions. Int J Pharm. 1997;154:185-190.
26. Wong WW, Maderich AB, Polli GP, Ravin LJ. Stability of cefonicid sodium in infusion fluids. Am J Hosp Pharm. 1985;42:1980-1983.
27. Das Gupta V. Stability of cefotaxime sodium as determined by High-Performance Liquid Chromatography. J Pharm Sci. 1984;73:565-567.
28. O’Brien MJ, Portnoff JB, Cohen EM. Cefoxitin sodium compatibility with intravenous infusions and additives. Am J Hosp Pharm. 1979;36:33-38.
29. Viaene E, Chanteux H, Servais H, Mingeot-Leclerq MP, Tulkens PM. Comparative stability studies of antipseudomonal ß-lactams for potential administration through portable elastomeric pumps (home therapy for cystic fibrosis patients) and motor-operated syringes (intensive care units). Antimicrob Agents Chemother. 2002;46:2327-2332.
30. Kedzierewicz F, Finance C, Nicolas A, Dixneuf P, Hoffman M. Stability of parenteral ceftriaxone disodium solutions in frozen and liquid states: effect of freezing and microwave thawing. J Pharm Sci. 1989;78:73-77.
31. Faouzi A, Dine T, Luyckx M, Gressier B, Brunet C, Goudaliez F, Mallevais ML, Cazin M, Cazin JC. Stability and compatibility studies of cefaloridine, cefuroxime and ceftazidime with PVC infusion bags. Pharmazie. 1994;49:425-427.
32. Xu QA, Zhang YP, Trissel LA, Gilbert DL, Martinez JF, Fox JL. Stability of cisatracurium besylate in vials, syringes and infusion admixtures. Am J Health-Syst Pharm. 1998;55:1037-1041.
33. Marble DA, Bosso JA, Townsend RJ. Stability of clindamycin phosphate with aztreonam, ceftazidime sodium, ceftriaxone sodium, or piperacillin sodium in two intravenous solutions. Am J Hosp Pharm. 1986;43:1732-1736.
34. Kambia NK, Dine T, Dupin-Spriet T, Gressier B, Luycks M, Goudaliez F, Brunet C. Compatibility of nitroglycerin, diazepam and chlorpromazine with a new multilayer material for infusion containers. J Pharm Biomed Anal. 2005;37:259-264.
35. Walker SE, Dufour A, Iazetta J. Concentration and solution dependent stability of cloxacillin intravenous solutions. Can J Hosp Pharm. 1998;51:13-19.
36. Wallace SJ, Li J, Rayner CR, Coulthard K, Nation RL. Stability of colistin methanesulfonate in pharmaceutical products and solutions for administration to patients. Antimicrob Agents Chemother. 2008;52,9: 3047-3051.
37. Gupta VD. Chemical stability of dexamethasone sodium phosphate after reconstitution in 0.9% sodium chloride injection and storage in polypropylene syringes. Int J Pharm Compound. 2002;6:395-397.
38. Anderson C.R. Stability of dexmedetomidine 4 μg/mL in polypropylene syringes. m J Health-Syst Pharm. 2012;69:595-597.
39. Kambia NK, Dine T, Dupin-Spriet T, Gressier B, Luycks M, Goudaliez F, Brunet C. Compatibility of nitroglycerin, diazepam and chlorpromazine with a new multilayer material for infusion containers. J Pharm Biomed Anal. 2005;37:259-264.
40. Shank WA, Coupal JJ. Stability of digoxin in common large-volume injections. Am J Hosp Pharm. 1982;39:844-846.
41. Sautou-Miranda V, Gremeau I, Chamard I, Cassagnes J, Chopineau J. Stability of dopamine hydrochloride and of dobutamine hydrochloride in plastic syringes and administration sets. Am J Health-Syst Pharm. 1996;53:186.
42. Williams OA, Middleton M, Henderson P, Reilly CS. Stability of morphine and droperidol separetely and combined, for use as an infusion. Hosp Pharm Pract. 1992;2,9:597-600.
43. Baaske DM, Dyskstra SD, Wagenknecht DM, Karnatz NN. Stability of esmolol hydrochloride in intravenous solutions. Am J Hosp Pharm. 1994;51:2693-2696.
44. Kiser TH, Oldland AR, Fish DN. Stability of phenylephrine hydrochloride injection in polypropylene syringes. Am J Health-Syst Pharm. 2007;64,10:1092-1095.
45. Fischer JH, Cwik MJ, Luer MS, Sibley CB, Deyo KL. Stability of fosphenytoin sodium with intravenous solutions in glass bottles, polyvinyl chloride bags, and polypropylene syringes. Ann Pharmacotherapy. 1997;31:553-559.
46. Nahata MC, Hipple TF, Strausbaugh SD. Stability of phenobarbital sodium diluted in 0.9% sodium chloride injection. Am J Hosp Pharm. 1986;43:384-385.
47. Kowalski SR, Gourlay GK. Stability of fentanyl citrate in glass and plastic containers and in a patient-controlled delivery system. Am J Hosp Pharm. 1990;47:1584-1587.
48. Donnelly RF. Chemical stability of furosemide in minibags and polypropylene syringes. Int J Pharm Compound. 2002;6:468-470.
49. Goodwin SD, Nix DE, Heyd A, Wilton JH. Compatibility of ciprofloxacin injection with selected drugs and solutions. Am J Hosp Pharm. 1991;48:2166-2171.
50. Zeidler C, Dettmering D, Schrammel W, Spieteller M. Compatibility of various drugs used in intensive care medicine in polyethylene, PVC and glass infusion containers. EJHP. 1999;5:106-110.
51. Rigge DC, Jones MF. Shelf lives of aseptically prepared medicines – stability of hydrocortisone sodium succinate in PVC and non-PVC bags and in polypropylene syringes. J Pharm Biomed Anal. 2005;38:332-336.
52. Zeidler C, Dettmering D, Schrammel W, Spieteller M. Compatibility of various drugs used in intensive care medicine in polyethylene, PVC and glass infusion containers. EJHP. 1999;5:106-110.
53. Fleury-Souverain S, Sigrist T, Griffiths W, Ing H, Matthey B; Sadeghipour F, Bonnabry P. The stability of soluble insulin in plastic syringes. EJHP Science. 2011;1:3-6.
54. Lau MH, Hackman C, Morgan DJ. Compatibility of ketamine and morphin injections. Pain. 1998;75:389-390.
55. Floy BJ, Royko CJ, Fleitman JS. Compatibility of ketorolac tromethamine injection with common infusion fluids and administration sets. Am J Hosp Pharm. 1998;47:1097-1100. 1990
56. Jäppinen A, Turpeinen M, Kokki H, ,Rasi A, Ojanen T, Pelkonen O, Naaranlahti T. Stability of sufentanil and levobupivacain solutions and a mixture in a 0.9% sodium chloride infusion stored in polypropylene syringes. Eur J Pharm Sci. 2003;19,1:31-36.
57. Trittler R, Hecklinger J. Aliquotierte Levosimendanlösungen – stabil?. ADKA Congress, Dresden, Germany 2013.
58. Strong DK, Decarie D, Ensom MHH. Stability of Levothyroxine in Sodium Chloride for IV Administration. Can J Hosp Pharm. 2011;63,6:437-443.
59. Manley HJ, McClaran ML, Bedenbaugh A, Peloquin CA. Linezolid stability in peritoneal dialysis solutions. Perit Dial Int. 2002;22:419-422.
60. Walker SE, Varrin S, Yannicelli D, Law S. Stability of meropenem in saline and dextrose solutions and compatibility with potassium chloride. Can J Hosp Pharm. 1998;51:156-168.
61. Lux M, Vigneron J, Perrin A, Hoffman MA, Hoffman M. Etude de stabilité de solutions de mesna destinées à la perfusion. J Pharm Clin. 1995;14:160-161.
62. Denson DD, Crews JC, Grummich KW, Stirm EJ, Sue CA. Stability of methadone hydrochloride in 0.9% sodium chloride injection in single-dose plastic containers. Am J Hosp Pharm. 1991;48:515-517.
63. Müller H-J, Berg J. Stabilitätsstudie zu metamizol-natrium im PVC-infusionbeutel. Krankenhauspharmazie. 1998;19:229-234.
64. Trissel LA, Zhang Y. Stability of methylprednisolone sodium succinate in autodose infusion system bags. J Am Pharm Assoc. 2002;42:868-870.
65. Hagan RL, Jacobs III LF, Pimsler M, Merritt GJ. Stability of midazolam hydrochloride in 5% dextrose injection or 0.9% sodium chloride injection over 30 days. Am J Hosp Pharm. 1993;50:2379-2381.
66. Vecchio M, Walker SE, Iazzetta J, Hardy BG. The stability of morphine intravenous infusion solutions. Can J Hosp Pharm. 1988;41:5-9.
67. Zeidler C, Dettmering D, Schrammel W, Spieteller M. Compatibility of various drugs used in intensive care medicine in polyethylene, PVC and glass infusion containers. EJHP. 1999;5:106-110.
68. D’Arcy PF. Stability of glyceryl trinitrate in plastic and glass containers. Pharm Int. 1985;6:7.
69. Sewell GJ, Forbes DR, Munton TJ. The stability of sodium nitroprusside infusion during administration by motorized syringe-pump. J Clin Hosp Pharm. 1985;10:351-360.
70. Peddicord TE, Olsen KM, ZumBrunnen TL, Warner DJ, Webb L. Stability of high-concentration dopamine hydrochloride, norepinephrine bitartrate, epinephrine hydrochloride, and nitroglycerin in 5% dextrose injection. Am J Health-Syst Pharm. 1997;54:1417-1419.
71. Casto DT. Stability of ondansetron stored in polypropylene syringes. Ann Pharmacotherapy. 1994;28:712-714.
72. Amri A, Achour AB, Chachaty E, Mercier L, Bourget P, Paci A. Microbiological and Physicochemical Stability of Oxycodone Hydrochloride Solutions for Patient-Controlled Delivery Systems. J Pain Symptom Manage. 2010;40,1:87-94.
73. Strong ML, Schaaf LJ, Pankaskie MC, Robinson DH. Shelf-lives and factors affecting the stability of morphine sulphate and meperidine (pethidine) hydrochloride in plastic syringes for use in patient-controlled analgesic devices. J Clin Pharm Ther. 1994;19:361-369.
74. Donnelly R.F. Stability of aseptically prepared Tazocin solutions in polyvinyl chloride bags. Can J Hosp Pharm. 2009;62,3:226-231.
75. Raymond GG, Reed MT, Teagarden JR, Story K, Geberbauer CW. Stability of procainamide hydrochloride in neutralized 5% dextrose injection. Am J Hosp Pharm. 1988; 45: 2513-2517.
76. Dupuis LL, Wong B, Trope A. Stability of propafenone hydrochloride in IV solutions. Am J Health-Syst Pharm. 1997;54:1293-1295.
77. Sautou-Miranda V, Levadoux E, Groueix MT, Chopineau J. Compatibility of propofol diluted in 5% glucose with glass and plastics (polypropylene, molyvinylchloride) containers. Int J Pharm. 1996;130:251-255.
78. Galante LJ, Stewart JT, Warren FW, Johnson SM, Duncan R. Stability of ranitidine hydrochloride at dilute concentration in intravenous infusion fluids at room temperature. Am J Hosp Pharm. 1990;47:1580-1584.
79. Storms ML, Stewart JT, Warren FW. Stability of succinylcholine chloride injection at ambient temperature and 4°C in polypropylene syringes. Int J Pharm Compound. 2003;7:68-70.
80. Manduru M, Fariello A, White RL, Fox JL, Bosso JA. Stability of ceftazidime sodium and teicoplanin sodium in a peritoneal dialysis solution. Am J Health-Syst Pharm. 1996;53:2731-2734.
81. Otero F.M. Estudio de estabilidad de tiaprida en disolución para administración en perfusión intravenosa continua. Farm Hosp. 2013;37,1:10-14
82. Zbrozek AS, Marble DA, Bosso JA, Bair JN, Townsend RJ. Compatibility and stability of clindamycin phosphate – aminoglycoside combinations within polypropylene syringes. Drug Intell Clin Pharm. 1987;21:806-810.
83. Müller H-J, Berg J. Stabilitätsstudie zu tramadolhydrochlorid im PVC-infusionbeutel. Krankenhauspharmazie. 1997;18:75-79.
84. Patel JP, Tran LT, Sinai WJ, Carr LJ. Activity of urokinase diluted in 0.9% sodium chloride injection or 5% dextrose injection and stored in glass or plastic syringes. Am J Hosp Pharm. 1991;48:1511-1514.
85. Sahraoui L, Chiadmi F, Schlatter J, Toledano A, Cisternino S, Fontan JE. Stability of voriconazole injection in 0.9% sodium chloride and 5% dextrose injections. Am J Health-Syst Pharm. 2006;63:1423-1426.
86. Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios. BOE núm. 178, de 27 de julio de 2006.
Abrir PDF con los anexos: Recomendaciones para garantizar la estabilidad de medicamentos fotosensibles
____
Descargar artículo PDF: Recomendaciones para garantizar la estabilidad de medicamentos fotosensibles
