Aragonès Eroles AM1, Schoenenberger Arnaiz JA2, Cano Marrón SM2, Puig Ganau T2, Morales Portillo A2, Manonelles Fernández A2
1 IRB Lleida. Fundació Privada Dr. Pifarré. Lleida (España)
2 Hospital Universitari Arnau de Vilanova. Lleida (España)
Fecha de recepción: 25/11/2019 – Fecha de aceptación: 09/12/2019
Correspondencia: Ana M. Aragonès Eroles – IRB Lleida Hospital – Universitari Arnau de Vilanova – Avda. Alcalde Rovira Roure, 80 – 25198 Lleida (España)
anaragones@gmail.com
____
RESUMEN
El objetivo del presente trabajo es evaluar si existe relación entre los niveles plasmáticos de efavirenz y la aparición de dislipemia como hipercolesterolemia, hipretrigliceridemia o aumento de LDL-c.
Se realizaron niveles plasmáticos de efavirenz a los pacientes en tratamiento con este fármaco desde septiembre de 2012 hasta junio de 2015. Se registraron los parámetros lipídicos correspondientes a cada analítica. Las determinaciones de efavirenz se realizaron mediante cromatografía líquida de alta eficacia. Los datos se manejaron mediante el programa Quick Statistics Calculator y Excel 2007.
Los niveles plasmáticos de efavirenz superiores a 4.000 ng/ml se asocian en nuestro estudio con una mayor frecuencia de niveles de colesterol superiores a 200 mg/dl.
Este estudio puede ser de utilidad para aquellas zonas en las que usen pautas de tratamiento con este fármaco de manera frecuente.
Palabras clave: Efavirenz, dislipemia, cromatografía, reacción adversa, monitorización terapéutica de fármacos.
Efavirenz plasma levels and dyslipidemia
SUMMARY
The aim of this study is to evaluate if there is a relationship between plasma levels of efavirenz and the occurrence of dyslipidemia such as hypercholesterolemia, hypretrigiceridemia or increased LDL-c.
Plasma levels of efavirenz were performed to patients under treatment with this drug during the period from September 2012 to June 2015. Lipid parameters corresponding to each analytical were recorded. Determinations of efavirenz were analyzed by high performance liquid chromatography. Data were managed using the Quick Statistics Calculator and Excel 2007 program.
Plasma levels of efavirenz higher than 4,000 ng/ml were associated, in our study, with a higher frequency of cholesterol levels higher than 200 mg/dl.
This study may be useful to those areas where treatment guidelines with this drug are used on a frequent basis.
Key Words: Efavirenz, dyslipidemia, adverse drug reaction, therapeutic drug monitoring.
____
INTRODUCCIÓN
La instauración del tratamiento antirretroviral de larga eficacia (TAR)1, ha disminuido la morbimortalidad asociada a la infección del virus de la inmunodeficiencia humana (VIH) y ha mejorado significativamente el estatus inmunológico de la población infectada, transformando esta infección en una enfermedad manejable con una marcada mejora en su pronóstico.
El hecho de que la infección por VIH se haya convertido en una enfermedad crónica controlable, hace que una de las preocupaciones sean las comorbilidades asociadas a la propia infección y los efectos secundarios del tratamiento a largo término1,2, ya que comprometen la calidad de vida y la adherencia al tratamiento por parte del paciente.
Desde principios de la década de los años 2000, la búsqueda de tratamientos más sencillos y con menos efectos adversos como alternativas al TAR triple ha sido un objetivo, como se evidencia en las recomendaciones de GESIDA/PNS, y en menor medida en las guías europeas y norteamericanas3.
Por otro lado, es preciso asegurar un adecuado cumplimiento debido a la posibilidad de aparición de resistencias en casos de tratamiento subóptimo.
Se han utilizado diferentes estrategias de tratamiento, y uno de los logros más importantes ha sido que en muchos casos se pueda administrar la medicación una sola vez al día.
Aunque recientemente las pautas recomendadas para tratamiento de inicio han cambiado y ya no incluyen a los análogos no nucleósidos de la transcriptasa inversa (ANNTI) inicialmente comercializados4, muchos pacientes siguen en tratamiento con esta clase de fármacos que seguirán siendo muy utilizados si el acceso a las pautas recomendadas no es posible.
Entre los efectos adversos producidos por estos fármacos, son frecuentes la toxicidad hepática y en general las alteraciones metabólicas (sobre todo cambios en el perfil lipídico).Entre las alteraciones metabólicas, se incluyen la hipercolesterolemia, aumento del HDL-c, del LDL-c y VLDL-c, la hipertrigliceridemia, la resistencia a la insulina asociada o no a diabetes mellitus, hiperlactacidemia y acidosis láctica, alteraciones óseas como osteopenia, osteoporosis y osteonecrosis5-8 .Marzolini et al. describieron una mayor incidencia de efectos adversos a nivel de SNC relacionado con los niveles plasmáticos de efavirenz (EFV) superiores a 4.000 ng/ml9.
En los últimos años se han incorporado nuevos fármacos y nuevas familias al arsenal antirretroviral, cuya toxicidad tanto a corto como a largo plazo es mucho menor que la de los antirretrovirales de primera generación. En el desarrollo de nuevos fármacos con menos toxicidad, así como en el conocimiento de los determinantes genéticos de la toxicidad farmacológica, es donde residen las mayores esperanzas para minimizar la toxicidad secundaria al TAR10.
Los fármacos antirretrovirales, son fármacos que presentan una alta variabilidad interindividual en sus niveles plasmáticos11, por esta razón, resulta interesante monitorizar sus niveles para verificar que la concentración obtenida se mantiene dentro de un margen terapéutico (entre una concentración mínima capaz de inhibir la replicación viral y una concentración que se relacionaría con la aparición de efectos adversos). El objetivo de monitorizar los fármacos antirretrovirales y fármacos en general, es obtener niveles constantes en el plasma de un determinado paciente dentro de un intervalo de referencia12,13, modificando la dosis, interrogando sobre la correcta toma del fármaco, o valorando los posibles factores que interfieran en su farmacocinética.
Se han observado incrementos en el colesterol total del 10-20% en voluntarios no infectados tratados con TAR, así como algunos incrementos moderados de los niveles séricos de triglicéridos, a corto plazo14.
No existe evidencia de que por encima de una determinada concentración plasmática de EFV, existan más dislipemias, aunque basándonos en nuestra experiencia en datos no publicados, apreciamos una tendencia a que la dislipemia esté presente hasta en un 50% más de pacientes con niveles de EFV superiores a 4.000 ng/ml.
Con el presente trabajo, hemos querido investigar si existe una relación entre las concentraciones de EFV y la presencia de dislipemia, teniendo en cuenta los parámetros más fácilmente accesibles en una analítica general como son el colesterol total, los triglicéridos y el LDL-c7.
MATERIAL Y MÉTODOS
Tipo de estudio
Se trata de un estudio observacional prospectivo, de una cohorte de pacientes que recibían tratamiento antirretroviral con EFV como fármaco de potencia en un hospital de nivel II. El periodo observacional se situó desde septiembre de 2012 hasta junio de 2015.
Pacientes
Todos los pacientes en tratamiento con EFV durante este periodo, así como los que iniciaron la terapia, eran candidatos potenciales a entrar en el estudio. A los pacientes debían habérseles realizado, por lo menos, dos determinaciones de niveles plasmáticos de efavirenz, para lo cual, se valoró su histórico. Los pacientes a los que no se había realizado nunca ningún nivel plasmático, se les realizó un mínimo de dos para ser incluidos en el estudio.
Se realizó también una entrevista inicial para detallar las siguientes variables: tiempo desde el inicio del tratamiento hasta la primera determinación, tratamiento concomitante, existencia de problemas de hiperlipemia, problemas cardiovasculares y efectos adversos a nivel de SNC.
Para la valoración de las alteraciones lipídicas se tuvieron en cuenta los valores obtenidos el día de la extracción.
Se consideraron criterios de exclusión si la determinación realizada al paciente no se correspondía entre las 8 y las 20 horas post toma, aquellos pacientes de los que se desconociera la fecha de inicio del tratamiento o pacientes menores de 18 años.
Todos los pacientes firmaron un consentimiento informado.
Manejo de las muestras
Las extracciones sanguíneas para las determinaciones de los niveles plasmáticos de EFV y parámetros lipémicos se realizaron en una extracción matutina durante la rutina normal de control de los pacientes. Las muestras se almacenaron a -20ºC hasta el análisis. La medida de los niveles plasmáticos se realizó con una versión modificada de un método analítico por cromatografía líquida en fase reversa15,16, que demostró ser exacto y preciso en las series intradía e interdía de tres niveles de control de calidad, con un error relativo de 0,3% a 3,2% de las concentraciones nominales de efavirenz, y con un rango de imprecisión intradía de 1,6% a 5,7% e interdía de 2,3% a 6,3%. El límite de cuantificación se situaba en 100 ng/ml. Nuestro laboratorio participa desde el año 2006 en el programa de control externo de calidad KKGT anti-VIH (Dutch Association for Quality Assessment in Therapeutic Drug Monitoring and Clinical Toxicology of the Radbound University Medical Centre Nijmen)17.
Análisis estadístico
Se utilizó la hoja de cálculo Excel 2007 para realizar los cálculos descriptivos y de dispersión, y para la creación de gráficos.
Se utilizó el programa gratuito Quick Statistics Calculator (www.socscistatistics.com), para realizar los estudios comparativos necesarios entre las variables.
RESULTADOS
– Demográficos: 63 pacientes, de los cuales 47 (74,6%) eran hombres y 16 (25,39%) eran mujeres. 46 pacientes (73%) eran de raza caucasiana, 14 (22,22%) de raza negra y un paciente era latino (1,5%)
La media de edad a la entrada del paciente en el estudio se situaba en 44,6 años con una desviación estándar de ± 11,4 años.
– Determinaciones niveles efavirenz y distribución según demografía: se realizaron 185 determinaciones en 63 pacientes. 173 de las cuales disponían de determinación de colesterol en esa misma analítica, 173 de triglicéridos y 167 de LDL.
El número de determinaciones de niveles de EFV por paciente fue de 2,92±1,08.
El promedio de tiempo entre determinaciones fue de 356±308 días.
Dos de las determinaciones se situaron por debajo del límite de cuantificación de 100 ng/ml.
El rango de determinaciones plasmáticas (sin tener en cuenta las dos mencionadas anteriormente) se situaba desde 430 ng/ml a 14.600 ng/ml, y su media era de 4.039,7 ±2.505,2 ng/ml.
El coeficiente de correlación edad – niveles plasmáticos fue de 0,07701.
La distribución de las concentraciones plasmáticas según la edad de los pacientes se refleja en la tabla 1 donde se observa una media de niveles más altos en la franja de edad de 51-60 años.
La distribución de las concentraciones (promedio ± SD en ng/ml) según raza y sexo se observa en la tabla 2. El promedio de niveles más altos se da en hombres de raza negra.
– Distribución de los niveles de parámetros lipémicos: la distribución se observa en la tabla 3.
El promedio de niveles de colesterol, triglicéridos y LDL fueron de 180,33±44,17, 135,43±110,43 y 107,45±40,37 mg/dl respectivamente.
– Relación niveles EFV con las variables estudiadas: el promedio de tiempo desde el inicio del tratamiento hasta la entrada en el estudio, se situaba en 63,5±46 meses. La correlación entre el tiempo desde el inicio del tratamiento y las medias de los niveles plasmáticos fue de -0,02917.
Las correlaciones entre las medias de las concentraciones de colesterol, triglicéridos y LDL-c y el tiempo desde el inicio del tratamiento fueron respectivamente -0,044, -0,037 y -0,0204.
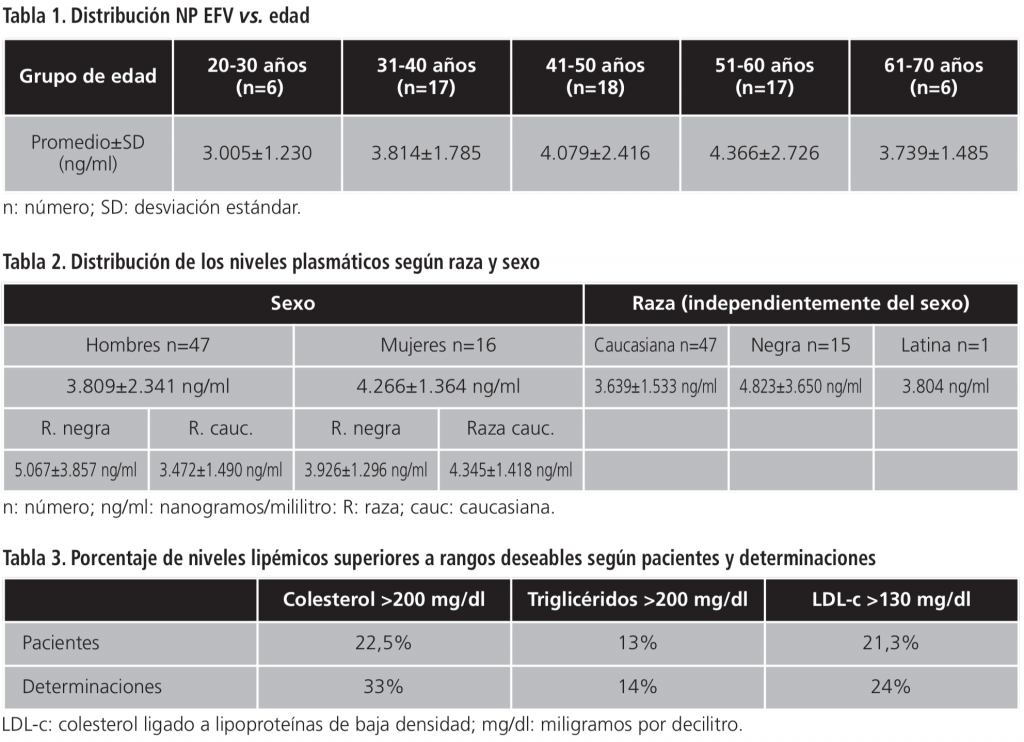
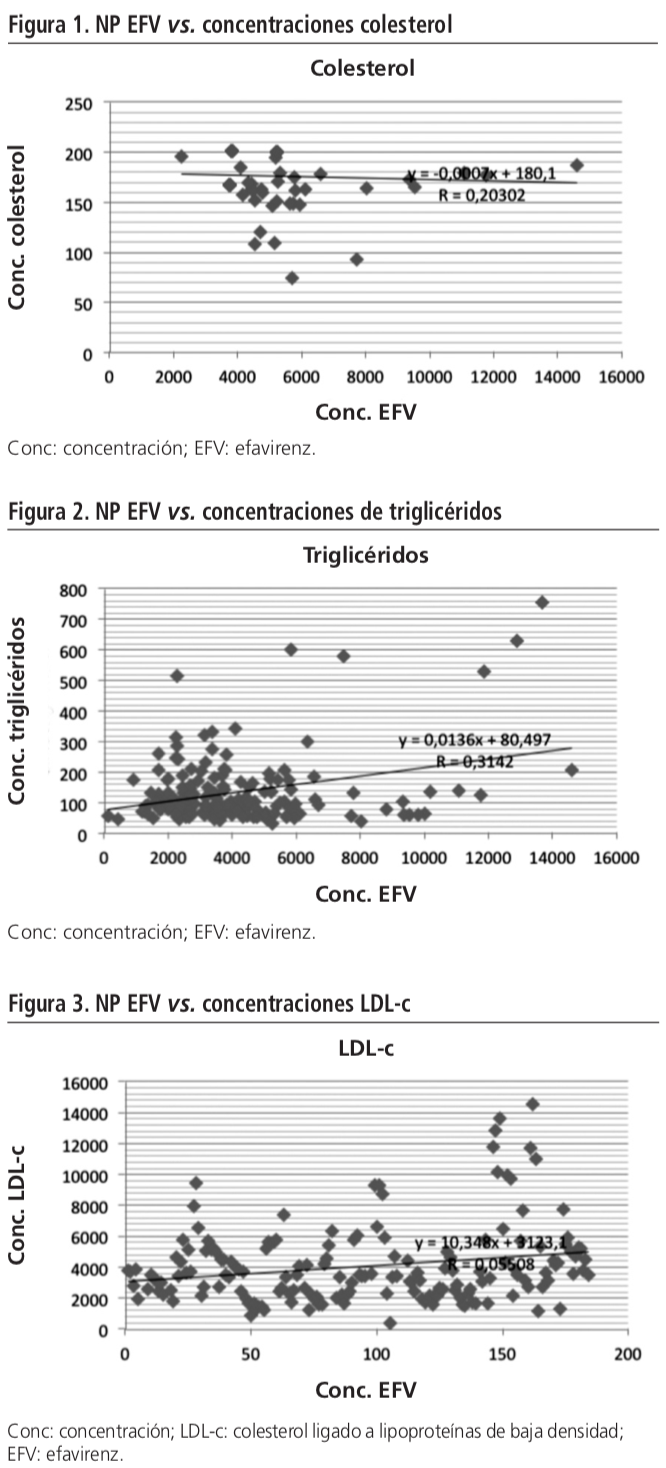
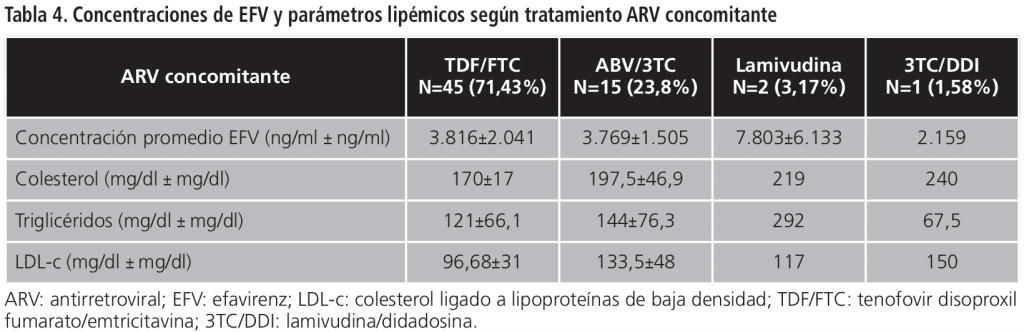
Los coeficientes de correlación entre nivel de EFV y nivel de colesterol, triglicéridos y LDL-c fueron respectivamente 0,203027, 0,31425 y 0,05508. (Figuras 1, 2 y 3)
Evaluamos la probabilidad de que siendo el nivel plasmático de efavirenz superior a 4.000 ng/ml, el paciente tuviera algún tipo de alteración lipémica, siendo el resultado no significativo. Enfrentamos posteriormente los niveles plasmáticos superiores a 4.000 ng/ml a los diferentes parámetros lipémicos. Se aplicó la prueba de Chi cuadrado siendo el resultado significativo para colesterol >200 mg/dl (para p<0,05, Chi cuadrado 7,96, p-valor 0,04), independientemente de si los pacientes en aquel momento llevaban tratamiento hipolipemiante o no. No fue significativo en el caso de triglicéridos (>200 mg/dl) y LDL-c (>130 mg/dl).
El riesgo de que los niveles de colesterol fueran superiores a 200 mg/dl cuando los niveles plasmáticos de fármaco eran superiores a 4.000 ng/ml fue del 42,8%, mientras que cuando los niveles plasmáticos de fármaco eran inferiores a 4.000 ng/ml era del 21,69%. El riesgo relativo se situó en 1,97.
– Grupos según tratamiento concomitante:
Otros antirretrovirales
En la tabla 4 se reflejan los promedios de las concentraciones plasmáticas de efavirenz según el tratamiento antirretroviral concomitante, así como las concentraciones de parámetros lipémicos correspondientes.
No se encontró correlación entre los niveles plasmáticos de efavirenz y los parámetros lipídicos en el grupo con TDF/FTC, ni relación significativa entre los niveles superiores a 4.000 ng/ml y los niveles de lípidos superiores a los niveles de corte.
Sí se encontró correlación en el grupo en tratamiento con abacavir/lamivudina para los tres parámetros analíticos (Figura 4).

Tratamiento hipolipemiante
En la figura 5 se observa la distribución de niveles plasmáticos de EFV y de parámetros lipémicos, según los pacientes tomaran o no tratamiento hipolipemiante. Entre paréntesis coeficiente de correlación NP EFV vs. parámetros lipémicos.

Evaluamos la probabilidad de que siendo el nivel plasmático de efavirenz superior a 4.000 ng/ml, el nivel de colesterol fuera superior a 200 mg/dl en el grupo de pacientes sin tratamiento hipolipemiante. Se aplicó la prueba de Chi cuadrado siendo el resultado no significativo (para p<0,05). No lo fue tampoco para triglicéridos (>200 mg/dl) y LDL-c (>130 mg/dl).
Tampoco fueron significativas estas relaciones en el grupo de pacientes en tratamiento hipolipemiante.
– Otros efectos adversos: un 26,9% (n=17) de los pacientes presentó efectos adversos al inicio del tratamiento, 94% de los cuales referían al sistema nervioso central, siendo los trastornos del sueño (56%) los más frecuentes. Los efectos adversos cedieron en todos los pacientes, salvo en uno. No se observó una relación significativa entre la aparición de efectos adversos y los niveles plasmáticos de EFV.
– Eventos cardiovasculares: en el momento de entrar en el estudio, un 23,8% refirió haber tenido algún evento cardiovascular. 9 pacientes (60%) HTA, 3 (20%) IAM, 4 pacientes refirieron algún evento trombótico (26,6%), dos de ellos conjuntamente con hipertensión arterial.
No había relación significativa entre la aparición de problemas cardiovasculares y los niveles plasmáticos superiores a 4.000 ng/ml.
Se evaluó esta relación para los subgrupos de pacientes tratados con TDF/FTC o abacavir/lamivudina. No hubo ningún paciente con los niveles de EFV >4.000 ng/ml y eventos cardiovasculares en el primer grupo. En el segundo grupo (n=15) había cuatro pacientes (33,33% del grupo) que sí tenían niveles elevados con evento cardiovascular, pero no existía una relación significativa para una p<0,05.
DISCUSIÓN
El control de la dislipemia es un factor importante para la prevención de problemas cardiovasculares (HTA, cardiopatía isquémica).Estos problemas aparecen más frecuentemente en la población infectada por el VIH con o sin tratamiento1,2. El detectar y tratar los factores externos que pueden influir en la aparición de dislipemia, pueden ayudar a que la morbimortalidad por enfermedad cardiovascular disminuya.
Nuestro estudio demuestra que existe una correlación entre los niveles plasmáticos de efavirenz y los de colesterol y triglicéridos (0,203027 y 0,31425 respectivamente), que se refuerza en el grupo de pacientes que habían precisado tratamiento hipolipemiante (0,479 y 0,636 para colesterol y triglicéridos), lo que nos hace pensar que los niveles plasmáticos de fármaco tuvieron un papel en el aumento de los niveles de estos parámetros.
El segundo punto importante a tener en cuenta, es que por encima de 4.000 ng/ml, la aparición de niveles de colesterol superiores a 200 mg/dl es significativa, con un riesgo relativo de 1,97. Hemos situado este nivel de corte para efavirenz para seguir la línea inicial de Marzolini et al.9, que situaba en este nivel de corte la aparición de efectos adversos a nivel de sistema nervioso central.
La frecuencia de dislipemia en la literatura se sitúa alrededor de un 70%18 de los pacientes en TAR. Teniendo en cuenta el porcentaje de pacientes tratados con hipolipemiantes respecto al total de pacientes (20,6%), y que existían 12 pacientes que no recibían tratamiento hipolipemiante pero presentaban alguna alteración lipémica (19,04%), nos situaría en un 39,6% del total. Probablemente sería determinante que el tratamiento con ANNTI es menos aterogénico que el tratamiento con inhibidores de la proteasa19.
Respecto a la medicación antirretroviral concomitante, los niveles de colesterol, triglicéridos y LDL-c son más altos en el grupo tratado con abacavir/lamivudina.
En los resultados del estudio DAD20, se asociaba un mayor riesgo de infarto a los pacientes que habían sido tratados con abacavir y didanosina. Carecemos de datos para postular que los niveles de lípidos pudieran tener algún papel en estos resultados.
También existe una correlación positiva en este grupo de pacientes entre el nivel plasmático de EFV y los parámetros lipémicos, que nos podría orientar a que los niveles plasmáticos de EFV jugarían un papel potenciador de la dislipemia.
Existen trabajos que revelan aumento a nivel de lipoproteínas después del inicio de TAR5, pero no se han evaluado referidos a un nivel de corte de fármaco determinado. Creemos que éste es un factor importante, ya que nos permite incidir en el tratamiento del paciente, manteniendo al fármaco dentro de un margen terapéutico que pueda ayudar a una aparición más tardía, a una menor severidad e incluso a una disminución de los lípidos aplicando el TDM.
Curiosamente, en nuestro estudio, no hallamos una relación significativa entre la referencia por parte del paciente de efectos adversos a nivel del SNC al inicio del tratamiento y los niveles plasmáticos por encima de 4.000 ng/ml, probablemente debido a que la mayoría de pacientes ya llevaban tiempo en tratamiento, y se hubiese evaluado mejor este factor, si el nivel plasmático se hubiera realizado en cuanto el paciente hubiera llegado al estado de equilibrio del fármaco. También hay que tener en cuenta que para evaluarlo, se utilizaron los promedios de los niveles de los pacientes frente a si existieron o no efectos adversos.
Una vez valorados todos los datos, podemos concluir que los pacientes que más se beneficiarían del TDM serían aquellos de edad entre 40-60 años, de raza negra, en tratamiento concomitante con abacavir/lamivudina y que ya han requerido tratamiento hipolipemiante.
CONCLUSIÓN
Los niveles plasmáticos de efavirenz superiores a 4.000 ng/ml se asocian en nuestro estudio con una mayor frecuencia de niveles de colesterol superiores a 200 mg/dl. El mantener las concentraciones de este fármaco por debajo de esta concentración plasmática podría disminuir la aparición de hipercolesterolemia y la prescripción de tratamientos hipolipemiantes, con la consiguiente disminución de efectos adversos derivados de éstos últimos y el poder disponer durante más tiempo de un mayor arsenal terapéutico.
Se deberían monitorizar las concentraciones del fármaco y realizar una vigilancia de la adherencia al tratamiento dado el bajo umbral de resistencias de efavirenz.
Dado que los ANNTI han dejado de ser tratamiento de primera línea, estos datos pueden ser interesantes para aquellas situaciones en las que no se tenga un fácil acceso a las nuevas terapias antirretrovirales.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Bindu H, Anusha N. Adverse Effects of Highly Active Anti-Retroviral Therapy (HAART). J Antivir Antiretrovir. 2011,3-4.
2. Geldres Molina, F. “Niveles de Perfil lipídico en pacientes con VIH-SIDA en tratamiento con efavirenz y atazanavir”. ESSALUD. LA LIBERTAD. 2005 – 2016” Universidad Privada Antenor Orrego. Facultad de Medicina. Escuela profesional de medicina Humana. Tesis para obtener el Título de Médico Cirujano. Trujillo – Perú 2017.
3. Ribera E., Martínez-Sesmerob J.M., Sánchez-Rubioc, J., Rubiod, R., Pasquaue, J., Povedaf, J.L., et al. Impacto económico asociado a la implementación de las recomendaciones con grado de evidencia A-I del documento de consenso de GeSIDA/PNS (2015) relativas a la optimización del tratamiento antirretroviral en adultos infectados por virus de la inmunodeficiencia humana con carga viral suprimida en España. Enfermedades Infecciosas y Microbiología Clínica. Vol. 36. Núm. 3. Marzo 2018 páginas 149-206.
4. Documento de Consenso de GeSIDA/Plan Nacional sobre el SIDA respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana (Actualización enero 2018).
5. Rosenkranz, S.L., Yarasheski, K., Para, M., Reichman, R., Morse, G., Antiretroviral drug levels and interactions affect lipid, lipoprotein and glucose metabolism in HIV-1 exonerative subjects: A pharmacokinetic-pharmacodynamic analysis. Metab Syndr Disord Relat. 2007 June; 5(2):163-173.
6. Back David J, Saye H Khoo. The Role of Therapeutic Drug Monitoring in the Management of HIV Infection. European Infectious Disease. Touch Briefings 2008. HIV and AIDS 23-30.
7. Stein J., Komarow L., Cotter B, Currier J., Dubé M., Fichtenbaum C., et al. Parker: Lipoprotein changes in HIV-Infected Antiretroviral-Naïve Individuals after starting Antiretroviral Therapy: ACTG Study A5152s Stein: Lipoprotein changes on antiretroviral therapy. J Clin Lipidol. 2008 December; 2(6):464-471. Doi: 10.1016/j.jacl.2008.08.442.
8. G Yimer, W Amogne, A Habtewold, E Makonnen, N Ueda , A Suda , A Worku, WE Haefeli, J Burhenne, G Aderaye, L Lindquist and E Aklillu. High plasma efavirenz level and CYP2B6*6 are associated with efavirenz-based HAART-induced liver injury in the treatment of naïve HIV patients from Ethiopia: a prospective cohort study The Pharmacogenomics Journal (2012)12,499-506.
9. Marzolini C, Telenti A, Decosterd L, Greubb G, Biollaza J, and Buclin. Efavirenz plasma levels can predict treatment failure and central nervous system side effects in HIV-1-infected patients. AIDS 2001, vol. 15 no1.71-75.
10. Domingo P, Lozano F. Manejo de la toxicidad por fármacos antirretrovirales. Enfermedades Infecciosas y Microbiología Clínica. 2011,29(7):535-544.
11. van Luin M, Gras L, Richter C, van der Ende ME, Prins JM, de Wolf F, Burger DM, Wit FW. Efavirenz dose reduction is safe in patients with high plasma concentrations and may prevent efavirenz discontinuations. J Acquir Immune Defic Syndr. 2009 Oct 1;52(2):240-5. Doi:10.1097/QAI.0b013e3181b061e6.
12. Pérez Elias MJ. Utilidad clínica de la determinación de resistencias y la concentración de fármacos antirretrovirales. Capítulo 4 Actualización en terapia Antirretroviral (Web).
13. Ju-Seop Kang and Min-Ho Lee Overview of Therapeutic Drug Monitoring. The Korean Journal of Internal Medicine Vol. 24, No. 1, March 2009.
14. Efavirenz. Ficha técnica.
15. P WH Hugen, CPWGM Verwey-van Wissen, DM Burger, EW Wuis, PP Koopmans, and YA Hekster. Simultaneous determination of the HIV-protease inhibitors indinavir, nelfinavir, saquinavir and ritonavir in human plasma by reversed- phase high-performance liquid chromatography. J Chromatogr B Biomed Sci Appl. 1999;727:139-149.
16. Sarasa-Nacenta M, López-Púa Y, Mallolas J, Blanco JL, Gatell, JM, Carne X. Simultaneous determination of the HIV-protease inhibitors indinavir, amprenavir, ritonavir, saquinavir and nelfinavir in human plasma by reversed phase high performance-liquid-chromatography. J Chromatogr B Biomed Sci Appl. 2001; 757:325-332.
17. Droste JAH, Aarnoutse RE, Koopmans PP, Hekster YA, Burger DM. Evaluation of antiretroviral drug measurements by an interlaboratory quality control program. J Acquir Immune Defic Syndr. 2003;32:287-291.
18. Maria Clara A Silva, Maria Goretti PA Burgos, Rafaella A Silva. Alterações Nutricionais e Metabólicas em Pacientes com Aids em Uso de Terapia Antirretroviral DST – J bras Doenças Sex Transm. 2010;22(3):118-122.
19. van Leth F, Phanuphak P, Stroes E, Gazzard B, Cahn P, Raffi F, et al. Nevirapine and Efavirenz Elicit Different Changes in Lipid Profiles in Antiretroviral-Therapy-Naive Patients Infected with HIV-1. PLoS Medicine http://www. plosmedicine.org October 2004 Volume 1, Issue 1. e19.
20. The DAD Writing Committee. Cardio-and cerebrovascular events in HIV-infected persons. AIDS 18:1811-1817,2004.
____
