de Gorostiza Frías C1, Ramírez Cruz S2, Peña Cabia S2, García Díaz B2
1 Servicio de Farmacia. Hospital Universitario Fundación Jiménez Díaz. Madrid (España)
2 Servicio de Farmacia. Hospital Universitario Severo Ochoa. Leganés. Madrid (España)
Fecha de recepción: 01/05/2020 – Fecha de aceptación: 17/05/2020
Correspondencia: Carlos de Gorostiza Frías – Hospital Universitario Fundación Jiménez Díaz (Servicio de Farmacia) – Avenida Reyes Católicos, 2 – 28040 Madrid (España)
carlos.gorostiza91@gmail.com
____
INTRODUCCIÓN
La digoxina es un fármaco inotrópico clásico que aún sigue teniendo presencia en la práctica clínica habitual. Su condición de fármaco de estrecho margen terapéutico pone de manifiesto la relevancia de sus efectos adversos más comunes (cardiovasculares, gastrointestinales y neuropsicológicos)1. Existe evidencia que indica que el uso de digoxina sin un control de niveles séricos se asocia a una mayor mortalidad, particularmente en pacientes con fibrilación auricular, en quienes debe administrarse con precaución2.
El posaconazol es un inhibidor del citocromo P450 3A4 y de la glicoproteína P (P-gp). Este último es un transportador dependiente de ATP, con función en la absorción, distribución y eliminación de fármacos. Varios estudios in vitro han demostrado que digoxina es un sustrato de la P-gp3. Como resultado de esta interacción farmacocinética puede producirse un aumento de la absorción intestinal y/o disminución del aclaramiento renal4.
DESCRIPCIÓN DEL CASO
Varón de 70 años, con antecedentes de fibrilación auricular permanente (FA) y linfoma no Hodgkin. En febrero de 2017 es diagnosticado de leucemia aguda mieloblástica (LAM) y tratado con idarrubicina y citarabina. El paciente desarrolló disfunción sistólica severa del ventrículo izquierdo, posiblemente debido a idarrubicina. En agosto de 2017, comenzó tratamiento con decitabina, desarrollando diversas pancitopenias que requirieron transfusiones de concentrados de hematíes y plaquetas, así como ingresos múltiples por descompensaciones de la insuficiencia cardíaca congestiva.
Previamente el paciente había recibido tratamiento con digoxina, pero fue suspendida en agosto de 2017 por buen control de la FA con bisoprolol. En octubre de 2018, presenta pancitopenia postquimioterapia y dos episodios de insuficiencia cardíaca congestiva descompensada. El Servicio de Hematología plantea profilaxis antifúngica con posaconazol y, por parte del Servicio de Cardiología, se retoma el tratamiento con digoxina (0,125 mg/día) por presentar descompensación de la FA en contexto de la anemia. El Servicio de Farmacia revisa las interacciones con su tratamiento habitual: eplerenona 75 mg/día, ranitidina 300 mg/día, furosemida 40 mg/día, carvedilol 12,5 mg/día y rivastigmina 60 mg/8 horas. Se detectan dos interacciones de relevancia con posaconazol: eplerenona (tipo grave; Lexicomp; Medscape Drug Reference) y digoxina (tipo moderada, recomendado monitorizar; Lexicomp; Medscape Drug Reference), por lo que el Servicio de Farmacia aconseja no iniciar posaconazol. A principios de enero de 2019, tras el 13º ciclo con decitabina, el paciente desarrolla una neutropenia grado 4 (valores postquimioterapia de 50 neutrófilos/mm3). Hematología decide finalmente iniciar tratamiento con posaconazol el 8 de enero 2019, con la recomendación desde Farmacia de monitorizar estrechamente al paciente.
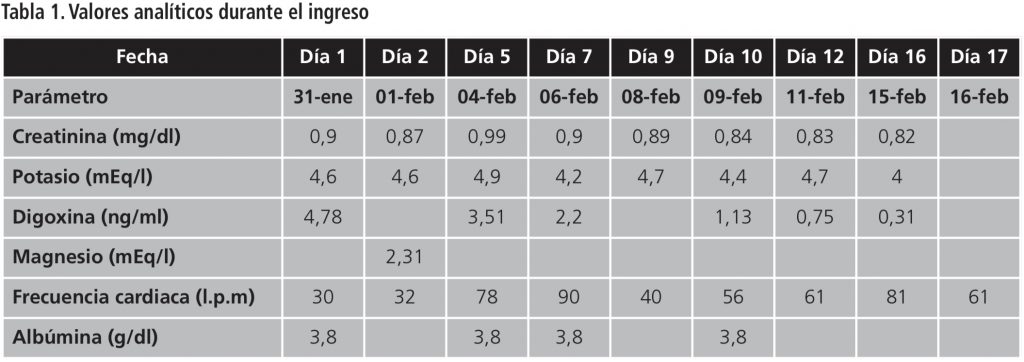
El 31 de enero de 2019 el paciente acude a la consulta de Hematología presentando astenia, vómitos y diarrea de una semana de evolución. Se deriva al Servicio de Urgencias con fibrilación auricular bloqueada con escape regular a 30 latidos por minuto (LPM), con complejos QRS de duración intermedia y analítica de 90 neutrófilos/mm3, hemoglobina de 8,7 g/dl y digoxina de 4,78 ng/ml. El paciente ingresa a cargo del Servicio de Cardiología con diagnóstico de intoxicación digitálica, requiriendo tratamiento con isoproterenol intravenoso y retirada de posaconazol, carvedilol, eplerenona y digoxina.
La función cardíaca se recupera lentamente durante el ingreso. El paciente presenta una semivida de eliminación de digoxina de 147 horas por lo que tarda casi 9 días en alcanzar niveles por debajo del 2 ng/ml (tabla 1). No se reinicia tratamiento con digoxina. Al alta el paciente mantiene frecuencias entre 50 y 70 LPM, en tratamiento con 7,5 mg/día de bisoprolol.
DISCUSIÓN
Revisando la farmacoterapia del paciente, las interacciones más probables de digoxina podrían ser con carvedilol, furosemida y posaconazol. Con los dos primeros, se aumenta el riesgo de bradicardia por bloqueo auriculoventricular y la sensibilidad a digoxina por inducción de hipopotasemia, respectivamente. Sin embargo, son interacciones sin un gran impacto en el área bajo la curva (AUC)4,5. Además, los valores de potasio y la función renal fueron normales antes y durante el ingreso, el paciente había retomado el tratamiento con digoxina en octubre de 2018 y no fue hasta la introducción del posaconazol cuando presentó bradicardia sintomática.
La forma en que la digoxina se distribuye ha sido materia de diversos estudios, centrándose en la eliminación por la P-gp6. Ledwitch y Roberts ponen de manifiesto que la digoxina es un buen sustrato para este transportador3. La inhibición del transporte a través de la P-gp generalmente conduce a aumentos significativos en el AUC, la concentración plasmática máxima (Cmáx) y la semivida (t1/2) y disminuye el aclaramiento renal y extrarrenal de digoxina6. Esto se traduce en una mayor absorción oral y biodisponibilidad del medicamento y en una disminución de su eliminación. Jalava et al. sugirieron que el efecto de la interacción digoxina-itraconazol podría ser mediado por la P-gp7. En la misma línea, Shumaker et al. describieron el caso de un paciente con LAM y fibrilación auricular que recibió posaconazol como tratamiento empírico para una neumonía de origen fúngico y en el que se manifestó el efecto de la interacción entre posaconazol y digoxina, con niveles de ésta que alcanzaron valores de 3,1 ng/ml tras 7 días de coadministración de los dos medicamentos. Dado que la digoxina no se metaboliza de forma importante por el citocromo P450, sugirieron que posaconazol podría actuar como inhibidor de la P-gp8.
La semivida de eliminación de digoxina y posaconazol es de 30-40 horas y de 29 horas, respectivamente8. En nuestro caso, el tiempo de concomitancia entre los dos medicamentos fue de 23 días, lo que podría explicar el hecho de que se necesitaron 7 días para disminuir los niveles de digoxina a la mitad y casi 9 días en alcanzar niveles por debajo del intervalo terapéutico. En el caso de Shumaker et al. los niveles se normalizaron al cabo de 72 horas, con un tiempo menor de concomitancia de ambos medicamentos (7 días)8.
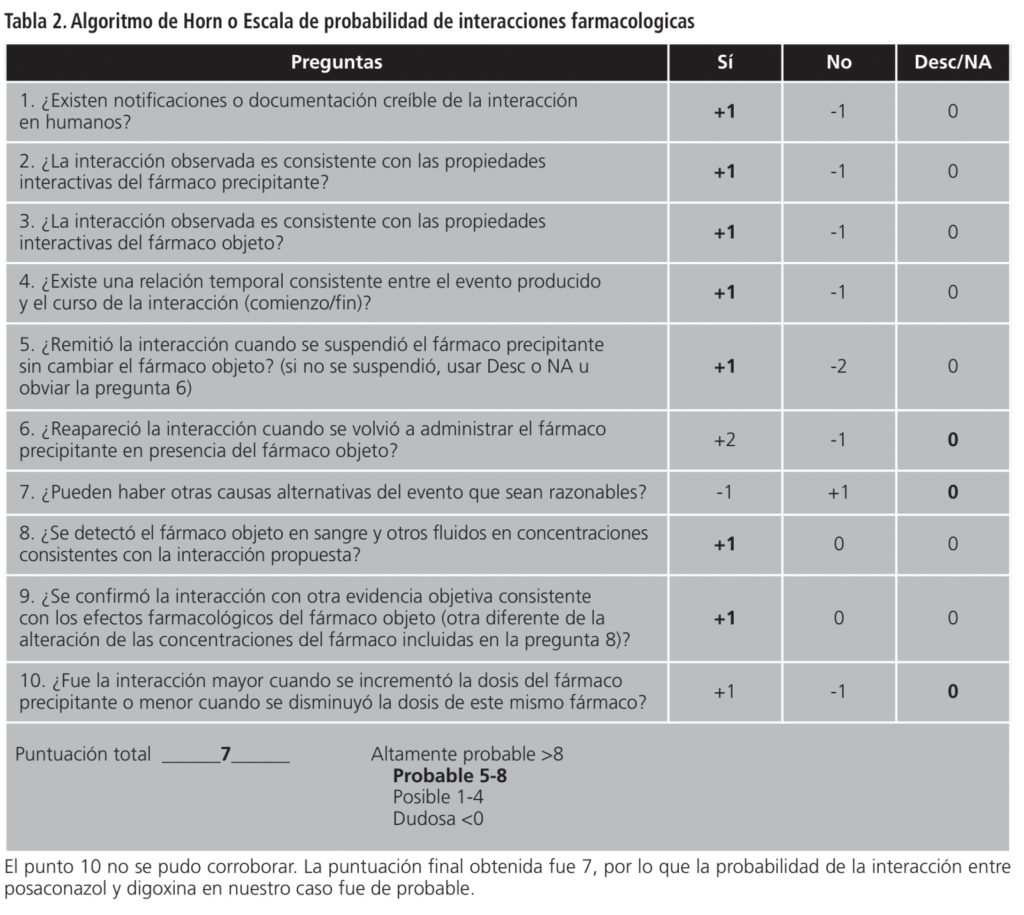
Se realizó la escala de probabilidad de interacciones farmacológicas de Horn y de Naranjo9, con un resultado de interacción probable en ambas (tabla 2; puntuación de 7 para digoxina y de 6 para posaconazol en algoritmo de Naranjo). No se pudo obtener información sobre la reintroducción de los medicamentos. La reacción adversa fue comunicada al Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Botelho, A.F.M., Pierezan, F., Soto-Blanco, B., Melo, M.M. A review of cardiac glycosides: structure, toxicokinetics, clinical signs, diagnosis and antineoplastic potential. Toxicon. https://doi.org/10.1016/j.toxicon.2018.11.429.
2. Mate Vamos, Julia W. Erath, Stefan H. Hohnloser. Digoxin-associated mortality: a systematic review and meta-analysis of the literature. European Heart Journal. Volume 36, Issue 28, 21 July 2015, Pages 1831-1838. https://doi.org/ 10.1093/eurheartj/ehv143.
3. Ledwitch KV, Roberts AG. Cardiovascular Ion Channel Inhibitor Drug-Drug Interactions with P-glycoprotein. AAPS J. 2016;19(2):409-420. Doi:10.1208/ s12248-016-0023-y.
4. Wang MT, Su CY, Chan AL, Lian PW, Leu HB, Hsu YJ. Risk of digoxin intoxication in heart failure patients exposed to digoxin-diuretic interactions: a population-based study. British Journal of Clinical Pharmacology. 2010;70:258-267.
5. Bachmakov I, Werner U, Endress B, Auge D. Characterization of adrenoreceptor antagonists as substrates and inhibitors of the drug transporter P‐glycoprotein. Fundam Clin Pharmacol. 2006;20:273-282.
6. Fenner KS, Troutman MD, Kempshall S, Cook JA, Ware JA, Smith DA, et al. Drug-Drug interactions mediated through P-glycoprotein: Clinical relevance and in vitro-in vivo correlation using digoxin as a probe drug. Clin Pharmacol Ther. 2009; 85(2):173-81. DOI: 10.1038/clpt.2008.195 [PubMed: 18987624].
7. Jalava, KirsiMaija; Partanen, Juhani; Neuvonen, Pertti J. Itraconazole Decreases Renal Clearance of Digoxin. Therapeutic Drug Monitoring. December 1997, Volume 19, Issue 6, p609,613.
8. Shumaker AC, Bullard HM, Churpek J, Knoebel RW. Posaconazole-digoxin drug-drug interaction mediated by inhibition of P-glycoprotein. J Oncol Pharm Pract. 2018 Sep 27:1078155218801055.
9. Horn JR, Hansten PD, Chan LN. Proposal for a new tool to evaluate drug interaction cases. Ann Pharmacother. 2007;41:674.80.
____
