Xajil Ramos LY1,5, Gaitán Izaguirre GME1, Luna Aguilera MF2, Vargas Rosales RJ3,5, Higueros Villagrán RA4,5, Saldaña Santiago DG3
1 Química Farmacéutica. Profesora. Subprograma de Farmacia Hospitalaria. Programa de Expericencias Docentes con la Comunidad. Facultad de Ciencias Químicas y Farmacia. Universidad de San Carlos de Guatemala (Guatemala)
2 Médico Geriatra. Clínica del Adulto Mayor. Departamento de Medicina Interna. Hospital Roosevelt (Guatemala)
3 Químico Farmacéutico. Investigador. Biofarn (Guatemala)
4 Bioquímico. Investigador. Biofarn (Guatemala)
5 Investigador-Red Latinoamericana de Implementación y Validación de Guías Clínicas Farmacogenómicas (RELIVAF), CYTED 219RT0572
Fecha de recepción: 14/05/2019 – Fecha de aceptación: 25/05/2019
Correspondencia: Lesly Yanira Xajil Ramos – Facultad de Ciencias Químicas y Farmacia. Universidad de San Carlos de Guatemala, Zona 12 – Guatemala
lesyanxr@hotmail.com
____
RESUMEN
Objetivos: El escitalopram es un fármaco antidepresivo del grupo de los inhibidores selectivos de la recaptación de serotonina utilizado ampliamente en el tratamiento del síndrome depresivo mayor. Este medicamento es metabolizado por la enzima CYP2C19 del complejo enzimático citocromo P450, y se conoce que variaciones genéticas en esta enzima están directamente relacionadas a variaciones en la respuesta farmacológica al escitalopram, en eficacia y toxicidad. El objetivo de este estudio fue determinar la presencia de variantes alélicas para CYP2C19 en pacientes geriátricos tratados con escitalopram y evaluar el ajuste al tratamiento farmacológico con escitalopram de acuerdo con su perfil farmacogenético.
Materiales y métodos: Se realizó un estudio cuantitativo, descriptivo y transversal. La muestra se conformó por 36 pacientes geriátricos de ambos sexos, diagnosticados con síndrome depresivo mayor y tratados con escitalopram en la Clínica del Adulto Mayor del Hospital Roosevelt durante marzo a agosto de 2017. Para la determinación de la presencia de variantes alélicas se utilizó la técnica de análisis de reacción en cadena de la polimerasa-polimorfismos de longitud de fragmentos de restricción (PCR-RFLP).
Resultados: Se encontró presencia de variantes alélicas en 4 pacientes (11,1%). Según los diplotipos encontrados, 32 pacientes (88,9%) correspondieron al fenotipo metabolizador extensivo y 4 (11,1%) al intermedio, no se encontraron casos de fenotipos metabolizadores pobres.
Conclusiones: En todos los casos se realizó intervención farmacéutica con recomendación terapéutica al médico. En ningún caso fue necesario reajuste de dosis. La frecuencia de la presencia de variantes alélicas encontrada para Guatemala fue similar al promedio de frecuencia multiétnica conocida.
Palabras clave: Farmacogenética, escitalopram, pacientes geriátricos, CYP2C19, recomendación terapéutica.
Pharmacogenetic response to escitalopram in geriatric patients in Guatemala
SUMMARY
Objectives: Escitalopram is an antidepressant drug from the group of selective serotonin reuptake inhibitors widely used in the treatment of major depressive syndrome. This drug is metabolized by the enzyme CYP2C19 of the cytochrome P450 enzyme complex and it is known that genetic variations in this enzyme are directly related to variations in the pharmacological response to escitalopram, in efficacy and toxicity. The aim of this study was to determine the presence of allelic variants for CYP2C19 in geriatric patients treated with escitalopram and to evaluate the adjustment to pharmacological treatment with escitalopram according to their pharmacogenetic profile.
Materials and methods: A quantitative, descriptive and cross-sectional study was conducted. The sample consisted of 36 geriatric patients of both sexes, diagnosed with major depressive syndrome and treated with escitalopram in the Senior Adult Clinic of the Roosevelt Hospital of Guatemala during March to August 2017. For the determination of the presence of allelic variants the analysis technique of polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) was used.
Results: Allelic variants were found in 4 patients (11.1%). 32 patients (88.9%) corresponded to the extensive metabolizer phenotype and 4 (11.1%) to the intermediate, no cases of poor metabolizing phenotypes were found.
Conclusions: In all cases, a pharmaceutical intervention was carried out with therapeutic recommendation to the doctor. In no case was dose readjustment necessary. The frequency of the presence of allelic variants found for Guatemala was similar to the known multiethnic frequency average.
Key Words: Pharmacogenetics, escitalopram, geriatric patients, CYP2C19, therapeutic recommendation.
____
INTRODUCCIÓN
Las variantes alélicas para las enzimas implicadas en el metabolismo de fármacos, tales como las isoenzimas del complejo enzimático P450 han sido ampliamente estudiadas1. La determinación e interpretación es de gran importancia, y constituye las bases de la medicina personalizada2.
Tanto el citalopram, como el escitalopram pertenecen al grupo de medicamentos conocidos como inhibidores selectivos de la recaptación de la serotonina (SRRIs, por sus siglas en inglés), los cuales constituyen el tratamiento de primera línea para la mayoría de los trastornos depresivos y de ansiedad, y pueden ser utilizados también en el tratamiento de otras condiciones psiquiátricas tales como el síndrome obsesivo-compulsivo, entre otros3. El citalopram fue aprobado en 1998 para el tratamiento de la depresión y se produce como un racemato, esto significa que es una mezcla de dos estereoisómeros: R-citalopram y S-citalopram, el escitalopram es sólo un enantiómero, el S-citalopram. Estas diferencias estructurales proveen características específicas en las moléculas4, de tal forma que se ve afectada la respuesta terapéutica, tal es el caso del escitalopram5.
Se conoce que estos fármacos son metabolizados por el complejo enzimático del citocromo P450, y existe evidencia que la isoenzima CYP2C19 es una de las más implicadas en este proceso6,7, donde serios eventos adversos tales como arritmias causadas por prolongación QT, que puede conducir a efectos letales, que han sido asociados con los SRRIs, particularmente en individuos metabolizadores pobres del CYP2C19 tratados con citalopram y escitalopram, en los cuales se han encontrado altos niveles plasmáticos de estos medicamentos8. Sin embargo, se conoce que la prolongación del intervalo QT a dosis terapéuticamente equivalentes de escitalopram fue de aproximadamente la mitad que con citalopram9,10, por lo que actualmente se considera de uso más seguro, especialmente en pacientes geriátricos en Guatemala.
El objetivo de este estudio fue realizar las recomendaciones pertinentes en cuanto a la terapia individualizada por paciente a través de la determinación de las variantes alélicas de la enzima CYP2C19 en pacientes geriátricos tratados con escitalopram. Mediante la genotipificación de variantes alélicas de la enzima CYP2C19 y de los distintos fenotipos metabolizadores presentes en la población geriátrica en Guatemala. La aplicación clínica consistió en realizar intervenciones farmacéutico-médico, conociendo previamente el perfil farmacogenético del paciente, lo que permitió predecir la respuesta al tratamiento, permitiendo a su vez, realizar recomendaciones terapéuticas oportunas, tales como ajuste de dosis o cambio en la medicación. Este proceso se realizó a través del Servicio de Consulta Terapéutica y Toxicológica (Secott), como parte del servicio en información de medicamentos que esta instancia proporciona en dicho hospital. Con este estudio se logró aportar en primer lugar en beneficio de la terapia de los pacientes, así como realizar el aporte científico en el área de la farmacia hospitalaria, reconociendo que la farmacogenética es un tema amplio del cual se conoce poco aún, haciendo posible el desarrollo de la farmacogenética clínica como parte de los servicios farmacéuticos en Guatemala, logrando excelente aceptación del aporte del farmacéutico a través de esta herramienta clínica, por parte del equipo médico de la clínica del adulto mayor, al incluir las recomendaciones terapéuticas proporcionadas en la terapia de los pacientes tratados con escitalopram.
Materiales y métodos
Se incluyeron 36 pacientes geriátricos de ambos sexos con edad mayor de 65 años, tratados con escitalopram, atendidos en la Clínica del Adulto Mayor del Hospital Roosevelt durante los meses de marzo a agosto de 2017. El muestreo fue no probabilístico por casos consecutivos durante seis meses.
Consideraciones éticas
El estudio fue aprobado por el Comité de Ética Independiente del Hospital Roosevelt, Guatemala. Un consentimiento informado a los pacientes y sus cuidadores fue realizado previo a la toma de muestra. La toma de muestra fue por hisopado bucal. Los datos del paciente fueron registrados en un perfil farmacoterapéutico y en la base de datos. El acceso a las historias clínicas y su revisión fue autorizado por el Departamento de Docencia e Investigación del Hospital Roosevelt.
Genotipificación
Extracción de ADN, amplificación de regiones mediante PCR punto final, análisis RFLP por digestión enzimática y electroforesis en gel de agarosa. Se determinó la presencia de dos variantes alélicas: *2 y *3, a partir de las cuales se analizó la asociación de las mismas en los diplotipos correspondientes a cada paciente, determinando el genotipo de los mismos11.
Análisis de genotipos
Con el resultado de la genotipificación se procedió al análisis para la determinación de los fenotipos metabolizadores, y su relación con la respuesta al tratamiento con escitalopram, utilizando para esto las guías terapéuticas del Consorcio de Implementación de Farmacogenética Clínica (Clinical Pharmacogenetics Implementation Consortium, CPIC), disponibles en la base de datos de acceso libre en línea a través de los sitios electrónicos de: PharmGKB® Pharmacogenetics and Pharmacogenomics Knowledge Base8.
Intervención farmacéutica
Cuando fue necesario, se realizó intervención farmacéutica con el médico geriatra analizando los casos y realizando las recomendaciones terapéuticas, de la terapia en curso o previo a su inicio, registrando la resolución de las mismas en la ficha de intervención. El análisis de los casos y las intervenciones se realizaron en el Servicio de Consulta Terapéutica y Toxicológica, Secott, del Hospital Roosevelt.
Análisis estadístico
Las frecuencias de las variantes alélicas en estudio y de los fenotipos se estimaron calculando la proporción de pacientes que fueron portadores de cada variante según su genotipo y fenotipo, por medio de estadística descriptiva (frecuencias absolutas y porcentajes). Para el análisis de las frecuencias alélicas fue necesario aplicar la prueba del equilibrio de Hardy-Weinberg para genética de poblaciones, por medio de la prueba de Ji cuadrado. De no encontrarse diferencia significativa para la prueba de equilibrio de Hardy-Weinberg (p>.05), se concluye que la población en estudio se encuentra genéticamente en equilibrio. Una población en equilibrio de Hardy-Weinberg indica que las variantes alélicas se encuentran en las proporciones esperadas.
RESULTADOS
La muestra se conformó por pacientes de edad mayor o igual a los 65 años, siendo la media (desviación estándar) de edad los 73 (6) años. En cuanto al sexo, se incluyeron 29 (80,6%) pacientes femeninos, y 7 (19,4%) masculinos. De acuerdo a la etnia, la muestra incluyó 2 (5,6%) pacientes indígenas y 34 (94,4%) pacientes ladinos. Todos fueron tratados con escitalopram con dosis entre 5 y 20 mg, con frecuencia de administración cada 24 h.
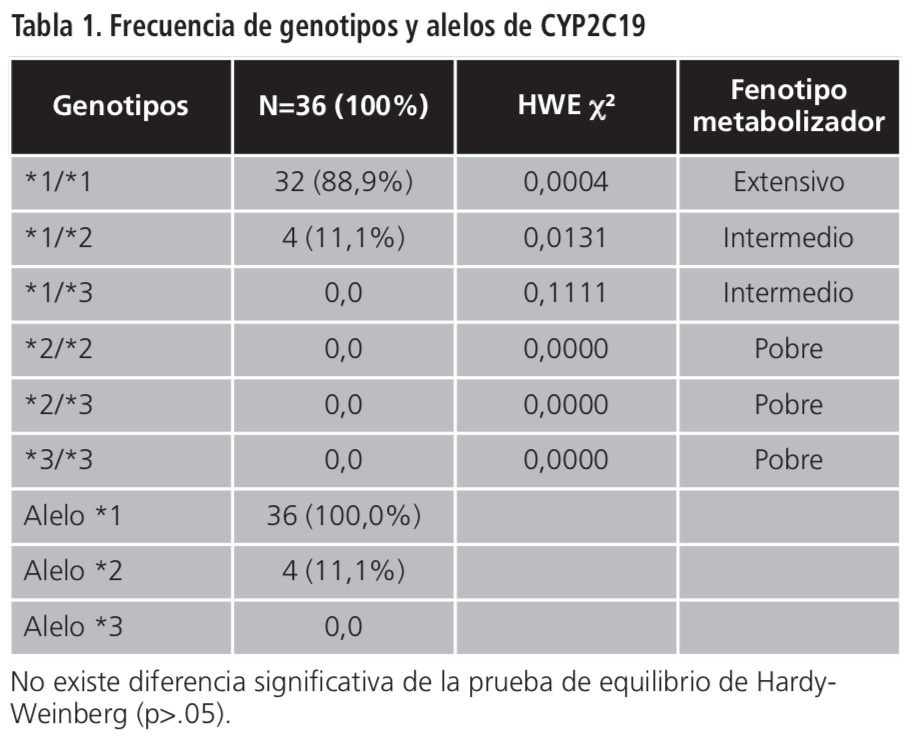
En la tabla 1 se observan los diplotipos encontrados, de acuerdo con la genotipificación de las variantes y los fenotipos metabolizadores correspondientes a los mismos. Las frecuencias alélicas encontradas para las variantes en estudio corresponden a 11,1% para CYP2C19*2. No se encontró sujetos portadores de CYP2C19*3. En general, se encontró presencia de variantes alélicas en el 11,1% de los pacientes, correspondientes en su totalidad a los sujetos portadores de genotipo heterocigoto para la variante *2 y el alelo salvaje (*1/*2). De acuerdo a los diplotipos encontrados, en el 88,9% de los casos se determinó fenotipo metabolizador extensivo, (genotipo homocigoto *1/*1), y 11,1% metabolizador intermedio (genotipo heterocigoto *1/*2). Para el análisis de las frecuencias alélicas se aplicó la prueba de equilibrio de Hardy-Weinberg para genética de poblaciones, comprobándose que la población en estudio se encuentra en equilibrio (p>.05).
No se encontraron pacientes con fenotipo metabolizado pobre para escitalopram. En todos estos casos se realizó intervención farmacéutica con sugerencia de recomendación terapéutica al médico, y en ninguno de los casos fue necesario readecuación de dosis. La respuesta y aceptación del médico a las sugerencias en la terapia farmacológica fueron evaluadas y la totalidad de las sugerencias fueron aceptadas por el médico.
DISCUSIÓN
Las frecuencias multiétnicas en estudios poblacionales para CYP2C19, las variantes CYP2C19*2 y CYP2C19*3 son las más frecuentemente encontradas, por lo que en este estudio se planteó la determinación de estas dos variantes, estimándose mayor probabilidad de ser halladas en la población guatemalteca. Aunque actualmente se conocen más de 30 variantes alélicas del gen CYP2C19 en la población en general8, se espera baja probabilidad de encontrarlas en la población incluida en este estudio, considerando el comportamiento reportado en estudios previos12.
El análisis de frecuencia de variantes alélicas de la enzima CYP2C19 para los pacientes geriátricos tratados con escitalopram incluidos en este estudio, demostró que la variante más frecuente fue la CYP2C19*2 (11,1%). En general, el 100% de los pacientes fueron portadores del alelo salvaje del gen en estudio, definido como CYP2C19*1, el 11,1% fueron portadores de la variante alélica CYP2C19*2 y no se encontraron pacientes portadores de CYP2C19*3. Los resultados corresponden a las frecuencias alélicas esperadas, en las que se estima encontrar en baja frecuencia de pacientes portadores de CYP2C19*3 para la población en general, especialmente en la población latinoamericana.
Al comparar este resultado con los reportados por el CPIC, se determinó que la frecuencia encontrada en Guatemala es similar a la reportada según el promedio de frecuencia multiétnica conocido. Estudios previos han comparado la marcada relación interétnica en la frecuencia de las variantes alélicas para el gen CYP2C19, mostrando que el alelo más común es el CYP2C19*2, presente del 9 al 26% de los caucásicos, y del 20 al 35% en la población india y de Asia del Este. En cuanto al alelo CYP2C19*3, a pesar de ser uno de los más frecuentes, se ha documentado baja frecuencia en caucásicos, indios y africanos, siendo portadores entre el 0 y el 2% de la población12-14.
Publicaciones han determinado la frecuencia alélica de CYP2C19*2 y *3 en individuos suramericanos, encontrándose que en esta población, la frecuencia de estos alelos fue más baja que la frecuencia alélica de la población caucásica15. A diferencia de esto, se ha encontrado alta prevalencia de estas variantes alélicas en otras poblaciones, tal es el caso de Oceanía, en donde se reportó un 57% de individuos portadores de CYP2C19*2 y 25% portadores de CYP2C19*3, determinándose 68% de los individuos con fenotipo metabolizador pobre, representado la población con más alta frecuencia de este fenotipo que ninguna otra16.
En este estudio se encontraron dos pacientes de origen amerindio (5,6%), que reportaron variantes alélicas semejantes a las proporciones esperadas para la población en general.
A partir de la identificación de las variantes alélicas en los pacientes en estudio, y la determinación de los diplotipos y su genotipo correspondiente, se analizó la asociación entre las variantes presentes y la actividad enzimática de CYP2C19, de acuerdo a los datos proporcionados por el CPIC, estableciéndose los siguientes fenotipos metabolizadores para escitalopram. Los pacientes con el genotipo CYP2C19 *1/*1, homocigotos para el alelo salvaje, se definieron como “metabolizadores extensivos”, los pacientes con genotipo *1/*2 o *1/*3, heterocigotos para una de las variantes alélicas en estudio y el alelo salvaje, se definieron como “metabolizadores intermedios” y por último, aquellos con genotipo *2/*3, *2/*2 o *3/*3, heterocigotos u homocigotos para los alelos mutados, se definieron como “metabolizadores pobres”8. Clínicamente, la expresión de estas asociaciones, indica variaciones en la concentración sérica final del fármaco que se alcanza en el paciente en estudios previos, y por lo tanto a la eficacia y toxicidad del mismo7. De esta forma, se analizó cada caso de forma individualizada, basándose en las guías terapéuticas para los SRRIs del CPIC, disponibles en la base de datos de acceso libre en línea a través de los sitios electrónicos de: PharmGKB® Pharmacogenetics and Pharmacogenomics Knowledge Base8,17, indicando al médico el resultado mediante un informe escrito en el que se incluyó la recomendación terapéutica en los casos que fue necesario.
De acuerdo con los diplotipos encontrados, en el 88,9% de los casos se determinó fenotipo metabolizador extensivo y 11,1% intermedio, no se encontraron casos de fenotipos metabolizadores pobres, por lo que no fue necesario reajuste de dosis de escitalopram en ninguno de los pacientes. Sin embargo, de haberse identificado pacientes metabolizadores pobres, se lograría identificar el riesgo de toxicidad previo al tratamiento con escitalopram, realizando cambios en la terapia, tales como el ajuste de dosis al 50% de la dosis convencional inicial, o bien el cambio del tratamiento por un fármaco alternativo que no fuere sustrato de CYP2C19. En estos pacientes se recomienda también vigilar la respuesta por el riesgo de efectos adversos cardiovasculares, específicamente el riesgo de prolongación del intervalo QT, así como la función hepática y renal en su uso concomitante con algún fármaco inhibidor de la función enzimática de CYP2C1918, tomando en cuenta que el riesgo aumenta en pacientes mayores de 60 años, en los cuales el riesgo de altas concentraciones plasmáticas de escitalopram es mayor5. De esta forma, las pruebas farmacogenéticas permiten individualizar la terapia farmacológica en los pacientes, disminuyendo el riesgo de presentar problemas relacionados a la medicación y aumentando la eficacia del mismo. Adicionalmente, es relevante el estudio de la presencia de variantes alélicas en pacientes con tratamiento de escitalopram, tomando en cuenta que estudios señalan la relación entre la expresión elevada del gen CYP2C19 en humanos y los síntomas depresivos, así como el aumento en el comportamiento suicida en pacientes con alta capacidad enzimática de CYP2C1919.
Todas las intervenciones farmacéuticas se realizaron previo al inicio de tratamiento (pre-test) o posterior a la indicación por el médico (post-test) en los primeros días del tratamiento. La información se hizo llegar al médico mediante un reporte escrito realizado por el farmacéutico en el Servicio de Consulta Terapéutica y Toxicológica del Hospital Roosevelt, incluyendo el resultado del análisis, la interpretación del mismo, y la recomendación terapéutica en todos los casos. La totalidad de las intervenciones fueron aceptadas por el médico tratante, accediendo a las sugerencias en cuanto al tratamiento farmacológico del paciente, por lo que se considera una exitosa aceptación del servicio. El conocimiento temprano del resultado de las pruebas farmacogenéticas, su interpretación y consideraciones de decisión clínica hacia el paciente, permiten actuar de forma oportuna, al poder predecir genéticamente la respuesta de este al tratamiento. En este caso, con el método de análisis utilizado, los resultados pudieron estar disponibles para el médico en un tiempo prudencial, tomando en cuenta el tiempo de análisis de la muestra y el tiempo del farmacéutico en realizar la interpretación del resultado y la intervención farmacéutica, de tal forma que permitió al médico intervenir tempranamente en la terapia20.
Actualmente más de 100 insertos para medicamentos aprobados por la Food and Drug Administration (FDA) contienen información farmacogenética y se conoce que aproximadamente el 12% de los medicamentos aprobados entre 1998 y 2012 contenían información sobre marcadores farmacogenéticos en sus fichas de información al momento de su aprobación21, por lo que es de esperarse que la farmacogenética aplicada en la clínica constituya cada vez más una herramienta clave en la optimización de los tratamientos farmacológicos, que ha demostrado mejores resultados clínicos en pacientes, optimizando la terapia y disminuyendo el riesgo de efectos adversos22.
En el desarrollo de este estudio, se logró integrar el criterio médico, con el criterio clínico del farmacéutico, discutiendo y aportando sugerencias en la optimización del tratamiento farmacológico de los pacientes, siendo esta una actividad complementaria a los servicios farmacéuticos hospitalarios que actualmente se realizan, logrando la integración de la farmacogenética en la clínica. Por otro lado, esta experiencia demostró la factibilidad del diseño y funcionamiento de un servicio de farmacogenética clínica en Guatemala.
La metodología para la aplicación clínica de las pruebas farmacogenéticas en este estudio fue similar a las utilizadas en los servicios de farmacia de otros hospitales a nivel internacional, en los cuales esta práctica ya se ha convertido en parte de la rutina del servicio del farmacéutico en el cuidado de pacientes, especialmente en aquellos en tratamiento de enfermedades crónicas o terapias farmacológicas de largo plazo, tal como los pacientes oncológicos23.
La prueba del equilibrio de Hardy-Weinberg permite determinar las frecuencias genotípicas esperadas en función de las frecuencias de los alelos en estudio. En una población en equilibrio, la transmisión de los alelos de los progenitores a los descendientes es independiente y no ocurren fenómenos distorsionadores, como la aparición frecuente de nuevas mutaciones o la selección de alelos, la probabilidad de observar una combinación de alelos específica (un genotipo) depende del producto de las probabilidades (frecuencias) de cada alelo. En este estudio se aplicó esta prueba de equilibrio, comprobándose que la población en estudio se encuentra genéticamente en equilibrio, al no encontrarse diferencia significativa al comparar las frecuencias esperadas con las observadas (p>.05). A partir de esta determinación, se puede inferir que, al encontrarse pacientes heterocigotos en una población en equilibrio, la probabilidad de encontrar pacientes homocigotos *2/*2 es baja y homocigotos y heterocigotos *2/*3, *3/*3 extremadamente baja. Como se mencionó anteriormente, en estudios similares realizados en distintas poblaciones, los genotipos *2/*2, *2/*3 y *3/*3 se han reportado en baja o nula frecuencia, por lo que los resultados del presente estudio son acordes a lo esperado, demostrando mediante el equilibrio de Hardy-Weinberg una población en equilibrio. Aunque se esperaba no encontrar estos genotipos en el estudio, se incluyó su análisis para poder realizar esta comparación. Al respecto, también puede mencionarse que, si se encontró individuos portadores de genotipos homocigotos *1/*1 y heterocigotos *1/*2, coincidiendo con las frecuencias esperadas.
Tomando en cuenta la diversidad étnica en Guatemala y en la región centroamericana en general24, se recomienda realizar un estudio poblacional para determinar la frecuencia en las distintas regiones guatemaltecas. También se recomienda realizar seguimiento farmacoterapéutico a largo plazo en los pacientes para asegurar la adherencia y mejor respuesta a los tratamientos prestando especial atención a todos los aspectos que afectan al mismo, complementando las pruebas farmacogenéticas en la terapia del paciente. En este sentido, también es imprescindible el abordaje de la farmacogenética desde la perspectiva de la farmacovigilancia, en cuanto al análisis de reacciones adversas a los medicamentos, de acuerdo con las bases genéticas en la respuesta a los fármacos. La farmacogenética podría representar una de las principales herramientas de la farmacovigilancia, al poder detectar de esta forma, aquellos pacientes en mayor riesgo de presentar reacciones adversas, y por lo tanto permitiría la prevención de las mismas, cumpliendo de esta forma con uno de los principales objetivos de la farmacovigilancia.
Agradecimientos: Esta investigación fue cofinanciada por el fondo de investigaciones Digi-Usac-2017, Proyecto: 4.8.63. 1.01 y desarrollada en el Laboratorio de Farmacogenética de la Facultad de Ciencias Químicas y Farmacia, USAC con equipo adquirido a través del Proyecto SENACYT: FD24-2013.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Baye TM, Wilke RA. Mapping genes that predict treatment outcome in admixed populations. The Pharmacogenomics Journal. 2010;10(6):465-477.
2. Tomalik Scharte D, Lazar A, Fuhr U, Kirchheiner J. The clinical role of genetic polymorphisms in drug-metabolizing enzymes. The Pharmacogenomics Journal. 2008;8(1):4-15.
3. Barak Y, Swartz M, Baruch Y. Venlafaxine or a second SSRI: Switching after treatment failure with an SSRI among depressed inpatients: A retrospective analysis. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 2011;35(7):1744-1747.
4. Vargas R, Higueros R, Saldaña D, Xajil L. Promiscuity of NSAIDs, the secret of their effectiveness: perspective. Pharmacology Online. 2017;1(01):1-4.
5. Huezo Diaz P, Perroud N, Spencer EP, Smith R, Sim S, Virding S, et al. CYP2C19 genotype predicts steady state escitalopram concentration in GENDEP. Journal of Psychopharmacology. 2012;26(3):398-407.
6. Altar CA, Hornberger J, Shewade A, Cruz V, Garrison J, Mrazek D. Clinical validity of cytochrome P450 metabolism and serotonin gene variants in psychiatric pharmacotherapy. International Review of Psychiatry (Abingdon, England). 2013;25(5):509-533.
7. Hodgson K, Tansey K, Dernovsek MZ, Hauser J, Henigsberg N, Maier W, et al. Genetic differences in cytochrome P450 enzymes and antidepressant treatment response. Journal of Psychopharmacology (Oxford, England). 2014;28(2):133-141.
8. Hicks JK, Bishop JR, Sangkuhl K, Müller DJ, Ji Y, Leckband SG, et al. Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for CYP2D6 and CYP2C19 Genotypes and Dosing of Selective Serotonin Reuptake Inhibitors. Clinical Pharmacology & Therapeutics. 2015;98(2):127-134.
9. Peña DM, Herazo MI, Calvo JM. Depresión en ancianos. Revista de la Facultad de Medicina, Universidad Nacional de Colombia. 2009;57(4):347-355.
10. Funk KA, Bostwick JR. A Comparison of the Risk of QT Prolongation Among SSRIs. Annals of Pharmacotherapy. 2013;47(10):1330-1341.
11. Ohkubo Y, Ueta A, Ando N, Ito T, Yamaguchi S, Mizuno K, et al. Novel mutations in the cytochrome P450 2C19 gene: A pitfall of the PCR-RFLP method for identifying a common mutation. Journal of Human Genetics. 2006;51(2): 118-123.
12. Jureidini ID, Chamseddine N, Keleshian S, Naoufal R, Zahed L, Hakime N. Prevalence of CYP2C19 polymorphisms in the Lebanese population. Molecular Biology Reports. 2011;38(8):5449-5452.
13. Rosemary J, Adithan C. The pharmacogenetics of CYP2C9 and CYP2C19: ethnic variation and clinical significance. Current Clinical Pharmacology. 2007;2 (1):93-109.
14. Kudzi W, Dodoo AN, Mills JJ. Characterisation of CYP2C8, CYP2C9 and CYP2C19 polymorphisms in a Ghanaian population. BMC Medical Genetics. 2009;10(1):1-6.
15. Bravo Villalta HV, Yamamoto K, Nakamura K, Bayá A, Okada Y, Horiuchi R. Genetic polymorphism of CYP2C9 and CYP2C19 in a Bolivian population: An investigative and comparative study. European Journal of Clinical Pharmacology. 2005;61(3):179-184.
16. Kaneko A, Bergqvist Y, Taleo G, Kobayakawa T, Ishizaki T, Bjorkman A. Proguanil disposition and toxicity in malaria patients from Vanuatu with high frequencies of CYP2C19 mutations. Pharmacogenetics. 1999;9(3):317-326.
17. Whirl Carrillo M, McDonagh EM, Hebert JM, Gong L, Sangkuhl K, Thorn CF, et al. Pharmacogenomics knowledge for personalized medicine. Clinical Pharmacology and Therapeutics. 2012;92(4):414-417.
18. Hampton LM, Daubresse M, Chang HY, Alexander GC, Budnitz DS. Emergency Department Visits by Adults for Psychiatric Medication Adverse Events. JAMA Psychiatry. 2014;71(9):1006-1014.
19. Jukiá MM, Opel N, Ström J, Carrillo Roa T, Miksys S, Novalen M. Elevated CYP2C19 expression is associated with depressive symptoms and hippocampal homeostasis impairment. Molecular Psychiatry. 2017;22(8):1155-1163.
20. Garrido C, Santizo VG, Müllers P, Soriano DR, Avila GB, Dean M, et al. Frequency of thiopurine S-methyltransferase mutant alleles in indigenous and admixed Guatemalan patients with acute lymphoblastic leukemia. Medical Oncology. 2013;30(1):1-7.
21. Tutton R. Pharmacogenomic biomarkers in drug labels: what do they tell us? Pharmacogenomics. 2014;15(3):297-304.
22. Chang KL, Weitzel K, Schmidt S. Pharmacogenetics: Using Genetic Information to Guide Drug Therapy. American Family Physician. 2015;92(7):588-94.
23. Crews KR. Development and Implementation of a Pharmacist-Managed. American Journal of Health-System Pharmacy. 2011;68(2):143-150.
24. Céspedes Garro C, Naranjo M, Ramírez R, Serrano V, Fariñas H, Barrantes R, et al. Pharmacogenetics in Central American healthy volunteers: Interethnic variability. Drug Metabolism and Personalized Therapy. 2015;30(1):19-31.
____