Meroño-Saura MA, Ibañez-Caturla J, Rodríguez Martínez TM, Pacheco-López P, Plaza-Aniorte J, León Villar J
Servicio de Farmacia. Hospital General Universitario Morales Meseguer. Murcia (España)
Fecha de recepción: 19/05/2020 – Fecha de aceptación: 27/05/2020
Correspondencia: Mª Antonia Meroño-Saura – Hospital General Universitario Morales Meseguer (Servicio de Farmacia) – Avda. Marqués de los Vélez, s/n – 30008 Murcia (España)
m.antonia.ms92@gmail.com
____
RESUMEN
Objetivo: Los antivirales de acción directa han logrado tasas de respuesta viral sostenida muy elevadas desde su comercialización. El objetivo de este trabajo fue el análisis de la efectividad y seguridad de los antivirales de acción directa en pacientes infectados por el virus de la hepatitis C crónica.
Métodos: Se incluyeron pacientes infectados con el virus de la hepatitis C (VHC) y coinfectados por VHC y virus de la inmunodeficiencia humana (VIH) que iniciaron tratamiento con antivirales de acción directa entre 2015-2019. Como variable de efectividad se midió la respuesta viral sostenida.
Resultados: Se incluyeron 303 pacientes, 235 (77,56%) monoinfectados y 68 (22,44%) coinfectados. El genotipo de virus más prevalente fue el 1 en ambos grupos. La proporción de cirróticos fue superior en la población monoinfectada 38,3% vs. 20,6%; p=0,047). De los 303 pacientes, a 279 se le analizó la carga viral a las 12 semanas de tratamiento; un 97,8% (273/279) alcanzaron respuesta viral sostenida, confirmándose 6 fracasos virológicos. En un análisis de subgrupos, en la mayoría de grupos según la presencia o no de cirrosis, la coinfección VIH y el genotipo, la efectividad se situó próxima o por encima del 90%. El tratamiento fue seguro, con toxicidad leve y sólo una suspensión de tratamiento. Se detectaron interacciones medicamentosas potenciales en un 20% de los pacientes.
Conclusiones: Los antivirales de acción directa presentaron una efectividad elevada, igual e incluso superior a la descrita en los ensayos clínicos, e incluso en subpoblaciones difíciles de tratar.
Palabras clave: Hepatitis C crónica, agente antiviral, respuesta viral sostenida, seguridad, interacción medicamentosa.
Real life results of direct acting antiviral in hepatitis C treatment
SUMMARY
Objetive: Direct-acting antivirals have achieved high sustained viral response rates since their commercialization. The main objective of this study was the analysis of the efficacy and safety of direct-acting antivirals in patients infected with the chronic hepatitis C virus.
Methods: Patients infected with hepatitis C virus (HCV) and co-infected with HCV and human immunodeficiency virus (HIV) who started treatment with direct-acting antiviral drugs between 2015-2019 were included. The sustained viral response was measured as the effectivity variable.
Results: 303 patients were included, 235 (77.56%) were monoinfected and 68 (22.44%) were co-infected. Genotype 1 virus was the most prevalent 1 in both groups. The proportion of cirrhotic was higher in the monoinfected population (38.3% vs. 20.6%; p=0.047). Of the 303 patients, 279 pacients had viral load analysis at 12 weeks of treatment, 97.8% (273/279) achieved sustained viral response and 6 virological failures were confirmed. In a subgroup analysis, the majority of the groups, regardless of the presence or not of cirrhosis, HIV coinfection or genotype, the efficacy was close to or above 90%. The treatment was safe, with mild toxicity and only one treatment suspension. Potential drug interactions were detected in 20% of patients.
Conclusions: Direct-acting antivirals with a high efficacy, equal to or greater than that described in clinical trials, and even with subpopulations difficult to treat.
Key words: Chronic hepatitis, antiviral agents, sustained virologic response, safety, drug interactions.
____
INTRODUCCIÓN
La infección por el virus de la hepatitis C (VHC) ha sido una de las principales causas de muerte relacionadas con cirrosis y carcinoma hepatocelular. Actualmente, la infección por el VHC se adquiere principalmente a través de la exposición sanguínea percutánea, más comúnmente a través del uso de drogas inyectables1.
Según los resultados del 2º Estudio de Seroprevalencia en España (2017-2018)2, la prevalencia de anticuerpos frente al VHC en población general de 20 a 80 años en España era de 0,85% (IC 95%: 0,64%-1,08%) y la de infección activa de 0,22% (IC 95%: 0,12%-0,32%). Estos datos nos muestran un nivel de prevalencia de infección por VHC bajo, y proporciona información para alcanzar el objetivo de erradicación de la infección por el VHC en España para el año 2030, reduciendo las nuevas infecciones en un 90% y la mortalidad en un 65%, lo que requiere diagnosticar al 90% de las personas con infección y tratar al 80% de las personas diagnosticadas.
La infección crónica por VHC se caracteriza por un estado inflamatorio crónico, con lesión hepática que conduce al desarrollo de cirrosis en torno al 10-20% de los pacientes según avanza la infección. El riesgo de progresión a cirrosis en pacientes con VHC crónico es multifactorial, influyen factores como el consumo de alcohol y la coinfección con el virus de la hepatitis B (VHB) o VIH3.
En cuanto al diagnóstico, comienza con una detección de anticuerpos en sangre. Un resultado negativo significa no exposición al VHC, pero la presencia de anticuerpos no distingue entre infección actual y pasada. Aproximadamente el 15-25% de personas expuestas al VHC eliminan espontáneamente el virus sin desarrollar infección crónica; estos pacientes presentarán anticuerpos positivos sin tener infección activa. Los pacientes tratados y curados también presentarán anticuerpos positivos. En aquellos pacientes con anticuerpos positivos o indeterminados, el diagnostico confirmatorio es una prueba de ARN-VHC cualitativa o cuantitativa, específica para la infección activa4.
El tratamiento de la infección por el VHC ha cambiado drásticamente desde 1991, cuando la Food and Drug Administration (FDA) aprobó el primer tratamiento para la infección por VHC. El tratamiento de elección en ese momento era el interferón (posteriormente pegilado) y la ribavirina (RBV), con tasas de curación menores del 50%; el tratamiento requería autoinyección y presentaba reacciones adversas graves. Los primeros medicamentos orales, boceprevir y telaprevir (inhibidores de la proteasa NS3/4a), fueron aprobados en 2011 y fueron los primeros antivirales de acción directa (AAD) en atacar la replicación viral y lograr la eliminación de la infección. Sin embargo, aún presentaban efectos secundarios graves en pacientes con enfermedad avanzada, indicación exclusivamente en genotipo 1 y elevado coste. Los AAD de segunda generación han cambiado de forma radical el tratamiento de la hepatitis crónica por VHC, obteniéndose en algunas subpoblaciones de pacientes tasas de RVS superiores al 90%, todo ello con una menor duración de los tratamientos y una óptima tolerancia4,5.
El VHC se caracteriza por su heterogeneidad genética. Con las diferencias en la secuencia de nucleótidos del genoma del VHC se han identificado 7 genotipos con diferentes subtipos, siendo el genotipo 1 el más frecuente en España (70%; 44% subtipo 1b y 26% subtipo 1a), seguido del genotipo 3 (20%), el 4 (8%) y el 2 (3%). El genotipo viral era el factor predictivo más importante de respuesta viral sostenida (RVS) en pacientes tratados con interferón pegilado y ribavirina. La aparición de nuevos medicamentos antivirales ha demostrado la posibilidad de reforzar la respuesta virológica contra el virus de la hepatitis C y sus diferentes genotipos, muy superior a las tasas alcanzadas por el interferón y ribavirina en el tratamiento de la hepatitis C5,6.
El objetivo del presente trabajo es aportar datos de experiencia en vida real, mediante el análisis de efectividad y seguridad de los fármacos empleados en el tratamiento de la hepatitis C crónica durante los últimos 5 años.
MÉTODOS
Se llevó a cabo un estudio observacional y retrospectivo. Se incluyeron pacientes adultos diagnosticados de hepatitis C crónica que iniciaron tratamiento con AAD en monoterapia o en combinación con RBV entre 2015 y 2019, en el Hospital General Universitario Morales Meseguer. Se incluyeron tanto pacientes monoinfectados por VHC, como coinfectados por VHC y VIH. Se excluyeron pacientes tratados con regímenes a bases de interferón y aquellos que no habían finalizado el tratamiento, o a los que aún no se les había realizado una prueba de detección de ARN del VHC tras finalizar el tratamiento a la conclusión del periodo de estudio.
Los pacientes que cumplían los criterios de inclusión fueron identificados a través de los formularios de solicitud de inicio de AAD y los formularios de seguimiento terapéutico registrados en la historia clínica informatizada (Selene®).
Se analizaron variables sociodemográficas (sexo y edad), genotipo del VHC, existencia o ausencia de coinfección por VIH, tipo de paciente naïve (NV), no respondedor (NR), respondedor parcial (RP) o en recaída (RR) y la carga viral (CV). La CV se obtuvo pretratamiento, al finalizar el tratamiento y tras 12-24 semanas de haber finalizado el tratamiento, medida como niveles séricos de ARN del VHC en UI/mL. El estadio de la enfermedad hepática se estableció por biopsia y/o elastografía (Fibroscan®), clasificando la fibrosis según la escala METAVIR14, de F0 a F4, indicando F0 la ausencia de fibrosis y F4 cirrosis.
Respecto al régimen terapéutico empleado, se analizaron las siguientes variables: tipo de combinación de AAD utilizada, uso o no de RBV concomitante y duración del tratamiento.
Para el análisis de la efectividad, se evaluó la CV al finalizar el tratamiento y a partir de los 3 meses de haberlo finalizado. Se consideró RVS cuando la CV era indetectable a las 12 semanas de haber finalizado el tratamiento7. La presencia de viremia positiva a las 12 semanas de finalizar el tratamiento se consideró fracaso virológico. Se determinó el porcentaje de pacientes que alcanzaron RVS según diferentes subgrupos: monoinfectados o coinfectados, naïve o pretratados, genotipo viral y régimen terapéutico recibido.
Para el análisis de la seguridad se evaluaron los efectos adversos asociados al tratamiento y las interacciones farmacológicas detectadas. El grado de interacción y las recomendaciones realizadas se basaron en HEP Drug interactions®, de la Universidad de Liverpool8.
Para las variables clínicas y demográficas de la población de estudio, las variables continuas se expresan como media y rango o como mediana y el rango intercuartil (IQR). Las variables cualitativas se presentan como frecuencias absolutas y relativas. Se empleó la prueba de chi-cuadrado y la prueba exacta de Fisher para comparar las características de los pacientes monoinfectados y coinfectados y los tratamientos empleados, según la presencia o ausencia de coinfección por VIH. El porcentaje de pacientes con RVS y los intervalos de confianza (IC) del 95% se calcularon para los subgrupos estudiados.
Una vez seleccionados los pacientes, los datos de la base de datos se anonimizan asignando un número correlativo a cada paciente y desvinculando este número con el número de historia.
RESULTADOS
Datos clínicos y demográficos
Se incluyeron 303 pacientes diagnosticados de hepatitis C y tratados con AAD, de los cuales 235 (77,56%) eran monoinfectados y 68 (22,44%) presentaban coinfección con VIH. Las principales características demográficas se representan en la tabla 1.
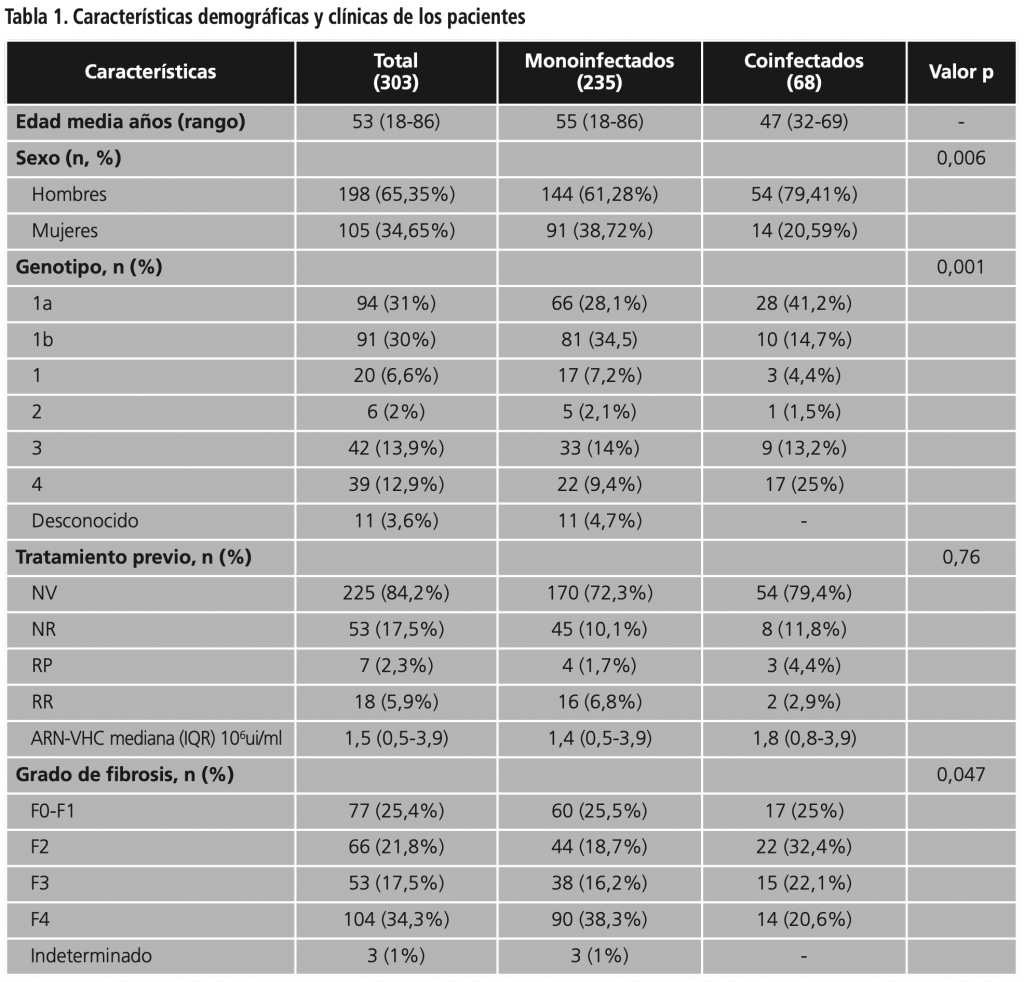
La gran mayoría de los pacientes incluidos eran hombres, destacando su mayor proporción en el grupo de los coinfectados (p<0,05). El genotipo más frecuente en nuestros pacientes fue el 1 (67,6%), con una mayor proporción de 1b en los monoinfectados y 1a en los coinfectados. El genotipo 4 también aparece en mayor proporción en los coinfectados (25 vs. 9,4%; p=0,001). En cuanto al grado de fibrosis, la mayoría de los pacientes presentaba un alto grado de fibrosis (F3-4 51,8%), observándose los valores más altos (F4) en el grupo de los monoinfectados (38,3% vs. 20,6%; p=0,047).
Referente al tratamiento empleado, en la tabla 2 se recogen los diferentes tratamientos empleados junto a su distribución temporal.
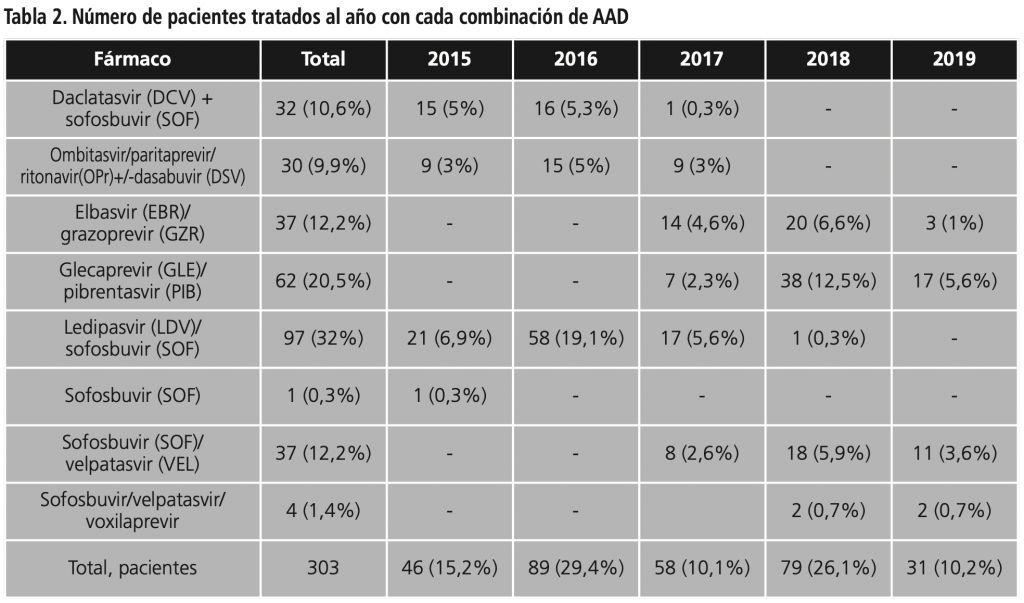
El tratamiento más utilizado fue LDV/SOF, seguido de GLE/PIB en mayor proporción que el resto de tratamientos. Según años, se observó una disminución del uso de LDV/SOF junto a un aumento de GLE/PIB. En cuanto al número de pacientes tratados, fue mayor en 2016 y 2018, con una clara disminución en 2017 y 2019 (p<0,0001).
Comparando los tratamientos en los pacientes coinfectados y monoinfectados, la combinación LDV/SOF fue la más común en los coinfectados (55,88%) y LDV/SOF junto a GLE/PIB en monoinfectados (25,1% cada uno) (p<0,0001).
Respecto al tratamiento combinado con RBV, se utilizó en 59 (19,47%) pacientes, incorporándose principalmente a la combinación LDV/SOF (35,6%) durante 12 semanas en pacientes con alto grado de fibrosis y genotipo 1. De forma general, el uso de RBV fue mayor en pacientes con grado de fibrosis F4 (43/59) y duración del tratamiento de 12 o más semanas (59/59).
Sofosbuvir/velpatasvir/voxilaprevir se utilizó en 4 pacientes con fracaso virológico tras el uso de otros AAD.
Efectividad
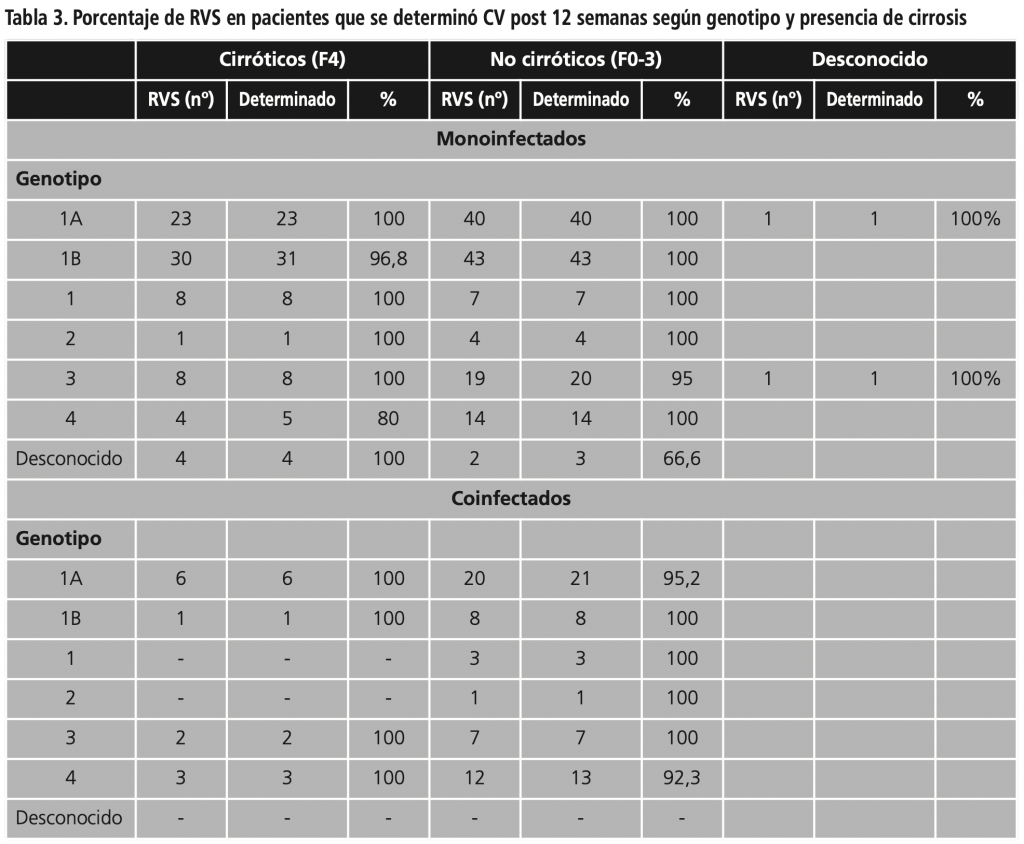
Para el análisis de efectividad sólo se incluyeron 302 pacientes, ya que un caso suspendió el tratamiento por efectos adversos. De los 302 pacientes, 23 pacientes no tenían análisis de CV para estimar la RVS, ya sea por pérdida de seguimiento o éxitus o por no haber transcurrido el tiempo suficiente desde el final del tratamiento. De los 279 pacientes restantes, un 97,8% (273/279) alcanzaron RVS, confirmándose 6 fracasos virológicos. Un total de 296 (98%) tuvieron CV indetectable al finalizar el tratamiento.
Los fracasos virológicos se dieron en 4 pacientes monoinfectados, dos tratados con DCV/SOF 12 semanas (uno de ellos junto a RBV), uno con LDV/SOF 12 semanas y uno con GLE/PIB 8 semanas, dos eran cirróticos, 2 eran NR, uno RR y uno NV, y tenían genotipos 1b, 3, 4 y sin determinar. Los otros dos pacientes eran coinfectados, tratados con LDV/SOF 12 semanas y GLE/PIB 8 semanas, no cirróticos, NV y con genotipos 1a y 4.
Los 4 pacientes tratados previamente con AAD que posteriormente habían iniciado sofosbuvir/velpatasvir/voxilaprevir respondieron al tratamiento.
La RVS fue superior al 95% en todos los grupos independientemente de la respuesta previa, excepto en los pacientes en recaída de forma no significativa (94%, p=0,077).
En la mayoría de los grupos de pacientes establecidos según la presencia o no de cirrosis, la coinfección por el VIH y el genotipo, la efectividad de los AAD se situó próxima o por encima del 90% (Tabla 3), excepto en aquellos con un escaso número de pacientes. Para el cálculo de los porcentajes sólo se tuvieron en cuenta los pacientes a los que se les determinó CV post-tratamiento a las 12 semanas.
Seguridad e interacciones
En cuanto a la seguridad, el tratamiento fue muy bien tolerado. Únicamente un paciente tratado con dasabuvir+ombitasvir+paritaprevir+ritonavir suspendió el tratamiento antes de su finalización, por la aparición de toxicidad generalizada grado 2. Sólo se notificó una reacción adversa grado 3 de tipo dérmico en un paciente tratado con ledipasvir+sofosbuvir, que no llevó a la suspensión del tratamiento.
Aun así, apareció toxicidad de cualquier grado en 105 (34,65%) de los pacientes.
En la tabla 4 se ha resumido el tipo de toxicidad según su grado y tipo de paciente. En cuanto a toxicidad neurológica, se incluyeron principalmente cuadros de cefaleas o mareos y trastornos del sueño; como toxicidad digestiva, la presencia de naúseas, diarrea o dolor en los hipocondrios; toxicidad hematológica a la afectación de alguna de las series sanguíneas; toxicidad dérmica la presencia de prurito o erupciones; toxicidad generalizada la presencia de astenia o cansancio, pérdida de apetito o peso. Los porcentajes se representaron respecto al total de pacientes.
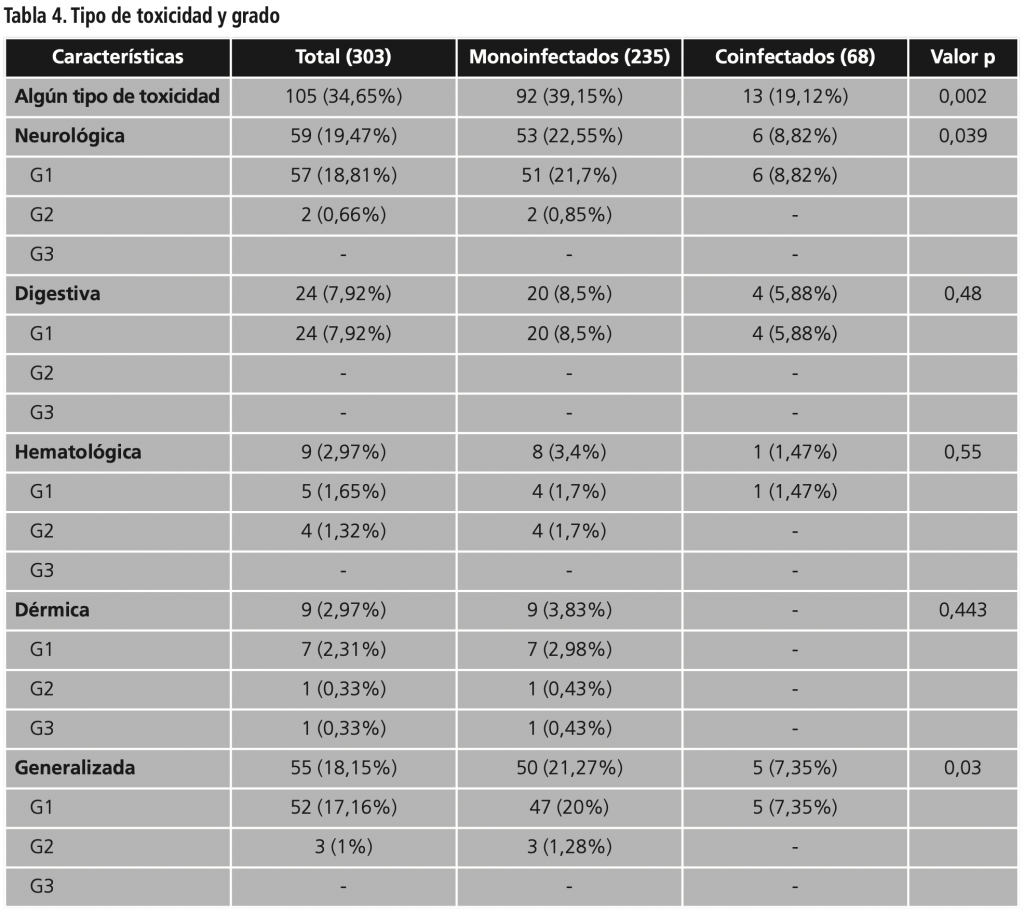
Como toxicidades raras o poco frecuentes destacaron la aparición en casos aislados de irritabilidad, trastornos sexuales, sequedad de boca o palpitaciones.
Respecto al análisis de las interacciones medicamentosas, se detectaron 86 interacciones en 63 (20,8%) pacientes diferentes. Las familias de fármacos más frecuentemente afectados fueron: protectores gástricos (26,74%), fármacos que afectan al sistema nervioso central (18,6%), antihipertensivos (15,11%), hipoglucemiantes (9,30%) y estatinas (8,14%). Cabe destacar que 4 pacientes tuvieron que modificar su tratamiento antirretroviral para poder iniciar tratamiento frente a la hepatitis C. Las medidas llevadas a cabo tras la detección de las interacciones fueron las siguientes: monitorización estrecha de posibles efectos adversos asociados a la interacción 16 (18,60%), reducción de dosis del fármaco implicado (25,58%), espaciar tomas entre el fármaco implicado y el tratamiento frente al VHC 36 (41,86%), suspender el fármaco implicado 7 (8,14%) o sustitución por equivalente terapéutico 5 (5,81%).
DISCUSIÓN
En este trabajo se ha analizado la efectividad del tratamiento a largo plazo de los fármacos contra la hepatitis C tras la inclusión de los AAD en la práctica clínica habitual.
Las cifras de RVS en pacientes tratados con AAD fueron muy elevadas en todos los grupos, al contrario que con los primeros fármacos para el tratamiento de la VHC que no superaban el 30-50%. Se ha demostrado que con las nuevas terapias esta RVS, al igual que en nuestro estudio, se encuentran por encima del 95%9.
Al comparar nuestros resultados con los ensayos clínicos de aprobación de los diferentes fármacos, y con otros estudios en vida real publicados a posteriori, las tasas de RVS fueron similares, o incluso ligeramente superiores a algunos estudios, con una tasa de RVS global del 97,8%10-17.
Al igual que en otros estudios, las tasas de respuesta se mantuvieron en niveles elevados independientemente del tipo de pacientes, incluso en aquellos considerados como difíciles de tratar como los pretratados o cirróticos18. En aquellos grupos que no se superar una RVS del 90% fue por un limitado grupo de pacientes, por lo que las cifras no fueron significativas. La mayoría de los pacientes tratados tenían un grado de fibrosis F4, aunque en global, prevalecían los no cirróticos, prevaleciendo en los primeros años tras comercialización de los AADs el tratamiento de pacientes cirróticos, mientras que en la actualidad se trata a todos los pacientes independientemente de su grado de fibrosis. Al analizar la respuesta por genotipo, al igual que ocurría con la presencia de cirrosis, se obtuvieron respuestas muy elevadas, excepto en aquellos subgrupos de pacientes muy reducidos donde las conclusiones obtenidas no fueron sólidas. Aun así, la RVS fue superior al 95% en casi todos los casos. Se han publicado estudios recientes que muestran que el aclaramiento del virus en pacientes tratados con AAD es muy similar en diferentes genotipos, por lo que en la actualidad, con la presencia de tratamientos pangenotípicos, esta característica adquiere una menor relevancia a la hora de seleccionar el tratamiento y la eficacia del mismo19,20.
El alto porcentaje de respuesta de los pacientes es debido a la elevada potencia de estos tratamientos, aunque pueden haber contribuido otros factores. En primer lugar, la baja tasa de suspensión del fármaco, con sólo un paciente. Otros estudios han obtenido tasas de abandono similares, concluyendo que la potencia y seguridad de estos fármacos supera los factores predictores de mala evolución descritos en otros estudios21. En nuestro trabajo, la toxicidad, aunque apareció en un número considerable de pacientes, fue en la mayoría de los casos leve y no requirió modificaciones del tratamiento. Otro factor importante es el estudio de posibles interacciones farmacológicas y el refuerzo de la adherencia al tratamiento, y que ha sido llevada a cabo mediante un trabajo en equipo de los servicios de Digestivo, Enfermedades Infecciosas y Farmacia Hospitalaria, favoreciendo la comunicación y el trabajo multidisciplinar. En nuestro estudio se detectaron interacciones en un 20% de los pacientes, tomando medidas como cambios de fármaco o modificaciones de dosis tras la comunicación médico prescriptor-farmacéutico, evitando así la aparición de reacciones adversas potenciales. Cada vez son más comunes los estudios que evalúan la importancia de estas interacciones, ya que los sujetos con VHC se asocian a elevada comorbilidad y consumo de otra medicación concomitante. Las cifras y el porcentaje de interacciones o relevancia de las mismas son variables según el estudio consultado22,23.
La obtención de estas cifras de RVS lleva a considerar los beneficios en salud y confirmar la posibilidad de cumplir el objetivo de erradicación de la infección, con una repercusión epidemiológica enorme, evitando nuevos casos de contagio. Sin embargo, el elevado coste de estos tratamientos tras su comercialización hizo necesario evaluar su impacto sobre el consumo de recursos sanitarios. Con el transcurso de los años ya ha sido analizado con un claro beneficio a medio-largo plazo, ya que, el coste del tratamiento se compensa con el ahorro en gasto sanitario. El impacto presupuestario anticipó un ahorro neto a partir del tercer año. Como parámetros clave, la disminución del precio del tratamiento con el tiempo y la RVS cercana al 100% de los pacientes tratados24.
Multitud de estudios han demostrado que el daño hepático se frena en pacientes con RVS tratados con AAD, por lo que el pronóstico de pacientes con niveles bajos de fibrosis será muy similar al resto de la población25. Estos resultados no parecen tan claros en pacientes con cirrosis, aunque algunos estudios si apuntan a una mejora leve en el grado de cirrosis26, aun así, son necesarios más estudios en ese tema. Según las guías, los pacientes con fibrosis no moderada (puntuación METAVIR F0-F2), con RVS y sin conductas de riesgo deben ser dados de alta, siempre que no tengan otras comorbilidades, mientras que los pacientes con fibrosis avanzada (F3) o cirrosis (F4) con RVS deben someterse a vigilancia cada 6 meses mediante ecografía27.
Las principales limitaciones de este trabajo son los sesgos asociados a un estudio retrospectivo y, a pesar del elevado número de pacientes, el bajo número de pacientes presentes en ciertos subgrupos, por lo que no se pueden extrapolar comparaciones entre los diferentes regímenes o llegar a conclusiones sobre resultados según diferentes características de los pacientes.
Este estudio analiza los resultados del tratamiento con AAD durante varios años en una serie de pacientes con hepatitis C crónica, confirmando una alta tasa de RVS en condiciones de práctica clínica, siendo los abandonos terapéuticos o la suspensión del tratamiento por efectos adversos escasos y leves.
Consideraciones éticas: De acuerdo a la Resolución 08430 de 1993 y la Resolución 2378 del 2008 del Ministerio De Salud. El estudio consiste en una simple recogida de datos clínicos y analíticos que no va a alterar el tratamiento de su médico ni las pruebas que le realizan habitualmente como paciente, previamente informado de los posibles riesgos y beneficios del mismo.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Millman AJ, Nelson NP, Vellozzi C. Hepatitis C: Review of the Epidemiology, Clinical Care, and Continued Challenges in the Direct Acting Antiviral Era. Curr Epidemiol Rep. 2017;4(2):174-85.
2. Prevalencia de la infección por hepatitis C en la población general en España; 2017-2018 Resultados del 2o Estudio de Seroprevalencia en España (2017 -2018) [Internet]. Disponible en: https://www.mscbs.gob.es/ciudadanos/ enfLesiones/enfTransmisibles/sida/docs/INFORME_INFECCION_VHC_ESPANA2019.pdf.
3. Terrault NA. Care of Patients Following Cure of Hepatitis C Virus Infection. Gastroenterol Hepatol. 2018;14(11):629-34.
4. Guss D, Sherigar J, Rosen P, Mohanty SR. Diagnosis and Management of Hepatitis C Infection in Primary Care Settings. J Gen Intern Med. 2018;33(4):551-7.
5. Juanbeltz R, Zozaya JM, Repáraz J, Castilla J, Sarobe MT, Úriz Otano JI, et al. Efectividad de los antivirales de acción directa de segunda generación en el tratamiento de la hepatitis C crónica. An Sist Sanit Navar. 2017;40:57-66.
6. López-Alonso G, Ágreda M, Devesa MJ, Cuenca F, Suárez A, Ortega L, et al. Resultados del tratamiento de la hepatitis crónica por VHC genotipo 4: Un análisis comparativo con el genotipo 1. Rev Esp Enfermedades Dig [Internet]. 2008 [citado 27 de enero de 2020];100(4). Disponible en: http://scielo.isciii.es/ scielo.php?script=sci_arttext&pid=S1130-01082008000400003& lng=en&nrm=iso&tlng=en.
7. EASL Recommendations on Treatment of Hepatitis C 2015. J Hepatol. 2015;63(1):199-236.
8. HEP drugs Interactions. University of Liverpool [Internet]. Disponible en: https://www.hep-druginteractions.org/checker; 2020 [consultado el 29 de enero de 2020].
9. Tran TT. Hepatitis C Virus Standard of Care: A Rapid Evolution and Considerations for Acute Hepatitis C Virus. Clin Liver Dis. 2018;12(5):130-2.
10. Asselah T. Daclatasvir plus sofosbuvir for HCV infection: An oral combination therapy with high antiviral efficacy. J Hepatol. 2014;61(2):435-8.
11. Ferenci P, Bourgeois S, Buggisch P, Norris S, Curescu M, Larrey D, et al. Real-world safety and effectiveness of ombitasvir/paritaprevir/ritonavir ± dasabuvir ± ribavirin in hepatitis C virus genotype 1- and 4-infected patients with diverse comorbidities and comedications: A pooled analysis of post-marketing observational studies from 13 countries. J Viral Hepat. 2019;26(6):685-96.
12. Papudesu C, Kottilil S, Bagchi S. Elbasvir/grazoprevir for treatment of chronic hepatitis C virus infection. Hepatol Int. 2017;11(2):152-60.
13. Persico M, Aglitti A, Milella M, Coppola C, Messina V, Claar E, et al. Real‐life glecaprevir/pibrentasvir in a large cohort of patients with hepatitis C virus infection: The MISTRAL study. Liver Int. 2019;39(10):1862-1859. doi: 10.1111/liv.14170.
14. Keating GM. Ledipasvir/Sofosbuvir: A Review of Its Use in Chronic Hepatitis C. Drugs. 2015;75(6):675-85.
15. Yoshida EM, Sulkowski MS, Gane EJ, Herring RW, Ratziu V, Ding X, et al. Concordance of sustained virological response 4, 12, and 24 weeks post-treatment with sofosbuvir-containing regimens for hepatitis C virus. Hepatology. 2015;61(1):41-5.
16. Younossi ZM, Stepanova M, Feld J, Zeuzem S, Jacobson I, Agarwal K, et al. Sofosbuvir/velpatasvir improves patient-reported outcomes in HCV patients: Results from ASTRAL-1 placebo-controlled trial. J Hepatol. 2016;65(1):33-9.
17. Llaneras J, Riveiro-Barciela M, Lens S, Diago M, Cachero A, García-Samaniego J, et al. Effectiveness and safety of sofosbuvir/velpatasvir/voxilaprevir in patients with chronic hepatitis C previously treated with DAAs. J Hepatol. 2019;71(4):666-72.
18. Horsley-Silva JL, Vargas HE. New Therapies for Hepatitis C Virus Infection. Gastroenterol Hepatol. 2017;13(1):22-31.
19. May S, Kurmoo F, Iliffe M, David J, Patel A, Wiselka M, et al. Comparative hepatitis C genotype 1-3 viral load kinetics in response to directly-acting antiviral therapy. J Infect. 2020;S0163445320300359.
20. Pol S, Parlati L. Treatment of hepatitis C: the use of the new pangenotypic direct-acting antivirals in “special populations”. Liver Int. 2018;38:28-33.
21. Crestelo DR, Cola MR, Gasca FJG, Martínez PG, Moya OB, Alfaro EM, et al. Efectividad del tratamiento con agentes antivirales directos en pacientes con coinfección por VHC y VIH. Estudio de cohorte multicéntrico. Rev Esp Enferm Dig. 2018;110(1):9.
22. Pino Marín DE, Amariles P, Peláez Alvárez JA, Alvárez Osorio GP, González Ceballos J. Aproximación para establecer y evaluar la relevancia clínica de las interacciones medicamentosas en el tratamiento de pacientes infectados con virus de hepatitis C, revisión estructurada (actualización 2015 – 2017). Rev Colomb Gastroenterol. 2019;34(2):159-76.
23. Sicras Mainar A, Navarro Artieda R, Hernández I, Morillo R. Prevalencia de las potenciales interacciones medicamentosas entre los antivirales de acción directa pangenotípicos y la medicación concomitante asociada a los pacientes con infección del virus de la hepatitis C crónica en España. Gastroenterol Hepatol. 2019;42(8):465-75.
24. Mar J, Ibarrondo O, Martínez-Baz I, Juanbeltz R, San Miguel R, Casado I, et al. Economic evaluation of a population strategy for the treatment of chronic hepatitis C with direct-acting antivirals. Rev Esp Enfermedades Dig [Internet]. 2018 [citado 10 de febrero de 2020];110. Disponible en: https://online.reed. es/fichaArticulo.aspx?iarf=230639254148-678297282469
25. Mauro E, Crespo G, Montironi C, Londoño M-C, Hernández-Gea V, Ruiz P, et al. Portal pressure and liver stiffness measurements in the prediction of fibrosis regression after sustained virological response in recurrent hepatitis C: Mauro et al. Hepatology. 2018;67(5):1683-94.
26. Garg G, Dixit VK, Shukla SK, Singh SK, Sachan S, Tiwari A, et al. Impact of Direct Acting Antiviral Drugs in Treatment Naïve HCV Cirrhosis on Fibrosis and Severity of Liver Disease: A Real Life Experience from a Tertiary Care Center of North India. J Clin Exp Hepatol. 2018;8(3):241-249.
27. Pawlotsky J-M, Negro F, Aghemo A, Berenguer M, Dalgard O, Dusheiko G, et al. EASL Recommendations on Treatment of Hepatitis C 2018. J Hepatol. 2018;69(2):461-511.
____