Villaverde Piñeiro L1, Cachafeiro Pin AI2, Otero Logilde A2
1 Facultativa Especialista en Farmacia Hospitalaria. Servicio de Farmacia. Hospital Público de Monforte de Lemos. Lugo (España)
2 Facultativa Especialista en Farmacia Hospitalaria. Servicio de Farmacia. Hospital Público de la Mariña. Lugo (España)
Fecha de recepción: 24/05/2022 – Fecha de aceptación: 15/06/2022
Correspondencia: Laura Villaverde Piñeiro — Hospital Público de Monforte de Lemos (Servicio de Farmacia) – Rúa Corredoira, s/n – 27400 Monforte de Lemos – Lugo (España)
lvillaverdepineiro@gmail.com
____
RESUMEN
Objetivo: El objetivo de esta revisión es analizar la bibliografía disponible sobre la efectividad y seguridad del colirio de insulina en los defectos epiteliales persistentes (DEP).
Métodos: Mediante la metodología PRISMA, se seleccionaron artículos publicados desde 1981 hasta diciembre de 2021, sobre la efectividad y seguridad del colirio de insulina en pacientes adultos o pediátricos con diagnóstico de patología corneal. Las bases de datos consultadas fueron Medline, Embase y Cochrane Library. Los términos utilizados para la búsqueda fueron: “Epithelium, Corneal”; “Corneal Ulcer” e “Insulin”.
Resultados: Se localizaron 15 publicaciones en Medline, 30 en Embase, 0 en Cochrane Library y 1 mediante búsqueda libre. Los resultados fueron revisados por pertinencia. Se estudiaron 115 ojos de 113 pacientes. La concentración de 1 UI/ml y la pauta 4 veces al día fueron las más habitualmente prescritas. El tiempo hasta el cierre del DEP osciló entre 2,5 y 114 días, alcanzando el cierre completo en la mayoría de los estudios en menos de 7 días.
Conclusiones: El tratamiento de los DEP refractarios con insulina tópica resultó efectivo y seguro. Además ofrece ventajas frente a otras alternativas entre las que destacan su coste, menor tiempo requerido hasta el cierre del DEP, supresión de la exposición ocupacional del elaborador y menor incomodidad para el paciente. Todo ello, podría contribuir a su posicionamiento como mejor alternativa de primera línea. Subyace la necesidad de realizar más ensayos clínicos controlados para confirmar estos hallazgos.
Palabras clave: Epitelio corneal, úlcera corneal, insulina, queratopatía diabética, defecto epitelial persistente.
Topical insulin in the treatment of persistent epithelial defects: a review
SUMMARY
Objective: The aim of this review is to analyze the available literature on the effectiveness and safety of insulin eye drops in persistent epithelial defects (PEDs).
Methods: Based on PRISMA methodology articles published from 1981 to December 2021, on the effectiveness and safety of insulin eye drops in adult or pediatric patients with diagnosis of corneal pathology were selected. Databases consulted were Medline, Embase and Cochrane Library. erms used were: “Epithelium, Corneal”; “Corneal Ulcer “and “Insulin”.
Results: 15 publications were located in Medline, 30 in Embase, 0 in Cochrane Library and 1 by free search. 115 eyes of 113 patients were studied. The concentration of 1 IU/ml and four times a day dosing were the most commonly prescribed. Time until PED closure was achieved ranged from 2.5 days to 114 days, achieving complete closure in most studies in less than 7 days.
Conclusions: Treatment of refractory PEDs with topical insulin was effective and safe. It also offers advantages over other alternatives, including its cost, less time required to close the PED, suppression of occupational exposure, as well as reduced discomfort for the patient. This could contribute to its positioning as the best first-line alternative. There is an underlying need for more controlled clinical trials to confirm these findings.
Key words: Epithelium, corneal, corneal ulcer, insulin, diabetic keratopathy, persistent epithelial defect.
____
INTRODUCCIÓN
Las úlceras corneales se definen como un defecto o pérdida de la capa epitelial que afecta al estroma subyacente1. En condiciones normales, su resolución es espontánea debido a la capacidad proliferativa del epitelio corneal, pero en ocasiones no se obtiene respuesta, pese a terapia convencional, evolucionando hacia diferentes manifestaciones que van desde el defecto epitelial persistente (DEP) hasta la fusión del estroma2.
Las úlceras corneales refractarias suponen un reto terapéutico. Se distinguen dos estrategias para su abordaje: el tratamiento conservador (no invasivo) o el tratamiento quirúrgico, cuando existe riesgo de perforación. Dentro del tratamiento no invasivo se incluyen: la retirada de colirios con conservantes del tratamiento del paciente, la prescripción y administración intensiva de lágrimas humectantes sin conservantes y utilización de lente de contacto terapéutica u oclusión puntual del ojo afecto, siempre comprobando la correcta adherencia terapéutica al tratamiento. El uso del colirio suero autólogo o de plasma rico en plaquetas también ha demostrado ser eficaz3,4.
En cuanto a las alternativas de tratamiento emergentes encontramos el factor de crecimiento nervioso recombinante (NGF)5 y la insulina tópica. Si bien existen diferentes hipótesis sobre el mecanismo de acción de la insulina a nivel ocular, se ha postulado que el factor de crecimiento similar a la insulina-1 (IGF-1) induce el crecimiento, diferenciación y proliferación de células epiteliales corneales, promoviendo la cicatrización de los DEP6.
La utilización de insulina en el tratamiento de úlceras corneales fue descrito por primera vez en 5 casos en el año 19457, sin especificar si se trataba o no de pacientes diabéticos. En uno de los casos se administró insulina tópica (sin precisarse la concentración empleada ni la posología) y en los 4 casos restantes por vía sistémica, observándose mejoría en todos ellos.
Dado el número limitado de estudios de la utilización insulina tópica en los DEP, la escasez de datos homogéneos y la falta de comparación con las opciones de tratamiento establecidas nos planteamos la realización de esta revisión bibliográfica de la literatura, como respuesta al incremento de la prescripción del colirio de insulina desde los servicios de oftalmología. Como objetivo principal se plantea conocer la eficacia y/o efectividad tras recibir tratamiento con colirio de insulina en pacientes adultos y/o pediátricos con diagnóstico de patología corneal. Como objetivo secundario se plantea conocer la seguridad reportada, procedente de la evidencia disponible sobre su utilización hasta la actualidad.
MÉTODOS
Estrategia de búsqueda y selección de artículos
Se realizó una revisión bibliográfica basada en Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA)8 con el objetivo de localizar, seleccionar, analizar y sintetizar artículos disponibles en inglés, castellano, francés, italiano y alemán publicados desde el 1 de enero de 1981 hasta el 20 de diciembre de 2021
Se eligieron los siguientes términos MeSH como descriptores más adecuados para realizar la búsqueda: «Epithelium, Corneal»,»Insulin» y «Corneal Ulcer». Se realizó una estrategia de búsqueda restringida en Medline, Embase y Cochrane Library, combinando, mediante operadores booleanos todos los descriptores de la siguiente manera: («Epithelium, Corneal» OR «Corneal Ulcer») AND «Insulin».
Los criterios de selección de los artículos se resumen en la tabla 1.
Para tratar de minimizar el silencio bibliográfico asociado a utilizar términos MeSH, se amplió mediante búsqueda libre, siguiendo el apartado “ver artículos similares” disponible en Medline.
La selección de artículos fue realizada por dos revisores independientes. En caso de discrepancia, la tercera farmacéutica del equipo resolvió las diferencias.
Extracción de datos
De las referencias incluídas se extrajeron los siguientes datos: referencia (título, autor y año), tipo de publicación, localización geográfica, características de los pacientes (número de pacientes, edad media, género, antecedente de diabetes mellitus), patología corneal, concentración y pauta posológica utilizada del colirio de insulina, duración del tratamiento, efectividad y seguridad.
RESULTADOS
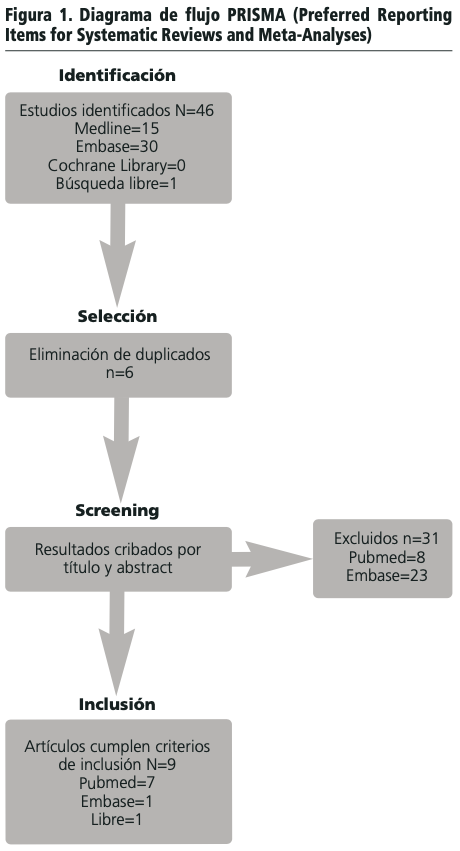
Siguiendo la estrategia de búsqueda en ambas bases de datos, tras la eliminación de duplicados (n=6), se realizó la selección sobre 39 artículos ,aplicando los criterios de inclusión y exclusión (tabla 1), en base a su título y resumen. Se incluyeron 8 (20,5%) y se excluyeron 31 (79,5%) publicaciones, tal y como puede observarse en la figura 1.
Los motivos de exclusión de las 31 referencias fueron los siguientes: estudios que no evaluaron la efectividad y seguridad del colirio de insulina (n=19), estudios in vitro que analizaron la función de la insulina y su mecanismo de acción a nivel ocular (n=6), estudios realizados en animales (n=2) y otros motivos (n=4).
Tras la ampliación de la búsqueda, mediante la estrategia “búsqueda libre” se localizó un nuevo artículo que cumplió los criterios de inclusión. Se analizaron, por tanto, un total de 9 estudios.
Las principales características de los mismos se resumen a continuación y en la tabla 2:
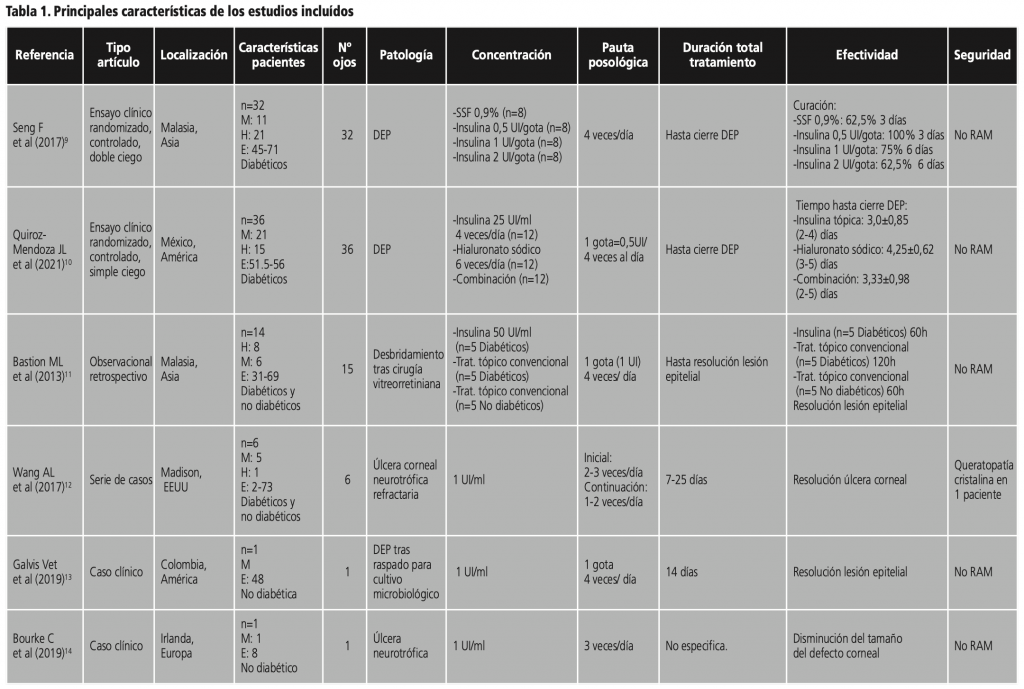
Seng F et al. (2017)9 desarrollaron en Malasia un ensayo clínico randomizado, controlado con placebo y doble ciego, con el objetivo de determinar el efecto del colirio de insulina sobre la cicatrización de heridas del epitelio corneal a tres concentraciones diferentes en el postoperatorio de cirugía vitreorretiniana. Los 32 pacientes diabéticos, de entre 45-71 años, fueron aleatorizados en 4 grupos iguales (8 ojos por grupo, en total 32 ojos) en los que se administró el tratamiento 4 veces al día: suero salino fisiológico (0,9%) tópico, insulina tópica 0,5 UI/gota, insulina tópica 1 UI/gota e insulina tópica 2 UI/gota. Para elaborar las tres concentraciones de insulina descritas se partió de una concentración de insulina 25 UI/ml (asumiendo que 1 gota de 25 UI/ml= 0,5 UI/gota). El tratamiento se suspendió una vez que se produjo la cicatrización del DEP y los pacientes fueron dados de alta. Fueron evaluados en la clínica 1 semana y 1 mes más tarde. La insulina tópica administrada a 0,5 UI/gota resultó superior al resto de concentraciones estudiadas, logrando una tasa de curación del 100% dentro de las 72 horas de tratamiento, diferencia estadísticamente significativas en comparación con el grupo de control en la tasa media de cicatrización de heridas epiteliales corneales, con el 62,5% en el grupo de cloruro sódico tópico 0,9%, 75% en el grupo 1 UI/gota y 62,5% en 2 UI/gota. No se notificaron efectos adversos.
El siguiente estudio, es otro ensayo clínico, simple ciego, randomizado y controlado llevado a cabo en México en el año 2021 por Quiroz-Mendoza JL et al.10 Su objetivo fue comparar el efecto de la insulina, hialuronato sódico y el tratamiento combinado de ambos, sobre el tiempo hasta cierre completo del DEP tras desbridamiento corneal transquirúrgico durante vitrectomía pars plana en 36 ojos de 36 pacientes diabéticos, rango mediana edad entre los 51,5-56 años. Los pacientes fueron aleatorizados en 3 grupos iguales (insulina tópica, hialuronato o combinación) en los que se administró el tratamiento 4 veces al día en el caso de insulina tópica (0,5 UI/gota) y seis veces al día el hialuronato sódico tópico. La evaluación clínica del DEP y las fotografías se realizaron todos los días hasta el cierre completo del DEP, momento en el que se suspendía el tratamiento. Se elaboró el colirio de insulina a una concentración de 25 UI/ml (0,5 UI/gota). El tiempo necesario hasta el cierre del DEP fue de 4,25±0,62 (rango: 3-5) días en el grupo hialuronato, 3,0±0,85 (rango: 2-4) días en insulina tópica y 3,33±0,98 (rango: 2-5) días para la combinación. Se observaron diferencias estadísticamente significativas tanto en el porcentaje de reducción del área del defecto epitelial como en porcentaje de reepitelización en el grupo que recibió insulina frente a hialuronato. No se reportaron efectos adversos.
En el artículo original de Bastion ML et al. (2013)11 se realiza un análisis retrospectivo, en el Departamento de Oftalmología de un Centro Médico de la Universidad Kebangsaan (Malasia), con el objetivo de determinar el efecto de la insulina tópica, aplicada a una concentración de 50 UI/ml y con pauta de 1 gota cuatro veces al día iniciado en el postoperatorio, sobre la cicatrización del epitelio corneal tras una cirugía vitreorretiniana en pacientes diabéticos. Se incluyeron 15 ojos de 14 pacientes (una paciente diabética recibió tratamiento con insulina en el ojo derecho y tratamiento convencional en el izquierdo): 8 hombres (5 diabéticos) y 6 mujeres (4 diabéticas), con edades comprendidas entre 31 y 69 años. Los pacientes fueron asignados en 3 grupos en función del tratamiento tópico recibido en el postoperatorio: pacientes diabéticos que reciben insulina tópica, N=5; pacientes diabéticos que reciben tratamiento tópico convencional, N=5 y pacientes no diabéticos que reciben tratamiento tópico convencional, N=5. Hubo una paciente diabética, mujer, que recibió tratamiento con insulina tópica en ojo derecho y tratamiento tópico convencional en ojo izquierdo. Como tratamiento tópico convencional se aplicaron ciprofloxacino hidrocloruro 0,3%, maleato de timolol 0,5%, tartrato de brimonidina 0,1%, dexametasona 0,1% y pomada con cloranfenicol 1% p/p. Para visualizar el efecto de la insulina en pacientes diabéticos frente al tratamiento tópico convencional, se fotografiaron las lesiones desde el inicio del tratamiento con insulina hasta la resolución de la lesión.
La administración tópica de insulina en concentración de 50 UI/ml con pauta de 1 UI (1 gota) cuatro veces al día dió lugar a la cicatrización del epitelio corneal en pacientes diabéticos a las 60 h frente a las 120 h en pacientes diabéticos que recibieron tratamiento convencional. El tiempo de cicatrización en los pacientes no diabéticos que recibieron tratamiento convencional fue de 60 h.
En el artículo de Wang AL et al. (2017)12 se exponen 6 ojos afectos de 6 pacientes con diagnóstico de úlceras corneales neurotróficas refractarias al tratamiento convencional. Se trata de 5 mujeres (una diabética) y 1 hombre con edades comprendidas entre los 2 a 73 años. Fueron tratados con insulina tópica a una concentración de 1 UI/ml con pauta de 2-3 veces/día, obteniéndose resolución de la úlcera corneal tras 7-25 días de tratamiento. Tres pacientes continuaron el tratamiento durante unos meses más, con pauta de 1-2 veces/día. Una de las pacientes (no diabética) desarrolló queratopatía cristalina. En ese momento llevaba 4 meses a tratamiento con insulina tópica (tras cierre de defecto a los 8 días de tratamiento).
Por su parte, Galvis V et al. (2019)13 describen el caso de una mujer de 48 años sometida a una resección de neurinoma del nervio acústico izquierdo (un ojo afecto), siendo evaluada reiteradamente por persistencia de síntomas y signos de mala evolución tras la cirugía. Los diagnósticos realizados en las diferentes valoraciones incluyen parálisis facial periférica izquierda, úlcera paracentral temporal y cultivo microbiológico positivo tras un raspado corneal. Todos ellos recibieron como tratamiento hialuronato de sodio 0,4% y oclusión palpebral nocturna en el primer diagnóstico, corticoide y antibiótico tópico en el segundo diagnóstico y dos antibióticos tópicos dirigidos por antibiograma en el tercer diagnóstico, con evolución favorable de la infección pero desfavorable de la lesión corneal; por lo que añaden al tratamiento un antioxidante, antibiótico oral y plasma autólogo enriquecido, sin éxito terapéutico. Una nueva valoración conduce al diagnóstico de úlcera neurotrófica, inicialmente tratada con lente de contacto terapéutica sin éxito, procediendo a su retirada. Seguidamente se inicia tratamiento con insulina tópica 1 gota 4 veces/día (concentración 1 UI/ml) y recolocación de lente terapéutica, con resolución de la lesión tras 14 días de tratamiento y posterior retirada de la lente. Los autores concluyen un efecto beneficioso de la insulina tópica en esta paciente, sin poder determinar si el resultado hubiese sido el mismo sin recolocar la lente.
En el artículo de Bourke C et al. (2019)14 se expone el caso clínico de una paciente de 8 años (1 ojo afecto), diagnosticada y tratada en el Hospital Universitario Temple Street Children (Irlanda). La paciente presentó un diagnóstico de úlcera neurotrófica en su ojo izquierdo, la cual se trató inicialmente con corticoide tópico y lubricación. Posteriormente desarrolló un hipopión, siendo ingresada en el hospital y tratada con antibiótico tópico y oral con buena evolución, con posterior alta y tratamiento domiciliario. Fue reevaluada en una semana, iniciándose colirio de insulina a concentración de 1 UI/ml y pauta de tres veces al día, observándose una disminución de la lesión corneal en las semanas posteriores.
Los autores concluyen que el tratamiento de los DEP con insulina tópica es eficaz y seguro, haciendo referencia a los resultados in vitro realizados en modelos con animales diabéticos.
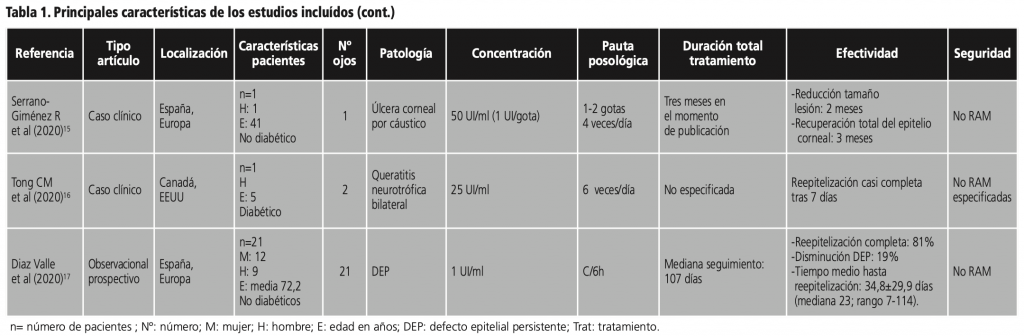
A su vez, Serrano-Giménez R et al. (2020)15 describen un caso clínico sobre la mejoría clínica tras administración de insulina tópica 50 UI/ml (1 UI/gota) en 1 ojo afecto de un varón de 41 años, no diabético, con historia de úlcera corneal de 4 años de duración con origen en salpicadura por cáustico, refractaria a tratamientos previos como antibióticos, corticoides, diclofenaco y suero autólogo. La pauta posológica fue 1-2 gotas 4 veces al día. Dos meses después del inicio del tratamiento, se encontró una clara reducción en el tamaño de la úlcera, y tras tres meses de tratamiento, se consiguió la recuperación total del epitelio corneal. No se detectaron toxicidades. En el momento de la publicación se mantenía el tratamiento. La retirada gradual se valoraría más adelante.
En el estudio de Tong CM et al. (2020)16 se describe un caso de un paciente varón de 55 años diabético, diagnosticado de queratitis neurotrófica bilateral refractaria a lágrimas artificiales, moxifloxacino y prednisolona oftálmicas, valaciclovir oral, lentes de contacto y tarsorrafia. No había evidencia de retinopatía diabética. Tras recibir durante una semana insulina tópica 25 UI/ml seis veces al día, en ambos ojos, se produjo una reepitelización casi completa de las úlceras. No se especifica si hubo o no efectos adversos al tratamiento.
Para finalizar, el último de los estudios incluídos fue el realizado por Díaz Valle et al. (2020)17 en Madrid, observacional prospectivo, con el objetivo de evaluar la efectividad del colirio de insulina, que incluyó 21 ojos de 21 pacientes adultos diagnosticados de DEP refractarios a otros tratamientos entre los que destacan colirios de vancomicina, ceftazidima,moxifloxacino, ganciclovir, ciclosporina, plasma enriquecido en plaquetas y suero autólogo, entre otros. Fueron tratados con colirio de insulina a una concentración de 1 UI/ml cada 6 horas. Las variables principales fueron la tasa y el tiempo hasta la curación completa del defecto epitelial. Los ojos de 17 pacientes (81%) con DEP refractarios se habían reepitelizado y 4 pacientes (19%) aún presentaban un defecto epitelial al final del período de seguimiento del estudio, aunque había disminuido su tamaño. En los pacientes en los que se alcanzó el cierre del DEP, el tiempo medio hasta la reepitelización fue de 34,8±29,9 días (mediana 23; rango 7-114 días). En los restantes, se alcanzó una reducción media del área de DEP en el 91,5%. No se produjeron efectos adversos.
DISCUSIÓN
Los resultados de nuestra revisión confirman la efectividad del colirio de insulina en el cierre de los DEP, lo que ratifica el auge en su prescripción. La alternativa de tratamiento en nuestro medio, el colirio de suero autólogo, reporta en los estudios tasas de curación que oscilan entre el 43,8% y 62,5% tras 2-4 semanas de tratamiento a concentración de 20% y del 68% tras 4 semanas de tratamiento a la concentración de 50%16. En el estudio de Díaz-Valle et al.18 se compara directamente el colirio de insulina y suero autólogo. En él se constata una mayor eficacia, con significación estadística, en el grupo de la insulina tópica 84% de epitelización frente al 48% en el colirio de suero autólogo. El tiempo medio hasta la reepitelización fue de 32,6±28,3 días (rango 4-124) y 82,6±82,4 días (rango 13-231) (p=0,011), respectivamente. Por tanto, se demuestra que el colirio de insulina tiene mayores tasas de reepitelización y cierre completo del DEP, produciéndose éste en menos tiempo, lo que podría contribuir a su posicionamiento como mejor alternativa terapéutica de primera línea. Por otra parte, el factor de crecimiento nervioso recombinante (NGF), medicamento huérfano aprobado en DEP por la EMA y la FDA en agosto de 2018 (Oxervate®, cenegermin)19, no se considera una alternativa factible en la práctica clínica pues cuenta con una resolución expresa de no financiación en el Sistema Nacional de Salud. El coste del tratamiento completo son 136.000 euros, cifra escandalosamente dispar e inasumible con respecto al coste del tratamiento con colirio de insulina (25 UI/ml estabilidad 9 días, matriz de riesgo intermedio): 40,69 euros para 114 días de tratamiento (duración máxima de tratamiento descrita en los estudios). La formulación magistral oftálmica se posiciona, por tanto, como una valiosa estrategia para paliar el vacío terapéutico existente en esta patología. En este ámbito los servicios de farmacia poseen un papel fundamental respecto a su elaboración y posterior control de calidad20.
En la revisión queda constatada, a su vez, la variabilidad de los tiempos requeridos hasta el cierre del DEP, por lo que subyace la necesidad de diseñar estudios que evalúen la efectividad del colirio de insulina durante períodos de tiempo predefinidos, por ejemplo de 7,10 o 14 días, para poder establecer la duración óptima inicial del tratamiento, minimizando a su vez el riesgo de padecer efectos adversos.
El tratamiento resultó seguro en los estudios analizados, pese a la controversia existente acerca de la toxicidad ocular del excipiente m-cresol, conservante y estabilizante de la molécula de insulina21 y los resultados de estudios sobre la toxicidad del colirio insulina en el ojo humano que concluyen que la insulina (100 UI / ml) en solución salina es bien tolerada22. La única reacción adversa reportada en los estudios revisados fue una queratopatía cristalina desencadenada en una paciente tratada con insulina tópica más allá del cierre del DEP. Este hecho abre el debate sobre qué beneficio adicional aporta prolongar el tratamiento y si podría traducirse en un compromiso de la seguridad. Una de las principales contribuciones al campo de esta revisión es que proporciona evidencia de que no existe mala evolución clínica tras la discontinuación de tratamiento una vez alcanzado el cierre del DEP y argumenta la necesidad de valorar su retirada una vez alcanzado el objetivo terapéutico.
En cuanto al perfil de pacientes, los estudios revisados incluyen pacientes con DEP de todos los grupos de edad, tanto diabéticos como no diabéticos, todos ellos tratados de forma satisfactoria con insulina tópica. Esto es concordante con estudios previos: en pacientes diabéticos, tras iniciar tratamiento con insulina para su diabetes, también se observaron signos de mejoría en el aspecto de la córnea23 y el diagnóstico de diabetes mellitus se realiza, en ocasiones, en el seguimiento de las úlceras corneales estériles que no cicatrizan24. Queda constatada, por tanto, la efectividad de colirio de insulina en pacientes con esta patología pero existe la necesidad de generar nuevas evidencias para conocer si existen perfiles de pacientes que se podrían beneficiar más del tratamiento del DEP con colirio de insulina que otros. Sería conveniente la realización de más ensayos clínicos que comparen directamente la efectividad de la insulina tópica en diferentes subgrupos.
Asimismo, existen otros aspectos diferenciales y relevantes entre el colirio de insulina y colirio suero autólogo a tener en cuenta. Si bien ambos se preparan en el área estéril del Servicio de Farmacia, la elaboración del colirio de insulina no requiere el desplazamiento del paciente al centro sanitario, permitiendo realizar la dispensación domiciliaria del mismo para pacientes que así lo requieran (dependientes y/o con dificultades visuales). Evitamos también realizar una extracción sanguínea, técnica invasiva desde el punto de vista del paciente y con riesgo de exposición ocupacional para el personal elaborador y además, una carga adicional de trabajo para laboratorio de análisis clínicos. Sería interesante conocer si su utilización como terapia de primera línea, podría traducirse tanto en una mejora de la calidad de vida del paciente, como en su satisfacción con el sistema sanitario, dada la menor incomodidad manifiesta tanto para el paciente como para sus familiares o personas de su entorno.
Los resultados de esta revisión deben ser interpretados teniendo en cuenta varias limitaciones potenciales. Por un lado, no disponemos de toda la evidencia científica, y por otro, no se ha hecho una revisión exhaustiva durante un periodo de tiempo prolongado para así recuperar, mediante alertas electrónicas, más artículos. Metodológicamente, uno de los problemas a abordar es la falta de homogeneidad en los estudios analizados: diferentes diseños, distintas etiologías del DEP y ausencia de uniformidad tanto en las concentraciones utilizadas (1,25 o 50 UI/ml) como en la duración de tratamiento. Se precisan más ensayos clínicos o estudios observacionales con un seguimiento prospectivo para comprobar cuál es la duración óptima que permita el cierre del DEP, evitando posibles recidivas, así como dilucidar la concentración más adecuada, inclusive valorando su individualización según las necesidades del paciente en el ámbito de la formulación magistral.
CONCLUSIONES
Los estudios descritos en esta revisión ponen de manifiesto que la insulina tópica como tratamiento del DEP refractario resulta efectiva y segura en la práctica clínica.
Además, en ella se subrayan las ventajas derivadas de su utilización frente a otras alternativas disponibles, entre las que destacan su coste, menor tiempo requerido hasta el cierre del DEP, supresión de la exposición ocupacional del elaborador así como una menor incomodidad para el paciente. Todo ello, podría contribuir a su posicionamiento como mejor alternativa de primera línea.
Subyace la necesidad de disponer de nuevos ensayos clínicos controlados para confirmar estos resultados. Esta revisión conforma el marco teórico en el que basar futuras investigaciones de campo.
Conflicto de intereses: Las autoras declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Byrd LB, Martin N. Corneal Ulcer. [Updated 2021 Aug 11]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan-. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK539689/.
2. Bremond-Gignac D,Daruich A, Robert MP, Chiambaretta F.Recent innovations with drugs in clinical trials for neurotrophic keratitis and refractory corneal ulcers. Expert opinion on investigationaldrugs. 2019;28(11):1013-20.DOI:10. 1080/13543784.2019.1677605.
3. Kim KM, Shin YT, Kim HK. Effect of autologous platelet-rich plasma on persistent corneal epithelial defect after infectious keratitis. Japanese journal of ophthalmology. 2012; 56(6): 544-50. DOI:10.1007/s10384-012-0175-y.
4. Rechichi M, Ferrise M, Romano F, Gallelli L, Toschi V, Dominijanni A, et al. Autologous platelet-rich plasma in the treatment of refractory corneal ulcers: A case report. American journal of ophthalmology case reports. 2020; 20:100838. DOI: 10.1016/j.ajoc.2020.100838.
5. Ahuja AS, Bowden FW, Robben JL. A Novel Treatment for Neurotrophic Corneal Ulcer Using Topical Cenegermin (OXERVATE™) Containing Recombinant Human Nerve Growth Factor.Cureus. 2020;12(11):e11724. DOI:10.7759/cureus.11724.
6.-Vaidyanathan U, Hopping GC, Liu HY, Somani AN, Ronquillo YC, Hoopes PC et al. Persistent Corneal Epithelial Defects: A Review Article. Med Hypothesis Discov Innov Ophthalmol. 2019 ;8(3):163-176.
7. Aynsley TR. The use of insulin in the treatment of corneal ulcers. Br J Ophthalmol. 1945;29:361-3.DOI: 10.1136/bjo.29.7.361.
8. Page MJ, Moher D, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. PRISMA 2020 explanation and elaboration: updated guidance and exemplars for reporting systematic reviews. BMJ 2021;372: n160. DOI:10.1136/bmj.n160.
9. Seng F, Amin A , Mushawiathi M,Umi Kalthum N, Mae-Lynn CB .Randomized Controlled Trial of Topical Insulin for Healing Corneal Epithelial Defects Induced During Vitreoretinal Surgery in Diabetics. Asia-Pacific Journal of Ophthalmology. 2017(6):418-24.DOI: 10.22608/APO.201780.
10. Quiroz-Mendoza JL, García-Roa M, Romero-Morales V, Valera-Cornejo D, Vázquez-Membrillo M, Ramírez-Neria P, et al. Ensayo clínico de insulina tópica y hialuronato sódico en el tratamiento del defecto epitelial producido por el desbridamiento corneal transquirúrgico durante la vitrectomía vía pars plana en diabéticos. Rev Mex Oftalmol. 2021;95(2):63-70. DOI:10.24875/rmo. m20000146.
11. Bastion ML, Ling KP. Topical insulin for healing of diabetic epithelial defects?: A retrospective review of corneal debridement during vitreoretinal surgery in Malaysian patients. Med J Malaysia. 2013;68(3):208-16.
12. Wang AL, Weinlander E, Metcalf BM, Barney NP, Gamm DM, Nehls SM, et al. Use of Topical Insulin to Treat Refractory Neurotrophic Corneal Ulcers. Cornea. 2017 ;36(11):1426-28. DOI: 10.1097/ICO.000000000000129.
13. Galvis V, Niño CA, Tello A, Gómez MA. Insulina tópica en queratopatía neurotrófica tras resección de neurinoma del acústico. ARCH SOC ESP OFTALMOL. 2019;94(2):100-4.DOI: 10.1016/j.oftal.2018.06.003.
14. Bourke C, Fitz Simon S, Chamney S. A case of a neurotrophic corneal ulcer successfully treated with topical insulin. Irish Journal of Medical Science (1971-). 2019. 188(Suppl 4):S15-S20. DOI:10.1007/s11845-019-02025-4.
15. Serrano-Giménez R, Contreras-Macías E, García-Bernal A, Fobelo-Lozano MJ. Insulin eye drops for treating corneal ulcer in a non-diabetic patient: regarding a case. Farm Hosp. 2020;44(6):297-9. DOI: 10.7399/fh.11521.
16. Tong CM, Iovieno A, Yeung SN.Topical insulin for neurotrophic corneal ulcers. Can J Ophthalmol.2020;55(5):e170-e172. DOI:10.1016/j.jcjo.2020.04.001
17. Díaz-Valle D, Burgos-Blasco B, Gegundez-Fernandez JA, García-Caride S, Puebla García V, Peña-Urbina P, et al. Topical insulin for refractory persistent corneal epithelial defects. European Journal of Ophthalmology. 2021;31(5): 2280-86. DOI:10.1177/1120672120958307.
18. Diaz-Valle D, Burgos-Blasco B, Rego-Lorca D, Puebla-Garcia V, Perez-Garcia P, Benitez-Del-Castillo JM, et al. Comparison of the efficacy of topical insulin with autologous serum eye drops in persistent epithelial defects of the cornea. Acta ophthalmologica. 2021. Advance online publication. DOI:10.1111/aos. 14997.
19. FDA label information. Oxervate (cenegermin-bkbj). Full prescribing information.https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/761094s001lbl.pdf. Accessed January 20, 2022.
20. Real Decreto 175/2001, de 23 de febrero, por el que se aprueban las normas de correcta elaboración y control de calidad de fórmulas magistrales y preparados oficinales. Boletín Oficial del Estado nº 65 (16 de marzo de 2001). [consultado 15/12/2021]. Disponible en: https://www.boe.es/boe/dias/ 2001/ 03/16/pdfs/A09746-09755.pdf.
21. Modi KD, Gadge PV, Jain P, Pawar S, Shah RD, Ingole SA, et al. Clinical challenges with excipients in insulin formulations and role of concentrated insulin- Int J Basic Clin Pharmacol. 2019;8(4):821-826. DOI: 10.18203/2319-2003. ijbcp20191125.
22. Bartlett JD, Turner-Hensen A, Atchinson JA, Woolley TW, Pillion DJ. Toxicity of insulin administration chronically to human eye in vivo. J Ocul Pharmacol Th. 1994;10(1):101-7. DOI: 10.1089/jop.1994.10.101.
23. Loannidis AS, Zagora SL,Wechsler AW. A non-healing corneal ulcer as the presenting feature of type 1 diabetes mellitus: a case report. Journal of medical case reports.2011;5:539. DOI:10.1186/1752-1947-5-539.
24. Kutubi M, Smith A.Corneal ulcer as the presenting feature of type 2 diabetes mellitus. BMJ case reports.2018, bcr2018225557.DOI:10.1136/bcr-2018-225557.
____