Vidal López C1, Basco Gironés A2, Ríos Quito GL3, Salom Garrigues C4
1 Farmacia Hospitalaria. Hospital Universitari Sant Joan de Reus. Reus. Tarragona (España)
2 Unitat d’Atenció Farmacèutica. Regió Sanitària Camp de Tarragona. Servei Catalá de Salut. Tarragona (España)
3 Medicina Familiar y Comunitaria. CAP El Vendrell. El Vendrell. Tarragona (España)
4 Farmacia Hospitalaria. Hospital Universitari Joan XXIII. Tarragona (España)
Fecha de recepción: 09/09/2022 – Fecha de aceptación: 10/10/2022
Correspondencia: Carlos Vidal López – Hospital Universitario San Joan de Reus (Servicio de Farmacia) – Av. Dr Josep Laporte, 2 – 43204 Reus, Tarragona (España)
cvidlop@hotmail.com
____
RESUMEN
Objetivos: Conocer la prevalencia y severidad de las interacciones medicamentosas clínicamente relevantes en pacientes adultos en tratamiento quimioterápico ambulatorio, su asociación con comorbilidades y el empleo de medicamentos de alto riesgo, y los hándicaps para su evaluación.
Método: Estudio descriptivo, transversal de las interacciones entre la quimioterapia y la medicación concomitante. Evaluamos todas las prescripciones dos veces por semana durante un mes mediante Lexicomp® y www.drugs.com, clasificadas con el riesgo D o X en Lexicomp® y con severidad de moderada a grave para ambas. Se evaluó su relación con la edad, sexo, comorbilidades y medicamentos de alto riesgo con la severidad mediante una regresión logística multinomial.
Resultados: Se incluyeron 189 pacientes (60,6% varones, 62,4±10,9 años). El 66,8% padecían más de dos enfermedades crónicas, el 54,7% con al menos un medicamento de alto riesgo y el 70,9% con una interacción. De 567 interacciones, en 277 (48,85%) estaban implicados los antineoplásicos y se informó de 36 al prescriptor. Presentaban riesgo asociado 234 interacciones (22,40% D y 18,87% X). No se evidenció relación de las interacciones con la edad, pluripatología o polimedicación.
Conclusiones: La evaluación sistemática de interacciones, en tiempo real, al validar el tratamiento antineoplásico es compleja por falta de integración con otras prescripciones y bases de datos. Seleccionar las que deben reportarse es un proceso difícilmente sistematizable. Las aplicaciones de prescripción deberían permitirlo con eficiencia acorde a la actividad asistencial, aprovechando la estancia en el hospital de día para la revisión farmacéutica integral.
Palabras clave: Agente antineoplásico, interacciones farmacológicas, paciente oncológico, polifarmacia, atención ambulatoria, quimioterapia.
Review of drug interactions in ambulatory oncological treatments from a practical aproach
SUMMARY
Objectives: To understand the prevalence and severity of clinically relevant drug interactions in adult patients undergoing outpatient chemotherapy treatment, their association with comorbidities and the use of high-risk drugs, and the handicaps for their evaluation.
Methods: A descriptive, cross-sectional study of interactions between chemotherapy and concomitant medication was conducted. We evaluated all prescriptions twice a week for a month using Lexicomp® and www.drugs.com, which are classified as risk D or X in the case of Lexicomp® and with moderate to severe severity for both. We evaluated their relationship with age, sex, comorbidities, and high-risk medications with severity using multinomial logistic regression.
Results: A total of 189 patients participated in this study (60.6% male, 62.4±10.9 years). About 66.8% suffered from more than two chronic diseases, 54.7% were those with at least one high-risk medication, and 70.9% with an interaction. Of the 567 interactions, 277 (48.85%) involved antineoplastics, and 36 interactions were reported to the prescriber. There were 234 interactions that were associated with risk (22.40% D and 18.87% X). There was no evidence of any relationship between interactions and age, pluripathology, or polymedication.
Conclusions: The systematic evaluation of interactions when validating antineoplastic treatment, in real time, is complex. This is because of the lack of integration with other prescriptions and databases. Selecting the interactions to report is a difficult process to systematize. Prescription applications should allow this to be done efficiently according to each health care function, taking advantage of the day hospital stay for conducting a comprehensive pharmaceutical review.
Key words: Antineoplastic agent, drug interactions,cancer patient, polypharmacy, ambulatory care, chemotherapy.
____
INTRODUCCIÓN
Los pacientes oncológicos tienen un elevado riesgo de interacciones medicamentosas (IM) que potencialmente pueden exacerbar las toxicidades o incluso comprometer la respuesta al tratamiento antineoplásico1. Habitualmente, utilizan un importante número de medicamentos durante su proceso oncológico que pueden interaccionar con otros empleados para tratar comorbilidades.
Por otra parte, la diversidad de profesionales clínicos que pueden llegar a atender a estos pacientes aumenta la probabilidad de que exista polifarmacia, definida habitualmente como el uso concomitante de más de cinco medicamentos2.
La prevalencia de la polimedicación en pacientes oncológicos varía entre un 48% y un 80%2.
A esta situación se añade la complejidad derivada de la ausencia habitual de conciliación de la medicación entre niveles asistenciales (ej. tratamientos oncológicos ambulatorios y prescritos en atención primaria) y el empleo de diferentes aplicaciones de prescripción electrónica no integradas entre sí.
La validación de una prescripción antineoplásica implica necesariamente la revisión de las posibles IM y el análisis de su relevancia clínica, pero en este proceso intervienen una serie factores que en ocasiones pueden dificultarlo considerablemente.
El diseño de las bases de datos (BD), así como la falta de integración entre éstas y los programas de prescripción, dificultan que este proceso sea lo suficientemente ágil y eficiente como para poder evaluar, en tiempo real, los tratamientos administrados a diario en los hospitales de día.
Hasta la fecha, los medicamentos se deben incorporar manualmente en las BD sin que exista opción de volcado de las prescripciones.
Una dificultad adicional es la disparidad de resultados para una misma IM entre distintas BD3, lo que hace necesario consultar al menos dos para evaluar un tratamiento, lo que va en detrimento de su practicidad.
De no ser así, se podrían obviar IM relevantes o, por el contrario, generar un excesivo número de alertas.
El estudio se planteó para conocer la prevalencia y la severidad de las IM entre los tratamientos oncológicos administrados en el hospital de día de nuestro centro y la medicación domiciliaria habitual de los pacientes.
También se pretendió evaluar los hándicaps de éste proceso, los cuales dificultan la evaluación de las IM con la eficiencia requerida dada la habitual elevada presión asistencial. Finalmente, se evaluó si la edad, la pluripatología y las terapias con medicamentos de alto riesgo tenían repercusión en la gravedad de las IM.
Por todo lo expuesto, es importante analizar la relevancia de las IM para garantizar la eficacia y seguridad de los tratamientos oncológicos, de modo que cualquier cambio de tratamiento se realice con una coordinación eficiente entre los servicios de Oncología Médica, Farmacia y Atención Primaria para garantizar la continuidad asistencial.
MATERIAL Y MÉTODOS
Se realizó un estudio descriptivo y transversal en el que se revisaron las IM entre los regímenes de quimioterapia intravenosa, la premedicación de los tratamientos oncológicos y medicación crónica prescrita principalmente en el ámbito de la Atención Primaria (AP).
Se evaluaron todas las prescripciones de los pacientes que cumplían los siguientes criterios de inclusión:
• pacientes oncológicos
• mayores de 18 años
• tratados en el Hospital de Día de Oncología
Se revisó la medicación de todos los pacientes que visitaron el hospital durante 8 días no consecutivos, entre el 15 de enero y el 7 de febrero de 2020, dos días por semana.
Se eligieron las siguientes BD para recoger y comprobar las IM: Lexi-InteractTM Online4 y Drugs5.
Las dos BD son de uso habitual en la práctica clínica ya que en sus resultados ofrecen una detallada descripción de los mecanismos de las IM lo que permite al profesional de farmacia decidir acerca de su relevancia.
Se cotejaron todas las líneas de prescripción de los tratamientos clasificadas con el riesgo D o X en el Lexi-InteractTM y con la severidad de moderada a grave para ambas BD. El riesgo D se corresponde con aquellas IM para las que se debe valorar la modificación del tratamiento según el balance beneficio/riesgo y el tipo X hace referencia a combinaciones a evitar (contraindicaciones). Se considera que la severidad de una IM es moderada cuando dicha asociación debe emplearse únicamente en circunstancias especiales5 y grave cuando se debe evitar la combinación porque el riesgo de la misma excede los posibles beneficios.
Con el fin de evitar un número excesivo de resultados, cuyo análisis no sería viable si se tratara de evaluarlos durante el proceso de validación farmacéutica, se establecieron los siguientes límites para el registro de IM:
• Riesgo: D o X
• Severidad: moderada o grave
Se recabaron datos sobre edad, sexo, comorbilidades (aquellas que clasificarían al paciente como pluripatológico según el Modelo de Selección y Atención Farmacéutica de Pacientes Crónicos de la Sociedad Española de Farmacia Hospitalaria6), patología oncológica, número de fármacos prescritos y presencia entre ellos de medicamentos de alto riesgo incluidos en el listado del ISMP7. Se analizaron los datos estadísticamente mediante una regresión logística multinomial empleando el programa SPSS® V25.
Se revisó toda la medicación, de cada paciente incluido en el estudio, en las dos BD de forma independiente. Se registraron las IM encontradas de acuerdo a los criterios de selección.
El farmacéutico oncológico evaluó la información y seleccionó aquellas IM que debían ser comunicadas a los profesionales prescriptores (Oncología o Medicina de Familia) por su severidad y posible trascendencia clínica. La notificación de las mismas se llevó a cabo mediante correo electrónico, anotaciones en el curso clínico o llamadas telefónicas. Algunas fueron comunicadas a un único prescriptor y otras a ambos ámbitos asistenciales, en función de los medicamentos involucrados, el mecanismo de la interacción y sus posibles consecuencias.
El estudio, calificado como EPA-OD por la Agencia Española del Medicamento, obtuvo la aprobación por el correspondiente Comité de Ética de Investigación Clínica (CEIC), con la exención de obtención del consentimiento informado, y se realizó acorde a los principios básicos de la Declaración de Helsinki de la World Medical Association
RESULTADOS
Se analizó el tratamiento de 189 pacientes, siendo la mayoría del sexo masculino (60,6%) y con una edad media de 62,4±10,9 años.
La mayoría de pacientes eran pluripatológicos, concretamente un 66,8% de ellos padecía más de dos enfermedades crónicas. Entre éstas figuraban: la hipertensión arterial (39,4%), dislipemia (23,4%), diabetes mellitus tipo 2 (16,5%), cardiopatías (7,4%), hipotiroidismo (4,3%) y osteoporosis (3,2%) y otras con menor representación.
Las neoplasias tratadas fueron el cáncer de pulmón (23,9%), cáncer de mama (20,2%), cáncer de colon (8,5%) y pancreático (6,4%), entre otras.
El promedio del total de medicamentos de administración diaria por paciente fue de 7,4.
En cuanto a la utilización de medicación de alto riesgo, un 54,7% de pacientes tenían prescritos al menos uno de estos medicamentos: opiáceos (26%), metformina (9,6%), heparinas de bajo peso molecular (8,5%), benzodiacepinas (7,4%) e insulina (5,3%), entre otros.
Tal como se muestra en la tabla 1, 134 pacientes (70,9%) presentaban una o más IM entre la medicación habitual y la quimioterapia.
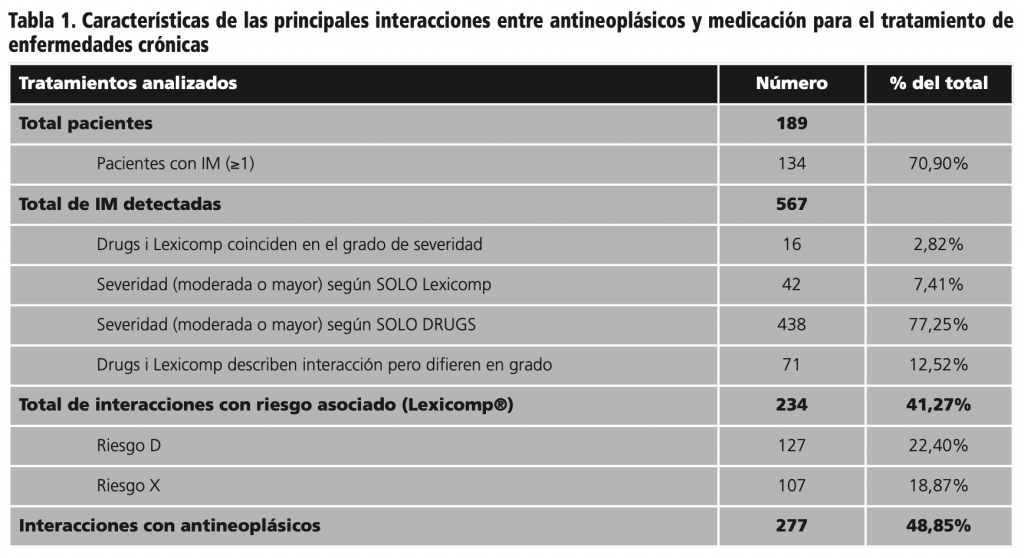
Se hallaron un total de 567 IM (4,2 interacciones por paciente), en 277 (48,85%) de ellas estaban involucradas los antineoplásicos. En las demás estaban implicados los medicamentos crónicos y la premedicación oncológica.
De todas las IM registradas, sólo en 16 (2,82%) coincidieron las dos BD en el grado de severidad. En 71 (12,52%) de los casos estaban descritas las IM en ambas BD, pero diferían en el grado de severidad. En los otros 480 (84,66%) casos las interacciones estaban descritas sólo en una de las dos BD.
En cuanto a la evaluación del riesgo, 234 interacciones presentaron riesgo asociado. Según Lexicomp® se debía considerar la modificación del tratamiento, valorando la relación beneficio/riesgo (riesgo D) en 127 casos (22,40%) y en 107 (18,87%) debía evitarse la combinación debido a que los riesgos asociados suelen superar los beneficios (riesgo X).
En la regresión logística no se alcanzó significación estadística entre la edad, pluripatología y polimedicación y las IM de tipo severo, en su comparación con las moderadas como categoría de referencia (valores p: 0,2, 0,6 y 0,8, respectivamente).
Como se muestra en la tabla 2, se repitieron más de 10 veces las siguientes IM: cisplatino con dexametasona, con una frecuencia de 26 veces (9,39%); seguidos de ácido fólico con 5-fluorouracilo, 18 veces (6,50%); paclitaxel con dexametasona, 14 veces (5,05%) y cisplatino con omeprazol, 12 veces (4,33%).
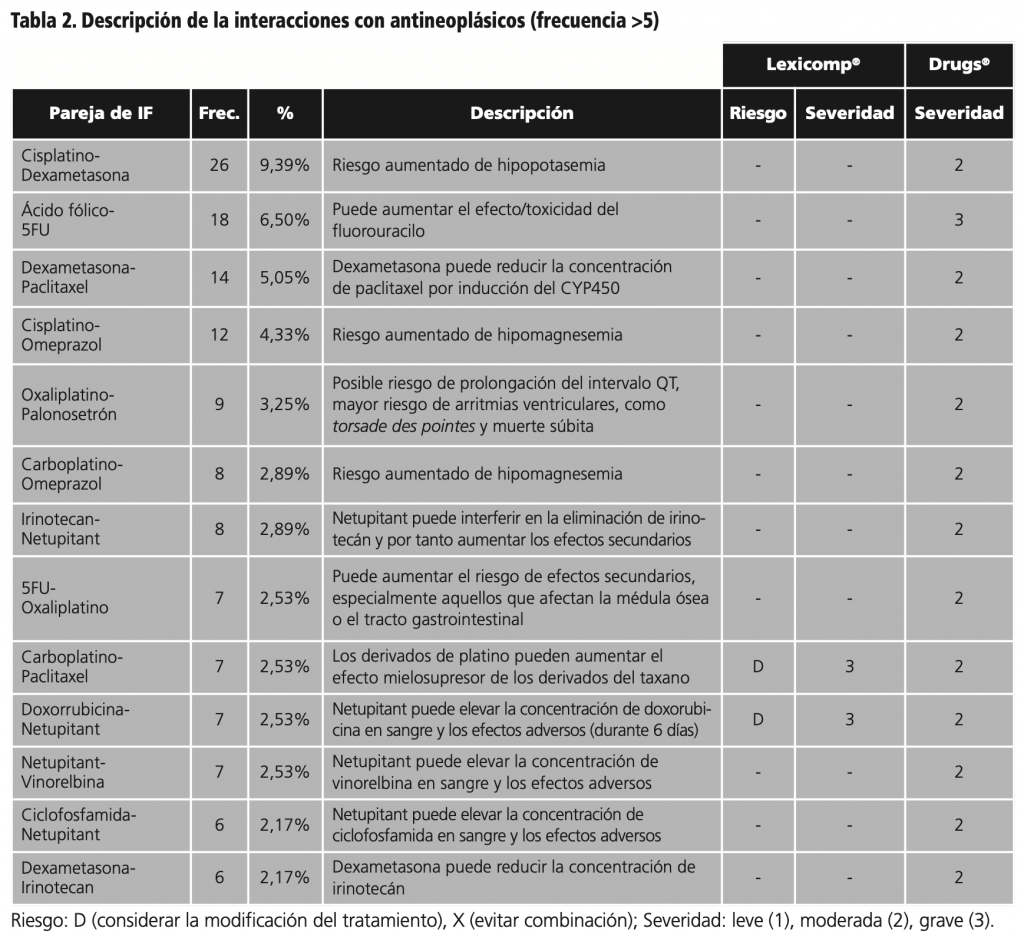
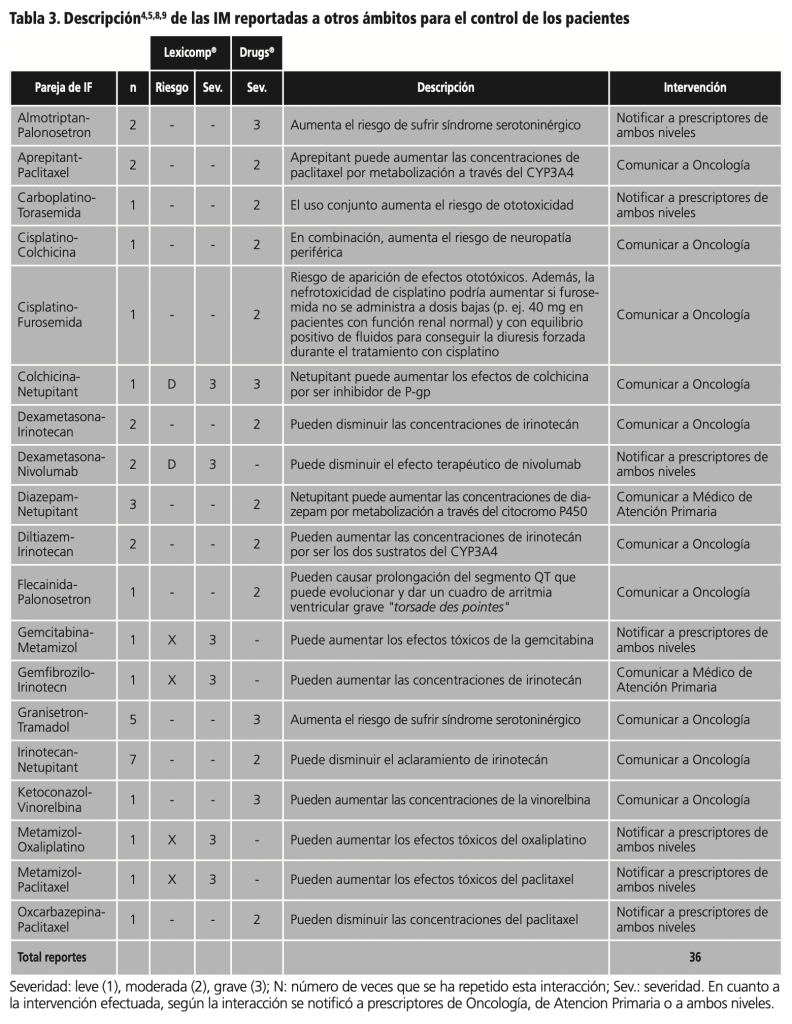
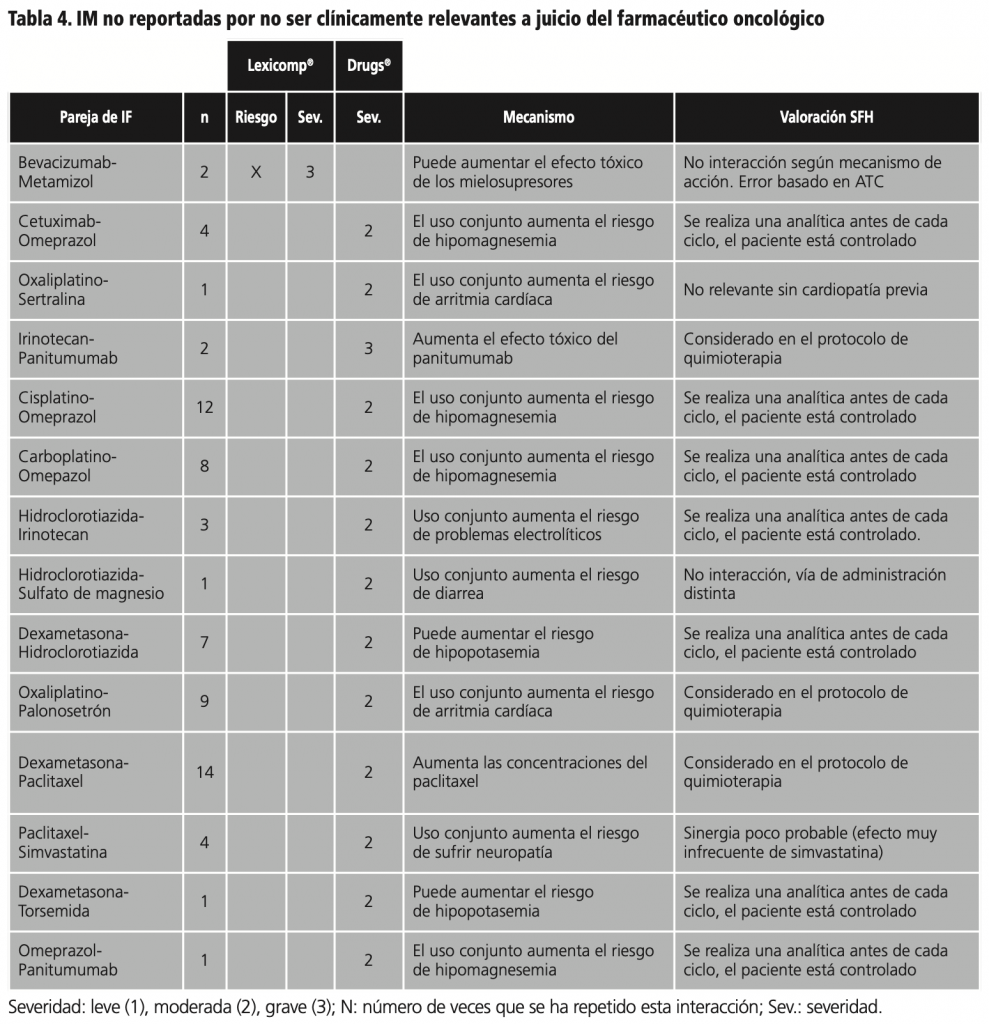
Posteriormente a la evaluación y análisis clínico de todas las interacciones se decidió reportar a los profesionales prescriptores 36 casos de IM, por su relevancia y posibles consecuencias en los pacientes. En éstos casos estuvieron implicadas 19 parejas de fármacos (tablas 3 y 4).
DISCUSIÓN
En el estudio los pacientes tenían una media de edad avanzada (62,4±10,9 años) y un importante grado de polifarmacia (el 65,07% de los pacientes eran polimedicados), lo que supone un mayor riesgo de IM severas que podrían conducir a eventos adversos clínicamente significativos, o incluso comprometer la respuesta al tratamiento antineoplásico.
Se trata de pacientes potencialmente más vulnerables a los efectos adversos derivados de la polifarmacia, y el riesgo es aún mayor si consideramos las enfermedades crónicas complejas concomitantes, así como el empleo de medicamentos de alto riesgo, condiciones que en los pacientes incluidos en el estudio fueron bastante prevalentes.
En el estudio se manifiestan unas cifras muy elevadas de IM: el 70,9% de los pacientes presentaba alguna interacción y se describieron 4,2 IM por paciente.
Las cifras de prevalencia de interacciones según severidad fueron similares a las de otras publicaciones recientes8, si bien el porcentaje de interacciones en las que se involucraban los antineoplásicos difiere con respeto a otros estudios previos9,10.
Las IM en pacientes oncológicos son bastante prevalentes y deben evaluarse sistemáticamente como parte ineludible del proceso de validación de la quimioterapia12.
En cuanto a la prevalencia de fármacos oncológicos implicados en las IM, también fue muy elevada (48,85%) en consonancia a otros estudios1. Seguramente se debe a la metodología seguida en el estudio, ya que se han tenido en cuenta todas las IM descritas en las dos BD consultadas, sin discriminación. Ello refleja la variabilidad de resultados de los estudios en este ámbito, que además presentan metodologías dispares, por lo que la incidencia de interacciones y su gravedad son diferentes11.
Se detectaron 277 IM en las que estaban involucrados los antineoplásicos. Después de una evaluación clínica se comunicaron 36 de ellas (12,6%), a profesionales tanto de oncología como de atención primaria. Estas cifras son similares a las reportadas en estudios previos13. La mayor parte de las IM eran interacciones de tipo farmacocinético, bien por aumento o por disminución de niveles plasmáticos de antineoplásicos.
Las características de las BD disponibles actualmente obligan a incorporar el listado de medicamentos manualmente. Además de las importantes discrepancias entre ellas, lo que hace necesario consultar las IM en diferentes BD. Todo esto dificulta su uso en la práctica diaria.
En el estudio se encuentran varias imprecisiones en las BD ya que en ocasiones se asume la existencia de una IM en base a la clasificación ATC. Tampoco se tienen en cuenta las diferentes vías de administración de los fármacos. Esto conlleva una desventaja adicional para una futura integración de las BD en las aplicaciones de prescripción electrónica asistida (PEA) debido a un posible exceso de alertas irrelevantes o incluso erróneas.
Los especialistas en farmacia oncológica deben evaluar la relevancia clínica de las IM y valorar la necesidad de reportar la información a los prescriptores. Para ello deben tener en cuenta las patologías del paciente, las características farmacocinéticas y farmacodinámicas de los medicamentos y el seguimiento estrecho de los pacientes oncológicos para detectar precozmente una toxicidad potencial (p. ej. hipomagnesemia inducida por cetuximab). Este es un proceso sujeto a gran variabilidad y de difícil sistematización ya que el criterio de selección de interacciones a reportar depende del juicio clínico de los farmacéuticos14.
Por otra parte, al considerar algunas características del paciente en relación con la gravedad de las IM, en este estudio no se encontró asociación estadísticamente significativa entre la relevancia de las IM y la presencia de enfermedades crónicas complejas ni el número de medicamentos de alto riesgo. Esto podría ser debido a que son variables independientes y que no tienen por qué establecer una relación entre sí. En el documento del Modelo de Estratificación y Atención Farmacéutica para pacientes con enfermedades oncológicas6 ya se tuvieron en cuenta como ítems independientes entre otros muchos.
Es posible que las interacciones no sean necesariamente más frecuentes ni de mayor severidad en aquellos pacientes pluripatológicos y polimedicados, lo que imposibilitaría establecer variables que permitan seleccionar a aquellos pacientes de mayor riesgo para priorizar su atención farma- céutica.
Sin una integración adecuada entre las diferentes aplicaciones de PEA y BD es realmente difícil revisar sistemáticamente las IM de todos los pacientes que diariamente reciben quimioterapia intravenosa en los hospitales de día. Es por tanto un proceso ineficiente y una necesidad no cubierta para los especialistas en farmacia oncológica.
A esto se añade que las aplicaciones de PEA de nuestro centro no poseen un sistema de mensajería que permita una comunicación adecuada con los profesionales prescriptores, teniendo que recurrir al correo electrónico o a anotaciones en el curso clínico de los pacientes dificultando las notificaciones.
CONCLUSIONES
Las interacciones entre el tratamiento oncológico y la medicación habitual son muy habituales y pueden llegar a comprometer la eficacia y seguridad de los mismos.
Su evaluación sistemática es compleja debido a la falta de integración entre las prescripciones de los diferentes ámbitos asistenciales y al diseño de las bases de datos de interacciones empleadas habitualmente.
Por otra parte, seleccionar las que deben reportarse es un proceso difícilmente sistematizable.
Se evidencia la necesidad de disponer de aplicaciones de prescripción, en el que se integren todos los medicamentos pautados desde cualquier ámbito asistencial.
Estas deberían disponer de alertas de interacciones graves que deban ser reportadas, para poder efectuar los cambios de tratamiento que las evitasen antes del inicio de los medicamentos que interaccionan.
Es preciso disponer de herramientas de comunicación directas entre diferentes niveles asistenciales para proponer alternativas terapéuticas en caso de interacciones graves, realizar una adecuada conciliación de tratamientos y, si es preciso, sugerir la deprescripción de medicamentos potencialmente inapropiados.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Nightingale G, Hajjar E, Swartz K, Andrel-Sendecki J, Chapman A. Evaluation of a pharmacist-led medication assessment used to identify prevalence of and associations with polypharmacy and potentially inappropriate medication use among ambulatory senior adults with cancer. J Clin Oncol. 2015;33(13):1453-9.
2. Prithviraj GK, Koroukian S, Margevicius S, Berger NA, Bagai R, Owusu C. Patient Characteristics Associated with Polypharmacy and Inappropriate Prescribing of Medications among Older Adults with Cancer. J Geriatr Oncol. 2012;3(3):228-37.
3. Fernandez de Palencia Espinosa MA, Espuny Miró A, Díaz Carrasco MS. Consistency among two drug interaction compendia in onco-haematological inpatients. European Journal of Clinical Pharmacy. 2016;18(2):90-7.
4. Lexi-Interact Online. http://www.uptodate.com/crlsql/interact/frameset.jsp. Accessed February 15, 2018.
5. Drugs. https://www.drugs.com/drug_interactions.php. Accessed February 15, 2018.
6. Mangues I, Bernardez B, Martínez MJ, Marcos JA, Fernández JJ, Martínez V, et al. Modelo de Estratificación y Atención Farmacéutica para pacientes con enfermedades oncohematológicasde la Sociedad Española de Farmacia Hospitalaria. [Internet] Madrid : Sociedad Española de Farmacia Hospitalaria; 2018. Disponible en https://www.sefh.es/mapex/index.php/documentacion.
7. Instituto para el Uso Seguro de los Medicamentos. Lista de medicamentos de alto riesgo. Septiembre 2012 [internet] [Consultado 10/01/2018]. Disponible en : http://www.ismp-espana.org/estaticos/view/39.
8. Nightingale G, Pizzi LT, Barlow A, Barlow B, Jacisin T , McGuire M et al. The prevalence of major drug-drug interactions in older adults with cancer andthe role of clinical decision support software. J Geriatr Oncol. 2018 Mar 3. pii: S1879-4068(18)30061-4. doi:10.1016/j.jgo.2018.02.001. [Epub ahead of print].
9. Bayraktar-Ekincioglu A, Demirkan K, Keskin B, Aslantas O, Ozdemir E. Potential drug interactions and side effects in an outpatient oncology clinic: a retrospective descriptive study. Eur J Hosp Pharm. 2014;21:216.
10. Riechelmann RP, Del Giglio A. Drug interactions in oncology: how common are they? Ann Oncol. 2009;20:1907-12.
11. Díaz-Carrasco MS, Almanchel-Rivadeneyra M, Tomás-Luiz A, Pelegrín-Montesinos S, Ramírez-Roig C1, Fernández-Ávila JJ. Observational study of drug-drug interactions in oncological inpatients. Farm Hosp. 2018 Jan 1;42(1):10-15. doi: 10.7399/fh.10857.
12. Cajaraville Ordoñana G, Carreras Soler MJ, Martínez Bautista MJ,Blanco Bermejo CJ,Espinosa Bosch M,García del Barrio MA et al. Validación farmacéutica de la prescripción del paciente oncohematológico Recomendaciones de GEDEFO (Grupo de Farmacia Oncológica de la Sociedad Española de Farmacia Hospitalaria. [Internet] Madrid : Sociedad Española de Farmacia Hospitalaria; 2018. [Consultado 10/07/2018] Disponible en tttps://gruposdetrabajo.sefh. es/gedefo/images/stories/documentos/2016/gedefo_validacion_farmaceutica_prescripcion_version_impresion.pdf.
13.Van Leeuwen RW, Jansman FG, Van den Bemt PM, de Man F, Piran F, Vincenten I et al Drug-druginteractions in patientstreatedforcancer: a prospectivestudyonclinicalinterventions. Ann Oncol. 2015;26:992-997.
14. Conde-Estévez D, Echeverría-Esnal D, Tusquets I, Albanell J. Potential clinical relevant drug–drug interactions: comparison between different compendia, do we have a validated method? Ann Oncol. 2015 Jun;26(6):1272.
____
