Rev. OFIL 2018, 28;1:62-76
Fecha de recepción: 11/01/2018 – Fecha de aceptación: 18/01/2018
Fuentes Irigoyen R, Tornero Torres O, Tejada González P
Hospital Central de la Cruz Roja. Madrid (España)
Los autores declaramos que los datos fueron presentados parciamente en el 62 Congreso de Sociedad Española deFarmacia Hospitalaria en forma de comunicación póster
____
Resumen
Objetivo: El Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT) establece recomendaciones sobre la manipulación de los medicamentos clasificados como peligrosos. No recoge información sobre materias primas utilizadas en la elaboración de fórmulas magistrales y preparados oficinales. El objetivo es identificar la normativa que regula la exposición laboral a materias primas y describir los peligros para la salud y medidas de protección necesarias en la manipulación de aquellas utilizadas en nuestro hospital.
Métodos: Se revisó la normativa sobre protección de los trabajadores expuestos a agentes químicos. Se analizaron las fichas de datos de seguridad (FDS) de las utilizadas en nuestro hospital.
Resultados: A las materias primas les son de aplicación el RD 374/2001 sobre la Protección de la Salud y Seguridad de los Trabajadores, los reglamentos CE/1907/2006 (REACH) y CE/1272/2008 (CLP) y el RD 665/1997 sobre la Protección de los Trabajadores contra los Riesgos de Exposición a Agentes Cancerígenos o Mutágenos. Las FDS indican los distintos riesgos y las condiciones de manipulación de sustancias. De las 65 materias primas evaluadas se encontraron 5 con toxicidad carcinógena, teratógena o reproductiva en distintas categorías: triamcinolona acetónido, borato sódico, captopril, enalapril maleato y fenol cristalizado; 60 requerían algún equipo de protección individual (EPI) (respiratoria, cutánea y/u ocular) y 21 requerían sistemas de extracción mecánica de aire.
Conclusiones: En la prevención de riesgos laborales en la manipulación de materias primas se aplica la normativa de agentes químicos. La gran mayoría de las materias primas analizadas requieren manipularse con EPI.
Palabras clave: Sustancias peligrosas, formulación magistral, exposición laboral.
____
Introducción
La Ley 31/95 de Prevención de Riesgos Laborables tiene por objeto la determinación del cuerpo básico de garantías y responsabilidades precisas para establecer un adecuado nivel de protección de la salud de los trabajadores frente a los riesgos derivados de las condiciones de trabajo1. En este sentido los trabajadores implicados en la elaboración de medicamentos en los Servicios de Farmacia (SF) pueden estar sometidos a determinados riesgos contemplados como “riesgos inherentes al trabajo” de acuerdo con dicha ley.
El National Institute for Occupational Safety and Health (NIOSH) define medicamento peligroso (MP) como aquel que muestra una o más de las siguientes características en humanos o en animales2:
- Carcinogenicidad.
- Teratogenicidad u otra toxicidad para el desarrollo.
- Toxicidad reproductiva.
- Toxicidad en órganos a dosis bajas.
- Genotoxicidad.
- Nuevos medicamentos con perfiles de estructura y toxicidad similares a medicamentos ya existentes considerados como peligrosos según criterios anteriores.
Este organismo publica periódicamente una lista de MP, la última en 20162, y hace recomendaciones generales para la manipulación de estos medicamentos. En España, el Documento Técnico sobre Medidas de Prevención para la Preparación y Administración de Medicamentos Peligrosos publicado por el Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT), en la actualidad Instituto Nacional de Seguridad, Salud y Bienestar en el Trabajo (INSSBT), en septiembre de 20163, recoge la relación de medicamentos clasificados como peligrosos de uso en España, con recomendaciones sobre su manipulación, medidas de prevención asociadas y equipos de protección individual (EPI) a utilizar. De esta forma, las autoridades de las distintas Comunidades Autónomas y los hospitales están tomando medidas para la aplicación de las recomendaciones recogidas en el documento del INSHT4,5.
Ni NIOSH ni el documento del INSHT recogen recomendaciones específicas de protección sobre productos sanitarios o materias primas utilizadas en la elaboración de las fórmulas magistrales (FM) y preparados oficinales (PO), puesto que su alcance está limitado a los MP, excluyendo los “agentes químicos peligrosos”, concepto diferente al de “medicamento peligroso”.
Respecto a los productos sanitarios, Muñoz y cols.6 realizaron una revisión de la composición de los productos sanitarios incluidos en su hospital, evaluándolos y clasificándolos según la International Agency for Research on Cancer (IARC) en cuanto a su potencial carcinógeno y concluyendo que, de una manera similar a la evaluación de medicamentos, se debe evaluar el potencial de peligrosidad de los productos sanitarios incluidos en cada centro e implementar medidas para garantizar la seguridad de los profesionales que van a utilizarlos.
Respecto a las materias primas utilizadas en la elaboración de las FM y PO en los SF no se ha encontrado información al respecto. En este sentido, el RD 175/2001 por el que aprueban las normas de correcta elaboración y control de calidad de fórmulas magistrales y preparados oficinales, define materia prima como toda sustancia activa o inactiva empleada en la fabricación de un medicamento, ya permanezca inalterada, se modifique o desaparezca en el transcurso del proceso7. Incluye por lo tanto los principios activos y excipientes.
Los objetivos de este trabajo son:
- Identificar la normativa que regula la exposición laboral a las materias primas en la elaboración de FM/PO en los SF.
- Definir los peligros para la salud del manipulador y las medidas de protección necesarias en la exposición laboral a las materias primas utilizadas en un hospital médico quirúrgico durante la elaboración de las FM/PO.
MATERIAL Y MÉTODOS
- Se llevó a cabo una revisión sobre la normativa que regula la exposición laboral a las materias primas.
- Se identificaron las materias primas dadas de alta en los sistemas de información del SF. Se excluyeron los medicamentos autorizados por la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) ya que las medidas de protección en su manipulación las recoge el Documento Técnico sobre Medidas de Prevención para la Preparación y Administración de Medicamentos Peligrosos3 y sus fichas técnicas.
- Se realizó una revisión de las fichas de datos de seguridad (FDS) de las materias primas identificadas. Concretamente se analizaron las secciones sobre identificación de los peligros (información sobre los efectos toxicológicos); manipulación y almacenamiento; y control de exposición/protección individual (secciones 2, 7 y 8 respectivamente de las FDS).
RESULTADOS
Normativa que regula la exposición laboral a las materias primas:
Los principios activos y excipientes son agentes químicos, por lo que en aspectos relacionados con su exposición laboral se deben aplicar:
- El Real Decreto 374/2001 sobre la protección de la salud y seguridad de los trabajadores contra los riesgos relacionados con los agentes químicos durante el trabajo8 y la Guía Técnica que lo desarrolla publicada por el INSHT9.
- El Reglamento (CE) nº 1272/2008 del Parlamento Europeo y del Consejo, de 16 de Diciembre de 2008, sobre clasificación, etiquetado y envasado de sustancias y mezclas (Reglamento CLP)10.
- El Reglamento (CE) nº 1907/2006, relativo al registro, la evaluación, la autorización y la restricción de sustancias y preparados químicos (REACH)11.
- Real Decreto 665/1997, de 12 de mayo, modificado por los Reales Decretos 1124/2000, de 16 de junio, 349/2003, de 21 de marzo, y 598/2015, de 3 de julio, sobre la protección de los trabajadores contra los riesgos relacionados con la exposición a agentes cancerígenos o mutágenos durante el trabajo12 y la Guía Técnica que lo desarrolla13.
El Real Decreto 374/2001 tiene por objeto, en el marco de la Ley 31/1995, de 8 de noviembre, de Prevención de Riesgos Laborales, establecer las disposiciones mínimas para la protección de los trabajadores contra los riesgos derivados o que puedan derivarse de la presencia de agentes químicos en el lugar de trabajo o de cualquier actividad con agentes químicos. Sus disposiciones serán aplicables a los agentes químicos peligrosos que estén o puedan estar presentes en el lugar de trabajo. Define agente químico como todo elemento o compuesto químico, por sí solo o mezclado, tal como se presenta en estado natural o es producido, utilizado o vertido, incluido el vertido como residuo, en una actividad laboral, se haya elaborado o no de modo intencional y se haya comercializado o no8,9.
Como agente químico peligroso se entiende, según el RD 374/2001, el agente químico que puede representar un riesgo para la seguridad y salud de los trabajadores debido a sus propiedades fisicoquímicas, químicas o toxicológicas y a la forma en que se utiliza o se halla presente en el lugar de trabajo. Se consideran incluidos en esta definición, en particular:
- Los agentes químicos que cumplan los criterios para su clasificación como sustancias o preparados peligrosos establecidos, respectivamente, en la normativa sobre notificación de sustancias nuevas y clasificación, y envasado y etiquetado de sustancias peligrosas y en la normativa sobre clasificación, envasado y etiquetado de preparados peligrosos, con independencia de que el agente esté clasificado o no en dichas normativas, con excepción de los agentes que únicamente cumplan los requisitos para su clasificación como peligrosos para el medio ambiente.
- Los agentes químicos que dispongan de un valor límite ambiental de los indicados en el apartado 4 del artículo 3 de dicho Real Decreto.
Este RD 174/2001 establece en su artículo 3 que el empresario debe hacer una evaluación de los riesgos para determinar las medidas específicas de prevención y protección de los trabajadores. Para llevar a cabo la evaluación de los riesgos se tendrán en cuenta, entre otros aspectos, las propiedades peligrosas del agente, las cantidades utilizadas y el tipo, nivel y duración de la exposición.
El objetivo del Reglamento CLP10 es determinar qué propiedades de las sustancias y las mezclas deben conducir a su clasificación como peligrosas, para que sus peligros se identifiquen y comuniquen adecuadamente. Entre dichas propiedades se cuentan los peligros físicos, los peligros para la salud humana y los peligros para el medio ambiente, con inclusión de los peligros para la capa de ozono. El Anexo I de dicho reglamento incluye los requisitos de clasificación y etiquetado de sustancias y mezclas peligrosas. No se aplica a los medicamentos en la fase de producto terminado destinados al usuario final. Sí se aplica a los principios activos o excipientes que habitualmente manejamos en los SF para la elaboración de FM/PO, esto es a las materias primas. Los principios activos y excipientes pueden considerarse agentes químicos peligrosos en tanto que puedan originar efectos adversos en la salud de las personas sanas (los trabajadores) si están sometidas a su exposición. La tabla 1 recoge los distintos peligros para la salud contemplados en la parte 3 del Anexo 1 del Reglamento CLP10. Cada uno de ellos contempla una o más categorías de peligro.

El reglamento REACH11 incluye en el Anexo II los requisitos para la elaboración de las FDS. El proveedor de una sustancia tiene la obligación de facilitar a su destinatario la FDS elaborada según el formato y contenido definidos en dicho Anexo. En ellas se identifican, entre otros, los peligros para la salud humana de la sustancia química. De esta forma se podrá realizar la correspondiente evaluación de los riesgos para la salud o la seguridad de los trabajadores a fin de adoptar las medidas necesarias para la protección de la salud humana y la seguridad en el trabajo.
Además si los agentes químicos cumplen criterios para su clasificación como cancerígeno o mutágeno en células germinales de categoría 1A o 1B (de acuerdo con los criterios que contempla la normativa relativa a clasificación, etiquetado y envasado de sustancias y mezclas –Reglamento CLP–) y si se puede producir la exposición a estos agentes, se deberán aplicar las disposiciones del RD 665/199712,13.
Peligros para la salud del manipulador y medidas de protección necesarias en la exposición laboral a las materias primas:
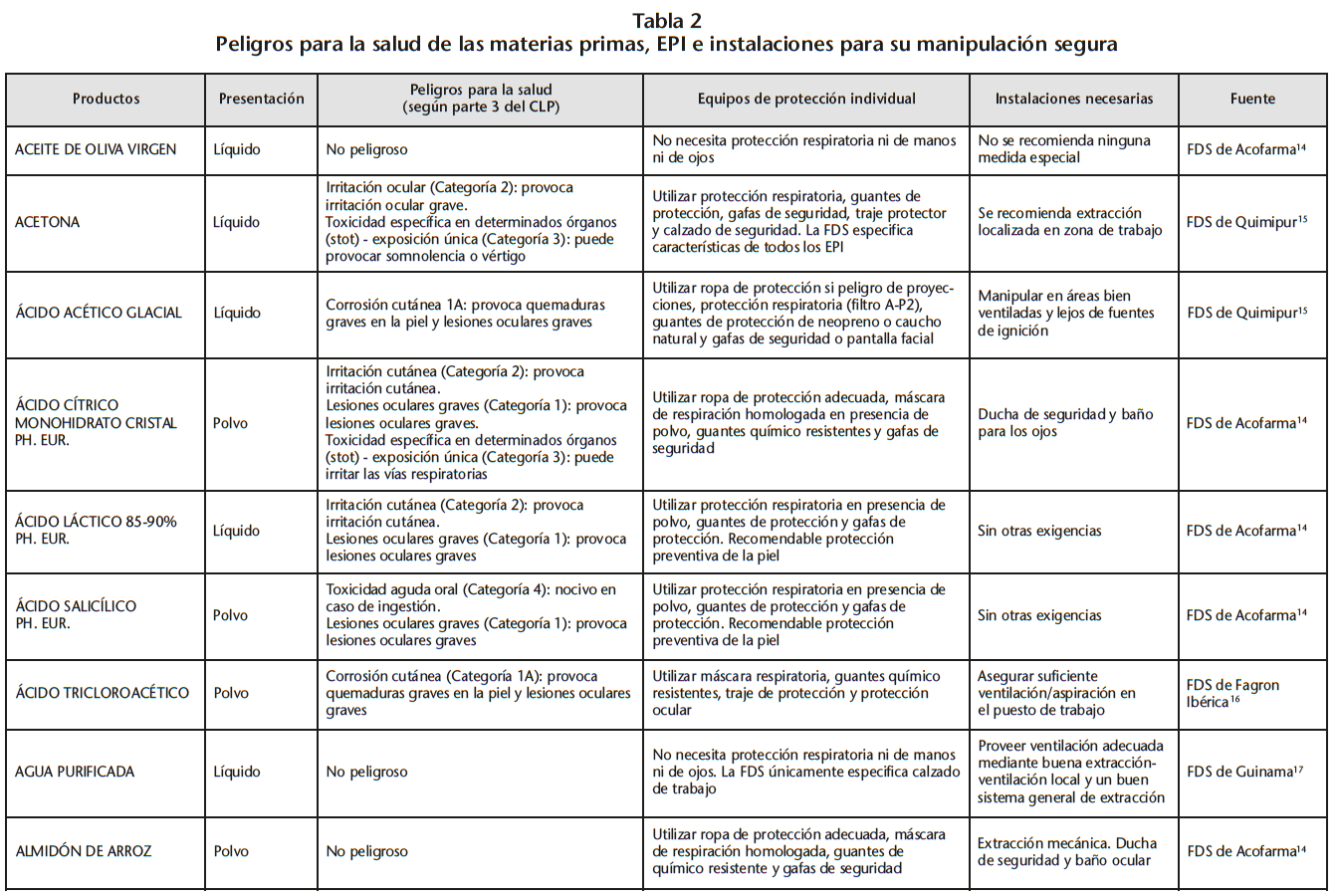
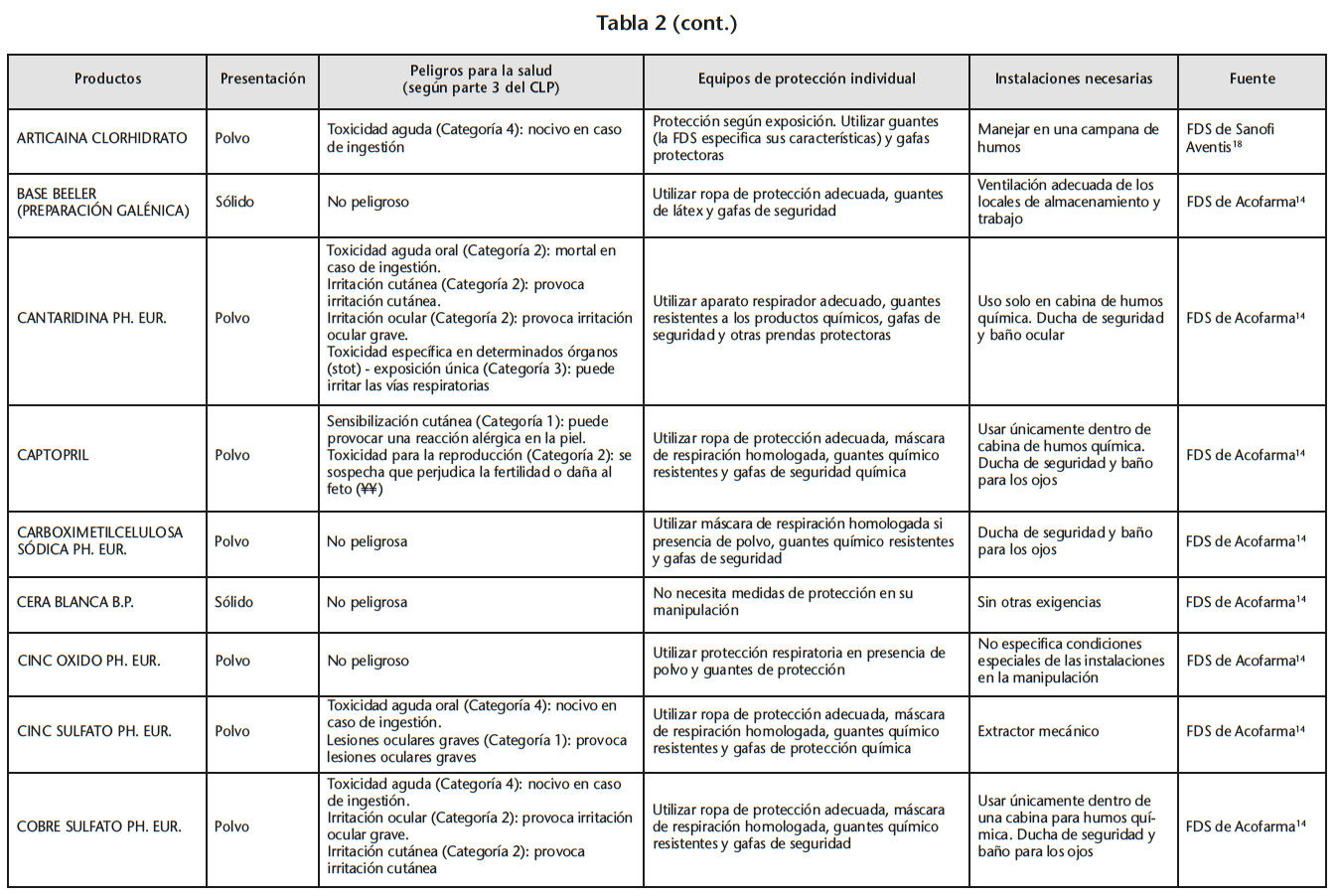
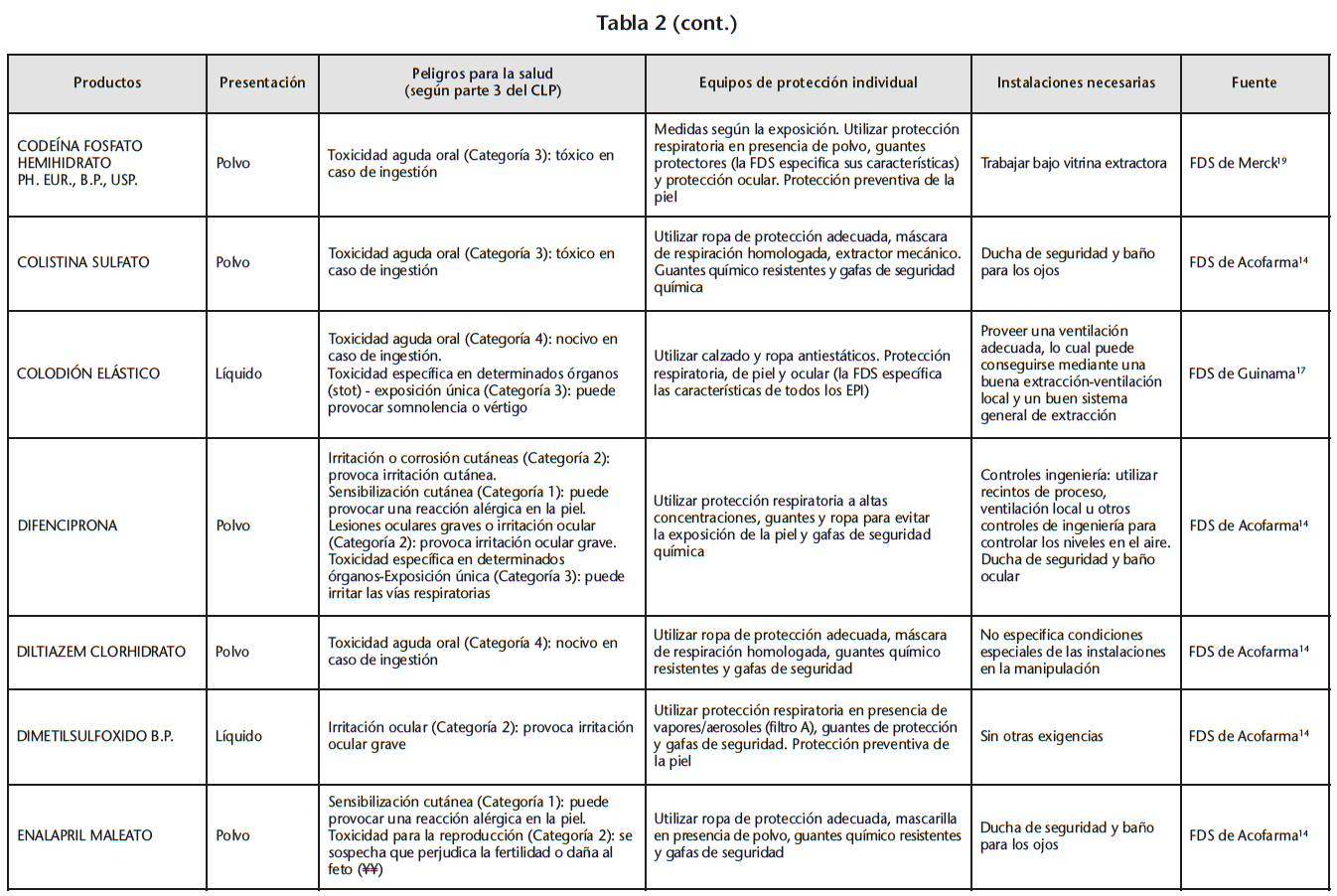
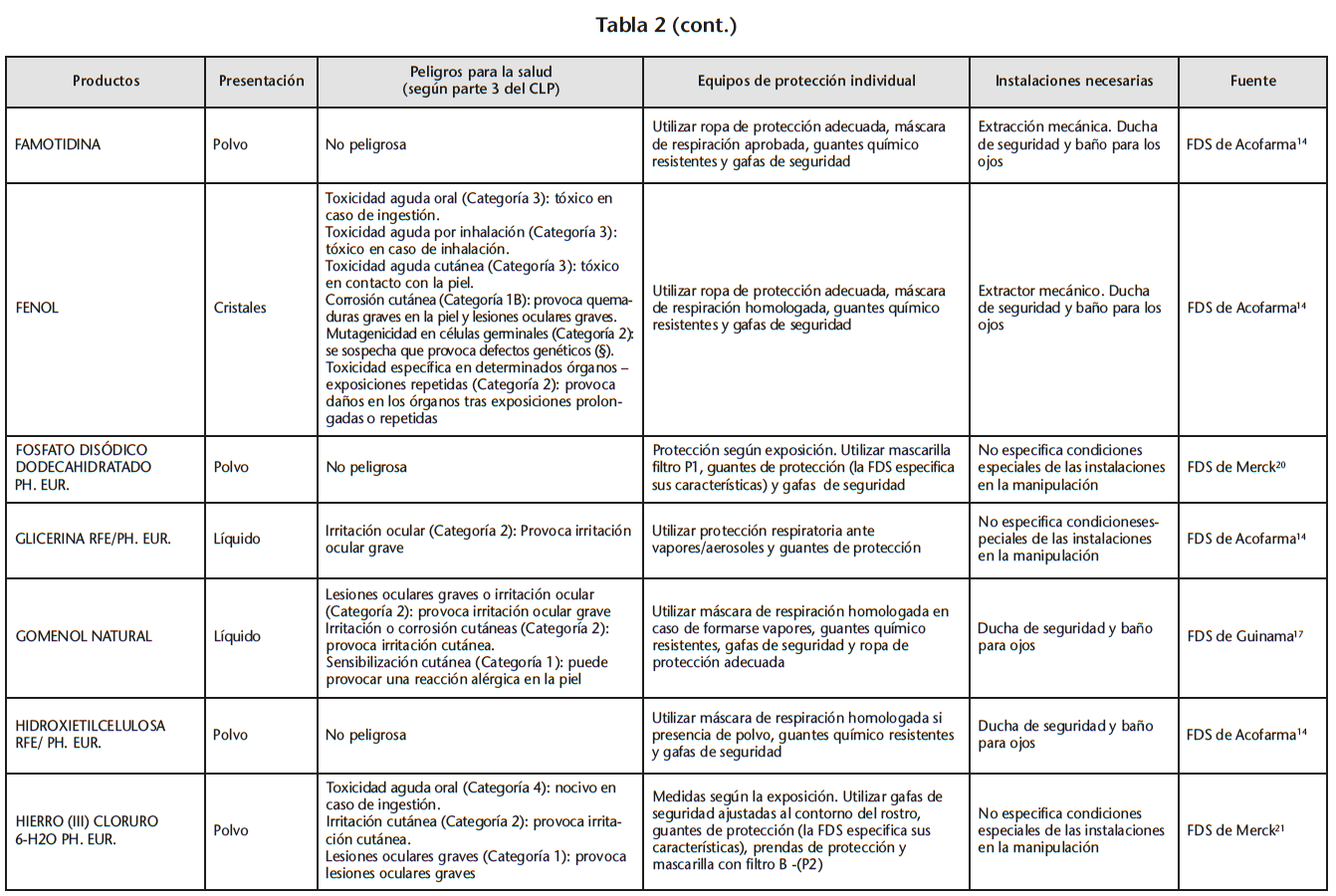
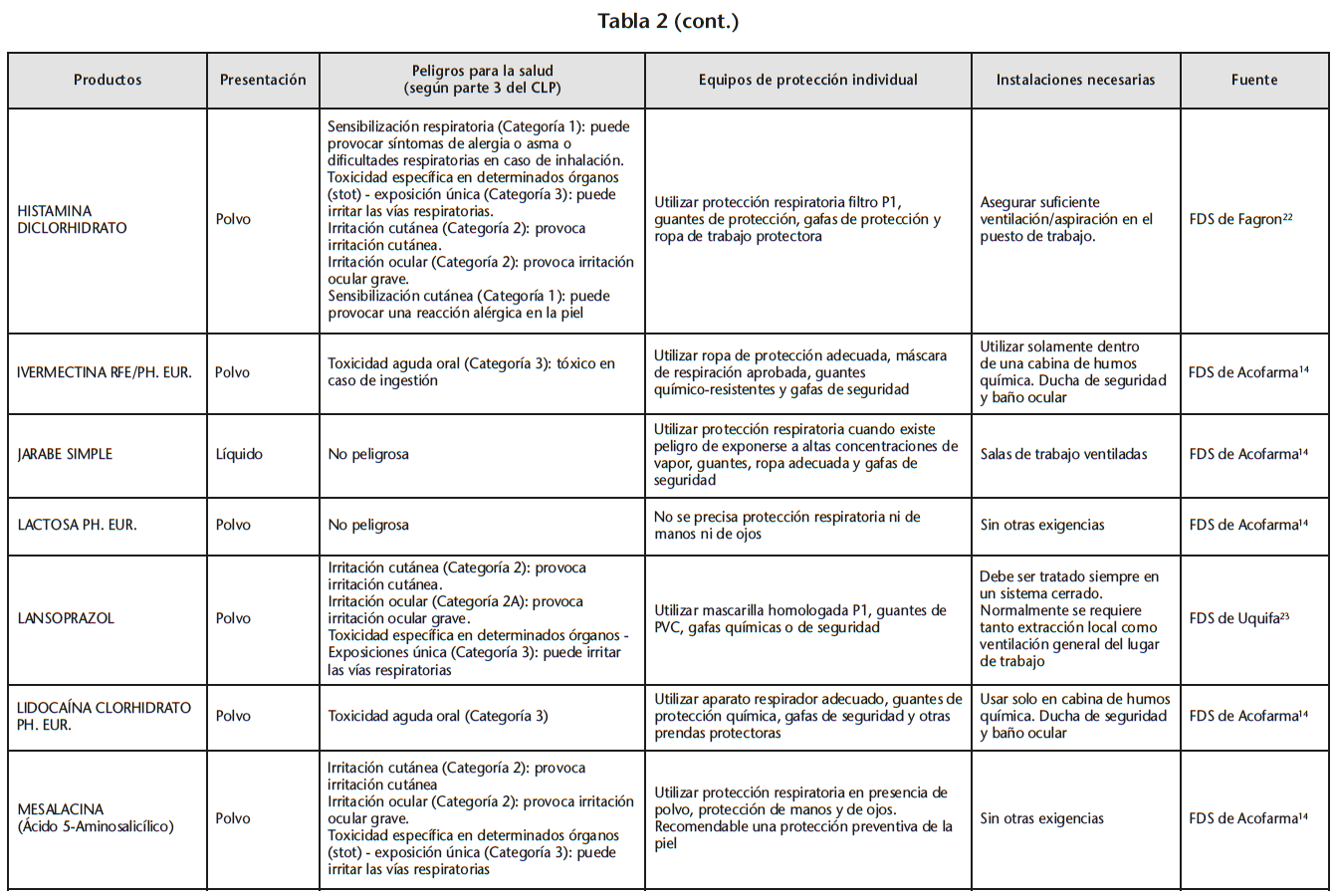
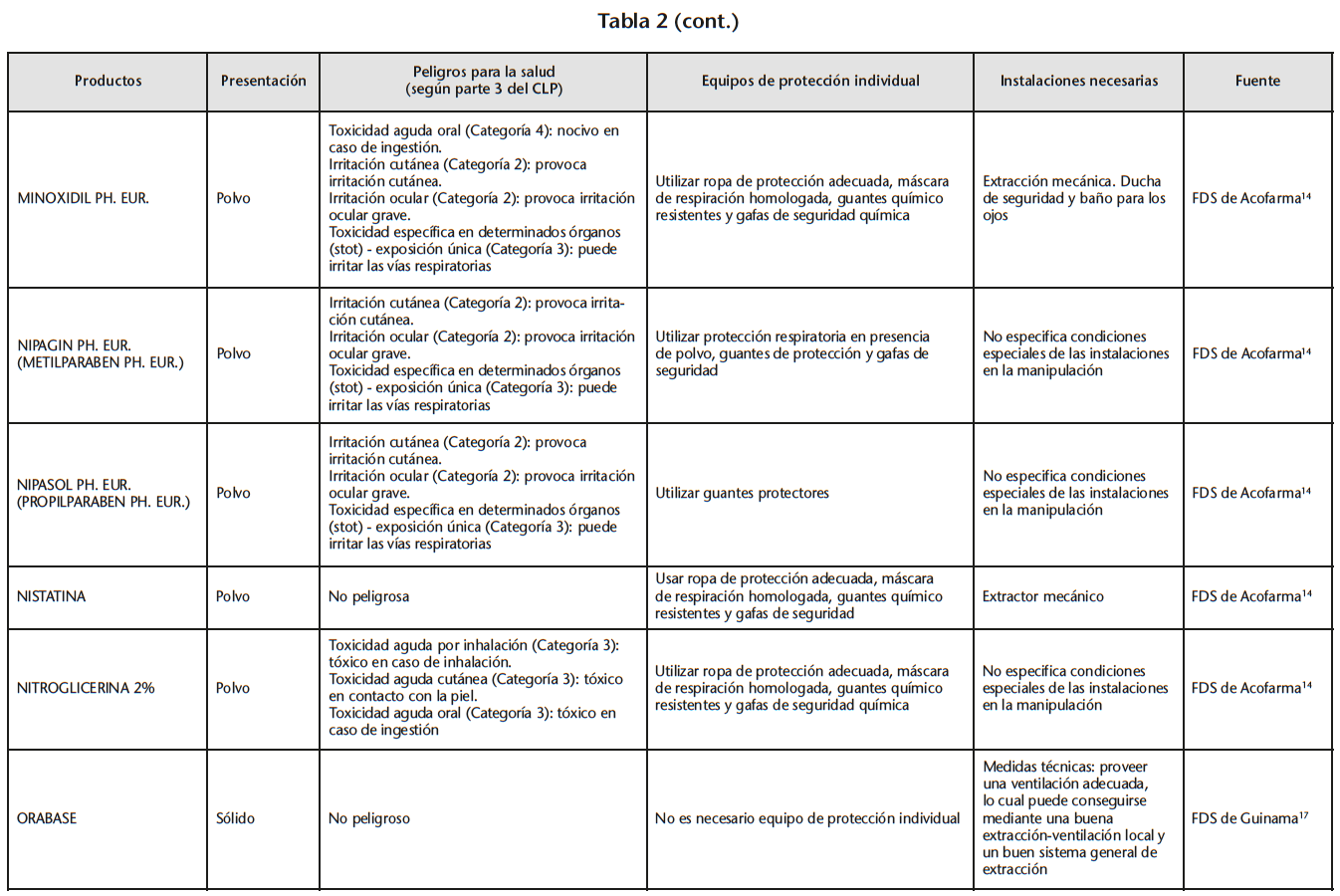
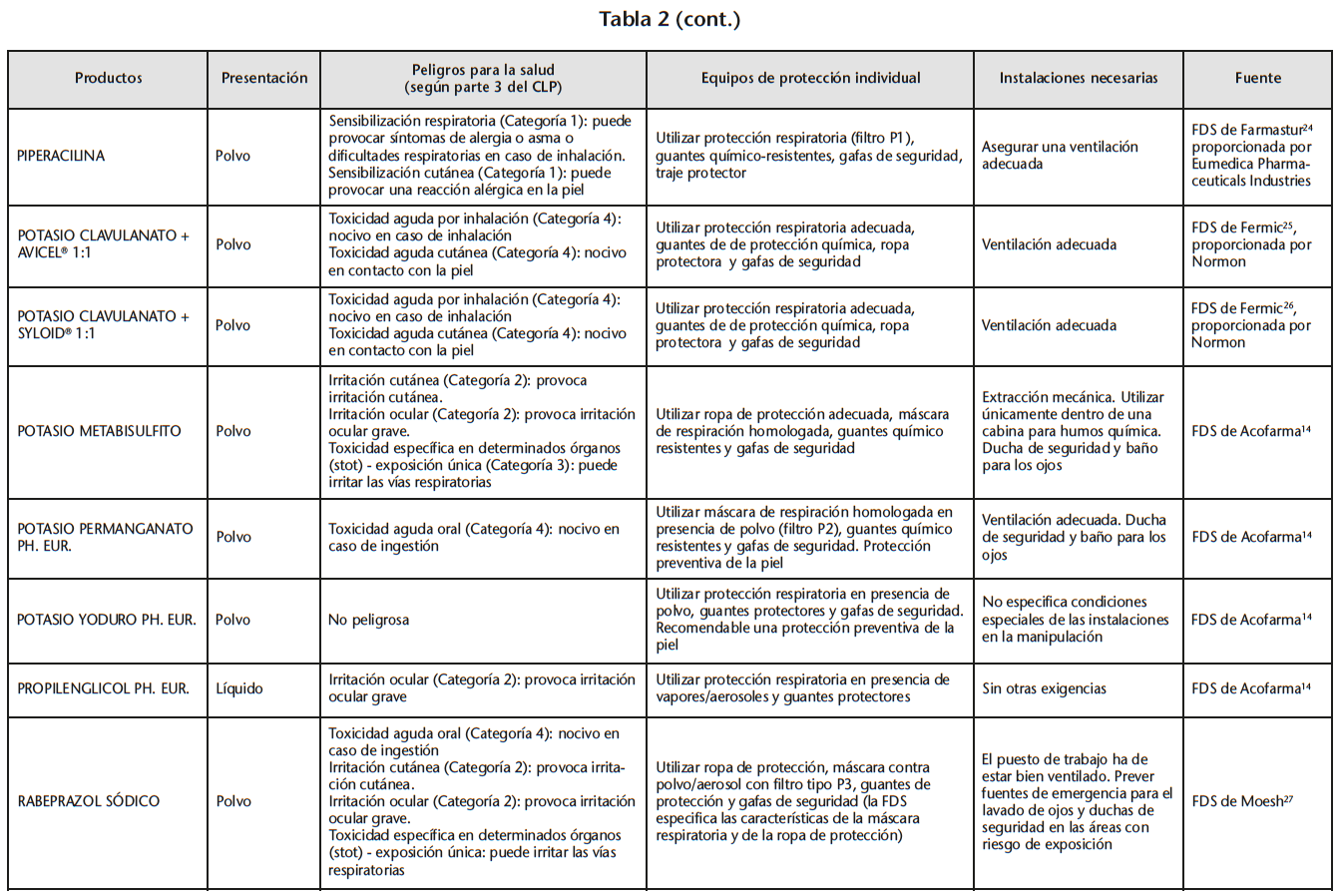
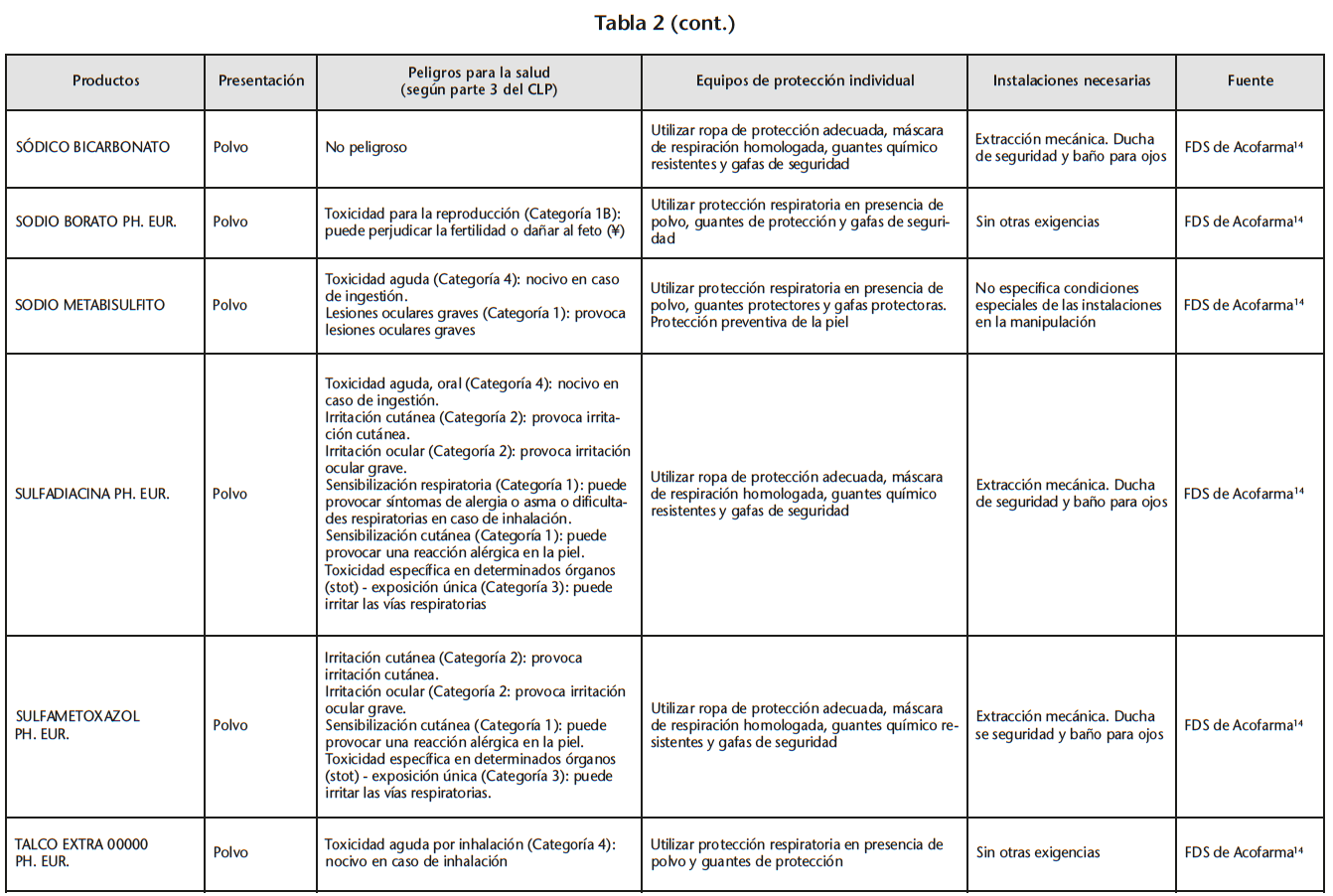
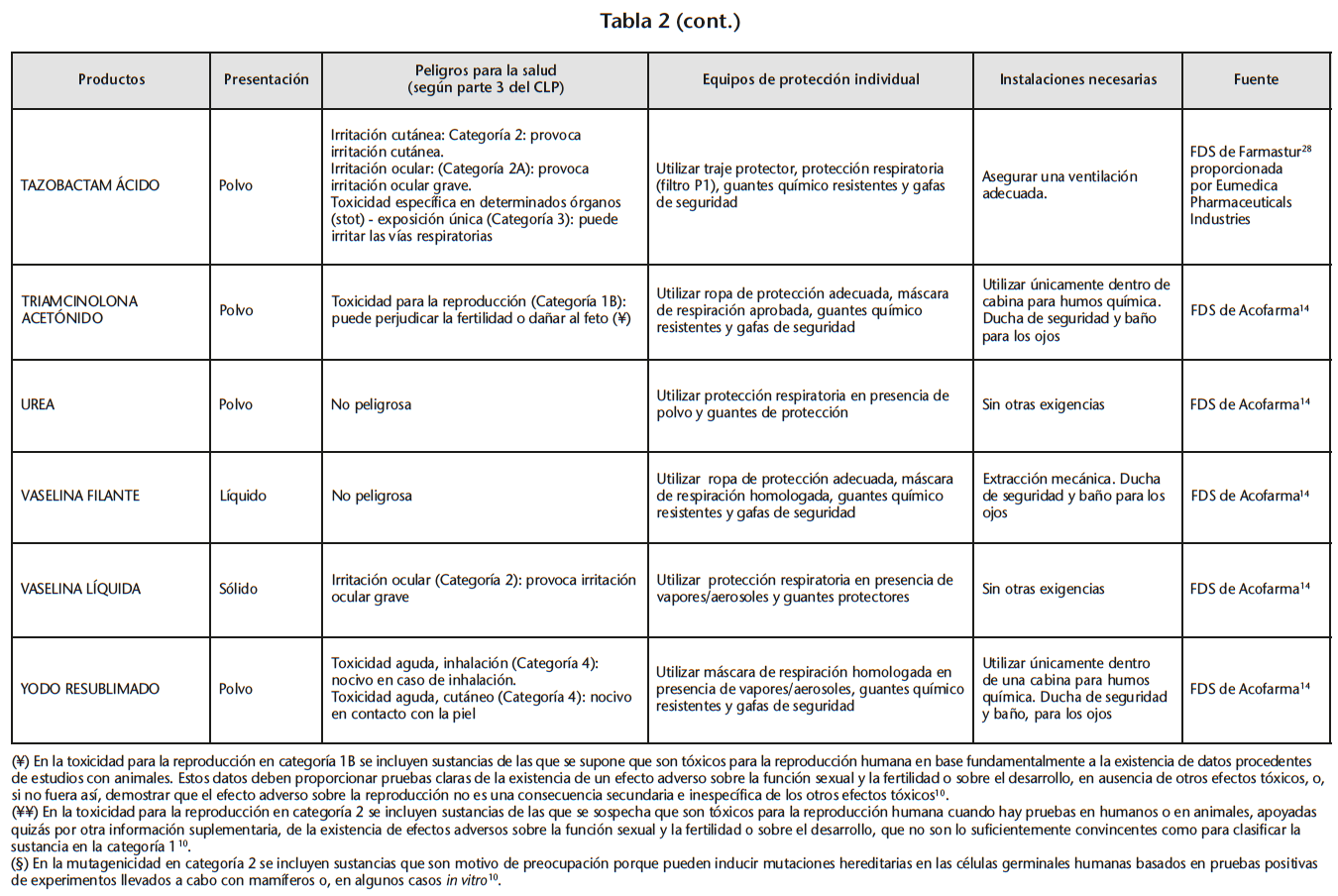
Se obtuvo un listado de 67 materias primas consiguiendo 65 FDS de proveedores oficiales. La tabla 2 recoge los peligros para la salud de las materias primas evaluadas, los EPI y las instalaciones necesarias para su manipulación, especificados en las FDS.
Se encontraron 5 materias primas con toxicidad carcinógena, teratógena o reproductiva: acetónido de triamcinolona y borato sódico con toxicidad para la reproducción de categoría 1B; captopril y enalapril maleato con toxicidad para la reproducción de categoría 2; fenol cristalizado con mutagenicidad en células germinales de categoría 2.
Según la información de las FDS, 60 de las 65 materias primas se debían manipular con algún EPI (protección respiratoria, cutáneo y/u ocular). Solo 14 de las 60 FDS hacían especificaciones sobre cómo debían ser los EPI. Determinados proveedores siempre incluían estas especificaciones mientras que otros simplemente hacían referencia a la necesidad del EPI.
21 sustancias requerían ser manipuladas bajo sistemas de extracción mecánica de aire. Sin embargo, sólo 10 de las 21 FDS especificaban la necesidad de cabina de humos química/vitrina extractora.
DISCUSIÓN
La información de los peligros para la salud de los trabajadores expuestos a productos químicos está recogida en las FDS. En tanto que los principios activos y excipientes utilizados en la elaboración de FM/PO son agentes químicos, para poder realizar correctamente la evaluación de los riesgos derivados de su exposición deben solicitarse las FDS a los proveedores de los mismos, así como cualquier otra información necesaria.
Pero en la elaboración de FM/PO en los SF además se manipulan medicamentos destinados al usuario final. En este caso los documentos de referencia a tener en cuenta desde el punto de vista de la seguridad laboral serían las listas de NIOSH, el Documento Técnico sobre Medidas de Prevención para la Preparación y Administración de Medicamentos Peligrosos del INSHT y las Fichas Técnicas aprobadas por la AEMPS29. No se tienen en cuenta las FDS de sus componentes a no ser que no existan dichas recomendaciones por haber sido comercializadas posteriormente a la evaluación. Es la razón por la cual excluimos de nuestro estudio los medicamentos autorizados por la AEMPS. Sin embargo, frente a una exposición potencial a agentes químicos derivada de la manipulación de medicamentos destinados al usuario final se deberán evaluar los riesgos para la salud y la seguridad de los trabajadores originados por dichos agentes y si existiera un riesgo para la salud y la seguridad de los trabajadores, serían de aplicación las medidas específicas de prevención, protección y vigilancia de la salud establecidas en los artículos 5, 6 y 7 del RD 374/2001. Así nos informó el INSHT en consulta realizada al respecto30. Para la evaluación de dichos riesgos habría que tener en cuenta todos los peligros para la salud recogidos en la FDS de los principios activos y excipientes del medicamento (no solo los criterios de peligrosidad de NIOSH) y también aspectos como las cantidades manipuladas, el tipo, nivel y duración de la exposición de los trabajadores, según artículo 3 del RD 174/2001. Por ejemplo, en la FDS de lanzoprazol se especifica irritación cutánea, ocular y toxicidad específica en determinados órganos – Exposiciones única (Tabla 3). Medicamentos comercializados con lansoprazol no aparecen en el documento técnico del INSHT por no cumplir criterios de peligrosidad de NIOSH y en las fichas técnicas de los medicamentos que lo contienen no se especifican precauciones especiales en la manipulación que protejan al trabajador. En la manipulación de presentaciones de lanzoprazol cápsulas autorizadas por la AEMPS, nos planteamos si tendríamos que revisar la FDS de dicho principio activo para la prevención de otros riesgos. Según consulta realizada al INSHT30 de no requerir manipulación por parte de los trabajadores no sería necesario adoptar precauciones especiales, pero de manipularse se debe evaluar el riesgo, para conocer la posibilidad de exposición y la necesidad de adoptar medidas preventivas.

Por otro lado hay materias primas que contemplan peligros para la salud incluidos en los criterios de peligrosidad de NIOSH para clasificar el medicamento como peligroso (lo que obligaría a manipularlas con los sistemas de protección para la salud adecuados) y sin embargo se han detectado medicamentos destinados a usuario final que contiene dicha materia prima que no están clasificados como MP. Por ejemplo, en la FDS de acetónido de triamcinolna14, en la identificación de peligros según Reglamento CLP, figura toxicidad para la reproducción (Categoría 1B) y sin embargo los medicamentos comercializados que contienen triamcinolona no figuran en el documento técnico del INSHT. Igualmente, borato sódico presenta toxicidad para la reproducción en categoría 1B, captopril y enalapril presentan toxicidad para la reproducción en categoría 2 y fenol presenta mutagenicidad en células germinales en categoría 2. ¿Habría que evaluar si las FM/PO elaboradas con principios activos/excipientes con criterios de peligrosidad según NIOSH deben considerarse como MP? En caso de tratarse de FM tipificadas o PO, ¿debería contener el Formulario Nacional información sobre la seguridad ante una exposición laboral?
Sería deseable, tal y como se recomienda para los MP31, incluir en los procesos de elaboración de FM/PO los aspectos a considerar desde el punto de vista de la seguridad de los trabajadores o incluso otros riesgos contemplados en las FDS de las materias primas como los riesgos para el medio ambiente.
Atendiendo a los resultados de la evaluación de los EPI necesarios en la manipulación de las materias primas, llama la atención que dependiendo del proveedor que haya proporcionado la FDS, se especifiquen el tipo de mascarilla o guantes, cuando el Reglamento REACH establece que se deben indicar siempre.
También resulta llamativo que sustancias como la glicerina, el nipasol o la vaselina líquida que pueden producir irritación ocular, no requieran manipulación con gafas de seguridad, según las FDS consultadas.
CONCLUSIONES
Las materias primas utilizadas en la elaboración de medicamentos son agentes químicos y por tanto les son de aplicación el RD 174/2001 sobre la protección de la salud y seguridad de los trabajadores contra los riesgos relacionados con los agentes químicos durante el trabajo. La peligrosidad del agente químico no incluye sólo aspectos de carcinogenicidad y mutagenicidad sino cualquier clase de peligro físico o para la salud, recogidos todos ellos en la FDS. La normativa vigente recoge que es necesario realizar una evaluación de los riesgos a los que se expone el manipulador de dichas materias primas para determinar las medidas específicas de prevención y protección. Esta evaluación incluye analizar, entre otros aspectos, las propiedades de peligrosidad de la materia prima (recogidas en las FDS), y las características de la exposición. Esto se debe contemplar en los procesos de elaboración de FM/PO.
La gran mayoría de las materias primas analizadas deben manipularse con EPI. Sin embargo hay falta de especificidad en las FDS en cuanto a las características específicas que deben cumplir los EPI y los sistemas de extracción. Es necesario evaluar los riesgos del personal manipulador y estudiar las FDS en colaboración con los Servicios de Prevención de Riesgos Laborales para establecer las medidas de protección individuales y estructurales necesarias para manipular materias primas.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Bibliografía
- Boletín Oficial del Estado. Ley 31/1995, de 8 de noviembre, de Prevención de Riesgos Laborales. BOE núm 269, de 10/11/1995.
- National Institute for Occupational Safety and Health. NIOSH List of Antineoplastic and Other Hazardous Drugs in Healthcare Settings, 2016. Cincinnati, OH; U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health; 2016.
- Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT). Medicamentos Peligrosos. Medidas de prevención para su preparación y administración. Barcelona: Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT); 2016.
- Marisa Gaspar Carreño, Ruben Achau Muñoz, Fátima Torrico Martín, Juan José Agún González, José Cristobal Sánchez Santos, Ana Cristina Cercos Letí, Pedro Ramos Orozco. Desarrollo de un procedimiento para el manejo seguro de medicamentos peligrosos. Farrm Hosp. 2017;41(2):222-256. DOI: 10.7399/fh.2017.41.2.10621.
- Beatriz G García-Alcántara, Catalina Perelló Alomar, Elena Moreno Centeno, Pilar Modamio, Eduardo L Mariño y Olga Delgado Sánchez. Impacto de las nuevas recomendaciones de manipulación de medicamentos peligrosos en un servicio de farmacia. Farm Hosp. 2017;41(2):257-269. DOI: 10.7399/fh.2017.41.2.10689.
- Rubén Achau Muñoz, Marisa Gaspar Carreño, Ana Ponce Sillas, Juan Francisco Márquez Peiró, Juan José Agún González, José Cristóbal Santos Sánchez ¿Podemos hablar de la existencia de productos sanitarios peligrosos? Farm Hosp. 2017;41(4):571-572. DOI: 10.7399/fh.2017.41.4.10794.
- Boletín Oficial del Estado. Real Decreto 175/2001, de 23 de febrero, por el que aprueban las normas de correcta elaboración y control de calidad de fórmulas magistrales y preparados oficinales. BOE núm. 65 de 16/03/2001.
- Boletín Oficial del Estado. Real Decreto 374/2001 sobre la Protección de la Salud y Seguridad de los Trabajadores contra los Riesgos Relacionados con los Agentes Químicos durante el Trabajo. BOE núm. 104 de 01/05/2001.
- Instituto Nacional de Seguridad e Higiene en el Trabajo. Guía técnica para la evaluación y prevención de los riesgos relacionados con los agentes químicos presentes en los lugares de trabajo. Madrid: Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT); 2013.
- Diario Oficial de la Unión Europea. Reglamento (CE) nº 1272/2008 del Parlamento Europeo y del Consejo de 16 de diciembre de 2008 sobre clasificación, etiquetado y envasado de sustancias y mezclas, y por el que se modifican y derogan las Directivas 67/548/CEE y 1999/45/CE y se modifica el Reglamento (CE) nº 1907/2006 (Reglamento CLP). Diario Oficial de la Unión Europea. Reglamento de 31/12/2008.
- Diario Oficial de la Unión Europea. Reglamento (CE) nº 1907/2006 del Parlamento Europeo y del Consejo de 18 de diciembre de 2006 relativo al registro, la evaluación, la autorización y la restricción de las sustancias y preparados químicos (REACH), por el que se crea la Agencia Europea de Sustancias y Preparados Químicos, se modifica la Directiva 1999/45/CE y se derogan el Reglamento (CEE) n o 793/93 del Consejo y el Reglamento (CE) n o 1488/94 de la Comisión, así como la Directiva 76/769/CEE del Consejo y las Directivas 91/155/CEE, 93/67/CEE, 93/105/CE y 2000/21/CE de la Comisión (Reglamento REACH). Diario Oficial de la Unión Europea núm L 396 de 30/12/2006.
- Boletín Oficial del Estado. Real Decreto 665/1997, de 12 de mayo, sobre la protección de los trabajadores contra los riesgos relacionados con la exposición a agentes cancerígenos durante el trabajo. BOE núm 124 de 24/05/1997.
- Instituto Nacional de Seguridad, Salud y Bienestar en el Trabajo (INSSBT), Guía técnica para la evaluación y prevención de los riesgos relacionados con la exposición a agentes cancerígenos o mutágenos durante el trabajo. Madrid: Instituto Nacional de Seguridad, Salud y Bienestar en el Trabajo (INSSBT), O.A., M.P.; 2017.
- Acofarma. Fichas de seguridad-Descargas [Base de datos en internet] Barcelona: Acofarma. 2014 [Citado 28 de diciembre de 2017] Disponible en: http://www. acofarma.com/es/formulacion-magistral/fichas-de-seguridad.
- Quimipur, S.L.U. Productos químicos [Base de datos en internet] Madrid: Quimipur S.L.U. 2011 [Citado 28 de diciembre de 2017]. Disponible en: http://quimipur.com/productos/productos-quimicos.
- Fagron Iberica, S.A.U. Ficha de datos de seguridad del Ácido tricloroacético. 36ª versión. Barcelona: Fagron Iberica, S.A.U; 2017.
- Guinama. Productos químicos [Base de datos en internet] Madrid: Guinama. [Revisada el 05/04/2016; Citado 28/12/2017]. Disponible en: https://www. guinama.com/materia-prima.html.
- Sanofi-Aventis Deutschland GmbH. Ficha de datos de seguridad de Clorhidrato de articaína. Versión 3.3. Frankfurt am Main: Sanofi-Aventis Deutschland GmbH; 2016.
- Merck KGaA. Ficha de datos de seguridad de Codeína fosfato hemihidrato. Versión no indicada. Darmstadt: Merck KGaA; 2004.
- Merck KGaA. Ficha de datos de seguridad de Fosfato disódico dodecahidratado Ph. Eur. Versión 9.1. Darmstadt: Merck KGaA; 2014.
- Merck KGaA. Ficha de datos de seguridad de Hierro (III) cloruro 6-H2O Ph. Eur. Versión 10.0. Darmstadt: Merck KGaA; 2014.
- Fagron Iberica, S.A.U. Ficha de datos de seguridad de 2-Imidazol-4-iletilamina, diclorhidrato. Versión 15. Barcelona: Fagron Iberica, S.A.U; 2010.
- Unión Químico Farmacéutica, S.A. Ficha de datos de seguridad de Lansoprazol. Ed 1-1. Barcelona. Unión Químico Farmacéutica, S.A.; 2011.
- Farmastur 2010, S.L. Ficha de datos de seguridad de Piperacilina. Versión 01. Asturias. Farmastur 2010, S.L.; 2013.
- Fermic S.A. de C.V. Safety Data Sheet Potassium clavulanate + Avicel 1:1. Revisión 1.0. México D.F. Fermic S.A. de C.V.; 2012.
- Fermic S.A. de C.V. Safety Data Sheet Potassium clavulanate + Syloid 1:1. Revisión 1.0. México D.F. Fermic S.A. de C.V.; 2012.
- Moesh Catalana S.L. Ficha de datos de seguridad de Rabeprazol. Versión 7.0. Barcelona. Moesh Catalana S.L.; 2015.
- Farmastur 2010, S.L. Ficha de datos de seguridad de Tazobactam acido. Versión 02. Asturias. Farmastur 2010, S.L.; 2013.
- Rubén Achau Muñoz, José María Alonso Herreros, Marisa Gaspar Carreño, Olga Delgado Sánchez, Eva González-Haba Peña, Ana Cris Cercós Lletí. Consulta a la lista de SEFH el 17/02/2017: medicamentos peligrosos: clasificación IARC y Clasificación ficha de seguridad. Madrid. Sociedad Española de Farmacia Hospitalaria; 2017 [Citado 28/12/2017]. Disponible en: http://gruposdetrabajo.sefh.es/gps/images/stories/listasefh/20170220_consulta%20colaboracion.pdf.
- Instituto Nacional de Seguridad e Higiene en el Trabajo. Respuesta escrita a la consulta escrita realizada al Instituto Nacional de Seguridad e Higiene en el Trabajo. Referencia 0832.17. 19/04/2017.
- VV.AA. Monografías de Farmacia Hospitalaria y de Atención Primaria: Medicamentos peligrosos (nº 6). Barcelona; Bayer Hispania SL, 2016 [Citado 28/12/2017]. Disponible en: https://www.sefh.es/fichadjuntos/Monografias_FH_Medicamentos_Peligrosos.pdf.
____
Descargar artículo en PDF: Peligros para la salud de las materias primas y medidas de protección ante la exposición laboral en la elaboración de fórmulas magistrales y preparados oficinales
