Fecha de recepción: 17/05/2017 – Fecha de aceptación: 07/09/2017
Liñana Granell C, Ferrando Piqueres R, Álvarez Martín T, Mendoza Aguilera M, García Martínez T, Montañes Pauls B
Servicio de Farmacia Hospitalaria. Hospital General Universitario de Castellón (España)
____
Correspondencia:
Carla Liñana Granell
Hospital General Universitario Castellón
(Servicio de Farmacia)
Avda. Benicassim, s/n
12004 Castellón de la Plana
Correo electrónico: carlalinana@gmail.com
____
Resumen
Objetivos: Analizar la existencia de interacciones farmacológicas entre inhibidores de la tirosincinasa y el resto de medicación concomitante. El objetivo secundario fue evaluar el impacto de la intervención farmacéutica realizada.
Método: Estudio observacional retrospectivo (clasificación EPA-OD). Para detectar las interacciones se realizó una búsqueda bibliográfica en las plataformas informáticas Up-to-date®, Lexicomp® y Micromedex®.
Resultados: Se analizaron un total de 28 pacientes. El 78,6% de los pacientes utilizaban medicación concomitante al inhibidor de la tirosincinasa. Se registraron un total de 50 interacciones significativas, de un total de 128 fármacos, por lo que el riesgo de tener interacción en la población de estudio fue de un 39,1%. No hubo diferencias significativas en el número de interacciones respecto al sexo. Tampoco entre los pacientes que utilizaban menos de 5 fármacos concomitantes, ni 5 o más fármacos. Respecto al inhibidor de la tirosincinasa utilizado, tampoco se encontraron diferencias significativas. En cuanto a la significación clínica de las interacciones definida por del hematólogo: 10 pacientes sufrían 14 interacciones relevantes. De estas el facultativo conocía el 50% y había realizado intervención en todos los casos: modificar el tratamiento en el 28,6%, interconsulta con servicio responsable del tratamiento en el 42,8% y espaciar la toma de los fármacos en el 28,6%.
Conclusión: El paciente polimedicado sufre un riesgo considerable de sufrir interacciones con el inhibidor de la tirosincinasa. En un 12% de los casos la combinación de fármacos estaba contraindicada. Las intervenciones farmacéuticas realizadas al respecto fueron aceptadas en su totalidad.
Palabras clave: Interacción farmacológica, inhibidor tirosincinasa, leucemia mieloide crónica.
____
Introducción
En los últimos años los avances en el tratamiento contra el cáncer han originado la aparición de numerosos antineoplásicos de administración oral. La vía oral se consolida en los tratamientos de primera línea de algunos carcinomas al haberse demostrado que la supervivencia libre de enfermedad y la supervivencia global, así como los perfiles de toxicidad, no son diferentes a los de la vía parenteral1. No obstante, a pesar de suponer una alternativa de tratamiento muy atractiva, también está asociada a nuevos retos que en ocasiones pueden limitar su uso.
La comodidad de los regímenes orales para el paciente ambulatorio es una realidad, pero no se debe olvidar que son fármacos de estrecho margen terapéutico, a menudo administrados en combinación con otros agentes de similares características y sujetos a posibles interacciones con otros fármacos o incluso a interacciones fármaco-alimento. Por todo ello, las características farmacodinámicas de los fármacos pueden variar a lo largo del tiempo como consecuencia de tratamientos concomitantes o hábitos alimenticios concretos2,3.
En este escenario se han planteado nuevos retos para los profesionales encargados del cuidado de estos pacientes, como son el seguimiento de la adherencia terapéutica, el control y manejo de efectos adversos e interacciones o el tratamiento de residuos tóxicos en el domicilio. La gravedad del paciente y la complejidad terapéutica de los tratamientos hacen necesarias estrategias para la obtención de entornos de seguridad en el sistema de utilización de medicamentos, como puede ser la participación de un farmacéutico clínico especializado en esta área en la consulta oncológica, que pueda aportar el más alto estándar de calidad y de seguridad, tanto en el tratamiento antineoplásico propiamente dicho como en el tratamiento sintomático y en su relación con el tratamiento domiciliario y otros alternativos y complementarios. El paciente oncohematológico es especialmente susceptible de padecer interacciones farmacológicas debido a que a menudo recibe uno o más agentes antineoplásicos junto con medicación concomitante para paliar el dolor o los efectos adversos de la propia quimioterapia. Además, existen diversos factores derivados de la propia enfermedad que le predisponen a sufrir interacciones, tales como la mala-absorción, la malnutrición o el daño hepático o renal4.
Las interacciones que más preocupan, porque complican la evolución clínica del paciente, son aquellas cuyas consecuencias resultan perjudiciales por variar la exposición al fármaco, bien porque ésta se vea aumentada originando efectos adversos, o bien porque se vea disminuida ocasionando una respuesta terapéutica insuficiente5. No todas las interacciones son clínicamente significativas, por lo que aun tras identificarlas hay que discernir entre las que tienen relevancia clínica y las que no. En el caso de los fármacos antineoplásicos, las consecuencias clínicas pueden llevar al fracaso del tratamiento o pérdida de las escasas opciones terapéuticas disponibles6, comprometiendo así la supervivencia de los pacientes7.
Riechelmann et al. concluyeron que el 67% de los pacientes oncológicos hospitalizados se encontraban en riesgo de presentar una interacción farmacológica8,9. Los factores que los predisponen a ello son: el importante número de fármacos implicados en el tratamiento de esta patología, el empleo frecuente de medicinas alternativas, las condiciones de comorbilidad asociadas habitualmente a estos pacientes, el deterioro orgánico que repercute en los procesos de metabolización y excreción renal de los fármacos y, por último, el hecho de que en un gran número de los citostáticos recientemente comercializados no se han realizado estudios amplios pre-comercialización que permitan conocer su potencialidad de interaccionar con otros fármacos10.
El caso que ocupa este estudio es el de los citostáticos orales implicados en el tratamiento de la leucemia mieloide crónica (LMC). Hasta la aparición de los inhibidores de tirosincinasa (ITC), el tratamiento de la LMC había progresado escasamente. Las opciones terapéuticas incluían el uso de agentes como busulfán, hidroxiurea, interferón alfa solo o en combinación y trasplante de progenitores hematopoyéticos. Gracias a la aparición de los fármacos ITC, la supervivencia de estos pacientes es cada vez mayor, motivo por el cual la prevalencia de esta enfermedad está aumentando en los últimos años11. Se trata de los primeros fármacos con diana terapéutica específica: el gen de fusión BCR-ABL. El primer ITC en aparecer fue el Imatinib. A pesar de los buenos resultados de estudios con este fármaco, hay un grupo de pacientes en los que no es posible utilizar Imatinib, ya sea por intolerancia, reacciones adversas, efectos subóptimos o resistencia al fármaco. Las opciones con las que se cuenta tras la resistencia a Imatinib a dosis máximas son los ITC de segunda generación: Dasatinib y Nilotinib.
En general y de manera resumida, hay que considerar dentro de este grupo de fármacos su potencialidad de interaccionar con todos aquellos que sean sustratos, inhibidores o inductores de la isoforma CYP3A4 y de la glicoproteina-P. Un estudio reciente ha revelado que la prescripción concomitante de fármacos que pueden inhibir la efectividad de los inhibidores de protein-quinasas puede variar entre el 23 y 57%, y la de fármacos que pueden aumentar su toxicidad entre el 25 y 74%10,12,13.
Los pacientes con LMC toman normalmente varios medicamentos de forma simultánea a la terapia oncológica por lo que, atendiendo a los riesgos de la polifarmacia, cabe la posibilidad de que existan interacciones farmacológicas potenciales entre el tratamiento oncológico y el resto de medicación. Para evaluar el impacto de dichas interacciones, se pretende llevar a cabo un estudio en pacientes tratados con ITC en un hospital universitario de tercer nivel.
El objetivo de este estudio es analizar la existencia de interacciones farmacológicas entre ITC y el resto de medicación concomitante utilizada en pacientes con LMC. El objetivo secundario del estudio es evaluar el impacto de la intervención farmacéutica realizada.
Método
Estudio observacional retrospectivo en el que se seleccionaron pacientes adultos diagnosticados de LMC y tratados con ITC que acudieron al Servicio de Farmacia de un Hospital Universitario de tercer nivel desde el 1 de octubre del 2015 al 1 de octubre del 2016. En primer lugar, se elaboró un protocolo inicial y documentos de compromiso y aceptación para obtener la confirmación por parte del Comité de Ética e Investigación de Medicamentos (CEIM) del hospital. Los datos sobre el tratamiento se obtuvieron, de forma retrospectiva, del módulo de dispensación individualizada del programa Farmasyst® y de la aplicación informática Abucasis®. Se recogieron las siguientes variables relacionadas con los pacientes: edad, sexo, tipo y dosis de fármaco antineoplásico, características y número de medicación concomitante no antineoplásica y número, nivel y tipo de interacciones. Para detectar las posibles interacciones existentes entre su mediación habitual y la terapia oncológica se realizó una búsqueda bibliográfica en las plataformas informáticas Up-to-date®, Lexicomp® y Micromedex® y se completó la información obtenida con las fichas técnicas de los fármacos. Se clasificaron las interacciones según su gravedad, siguiendo la clasificación de Lexicomp® database (LexiComp, Inc, Hudson, Ohio) 2010 y DRUG-REAX System® Thomson Reuters, Greenwood Village, Colo, USA, 2010.
– Nivel de interacción X: interacción significativa. Los riesgos asociados al uso concomitante de estos dos fármacos normalmente sobrepasan a los beneficios. Se trata de una asociación de fármacos contraindicada.
– Nivel de interacción D: interacción significativa. Debe realizarse una evaluación específica del paciente para determinar si los beneficios de dicho tratamiento superan a los riesgos. Se deberán realizar acciones como una monitorización exhaustiva, cambios de dosis o uso de fármacos alternativos para obtener beneficios o disminuir la toxicidad resultante del uso concomitante de dichos fármacos.
– Nivel de interacción C: interacción significativa. Normalmente los beneficios del uso concomitante de estos fármacos superan a los riesgos. De todas formas se debe llevar a cabo un plan de monitorización para detectar potenciales eventos adversos. Pueden ser necesarios ajustes de dosis en uno o ambos fármacos en una minoría de pacientes.
Se identificaron las interacciones potenciales o reales, así como la prevalencia de las mismas y el riesgo que le podía suponer al paciente. También se clasificaron según el tipo de interacción en farmacocinéticas, farmacodinámicas u otras y dentro de cada una de ellas si se esperaba un aumento o una disminución de dosis.
Las variables cuantitativas se resumieron con media y desviación estándar o mediana y rango, y las variables cualitativas con porcentajes. El análisis estadístico se realizó en el grupo de pacientes que tenían prescrito tratamiento concomitante y los pacientes se agruparon según si tenían interacciones relevantes entre el fármaco antineoplásico y el fármaco concomitante. Las diferencias en el sexo, el tratamiento concomitante (mayor o menor a 5 fármacos) y el ITC utilizado se evaluaron mediante la prueba Chi-cuadrado (χ2). Se realizó el análisis estadístico con el paquete estadístico SPSS 21.0 para Mac.
Una vez recopilada toda la información se informó al facultativo especialista responsable de los pacientes sobre las interacciones más relevantes. Se realizó una revisión detallada de cada paciente, conjunta entre el hematólogo y el farmacéutico, se revisó la historia clínica (Abucasis® y Orion Clinic®), la evolución de los datos analíticos (IGestlab®), los ingresos del paciente y los cambios de medicación y se tomó una decisión clínica para cada tipo de interacción en cada paciente concreto. Se recopiló la significación clínica de dichas interacciones por parte del hematólogo y se evaluó la aceptación y utilidad de la intervención farmacéutica realizada.
El proyecto contó con el dictamen favorable del Comité Ético del Hospital General Universitario de Castellón tras la clasificación realizada por la Agencia Española del Medicamento como Estudio Observacional (EPA-OD) en febrero de 2017.
Resultados
Se analizaron un total de 28 pacientes con LMC tratados con un ITC. Un 60,7% eran varones con una edad media de 56,5±14,2 años, solamente un 42,8% de los pacientes eran mayores de 60 años. Un 39,3% de los pacientes estaban tratados con un ITC de primera generación (Imatinib), mientras que un 39,3% estaban siendo tratados con Dasatinib y un 21,4% de los pacientes con Nilotinib.
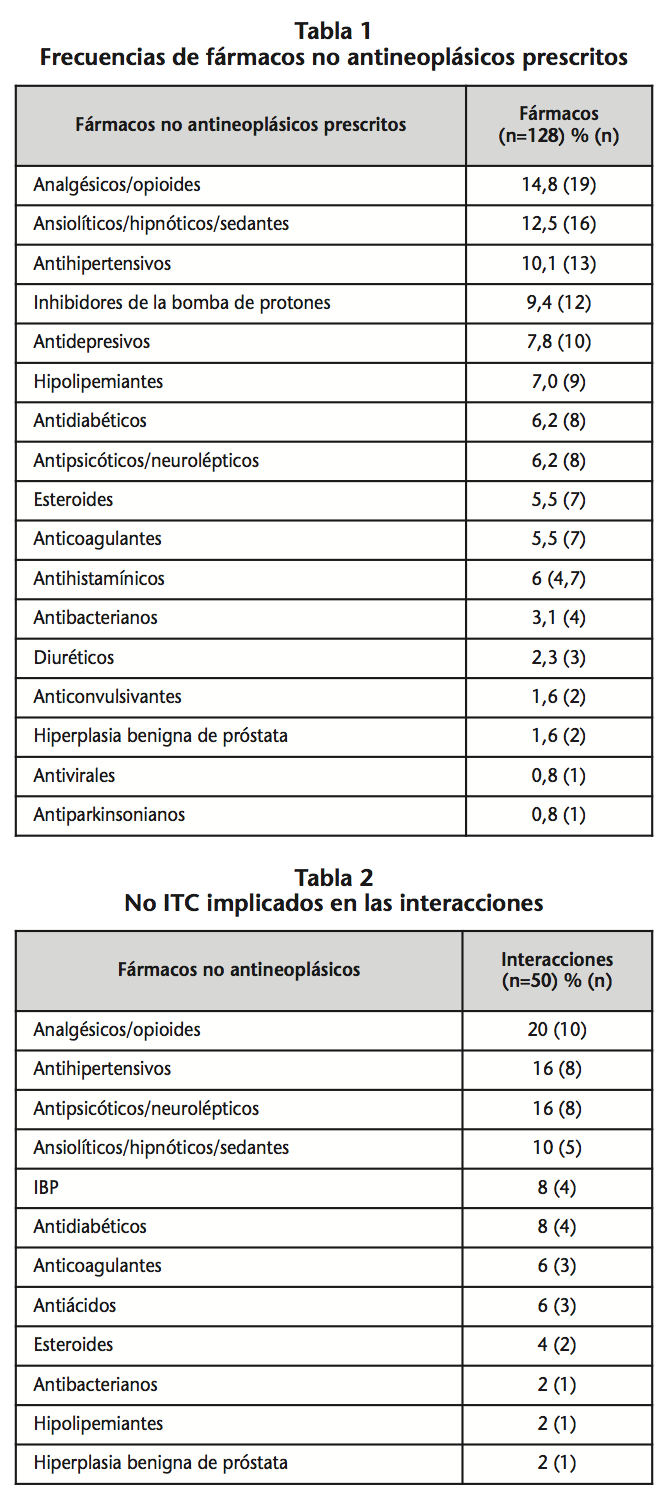 El 78,6% de los pacientes tenían medicación asociada al ITC y los fármacos más comúnmente prescritos fueron analgésicos/opioides, ansiolíticos/hipnóticos/sedantes y antihipertensivos, seguido de inhibidores de la bomba de protones (IBPs), en la tabla 1 se describen las frecuencias de fármacos no antineoplásicos prescritos.
El 78,6% de los pacientes tenían medicación asociada al ITC y los fármacos más comúnmente prescritos fueron analgésicos/opioides, ansiolíticos/hipnóticos/sedantes y antihipertensivos, seguido de inhibidores de la bomba de protones (IBPs), en la tabla 1 se describen las frecuencias de fármacos no antineoplásicos prescritos.
La mediana de fármacos concomitantes prescritos fue de 4 (0-16). El 21,4% de los pacientes no tomaban ningún fármaco adicional, el 39,3% llevaban de 1 a 5 fármacos concomitantes y el 39,3% llevaban ≥5 fármacos no antineoplásicos prescritos.
Se registraron un total de 50 interacciones significativas ITC – no ITC, estas interacciones ocurrieron en 20 pacientes de los 28, que tomaban un total de 128 fármacos, por lo que el riesgo de tener interacción en la población de estudio fue de un 39,1%. Del total de interacciones detectadas un 72,6% eran interacciones potenciales (nivel C) en las cuales no es necesario un ajuste de dosis pero sí precaución y monitorización de eventos adversos, un 15,1% eran de nivel D, en las que se debía considerar modificar la terapia, mientras que la cuantía de interacciones contraindicadas (nivel X) fue de un 12,2%, en el que se recomendaba evitar dicha combinación de fármacos. La mediana de interacciones fue de 1 (0-5). Las interacciones casi en su totalidad fueron de tipo farmacocinético (90,7%), de estas el 87,4% implicaba un posible aumento de las concentraciones de fármaco concomitante, debido a la naturaleza inhibitoria de los ITC y solamente en un 12,6% una posible disminución de la concentración de ITC, debido a interferencias en la absorción (antiácidos e IBPs). Los fármacos con mayor número de interacciones fueron analgésicos/opioides, antihipertensivos y antipsicóticos (Tabla 2).
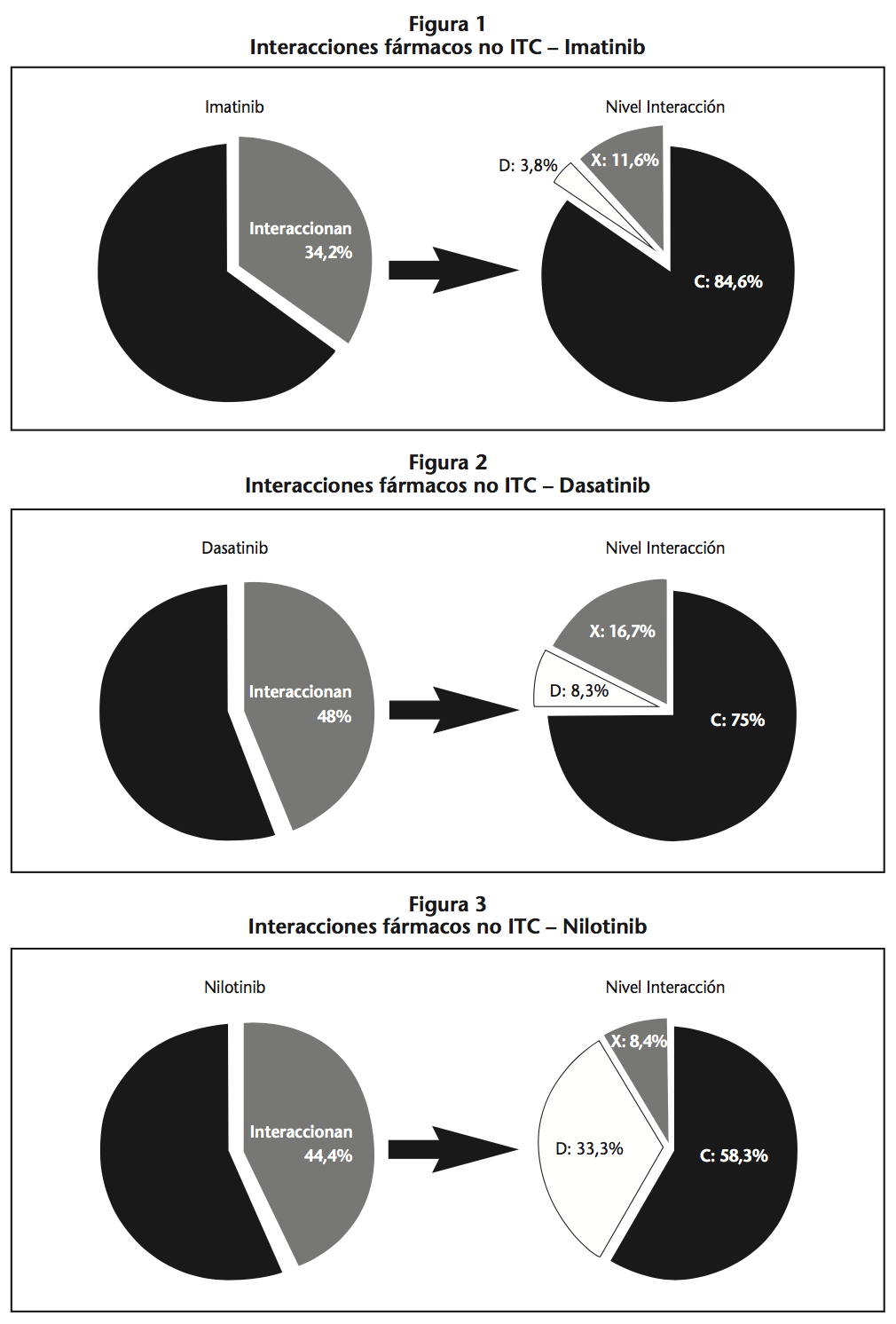
En los pacientes tratados con Imatinib, un 34,2% del tratamiento concomitante podía producir una interacción. De estas interacciones, un 84,6% fueron de nivel C, debidas a la inhibición moderada de citocromos CYP3A4 (31,8%) y CYP2D6 (27,3%) y de la glicoproteína-P (4,5%). Un 3,8% fueron de nivel D, y un 11,6% fueron de nivel X. En este último grupo destaca la interacción con Metamizol, ya que puede incrementar las reacciones adversas como agranulocitosis y pancitopenia (Figura1).
En el caso de Dasatinib, hubo un 48,0% de fármacos con posibilidad de interaccionar. De estas interacciones el 75,0% fue de nivel C, debido en su mayoría a la inhibición del citocromo CYP3A4 (44,4%) y al incremento del efecto antiagregante (33,3%). Un 8,3% fue de nivel D y un 16,7% de nivel X, destacando la interacción con IBPs, que reducen significativamente la absorción del Dasatinib, reduciendo así su concentración en plasma (Figura 2).
Por último, de los pacientes con Nilotinib, el 44,4% de los fármacos sufrían algún tipo de interacción. El 58,3% de las interacciones fueron de nivel C, el 33,3% fueron de nivel D, debido a su interacción con antiácidos e iones divalentes (66,7%) y el 8,4% de nivel X, debido al alto riesgo de prolongación del segmento QT y riesgo de desarrollar toxicidad cardíaca, como con la Quetiapina (Figura 3).
En el análisis estadístico global, no hubo diferencias significativas en el número de interacciones respecto al sexo (p=0,386). Tampoco se observaron diferencias significativas en cuanto a la frecuencia de interacciones relevantes entre los pacientes que llevaban menos de 5 fármacos concomitantes y más de 5 fármacos (p=0,603). Respecto al ITC utilizado, tampoco se encontraron diferencias significativas en aquellos pacientes que en su régimen utilizaban ITC de primera generación (Imatinib) o de segunda generación (Dasatinib/Nilotinib) (p=0,174), aunque existe una tendencia a la significación de sufrir más interacciones con los fármacos de segunda generación.
En cuanto a la significación clínica de las interacciones por parte del hematólogo y la aceptación de la intervención farmacéutica: 10 pacientes sufrían 14 interacciones de nivel alto (D o X). De estas el facultativo conocía el 50% de las interacciones y había realizado intervención en todos los casos: modificar el tratamiento en el 28,6%, interconsulta con servicio responsable del tratamiento en el 42,8% y espaciar la toma de los fármacos en el 28,6%. Con el otro 50% de las interacciones se realizó una intervención farmacéutica individualizada y se recomendó: interconsulta al servicio responsable del tratamiento (14,3%), espaciar la toma de los fármacos (42,8%), monitorizar posibles efectos adversos debido a la interacción (14,3%) y modificar/reducir tratamiento (28,6%). Todas las propuestas fueron aceptadas por el facultativo responsable.
Discusión
En el presente estudio, la estimación del riesgo de presentar interacciones clínicamente relevantes entre ITC y no ITC fue inferior a lo descrito en la literatura8,9. El porcentaje de interacciones que aumentan las concentraciones de fármaco concomitante fue superior al de un estudio presentado en USA por Bowlin et al. en 201314, mientras que el porcentaje de interacciones que disminuyen la concentración de ITC y con ello su efectividad, fue inferior al de dicho estudio. La causa de estas diferencias posiblemente sea la muestra limitada de pacientes y el hecho de que el estudio se ha realizado únicamente para los ITC que tratan la LMC. Otros trabajos confirman que a mayor número de fármacos concomitantes en pacientes diagnosticados de LMC con ITC aumenta el riesgo de interacciones5,6, en cambio, en el estudio realizado no se observaron diferencias significativas en cuanto a la frecuencia de interacciones relevantes entre los pacientes que llevaban menos de 5 fármacos concomitantes y más de 5 fármacos. Esto es debido a que no se han incluido las interacciones entre los fármacos no antineoplásicos entre sí. No existen tampoco diferencias de interacciones al administrar ITC de primera generación o segunda generación, ya que farmacológicamente no existe un perfil metabólico más susceptible a sufrir interacciones que otro.
Los fármacos analgésicos y sedantes junto con los antihipertensivos fueron los más prescritos en los pacientes incluidos en el estudio. El dolor, el insomnio y la depresión son una de las comorbilidades más frecuentes en la población oncológica y por tanto, los fármacos analgésicos y psiquiátricos son los fármacos más frecuentemente prescritos. Los fármacos concomitantes más implicados en las interacciones fueron analgésicos, antihipertensivos y antipsicóticos. Seguido muy de cerca por fármacos ansiolíticos, IBPs y antidiabéticos.
Con respecto a la valoración conjunta con el facultativo responsable se demostró la preocupación existente por parte de los profesionales sobre el tema de las interacciones de este grupo de fármacos y que, debido a la falta de tiempo en la consulta o a la limitación en el acceso a herramientas de búsqueda y a bases de datos, no pueden ser abordadas debidamente por el hematólogo. La intervención del farmacéutico clínico tanto al inicio del tratamiento como en revisiones sucesivas de medicación podría ayudar a evitar eventos adversos e incluso evitar el cambio a ITCs de segunda generación, que en ocasiones se produce debido a intolerancias o eventos adversos de origen desconocido, mejorando así la persistencia. Con esta intervención se valorará la necesidad real de otro fármaco, la respuesta molecular del paciente, la situación clínica y, en algún caso, los niveles plasmáticos de ITC ayudarían a prever el resultado de la interacción. Así pues, el seguimiento farmacoterapéutico personalizado del paciente hematológico debe conducir a la colaboración con el hematólogo y con el resto de profesionales sanitarios formando parte de un equipo multidisciplinar.
En el presente estudio la mayoría de las interacciones fueron de tipo farmacocinético, debidas a sustratos, inhibidores o inductores de la isoforma CYP3A4, CYP2D6 y de la glicoproteina-P, confirmando la información publicada en una revisión realizada en el año 20147.
El trabajo realizado presenta una serie de limitaciones perfectamente definidas. En primer lugar la muestra es limitada; condicionada directamente por la población de pacientes adultos con LMC tratados que hay en el área geográfica de estudio. En segundo lugar, al tratarse de un análisis retrospectivo puede haber pérdida de información en las variables recogidas de la historia clínica informatizada, ya que es posible que el tratamiento concomitante en curso no estuviera actualizado correctamente en algunos casos. En tercer lugar, los datos de interacciones no siempre estaban disponibles en las bases de datos para las distintas combinaciones de fármacos. En cuarto lugar, se ha realizado el estudio para los ITC que tratan LMC, existen más ITC con otras indicaciones y la mayoría de los estudios consultados analizan todos los ITC, por lo que no se pueden comparar. Por último, los índices de interacciones se han subestimado ya que no se han incluido las interacciones entre los fármacos antineoplásicos entre sí ni entre los fármacos no antineoplásicos.
En este estudio se ha podido demostrar que estos antineoplásicos orales requieren intervenciones farmacéuticas destinadas a prevenir y/o minimizar el riesgo de toxicidad o disminución de eficacia por interacciones con otros medicamentos. Muchas de las interacciones medicamentosas en oncología no se reconocen como tales ya que se encuentran enmascaradas por algunos síntomas de la propia patología e incluso, se confunden con la toxicidad inherente al empleo de los quimioterápicos. Por todo ello, antes de introducir un nuevo fármaco en la terapia del paciente oncohematológico es importante cuestionarse la necesidad real del mismo, valorando posibles alternativas más seguras. En caso de necesitar un medicamento que pueda interaccionar debe utilizarse de forma adecuada con objeto de minimizar los efectos adversos.
Los Servicios de Farmacia han mostrado que mediante la intervención farmacéutica se obtiene una reducción del riesgo absoluto del 25,9% de padecer un acontecimiento adverso por medicamento causado por una interacción farmacológica15. Este contexto hace que el acto de la entrevista farmacéutica sea una herramienta de gran valor para detectar y corregir interacciones en las que intervienen antineoplásicos orales16. En definitiva, se trata de pacientes con tratamientos complejos y con un riesgo elevado de sufrir problemas farmacoterapéuticos que pueden comprometer la efectividad y seguridad del tratamiento. Además, el paciente externo oncológico es el único responsable de la toma de su medicación. En este contexto, las unidades de atención farmacoterapéutica a pacientes externos han pasado a tener un papel fundamental en la atención y seguimiento farmacoterapéutico del paciente oncohematológico externo.
Otra posible directriz futura con estos fármacos, dada la amplia posibilidad de interacción farmacológica, sería su monitorización farmacocinética en la práctica clínica habitual, ya que se dispone de concentraciones dianas en términos de eficacia, y concentraciones diana para garantizar la seguridad del tratamiento17-19.
Con este estudio concluimos que la toma conjunta de medicamentos hace que exista un riesgo potencial de desarrollo de problemas relacionados con la medicación, especialmente derivados de las interacciones de tipo farmacológico. Además, es importante revisar periódicamente la medicación concomitante y disponer de una estrategia para controlar dichas interacciones y evitarlas. Y que el papel del farmacéutico es fundamental en la comunicación con el paciente, el control de su tratamiento, la detección de interacciones potenciales y la difusión de la información entre el equipo multidisciplinar.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Bibliografía
1. Cassidy J, Saltz L, Twelves C, et al. Efficacy of capecitabine versus 5-fluorouracil in colorectal and gastric cancers: a meta-analysis of individual data from 6171 patients. Ann Oncol. 2011;22(12):2604-9.
2. Ruggiero A, Maria G, Coccia P, et al. The role of diet on the clinical pharmacology of oral antineoplastic agents. Eur J Clin Pharmacol. 2012;68:115-122.
3. Santana Martínez S, Marcos Rodríguez JA, Romero Carreño E. Administración de citostáticos vía oral: interacciones fármaco-alimento. Farm Hosp. 2015;39(4):203-209.
4. Riechelmann RP, Tannock IF, Wang L, et al. Potential drug interactions and duplicate prescriptions among cancer patients. J Natl Cancer Inst. 2007;99:592-600.
5. Flores J, Armijo JA, Mediavilla A. Farmacología Humana. Masson-Salvat. 5o Edición. 2008.
6. Serrano JI. Interacciones farmacológicas de los nuevos antirretrovirales. Farm Hosp. 2011;35:36-43.
7. Sánchez Gómez E, Arco Prados Y. Revisión de las interacciones farmacológicas de los fármacos antineoplásicos orales dispensados en un servicio de farmacia. Farm Hosp. 2014;38(4):338-363.
8. Riechelmann RP, Moreira F, Smaletz O, et al. Potential for drug interactions in hospitalized cancer patients. Cancer Chemother Pharmacol. 2005;56:286-290.
9. Riechelmann R, Saad E. A Systematic Review on Drug Interactions in Oncology. Cancer Investigation. 2006; 24(7):704-712.
10. Master en oncología farmacéutica 4ª edición (nov2015-feb2017). Módulo 3. Interacciones clínicamente significativas. Aldaz A, Porta B.
11. Björkholm M, Ohm L, Eloranta S, et al. Success story of targeted therapy in chronic myeloid leukemia: a population-based study of patients diagnosed in Sweden from 1973 to 2008. J Clin Oncol. 2011 Jun 20;29(18):2514-20.
12. Teo YL, Ho HK, Chan A. Metabolism-related pharmacokinetic drug-drug interactions with tyrosine kinase inhibitors: current understanding, challenges and recommendations. Br J Clin Pharmacol. 2015;79(2):241-53.
13. Shao J, Markowitz JS, Bei D, et al. Enzyme and Transporter-Mediated Drug Interactions with Small Molecule Tyrosine Kinase Inhibitors. J Pharm Sci. 2014;103 (12):3810-33.
14. Bowlin SJ, Xia F, Wang W, et al. Twelve-month frequency of drug-metabolizing enzyme and transporter-based drug-drug interaction potential in patients receiving oral enzyme-targeted kinase inhibitor antineoplastic agents. Mayo Clin Proc. 2013 Feb;88(2):139-48.
15. Sánchez Gómez E, Sánchez del Moral R, González Rivas L. Disminución de consecuencias clínicas adversas prevenibles por interacciones farmacológicas. Aten Farm. 2010;12:55-63.
16. Documento de Consenso sobre el uso de Antineoplásicos orales. Grupo GEDEFO. Octubre 2009. Disponible: http://gruposdetrabajo.sefh.es/gedefo/images/stories/ documentos/consenso_gedefo_antineoplasicos_orales.pdf.
17. Guilhot F, Hughes TP, Cortes J, et al. Plasma exposure of imatinib and its corretaltion with clinical response in the Tyrosine Kinase Inhibitor Optimization and Selectivity Trial. Haematologica. 2012 May;97(5):731-8.
18. Larson RA, Yin OQ, Hochhaus A, et al. Population pharmacokinetic and exposure-response analysis of nilotinib in patients with newlydiagnosed Ph+ chronic myeloid leukemia in chronic phase. Eur J Clin Pharmacol. 2012 May;68(5):723-33.
19. Wang X, Agrawal S, Damokosh A. Dasatinib Exposure and Relationship to Efficacy and Safety In Patients with Newly Diagnosed Chronic Myeloid Leukemia In Chronic Phase (CML-CP). Blood 2010;116:4938.
____
Descargar artículo en PDF: Riesgo de interacciones farmacológicas en pacientes polimedicados en tratamiento con inhibidores de la tirosincinasa
