González-Bueno J1, Sierra-Torres MI1, Pérez-Blanco JL2
1 Farmacéutico Interno Residente
2 Especialista en Farmacia Hospitalaria
Unidad de Gestión Clínica de Farmacia. Hospital Universitario Virgen del Rocío. Sevilla (España)
Resumen
La reciente comercialización de dabigatrán, rivaroxabán y apixabán, condiciona la necesidad de concretar unas recomendaciones de uso, identificando aquellos pacientes en los que las ventajas de estos nuevos tratamientos sean mayores y asegurando que su empleo se produce de forma prudente con objeto de minimizar la aparición de efectos adversos hemorrágicos ligados a una marcada morbi-mortalidad.
La ausencia de una técnica de laboratorio adecuadamente validada para la monitorización de su efecto anticoagulante hace necesario caracterizar técnicas potencialmente útiles como, por ejemplo, el tiempo de coagulación de ecarina o el Heptest.
Los estudios pivotales muestran un perfil de seguridad superior para los nuevos anticoagulantes orales frente a warfarina. No obstante, los metanálisis de comparaciones directas limitan estas ventajas a una menor incidencia de eventos intracraneales. Aún considerando sus limitaciones intrínsecas, los estudios de comparaciones indirectas posicionan a apixabán como el anticoagulante de mayor seguridad en comparación con rivaroxabán y dabigatrán 150 mg.
Actualmente no disponemos de un claro antídoto que neutralice el efecto de este grupo de fármacos. Las distintas guías propuestas se basan en la escasa evidencia disponible.
El conocimiento de las características farmacocinéticas de los nuevos anticoagulantes orales, así como la evaluación del riesgo trombótico y hemorrágico, son pilares fundamentales de la prevención del sangrado en pacientes anticoagulados de riesgo como son aquellos sometidos a un procedimiento quirúrgico o a una anestesia neuroaxial.
Palabras clave: Anticoagulantes, revisión, hemorragia, monitorización, tratamiento.
Bleeding risk related to new oral anticoagulants
SUMMARY
The recent marketing approval of dabigatran, rivaroxaban and apixaban, determines the need to implement some terms of use, identifying those patients in whom the benefits of these drugs are larger and ensuring their prudent use, to minimize the incidence of hemorrhagic side effects linked with to a high morbi-mortality.
The absence of a properly validated technique for monitoring its anticoagulant effect requires the characterization of laboratory techniques potentially applicable to its measurement as the ecarin clotting time or the Heptest.
Pivotal trials showed a safer profile for the new oral anticoagulants vs. warfarin. However, current meta-analysis restricts these benefits to a lower incidence of intracranial events. Even considering its inherent limitations, indirect comparisons show apixaban as the safer new oral anticoagulant vs. rivaroxaban and dabigatran 150 mg.
No clear antidote has shown to effectively neutralize the effect of these drugs. Current guidelines are based on the limited evidence available.
Knowledge of the pharmacokinetics of the new oral anticoagulants, as well as a thrombotic and haemorrhagic risk assessment are key foundations for bleeding risk prevention in anticoagulated patients such as those undergoing a surgical procedure or neuraxial anaesthesia.
Key Words: Anticoagulants, review hemorrhage, drug monitoring, therapeutics.
_____
Dentro del Número: VOL. 25 – Nº1 – 2015
Descargar PDF: Riesgo hemorrágico asociado a los nuevos anticoagulantes orales
_____
Introducción
La reciente comercialización de un nuevo grupo de anticoagulantes orales (NACO), compuesto por dabigatrán, rivaroxabán y apixabán, condiciona la necesidad de definir adecuadamente sus condiciones de uso, identificando aquellos pacientes en los que las ventajas de estos nuevos tratamientos sean mayores y asegurando que su empleo se produce de forma prudente, con objeto de minimizar la aparición de efectos adversos hemorrágicos ligados a una marcada morbi-mortalidad.
A pesar de que este nuevo grupo de fármacos se pauta a dosis fijas, en determinadas situaciones puede ser necesaria la monitorización de su efecto anticoagulante1,2. Por ello, sería de gran utilidad conocer sus principales propiedades farmacocinéticas y la influencia de su efecto prohemorrágico en los distintos test de laboratorio disponibles. La figura 1 muestra las dianas terapéuticas de los NACO, los cuales, a diferencia de los anticoagulantes clásicos ejercen su efecto mediante una inhibición directa de sus dianas terapéuticas (la trombina o el factor Xa).
Por otro lado, el riesgo hemorrágico asociado a los NACO en el tratamiento de la fibrilación auricular únicamente ha sido evaluado en ensayos clínicos frente a warfarina o ácido acetil-salicílico3-6. Consecuentemente, desconocemos la seguridad relativa de los mismos, siendo necesario recurrir a la interpretación de comparaciones indirectas.
Existe un grupo de pacientes más propensos a desarrollar un proceso hemorrágico, son los que se someten a un procedimiento quirúrgico o a una anestesia neuroaxial. Así, sería especialmente importante conocer la correcta utilización de este nuevo grupo de medicamentos en estos pacientes.
No disponemos hasta la fecha de trabajos que aborden integralmente la seguridad de los NACO, limitándose únicamente a aspectos parciales. Por todo ello, la presente revisión pretende orientar acerca de las herramientas disponibles para la monitorización del efecto anticoagulante de los NACO. Adicionalmente, revisará la evidencia disponible respecto al riesgo de sangrado asociado, las estrategias terapéuticas para su manejo, así como las principales recomendaciones para su prevención en poblaciones de riesgo.
-
Monitorización del efecto anticoagulante de los NACO
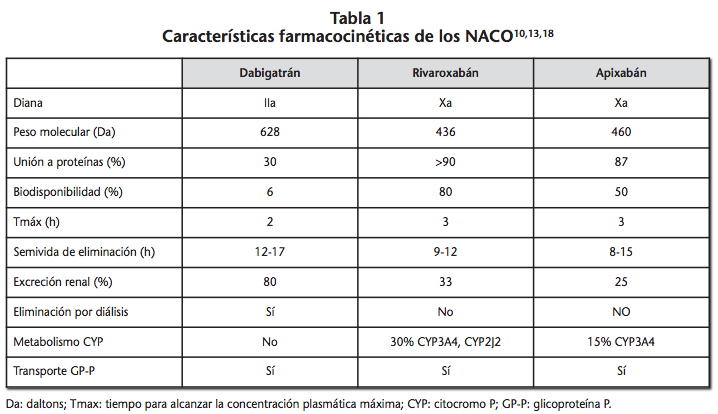
Actualmente no disponemos de técnicas de laboratorio aplicables a la determinación exacta de los niveles plasmáticos de los NACO, no siendo posible relacionar los mismos con la intensidad del efecto anticoagulante7-9. Por ello, es necesario recurrir al empleo de pruebas de laboratorio que permitan monitorizar indirectamente el efecto prohemorrágico de estos fármacos. La correcta interpretación de éstas exige conocer las principales características farmacocinéticas de los NACO (Tabla 1), al igual que su efecto sobre los distintos test de laboratorio.
A pesar de caracterizarse por una farmacocinética y farmacodinamia más predecible que los anticoagulantes clásicos10, la monitorización del efecto de los NACO mediante parámetros de laboratorio puede estar justificada en ciertas situaciones como son el sangrado activo, sobredosificaciones, empleo de procedimientos médicos invasivos o en la evaluación del cumplimiento terapéutico1,2,7.
A su vez, la falta de antídoto capaz de neutralizar de forma eficaz y predecible el efecto prohemorrágico de los NACO9,11,12 hace necesario conocer qué pruebas de laboratorio se ven afectadas por los NACO así como relacionar adecuadamente sus valores con la actividad prohemorrágica de los mismos y/o con sus niveles plasmáticos.
– Dabigatrán
Dabigatrán modifica los valores del tiempo de protrombina parcial activada (TTPa), incrementándolo de forma no proporcional a sus concentraciones. El TPPa presenta una relación curvilínea que alcanza una meseta a concentraciones superiores a 400 ng/ml; por este motivo no resulta un buen parámetro para cuantificar el efecto anticoagulante de dabigatrán, especialmente a concentraciones plasmáticas elevadas13-15.
El tiempo de protrombina (TP) aumenta de forma directa con respecto a la concentración de dabigatrán, aunque es relativamente insensible a los efectos totales del fármaco y existe una gran variabilidad en los resultados por lo que no resulta adecuado como guía para la reversión de los efectos del fármaco12. Relacionada con esta técnica de monitorización se encuentra el tiempo de tromboplastina diluida (DTT) que utiliza un agente similar a la tromboplastina ya diluido, incrementado así la sensibilidad. De esta forma se obtiene una buena correlación entre el efecto antitrombótico de dabigatrán y los valores del test14,16,17.
El tiempo de coagulación de ecarina (TCE) presenta una relación lineal con las concentraciones de dabigatrán11,18-20. En todo caso, el ensayo cromogénico de ecarina, una variante del TCE, es considerado el test más adecuado en términos de sensibilidad y precisión en la determinación del efecto anticoagulante de dabigatrán19.
– Rivaroxabán y apixabán
La medición del efecto de ambos fármacos se ha evaluado mediante la determinación del grado de inhibición inducido sobre el factor Xa. Para ello se recurre a la medida del TP y del TPPa, ambos incrementados ante la presencia del fármaco19. Este incremento es coherente con su capacidad de ejercer su inhibición en el punto de convergencia de las vías intrínseca y extrínseca de la coagulación. El aumento en los valores de ambos test es dependiente de la dosis, si bien el TP puede ser más sensible, especialmente a altas dosis22. La utilización del tiempo de trombina (TT) y del TCE en la monitorización de rivaroxabán y apixabán resulta inútil dado que ninguno de estos fármacos afecta a la trombina20.
-
Seguridad de los NACO
La evaluación de la seguridad de los NACO implica analizar conjuntamente los resultados procedentes tanto de los estudios pivotales como de la evidencia proporcionada por los distintos metanálisis de comparaciones directas e indirectas.
En este apartado se revisan aquellos estudios centrados en pacientes con fibrilación auricular por ser esta la primera indicación aprobada, disponiendo actualmente de una mayor evidencia tanto directa como indirecta.
– Estudios pivotales: principales hallazgos
La principal evidencia acerca de la incidencia de eventos hemorrágicos asociados con los NACO procede de los ensayos clínicos pivotales RE-LY (dabigatrán)3, ROCKET-AF (rivaroxabán)4, AVERROES5 y ARISTOTLE (apixabán)6. En todos ellos, se evaluaba la eficacia y seguridad de los NACO en la prevención del ictus tromboembólico en pacientes con fibrilación auricular. Los principales hallazgos obtenidos en estos estudios se resumen en la tabla 2.
– Seguridad comparada entre los NACO: resumen de comparaciones directas e indirectas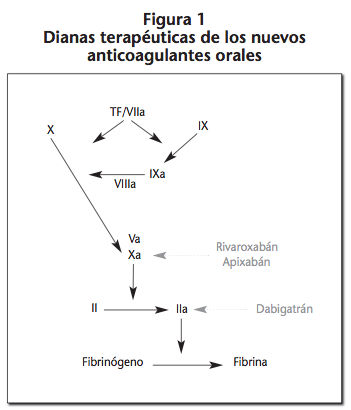
El metanálisis de Ruff et al.21 evalúa la seguridad de los NACO frente a warfarina considerando para ello los correspondientes estudios pivotales. Este trabajo muestra un incremento del riesgo de hemorragia gastrointestinal [1,25 (1,01 a 1,55)] y una reducción del riesgo de hemorragia intracraneal [0,48 (0,39 a 0,59)] asociado al empleo de los NACO.
En todos los ensayos clínicos pivotales, exceptuando el estudio AVERROES5, se empleó warfarina en el grupo control. Por ello, no se dispone de evidencia directa que compare la seguridad relativa entre los nuevos anticoagulantes, con excepción de los dos esquemas posológicos de dabigatrán del estudio RE-LY3. Ello condiciona la necesidad de recurrir preferentemente a la información aportada por comparaciones indirectas ajustadas22-24.
Entre las principales limitaciones en la realización de comparaciones indirectas encontramos la heterogeneidad existente entre las distintas poblaciones incluidas en los ensayos clínicos. Uno de los principales responsables de esta heterogeneidad es la inclusión en el estudio ROCKET-AF4 de pacientes con CHADS2 mayor de 2 y, por tanto, con un riesgo de ictus muy superior al de la población incluida en los estudios RE-LY3 y ARISTOTLE6.
Rasmussen et al.22 en su metaanálisis de comparaciones indirectas analizaron independientemente los pacientes en prevención primaria vs. secundaria. En prevención secundaria, no observaron diferencias en términos de seguridad para apixabán y dabigatrán 150 mg vs. rivaroxabán.
Por otra parte, observaron una menor tasa de sangrado mayor [0,68 (0,47 a 0,99)] y hemorragia intracraneal [0,27 (0,10 a 0,73)] para dabigatrán 110 mg vs. rivaroxabán. En prevención primaria, apixabán vs. dabigatrán 150 mg se asoció con un menor riesgo de sangrado mayor [0,75 (0,60 a 0,94)] y hemorragia gastrointestinal [0,61 (0,42 a 0,89)]. No se observaron diferencias en términos de seguridad entre dabigatrán 150 mg y rivaroxabán. Opuestamente, apixabán vs. rivaroxabán se asoció con un menor riesgo de hemorragia mayor [0,61 (0,48 a 0,78)].
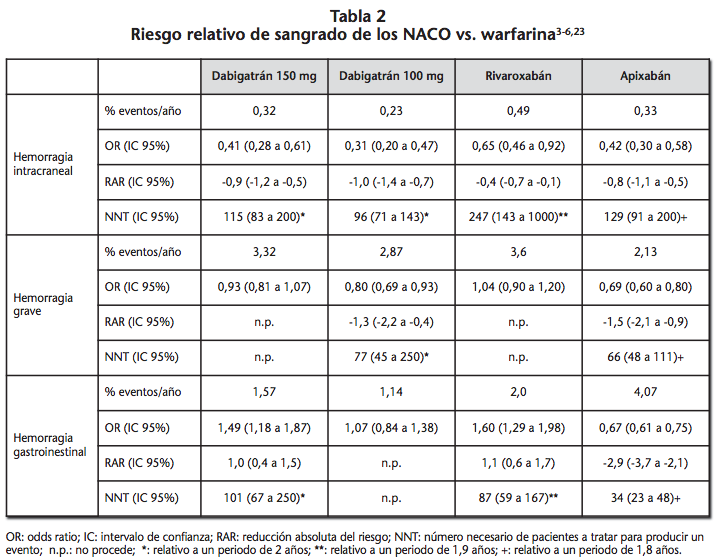
En el metaanálisis de comparaciones indirectas de Abdel-Kader Martín et al.23 se observó un incremento significativo de hemorragia grave para dabigatrán 150 mg vs. apixabán [1,36 (1,11 a 1,67)], rivaroxabán vs. apixabán [1,49 (1,22 a 1,83)] y rivaroxabán vs. dabigatrán 110 mg [1,29 (1,05 a 1,59)]. En el caso de dabigatrán 150 mg vs. 110 mg, el incremento del riesgo rozó la significación estadística [1,17 (1,00 a 1,35)]. En cuanto a las hemorragias intracraneales, se observó un incremento significativo para rivaroxabán vs. dabigatrán 110 mg [2,17 (1,24 a 3,80)]. Respecto a las hemorragias gastrointestinales, se observó un incremento para dabigatrán 150 mg vs. apixabán [1,69 (1,19 a 2,41)], rivaroxabán vs. apixabán [1,82 (1,29 a 2,56)], rivaroxabán vs. dabigatrán 110 mg [1,50 (1,08 a 2,08)] y dabigatrán 150 mg vs. 110 mg [1,39 (1,11 a 1,74)].
-
Manejo de los episodios hemorrágicos
Actualmente no disponemos de un claro antídoto que neutralice el efecto de los NACO9,12. Recientemente se han publicado estudios experimentales que avalan el empleo de un antídoto capaz de desplazar a dabigatrán de la trombina25, así como un factor Xa con capacidad de neutralizar tanto a rivaroxabán como apixabán26. Tampoco disponemos de evaluaciones clínicas acerca del tratamiento de las hemorragias asociadas a los NACO, aparte de un reducido número de estudios de diseño heterogéneo27,28.
A continuación, describimos la evidencia disponible en torno a las estrategias más contrastadas para el manejo clínico de la hemorragia secundaria a los NACO. Además de medidas basadas en el empleo de hemoderivados y técnicas de hemofiltración, las guías disponibles consideran el empleo de medidas de soporte (reanimación con expansores plasmáticos y empleo de concentrados de hematíes) o la utilización de carbón activado en caso que la ingesta del fármaco hubiese tenido lugar en las dos últimas horas. En todo caso, se trata de guías basadas en la escasa evidencia disponible, siendo por ello de utilidad limitada29-33.
– Dabigatrán
Disponemos de casos en los que se administró plasma fresco congelado para la corrección del sangrado causado por dabigatrán. Aparentemente, esta estrategia permite normalizar valores de laboratorio. Sin embargo, sus efectos sobre la coagulopatía y el sangrado son inciertos11,34.
A su vez, se ha observado en sangre extraída de voluntarios sanos la capacidad del factor VIIa de revertir la acción de dabigatrán al reducir el tiempo de formación del coágulo hasta valores propios de la normalidad35.
Eerenberg et al.27 evaluaron la efectividad del concentrado de complejo protrombínico (PCC) en la reversión de la anticoagulación por NACO. Para ello, realizaron un ensayo clínico controlado con placebo, aleatorizado, cruzado y doble ciego. La eficacia del PCC sobre la acción anticoagulante de dabigatrán se evaluó utilizando diversos parámetros analíticos como el TTPA, TT ó TCE. Durante el estudio no se observaron hemorragias clínicamente relevantes, por lo que no se pudo evaluar la reversión de la hemorragia por parte del PCC y, por tanto, la eficacia sólo se pudo medir mediante la normalización de los marcadores de laboratorio. Los autores concluyeron que la dosis empleada del PCC no tuvo efecto sobre la acción de dabigatrán27. Sin embargo, esta conclusión se ha puesto en entredicho ya que tal vez los marcadores empleados en la monitorización de la acción anticoagulante no fueran los apropiados36.
Dado que aproximadamente un 30% del fármaco está unido a proteínas plasmáticas y su principal vía de eliminación es la renal9,13, el empleo de técnicas de hemofiltración como la hemodiálisis podría considerarse una estrategia válida en la eliminación del anticoagulante circulante en el torrente sanguíneo31.
En un estudio de cohortes unicéntrico y abierto, diseñado por Strangier et al.28 para investigar el efecto de la insuficiencia renal en la farmacocinética y farmacodinamia de dabigatrán, se observó que en los pacientes con enfermedad renal en estado terminal la hemodiálisis eliminaba casi un 70% del fármaco. En todo caso, queda por discernir la relevancia, viabilidad y costo de esta estrategia en el manejo del sangrado secundario a dabigatrán15.
– Rivaroxabán
En el estudio de Eerenberg et al.27 se concluye que la dosis empleada de concentrado de complejo protrombínico (50 UI/Kg) tenía efecto inmediato y completo sobre la acción anticoagulante de rivaroxabán en voluntarios sanos37. Adicionalmente, se ha observado que el PCC activado corrige los parámetros de generación de la trombina en el plasma que se ha obtenido de voluntarios sanos que recibieron una única dosis de rivaroxabán o dabigatrán37.
La elevada unión a proteínas plasmáticas (principalmente albúmina) de rivaroxabán10,13,31 limita teóricamente la eficacia de las técnicas de hemodiafiltración, explicando la ausencia de estudios al respecto11.
– Apixabán
Actualmente no disponemos de estudios que evalúen el empleo de PCC, factor VIIa ni hemodiálisis en el manejo de la hemorragia secundaria a apixabán. En todo caso, su mecanismo de acción y características farmacocinéticas, similares a rivaroxabán, permitirían hipotéticamente extrapolar a éste la evidencia disponible para rivaroxabán11.
-
Manejo en situaciones especiales
La introducción en el arsenal terapéutico de los NACO condiciona la necesidad de definir adecuadamente el manejo de aquellos pacientes en los que podría estimarse un mayor riesgo de sufrir episodios hemorrágicos. Entre estos destacamos los pacientes con función renal alterada, los pluripatológicos o aquellos sometidos a procedimientos quirúrgicos u otros procedimientos invasivos como la anestesia neuroaxial. Sin embargo, no disponemos de recomendaciones acerca del manejo de los NACO en otras poblaciones especiales que no sean aquellos pacientes sometidos a procedimientos invasivos8,25,28,31,39.
Recientemente se ha estimado el riesgo de hemorragia en los pacientes sometidos a procedimientos quirúrgicos en el transcurso del estudio RE-LY38. Los autores concluyeron que tanto dabigatrán como warfarina se asociaban con tasas similares de hemorragia perioperatoria, incluyendo la cirugía urgente.
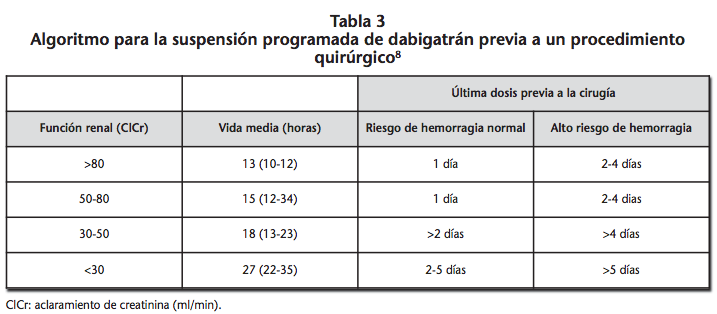
La interrupción de dabigatrán debe de considerar el riesgo de sangrado asociado a la intervención junto con la funcionalidad renal del paciente. De esta forma, el momento de retirada oscilará entre las 24 horas y los 5 días previos al procedimiento (Tabla 3)8.
En cambio, la función renal es menos importante en el caso de rivaroxabán, para el que un aclaramiento de creatinina disminuido no parece influir significativamente sobre su semivida de eliminación28.
El Grupo de Trabajo sobre la Hemostasia Perioperatoria y el Grupo de Estudio Francés sobre la Trombosis y Hemostasia recomiendan, para la cirugía programada o procedimientos invasivos con bajo riesgo de sangrado, la interrupción de los NACO 24 horas antes del procedimiento, reiniciando 24 horas después del mismo40. En caso de cirugía programada o procedimientos invasivos con moderado o alto riesgo de sangrado, se recomienda empíricamente la interrupción 5 días antes de la cirugía, reiniciándose el tratamiento de acuerdo con el riesgo de hemorragia.
En caso de ser necesaria una cirugía o procedimiento de urgencia, será necesario retrasarlos el tiempo equivalente a una o dos semividas de eliminación del fármaco o, en su defecto realizar algún ensayo de laboratorio que nos indique la intensidad del efecto anticoagulante.
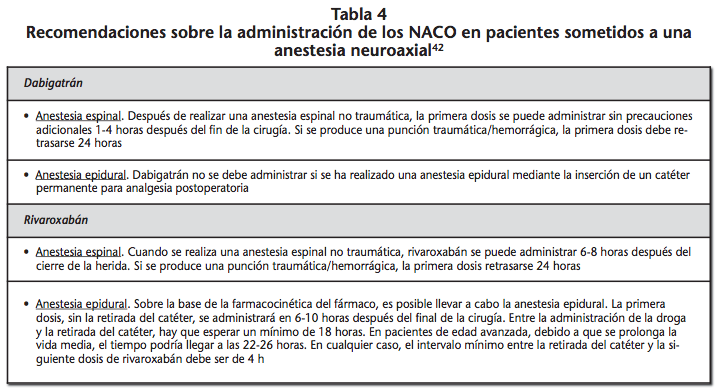
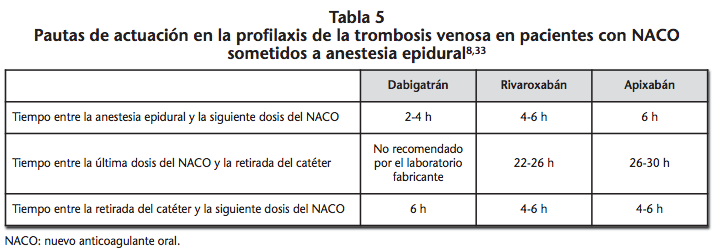
En caso de realizar una anestesia neuroaxial, el riesgo de hematoma epidural puede verse incrementado hasta 15 veces respecto a un paciente no anticoagulado41. Por ello, los procedimientos de inserción y de retirada del catéter deben de considerar las características farmacocinéticas del anticoagulante, procediendo en aquel momento en que se estimen unas concentraciones bajas del fármaco8. Rosencher et al.41 realizan una serie de recomendaciones para reducir el riesgo de hemorragia en pacientes en tratamiento con NACO y que deban recibir anestesia regional en el contexto de una cirugía ortopédica. Adicionalmente, Llau y Ferrandis42 (Tabla 4) y la Sociedad Europea de Anestesiologia (Tabla 5)8,33 proporcionan una serie de recomendaciones de actuación en pacientes sometidos a procedimientos especiales, basadas en las características farmacocinéticas de los NACO.
Conclusiones
La ausencia de una técnica de laboratorio adecuadamente validada para la monitorización del efecto anticoagulante de los NACO supone un lastre en el manejo del riesgo hemorrágico asociado a los mismos. En todo caso, la comercialización de los NACO ha supuesto la caracterización de técnicas de laboratorio como el TCE o el Heptest.
Los estudios pivotales muestran un perfil de seguridad superior para los NACO vs. warfarina. No obstante, no hay que olvidar la mayor incidencia de hemorragias gastrointestinales asociada con las distintas dosis de dabigatrán. Los metanálisis de comparaciones directas limitan estas ventajas a una menor incidencia de eventos intracraneales.
La ausencia de estudios comparativos entre los distintos NACO exige el desarrollo de comparaciones indirectas. Aun considerando sus limitaciones intrínsecas, estos estudios posicionan a apixabán como el NACO de mayor seguridad en comparación con rivaroxabán y dabigatrán 150 mg en términos de hemorragias graves e intracraneales.
Actualmente no disponemos de un claro antídoto que neutralice el efecto de los NACO. Tampoco hay evaluaciones clínicas acerca del tratamiento de las hemorragias asociadas a los mismos. Las distintas guías propuestas se basan en la escasa evidencia disponible, requiriéndose una futura evaluación de su utilidad.
La reciente introducción de los NACO en el arsenal terapéutico condiciona la necesidad de definir adecuadamente el manejo de aquellos pacientes sometidos a procedimientos quirúrgicos u otros procedimientos invasivos como la anestesia neuroaxial. Los factores que deben de considerarse para su adecuada utilización serían las características farmacocinéticas del fármaco y los riesgos de sangrado y de trombosis que puedan estimarse.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía
- Marco P, Tarín F, Lucas J. Nuevos anticoagulantes orales: características moleculares, mecanismos de acción farmacocinéticas y farmacodinámicas. Med. Clin (Barc). 2008;131 Supl 2:66-9.
- Suero Méndez C. Los nuevos anticoagulantes orales en la fibrilación auricular: preguntas y respuestas para el urgenciólogo. Emergencias. 2013;25:123-36.
- Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361:1139-51.
- Patel MR, Mahaffey KW, Garg J,Pan G, Singer DE, Hacke W, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;365:883–91.
- Connolly SJ, Eikelboom J, Joyner C, Diener HC, Hart R, Golitsyn S, et al. Apixaban in patients with atrial fibrillation. N Engl J Med. 2011;364:806-17.
- Granger CB, Alexander JH, McMurray JJ, Lopes RD, Hylek EM, Hanna M, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011;365:981-92.
- Heidbuchel H, Verhamme P, Alings M, Antz M, Hacke W, Oldgren J, et al. European Heart Rhythm Association Practical Guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation. Europace. 2013;15:625-51.
- Levy JH, Faraoni D, Spring JL, Douketis JD, Samama CM. Managing new oral anticoagulants in the perioperative and intensive care unit setting. Anesthesiology. 2013;118:1466-74.
- Godier A, Miclot A, Le Bonniec B, Fischer AM, Marchand-Leroux C, Lecompte T, et al. Evaluation of prothrombin complex concentrate and recombinant activated factor VII to reverse rivaroxaban in a rabbit model. Anesthesiology. 2012;116:94-102.
- Durán Parrondo C, Rodríguez Moreno C, Tato Herrero F, Alonso Vence N, Lado Lado FL. Anticoagulación oral. An Med Interna. 2003;20:377-84.
- Surgical Critical Care Evidence-Based Medicine Guidelines Committee. Non-Vitamin K anticoagulant reversal Guideline. [monografía en Internet]. 2013 [citado 10-01-2014]. Disponible en: http://www.surgicalcriticalcare.net/Guidelines/Non-VitaminKAnticoagulant Reversal 2013.pdf.
- Esmon CT. What did we learn from new oral anticoagulant treatment? Thromb Res. 2012;130 Suppl 1:S41-3.
- Mateo J. Nuevos anticoagulantes orales y su papel en la práctica clínica. Rev Esp Cardiol. 2013;13 Supl C:33-41.
- Choi S, Douketis JD. Management of patients who are receiving warfarin or a new oral anticoagulant and require urgent or emergency surgery. Pol Arch Med Wewn. 2012;122:437-42.
- Canadian agency for drugs and technologies in health. Anticoagulation monitoring and reversal strategies for dabigatran, rivaroxaban and apixaban: A review of clinical effectiveness. [monografía en Internet]. 2012 [citado 10-01-2014]. Disponible en: http://www.cadth. ca/en/products/therapeutic-reviews/anticoagulants/reports.
- Spahn DR, Korte W. Novel oral anticoagulants: new challenges for anesthesiologists in bleeding patients. Anesthesiology. 2012;116:9-11.
- Alquwaizani M, Buckley L, Adams C, Fanikos J. Anticoagulants: A Review of the Pharmacology, Dosing, and Complications. Curr Emerg Hosp Med Rep. 2013;1:83-97.
- Sociedad Española de Hematología y hemoterapia/ Sociedad Española de Trombosis y Hemostasia. Guía sobre los nuevos anticoagulantes orales. [monografía en Internet]. 2012 [citado 10-01-2014]. Disponible en: http://www.sehh.es/documentos/varios/Actualizacion_Guia_Nuevos_Anticoag_Orales_05112012.pdf.
- Ordovás Baines JP, Climent Grana E, Jover Botella A, Valero García I. Farmacocinética y farmacodinamia de los nuevos anticoagulantes orales. Farm. Hosp. 2009;33: 125-33.
- Miyares MA, Davis K. Newer oral anticoagulants: a review of laboratory monitoring options and reversal agents in the hemorrhagic patient. Am J Health Syst Pharm. 2012;69:1473-84.
- Ruff CT, Giugliano RP, Braunwald E, Hoffman EB, Deenadayalu N, Ezekowitz MD, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet. 2014;383:955-62.
- Rasmussen LH, Larsen TB, Graungaard T, Skjøth F, Lip GYH. Primary and secondary prevention with new oral anticoagulant drugs for stroke prevention in atrial fibrillation: indirect comparison analysis. BMJ. 2012; 345:e7097.
- Agencia de Evaluación de Tecnologías Sanitarias de Andalucía (AETSA). Nuevos anticoagulantes orales para la prevención del ictus y la embolia sistémica en fibrilación auricular no valvular. [monografía en Internet]. 2013 [citado 10-01-2014]. Disponible en: http://www. juntadeandalucia.es/salud/servicios/contenidos/nuevaaetsa/up/AETSA_2012-2_ACOs_def.pdf.
- Lip GYH, Larsen TB, Skjøth F, Rasmussen LH. Indirect comparisons of new oral anticoagulant drugs for efficacy and safety when used for stroke prevention in atrial fibrillation. J Am Coll Cardiol. 2012;60:738-46.
- Van Ryn J, Stangier J, Haertter S, Liesenfeld KH, Wienen W, Feuring M, et al. Dabigatran etexilate-a novel, reversible, oral direct thrombin inhibitor: interpretation of coagulation assays and reversal of anticoagulant activity. Thromb. Haemost. 2010;103:1116-27.
- Lu G, DeGuzman FR, Hollenbach SJ, Karbarz MJ, Abe K, Lee G, et al. A specific antidote for reversal of anticoagulation by direct and indirect inhibitors of coagulation factor Xa. Nat Med. 2013;19:446-51.
- Eerenberg ES, Kamphuisen PW, Sijpkens MK, Meijers JC, Buller HR, Levi M. Reversal of rivaroxaban and dabigatran by prothrombin complex concentrate: a randomized, placebo-controlled, crossover study in healthy subjects. Circulation. 2011;124:1573-9.
- Stangier J, Rathgen K, Stähle H, Mazur D. Influence of renal impairment on the pharmacokinetics and pharmacodynamics of oral dabigatran etexilate: an open-label, parallel-group, single-centre study. Clin. Pharmacokinet. 2010;49:259-68.
- Kaatz S, Kouides PA, Garcia DA, Spyropolous AC, Crowther M, Douketis JD, et al. Guidance on the emergent reversal of oral thrombin and factor Xa inhibitors. Am. J. Hematol. 2012;87 Supl 1:S141-5.
- Siegal DM, Crowther MA. Acute management of bleeding in patients on novel oral anticoagulants. Eur Heart J. 2013;34:489-498b.
- Ageno W, Gallus AS, Wittkowsky A, Crowther M, Hylek EM, Palareti G. Oral anticoagulant therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141 Supl 2:e44S-88S.
- Bauer KA. Reversal of antithrombotic agents. Am J Hematol. 2012;87 Supl 1:S119-26.
- Gogarten W, Vandermeulen E, Van Aken H, Kozek S, Llau J V, Samama CM. Regional anaesthesia and antithrombotic agents: recommendations of the European Society of Anaesthesiology. Eur J Anaesthesiol. 2010;27:999-1015.
- Warkentin TE, Margetts P, Connolly SJ, Lamy A, Ricci C, Eikelboom JW. Recombinant factor VIIa (rFVIIa) and hemodialysis to manage massive dabigatran-associated postcardiac surgery bleeding. Blood. 2012;119:2172-4.
- Chan HHW, Atkinson HM, Goncharenko M, Berrry LR, Chan AKC. Reversal of dabigatran using recombinant activated factor VII and activated prothrombin complex concentrates in thromboelastography assay. J Thromb Haemost. 2011;9:576-7 Abstract P–WE–180.
- Battinelli EM. Reversal of new oral anticoagulants. Circulation. 2011;124:1508-10.
- Marlu R, Hodaj E, Paris A, Albadalejo P, Cracowski JL, Pernod G. Effect of non-specific reversal agents on anticoagulant activity of dabigatran and rivaroxaban: a randomised crossover ex vivo study in healthy volunteers. Thromb Haemost. 2012;108:217-24.
- Healey JS, Eikelboom J, Douketis J, Wallentin L, Oldgren J, Yang S, et al. Periprocedural bleeding and thromboembolic events with dabigatran compared with warfarin: results from the Randomized Evaluation of Long-Term Anticoagulation Therapy (RE-LY) randomized trial. Circulation. 2012;126:343-8.
- Clemens A. Dabigatran etexilate for stroke prevention in patients with atrial fibrillation: resolving uncertainties in routine practice. Thromb Haemost. 2012;107:838-47.
- Sié P, Samama CM, Godier A, Rosencher N, Steib A, Llau JV, et al. Surgery and invasive procedures in patients on long-term treatment with direct oral anticoagulants: thrombin or factor-Xa inhibitors. Recommendations of the Working Group on Perioperative Haemostasis and the French Study Group on Thrombosis and Haemostasis. Arch Cardiovasc Dis. 2011;104:669-76.
- Rosencher N, Bonnet M-P, Sessler DI. Selected new antithrombotic agents and neuraxial anaesthesia for major orthopaedic surgery: management strategies. Anaesthesia. 2007;62:1154-60.
- Llau JV, Ferrandis R. New anticoagulants and regional anesthesia. Curr Opin Anaesthesiol. 2009;22:661-6.
