Fecha de recepción: 20/02/2018 – Fecha de aceptación: 31/05/2018
Cárdaba-García ME, Izquierdo-Muñoz S, Izquierdo-Navarro MC, Sánchez-Sánchez MT
Servicio de Farmacia. Hospital Clínico Universitario de Valladolid. Valladolid (España)
____
Correspondencia:
María Elena Cárdaba García
Avda. Ramón y Cajal, 3
47003 Valladolid
Correo electrónico: mcardabag@saludcastillayleon.es
____
RESUMEN
La miastenia gravis es un trastorno autoinmune que, en el 15-20% de los casos, es refractario a los fármacos anticolinesterásicos y a los inmunosupresores, así como a las terapias inmunomoduladoras (inmunoglobulinas inespecíficas y plasmaféresis). En estas situaciones es preciso valorar otras alternativas, entre las que se incluye rituximab.
Se presentan 3 casos de pacientes diagnosticados de miastenia gravis refractaria y tratados con rituximab, resultando la terapia beneficiosa para uno de los sujetos. Este manuscrito contribuye a aumentar la literatura publicada sobre el manejo de la miastenia gravis refractaria, aportando nuevos datos sobre la efectividad de rituximab en esta patología.
Palabras clave: Miastenia gravis, rituximab, enfermedades autoinmunes, inmunomodulación.
____
INTRODUCCIÓN
La miastenia gravis (MG) es un trastorno autoinmune, afecta a la unión neuromuscular y se caracteriza por debilidad muscular variable1. La Fundación Americana de Miastenia Gravis (MGFA) clasifica la MG en función de los síntomas, la evolución y el estadío de la enfermedad y la cataloga en 5 clases (I a V), siendo la I la menos grave (afectación puramente ocular) y la V la más grave (crisis miasténica que requiere intubación)2.
El tratamiento de la MG consiste en fármacos anticolinesterásicos1 y terapias inmunosupresoras e inmunomoduladoras1,3. El 15-20% de los pacientes son refractarios3 a estos tratamientos, siendo necesario considerar otras alternativas, como rituximab1. Es importante mencionar que el efecto de las terapias que reciben los pacientes con MG, puede establecerse utilizando la escala modificada post-intervención de la MGFA (MGFA-PISm)2, que clasifica el resultado en 8 items: remisión completa estable, remisión farmacológica, manifestaciones mínimas (MM), mejoría, sin cambios, empeoramiento, exacerbación, exitus (consecuencia de la MG).
DESCRIPCIÓN DE LOS CASOS
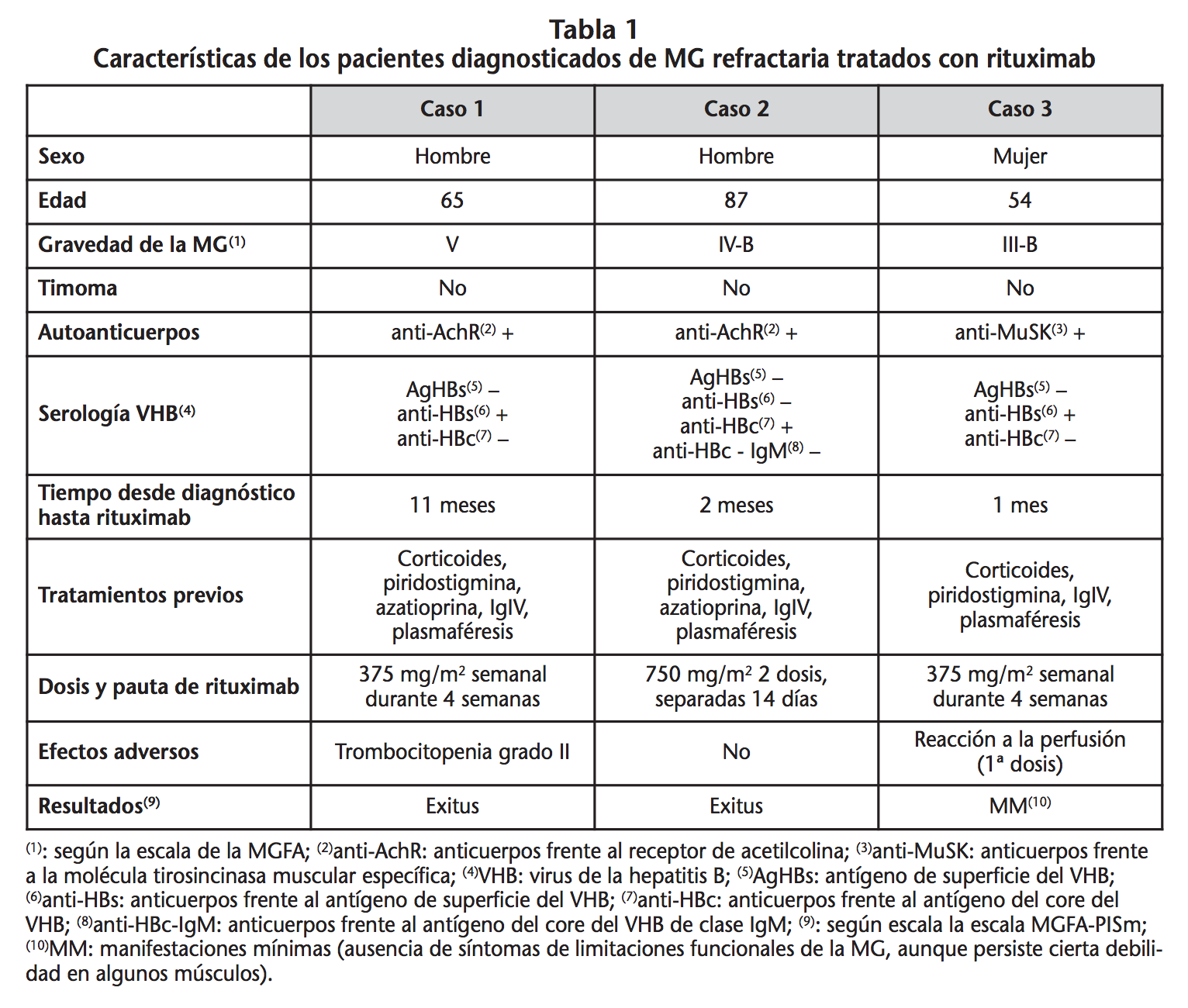
Caso 1: Varón diagnosticado de MG refractaria que inicia rituximab concomitantemente con corticoides y piridostigmina. Ante la ausencia de respuesta al ciclo inicial, se prescriben 2 dosis adicionales (375 mg/m2 semanal), administrándose sólo la primera por inestabilidad del paciente. Dos semanas después de la última dosis, fallece por complicaciones asociadas a la MG (insuficiencia respiratoria aguda) y al ingreso (shock séptico y fracaso multiórganico).
Caso 2: Varón diagnosticado de MG refractaria. Recibe rituximab junto con piridostigmina, corticoides y plasmaféresis alternante, con buena evolución inicial. Posteriormente, la evolución es tórpida por complicaciones durante el ingreso (trastorno hidroelectrolítico asociado a plasmaféresis e infección pulmonar), falleciendo por parada respiratoria por fracaso ventilatorio consecuencia de la MG.
Caso 3: Mujer diagnosticada de MG refractaria. Recibe rituximab junto con piridostigmina, corticoides y plasmaféresis alternante, presentando buena respuesta y persistiendo únicamente ptosis parpebral leve. Tras este episodio, la paciente recibe tratamiento con piridostigmina y presenta buen control de la MG.
Las características de cada caso se describen detalladamente en la tabla 1.
DISCUSIÓN
La utilidad de rituximab en MG refractaria con anticuerpos frente al receptor de acetilcolina (anti-AchR) o frente a la molécula tirosincinasa muscular específica (anti-MuSK), queda reflejada en diferentes series de casos: produce mejoría clínica3-7, disminuye la necesidad de ciclos de IgIV y plásmaferesis3,4, reduce la actividad anticolinesterásica3 y los niveles de anti-AchR4 y de anti-MuSK8, y permite reducir e incluso suspender los corticoides3-5. Por otro lado, una revisión sistemática8 (169 pacientes, 56% anti-AchR positivos, 34% anti-MuSK positivos, mediana de gravedad de la MG IV-B) concluye que rituximab es efectivo en pacientes con MG refractaria que han recibido inmunomoduladores: alcanzaron un MGFA-PISm de MM o inferior, presentaron menor tasa de recaídas y mayor tasa de remisión combinada, farmacológica y clínica completa estable. En pacientes con MG grave anti-MuSK positiva, rituximab mejora la clínica y reduce la necesidad de tratamiento inmunosupresor9. Es importante comentar que no existen ensayos clínicos randomizados que avalen la efectividad de rituximab en el tratamiento de la MG refractaria aunque, actualmente, se está realizando un ensayo fase II randomizado, doble ciego, para establecer la eficacia y seguridad de rituximab en pacientes con MG generalizada de nuevo diagnóstico.
Los tres pacientes presentaban MG refractaria grave, sin alternativas terapéuticas autorizadas disponibles, siendo rituximab una opción a considerar para su tratamiento. Sin embargo, la respuesta alcanzada no fue la misma en todas las situaciones. En el caso de los pacientes que fallecieron, ambos por complicaciones derivadas de la MG, rituximab pudo no ser efectivo debido a la alta gravedad de la enfermedad en el momento de su administración. Otros factores que pudieron contribuir a la falta de efectividad de rituximab fueron la edad avanzada y la presencia de anti-AchR. Por otro lado, estudios recientes establecen como factores predictivos de respuesta a rituximab en pacientes con MG la presencia de anti-MuSK, MG leve/moderada y edad inferior a 45 años en el momento del tratamiento con rituximab8. También se ha observado que la tasa de pacientes que alcanzaban las tres variables mencionadas anteriormente era mayor en los pacientes anti-MuSK positivos que en los anti-AchR positivos8. Esto puede aclarar porqué rituximab fue eficaz en la paciente con MG menos grave anti-MuSK positiva, y no en los pacientes más graves y anti-AchR positivos. Además, en el caso de la paciente que respondió, el tiempo transcurrido desde el diagnóstico de la MG hasta rituximab fue corto. Esto se corresponde con las recomendaciones de algunos autores, quienes proponen el uso temprano de rituximab en pacientes con MG anti-MuSK positiva y mal control de la enfermedad10. No obstante, el tiempo que transcurre desde el diagnóstico de la patología hasta el inicio de rituximab no se considera un factor predictivo de respuesta8.
El perfil de seguridad de rituximab cuando se ha utilizado en nuestro hospital para el tratamiento de MG se corresponde con el que aparece cuando se utiliza en indicaciones autorizadas; los efectos adversos registrados se notificaron al Sistema Español de Farmacovigilancia. En la literatura publicada, la tolerancia a rituximab fue buena3-9, aunque se notificaron cefaleas3,7,8 e infecciones7,8 en varios pacientes. Para evitar la reactivación del virus B, en nuestro centro se revisaron las serologías de los pacientes: 2 fueron negativas (pacientes vacunados), la restante fue positiva para el anticuerpo frente al antígeno del core, prescribiéndose lamivudina para evitar la reactivación (no se determinó el ADN viral). Ninguno de los pacientes desarrolló leucoencefalopatía multifocal progresiva.
La posología de rituximab utilizada para tratar a los pacientes de nuestro centro concuerda con la publicada en la literatura científica. Ésta es muy variable y no está bien establecida para el tratamiento de la MG3,6-9. Con mayor frecuencia se utiliza la misma posología que en linfoma no-Hodgkin (375 mg/m2 semanal durante 4 semanas)3,7,8, así como la indicada en artritis reumatoide (2 infusiones de 1.000 mg separadas 14 días)5.
Por último, es importante mencionar que la principal limitación de rituximab en el tratamiento de la MG refractaria es el bajo nivel de evidencia de la literatura que avala esta terapia. Además, el perfil de los pacientes que podrían beneficiarse de este tratamiento no está bien definido en los estudios publicados.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Silvestri NJ, Wolfe GI. Myasthenia gravis. Semin Neurol. 2012;32(3):215-26.
2. Barohn RJ, McIntire D, Herbelin L, Wolfe GI, Nations S, Bryan WW. Reliability testing of the quantitative myasthenia gravis score. Ann N Y Acad Sci. 1998;841(1): 769-72.
3. Anderson D, Phan C, Johnston WS, Siddiqi ZA. Rituximab in refractory myasthenia gravis: a prospective open-label study with long-term follow-up. Ann Clin Trans Neurol. 2016;3(7):552-5.
4. Lebrun C, Bourg V, TIeulie N, Thomas P. Successful treatment of refractory generalized myasthenia gravis with rituximab. Eur J Neurol. 2009;16(2):246-50.
5. Zebardast N, Patwa HS, Novella SP, Goldstein JM. Rituximab in the management of refractory myasthenia gravis. Muscle Nerve. 2010;41(3):375-8.
6. Stieglbauer K, Pichler R, Topakian R. 10-years-outcomes after rituximab for myasthenia gravis: Efficacy, safety, cost of inhospital care, and impacto on childbearing potential. J Neurol Sci. 2017;375:241-4.
7. Iorio R, Damato V, Alboini PE, Evoli A. Efficacy and safety of rituximab for myasthenia gravis: a systematic review and meta-analysis. J Neurol. 2015;262(5):1115-9.
8. Tandan R, Hehir M, Waqar W, Howard DB. Rituximab treatment of myasthenia gravis: a systematic review. Muscle Nerve. 2017;56(2):185-96.
9. Hehir MK, Hobson-Webb LD, Benatar M, Barnett C, Silvestri NJ, Howard JF, et al. Rituximab as treatment for anti-MuSK myasthenia gravis. Multicenter blinded prospective review. Neurology. 2017;89(10):1069-77.
10. Díaz-Manera J, Martínez-Hernández E, Querol L, Klooster R, Rojas-García R, Suárez-Calvet X, et al. Long-lasting treatment effect of rituximab in MuSK myasthenia. Neurology. 2012;78(3):189-93.
____
Descargar artículo en PDF: Rituximab en el tratamiento de la miastenia gravis refractaria
