Fecha de recepción: 27/06/2017 – Fecha de aceptación: 29/07/2017
Domínguez Cantero M1, Celaya Lecea MC1, Saiz Fernández LC2, Garjón Parra J1
1 Servicio de Gestión de la Prestación Farmacéutica. Subdirección de Farmacia. Servicio Navarro de
Salud-Osasunbidea (España)
2 Coordinador de Investigación en Farmacoterapia. Servicio de Gestión de la Prestación Farmacéutica.
Subdirección de Farmacia. Servicio Navarro de Salud-Osasunbidea (España)
Han sido presentados resultados en el XXI Congreso de la Sociedad Española de Farmacéuticos de Atención Primaria 2016.
____
Correspondencia:
Marcelo Domínguez Cantero
Plaza de la Paz, s/n
31002 Pamplona (Navarra)
Correo electrónico: marcelodcantero@gmail.com
____
Resumen
Objetivo: El perfil de seguridad de canagliflozina ha ido evolucionando desde su comercialización en España. La finalización de ensayos clínicos y los programas de farmacovigilancia han generado nuevas evidencias de seguridad. El objetivo de nuestro estudio fue describir las sospechas de reacciones adversas (RAM) con canagliflozina, sola o en combinación con otros antidiabéticos en pacientes diagnosticados de diabetes mellitus tipo 2.
Metodología: Estudio observacional retrospectivo de los pacientes tratados con canagliflozina en la Comunidad Foral de Navarra. Para ello, se revisó la historia clínica electrónica de todos los pacientes tratados con canagliflozina.
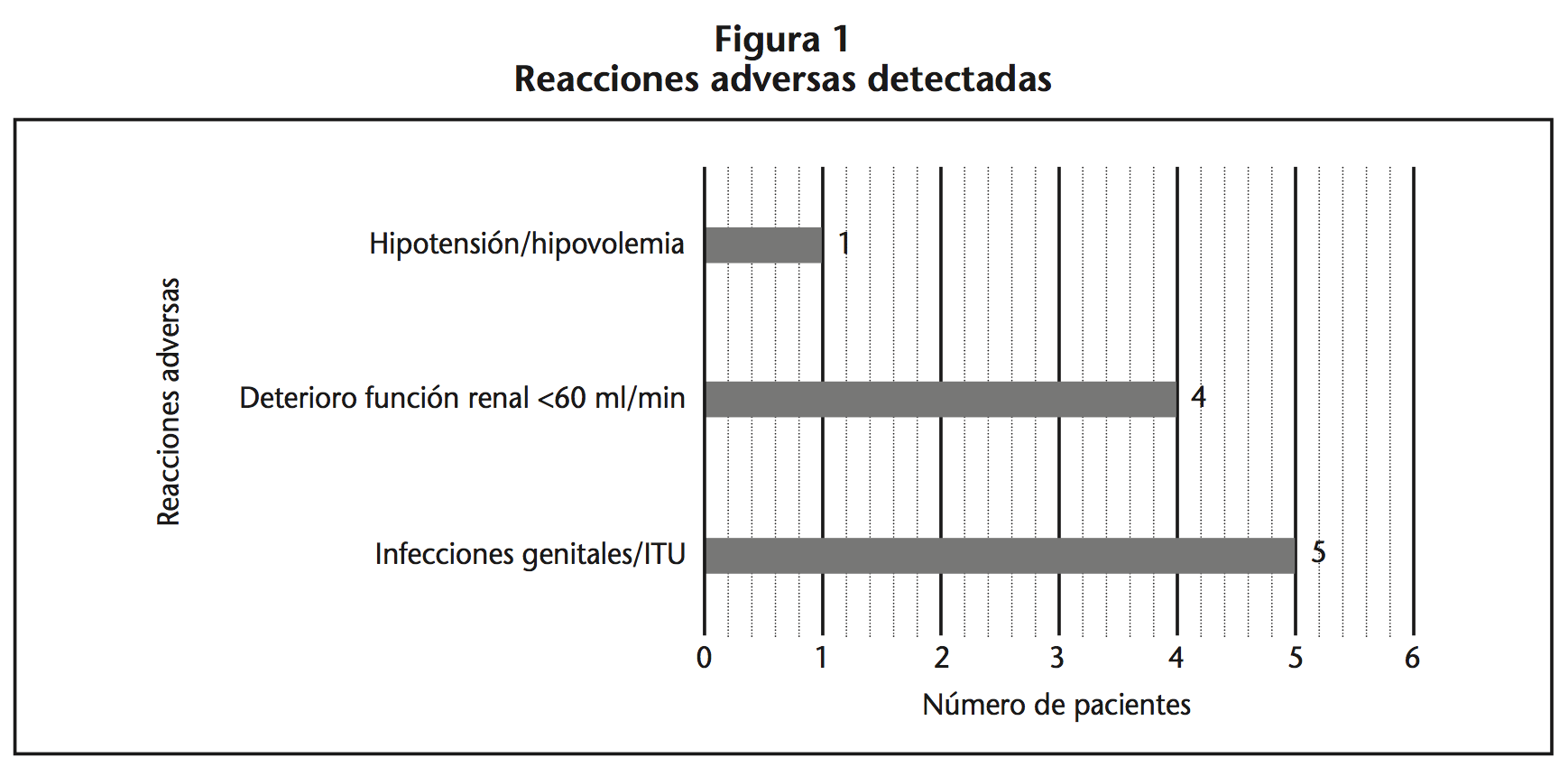
Resultados: El 25,6% (10/39) de los pacientes presentaron alguna sospecha de RAM: en cuatro pacientes se deterioró la función renal <60 ml/min, un paciente presentó hipotensión/hipovolemia y cinco pacientes presentaron infecciones genitales/tracto urinario. Las infecciones genitales y del tracto urinario y el empeoramiento de la función renal fueron los efectos adversos más frecuentes, siendo para tres pacientes el motivo de suspensión.
Palabras clave: Canagliflozina, efectos adversos relacionados con medicamentos, diabetes mellitus tipo 2.
____
Introducción
Canagliflozina pertenece a un grupo de nuevos antidiabéticos orales (ADO) que ejercen su acción inhibiendo el co-transportador sodio-glucosa tipo 2 (SGLT2) del túbulo proximal renal, reduciendo la concentración de glucosa sanguínea. Está indicada en adultos con diabetes mellitus tipo 2 (DM2) en monoterapia o combinación con otros hipoglucemiantes1.
Tras su introducción en el mercado (2015) distintas autoridades reguladoras emitieron alertas de seguridad, bien relacionadas exclusivamente con canagliflozina, como el riesgo de amputación no traumática en miembros inferiores2, o afectando al conjunto de SGLT2, como el riesgo de fracturas óseas y disminución de la densidad mineral ósea3, fracaso renal agudo4 y riesgo de cetoacidosis diabética5.
El objetivo de nuestro estudio fue describir las sospechas de reacciones adversas a medicamentos (RAM) con canagliflozina en pacientes diagnosticados de DM2.
MATERIAL Y MÉTODOS
Estudio observacional retrospectivo incluyendo todos los pacientes con DM2 tratados con canagliflozina, en monoterapia o combinación, desde enero-2015 hasta junio-2016, en la Comunidad Foral de Navarra (CFN).
Los casos se identificaron en el histórico de pacientes tratados con canagliflozina del programa de prescripción electrónica (Lamia) de la CFN. Se obtuvo información seis meses antes y después del inicio con canagliflozina de la historia clínica electrónica. Se consideró posibilidad de imputar una RAM si, tras el inicio de su prescripción, se describió en la historia clínica electrónica (HCE) alguno de los siguientes problemas de salud:
• Hipoglucemia sintomática: síntomas de hipoglucemia acompañadas de glucemias <70 mg/dl6.
• Signos de depleción de volumen: disminución de la tensión arterial, hipotensión (tensión arterial sistólica/diastólica <90/60 mm de Hg), mareos posturales, hipotensión ortostática, síncope o presíncope.
• Deterioro de la función renal, filtrado glomerular inferior a 60 ml/min/1,73m2, calculado mediante la ecuación MDRD-4 (Modification of Diet in Renal Disease) que incluye factor de corrección de la medida de creatinina respecto a espectrometría de masas con dilución isotópica (IDMS)7.
• Fracaso renal agudo, deterioro de la función renal según la escala RIFLE (Risk-Injury-Failure-Loss-End) con categoría R o superior, definida como un aumento de la creatinina sérica de 1,5 veces la basal o disminución del 25% del filtrado glomerular8.
• Hospitalización por cetoacidosis.
• Disminución de la densidad mineral ósea o presencia de fracturas.
• Alteraciones gastrointestinales (dispepsias, estreñimiento, náuseas).
• Infección del tracto urinario.
• Infección genital (balanitis, balanopostitis, prurito vulvovaginal o candidiasis vulvovaginal).
• Amputaciones no traumáticas en miembros inferiores.
Se excluyeron los sujetos sin los valores analíticos necesarios o que carecían de evolución en la HCE desde el inicio con canagliflozina hasta su suspensión o cambio por otro ADO.
Se realizó un análisis descriptivo. Las variables cualitativas se expresaron mediante número y porcentaje. Las cuantitativas mediante la mediana y el rango.
RESULTADOS
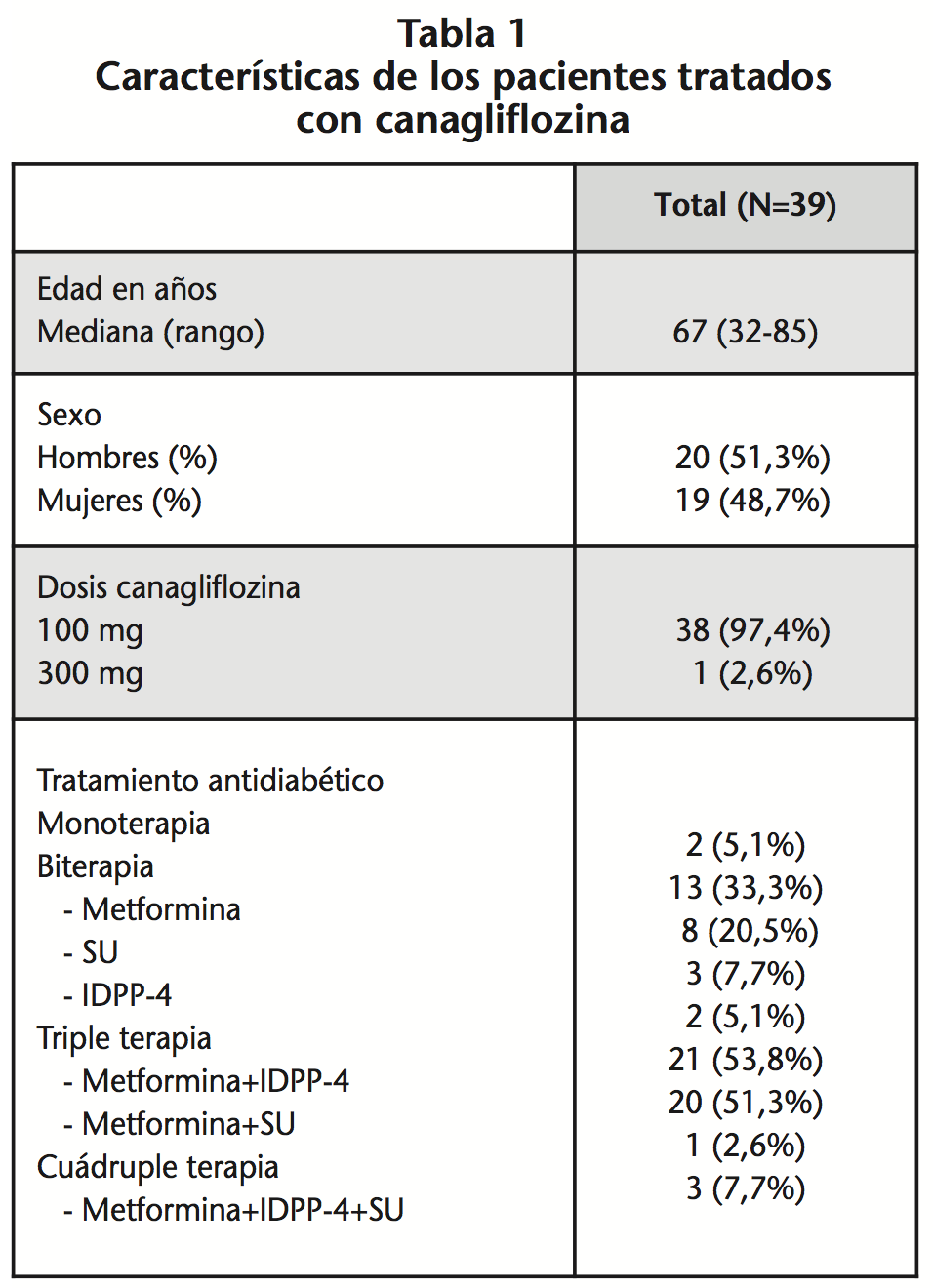
En la CFN 626.074 personas cuentan con tarjeta sanitaria del servicio de salud. De ellos, 45 recibían tratamiento con canagliflozina. Seis pacientes fueron excluidos por carecer de los datos necesarios para evaluar la sospecha de RAM. De los 39 incluidos, la mediana de edad fue de 67 años (rango 32-85) y el 51,3% (20/39) eran varones. Recibieron dosis de 100 mg diarios de canagliflozina –salvo uno con 300 mg diarios– durante una media de 8,3 meses (rango 1,0-13,9). En monoterapia se encontraban 2/39 pacientes, 13/39 en biterapia y 3/39 pacientes en terapia cuádruple con metformina + IDPP-4 + sulfonilureas (Tabla 1).
El 25,6% (10/39) presentaron alguna sospecha de RAM (Figura 1): cinco infecciones genitales/tracto urinario, cuatro con deterioro de la función renal y un paciente presentó hipotensión/hipovolemia.
En cuatro pacientes (10,3%) fue necesaria la suspensión de canagliflozina. Un caso por deterioro de la función renal <40 ml/min, una suspensión previa a una intervención quirúrgica vascular en miembros inferiores y dos casos de infecciones genitales en varones.
DISCUSIÓN
En nuestro estudio las infecciones del tracto urinario/genital fueron el principal motivo de efectos adversos, de forma similar a los datos aportados por el informe público europeo de evaluación (EPAR)9 y estudios post hoc sobre seguridad10. A diferencia de los resultados obtenidos en los estudios mencionados con anterioridad9,10, no detectamos ningún caso de hipoglucemia sintomática a pesar de ser uno de los más frecuentes. Cabe mencionar que en pocos pacientes se usó la canagliflozina combinada con SU.
Por otra parte, es destacable el elevado porcentaje de pacientes de nuestro estudio con deterioro de la función renal. Aunque la FDA emitió una alerta4 haciendo referencia a esta reacción adversa, en principio no se contempla dentro de las más comunes2,11. Nuestros datos sugieren que, además de seguir las recomendaciones de ajuste de dosis o contraindicación en pacientes con función renal disminuida, sería recomendable realizar un seguimiento estrecho en pacientes tratados con fármacos nefrotóxicos, presencia de deterioro renal previo y edad avanzada.
El escaso número de pacientes y el corto periodo de exposición a canagliflozina de nuestro trabajo supone una limitación para extraer conclusiones consistentes. Esto puede ser debido, primero, al lugar que ocupan actualmente en la terapéutica los inhibidores de SLGT2, tras fracaso o intolerancia a otros ADO. En segundo lugar, los pacientes tratados con canagliflozina representan sólo un 3,76% del total dentro de este grupo de fármacos frente a 726 pacientes tratados con dapagliflozina y 424 con empagliflozina.
Las infecciones genitales y del tracto urinario y el empeoramiento de la función renal han sido los efectos adversos más frecuentes registrados asociados al uso de canagliflozina, siendo para tres pacientes motivo de suspensión.
Estos casos han sido notificados al Centro de Farmacovigilancia de la CFN.
Agradecimientos: Gabriela Elizondo Rivas, responsable del Centro de Farmacovigilancia de la Comunidad Foral Navarra.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Bibliografía
1. Informe de Posicionamiento Terapéutico de canagliflozina. [Internet].Agencia Española del Medicamento y Productos Sanitarios; 2016. [citado 7 noviembre 2016]. Disponible en: https://www. aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-canagliflozina-invokana.pdf.
2. Nota informativa. Canagliflozina y riesgo de amputación no traumática en miembros inferiores. [Internet]. Agencia Española del Medicamento y Productos Sanitarios; 2017. [citado 27 junio 2017]. Disponible en: https://www.aemps. gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2017/docs/NI-MUH_FV_01-canagliflozina.pdf.
3. Drug Safety Communication. FDA revises label of diabetes drug canagliflozin (Invokana®, Invokamet®) to include updates on bone fracture risk and new information on decreased bone mineral density. [Internet].Food and Drug Administration (FDA); 2015. [citado 7 noviembre 2016]. Disponible en: www.fda.gov/downloads/ Drugs/DrugSafety/UCM461790.pdf.
4. Drug Safety Communication. FDA strengthens kidney warnings for diabetes medicines canagliflozin (Invokana®, Invokamet®) and dapagliflozin (Farxiga®, Xigduo® XR). [Internet]. Food and Drug Administration (FDA); 2016. [citado 7 noviembre 2016]. Disponible en: http://www.fda.gov/downloads/Drugs/DrugSafety/UCM507426.pdf.
5. Nota informativa. Riesgo de cetoacidosis diabética asociada al uso de canagliflozina, dapagliflozina y empagliflozina. [Internet]. Agencia Española del Medicamento y Productos Sanitarios; 2015. [citado 7 noviembre 2016]. Disponible en: https://www.aemps gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2015/NI-MUH_FV_07-cetoacidosis-diabetica.htm.
6. Griffing KL. Hypoglycemia Prevention in Hospital Patients: A Quality Improvement Project to Prevent Severe and Recurrent Hypoglycemia. Clinical Diabetes. 2016;34(4):193-99.
7. Levey AS, Coresh J, Greene T, Stevens LA, Zhang YL, Hendriksen S, et al. Using standardized serum creatinine values in the modification of diet in renal disease study equation for estimating glomerular filtration rate. Ann Intern Med. 2006;145:247-54.
8. Warnock DG. Towards a definition and classification of acute kidney injury. J Am Soc Nephrol. 2005;16:3149-3150.
9. European public assessment reports (EPAR) for human medicines: Invokana®. [Internet]. European Medicines Agency; 2016. [citado 7 noviembre 2016] Disponible en: http://www.ema.europa.eu/ ema/index.jsp?curl=pages/medicines/human/medicines/ 002649/human_med_001707.jsp&mid=WC0b01ac058001d124.
10. Gilbert RE, Weir MR, Fioretto P, Law G, Desai M, Kline I, et al. Impact of Age and Estimated Glomerular Filtration Rate on the Glycemic Efficacy and Safety of Canagliflozin: A Pooled Analysis of Clinical Studies. Cananadian Jornal of Diabetes. 2016;40(3):247-57.
11. Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N, et al. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes.[Internet]. N Engl J Med; 2017. [citado 14 julio 2017]. Disponible en: http://www.nejm.org/doi/10.1056/NEJMoa1611925.
____
Descargar artículo en PDF: Seguridad de canagliflozina en la práctica clínica. Serie de casos
