Cazorla Poderoso L1, Merchante Andreu M1, Hernández Mata CF2, Aulés Leonardo A2
1 Servicio de Farmacia
2 Servicio de Hematología y Hemoterápia
Hospital Universitario Miguel Servet de Zaragoza (España)
Fecha de recepción: 22/03/2022 – Fecha de aceptación: 13/04/2022
Correspondencia: Lucía Cazorla Poderoso – C/Alpujarra, 8 – 3º izqda – 03202 Elche, Alicante (España)
luciacp23@gmail.com
____
RESUMEN
Blinatumomab es un anticuerpo biespecífico que está indicado en monoterapia en pacientes adultos con leucemia linfoblástica aguda B refractaria o en recaída con cromosoma filadelfia negativo como terapia puente al trasplante y se asocia a remisiones a largo plazo.
Se presenta el caso de una paciente de 40 años diagnosticada de esta enfermedad, que respondió al tratamiento con blinatumomab y posteriormente fue trasplantada en condiciones óptimas, a pesar de no haber recibido los dos ciclos de tratamiento a dosis plenas por motivos de toxicidad pancreática y gastrointestinal.
Palabras clave: Leucemia linfoblástica aguda B refractaria, cromosoma filadelfia negativo, blinatumomab, trasplante alogénico de progenitores hematopoyéticos.
Safety and efficacy of blinatumomab in the treatment of relapsed/refractory acute lymphoblastic leukemia B: a case report
SUMMARY
Blinatumomab is a bispecific antibody that is indicated as monotherapy in adult patients with refractory or relapsed Philadelphia chromosome-negative acute lymphoblastic leukaemia B as bridge therapy to transplantation and is associated with long-term remissions.
We present the case of a 40-year-old patient diagnosed with this disease, who responded to treatment with blinatumomab and was subsequently transplanted under optimal conditions, despite not having received the two cycles of full-dose treatment due to pancreatic and gastrointestinal toxicity.
Key words: Refractory B acute lymphoblastic leukemia, philadelphia chromosome negative, blinatumomab, allogeneic haematopoietic stem cell transplantation.
____
INTRODUCCIÓN
La leucemia linfoblástica aguda B refractaria o en recaída (LLA-RR) con cromosoma filadelfia negativo, en adultos, tiene una tasa de remisión completa del 20-45% y una mediana de supervivencia global de 3-9 meses1-2. El trasplante alogénico de precursores hematopoyéticos (alo-THP) es la única opción potencialmente curativa. La tasa de recaída post-trasplante tiene una estrecha relación con la repuesta pre-trasplante, donde la enfermedad mínima residual (EMR) negativa (menos de 0,01% de blastos en médula ósea) confiere el mejor pronóstico2-4.
Blinatumomab es un anticuerpo biespecífico para CD19 y CD3 diseñado para unir células T previamente no estimuladas con células B malignas e inducir su lisis3. Está indicado en pacientes adultos con LLA-RR con cromosoma filadelfia negativo, y se ha asociado con remisiones a largo plazo2,4-6. Se recomienda la monitorización estrecha de sus efectos adversos, siendo los más frecuentes el síndrome de liberación de citoquinas y los eventos a nivel del sistema nervioso central6. En octubre de 2016 la Agencia Española de Medicamentos y Productos Sanitarios notificó una alerta sanitaria sobre la aparición de casos de pancreatitis, mortales o potencialmente mortales, en pacientes tratados con blinatumomab7,8, hasta febrero de 2021, se habían registrado en la base EudraVigilance 3 casos de pancreatitis aguda y 7 de pancreatitis sin especificar9.
DESCRIPCIÓN CASO CLÍNICO
Se describe el caso de una mujer de 40 años, sin antecedentes clínicos relevantes, que fue diagnosticada de LLA WT1+ en septiembre de 2016. La paciente recibió tratamiento quimioterápico según PETHEMA-LAL-AR/2011 con buena tolerancia y respuesta clínica.
En la reevaluación medular de control tras un año de haber finalizado el tratamiento de mantenimiento, marzo de 2020, se objetivó recaída tardía al documentarse EMR positiva (0,01% de blastos en médula ósea) mediante citometría de flujo, no así por biología molecular al presentar WT1 negativo. Ante este hallazgo la paciente fue considerada y aceptada como candidata para alo-TPH haploidéntico de su madre. Se recomendó tratamiento pretrasplante con blinatumomab, con la intención de reducir la carga tumoral y obtener un resultado de EMR negativa. La administración del fármaco es mediante perfusión continua y se recomienda la hospitalización del paciente para su estrecha monitorización y manejo de posibles complicaciones. Según ficha técnica, la posología de blinatumomab para esta indicación es de dos ciclos de 28 días cada uno, separados por un periodo de 14 días sin tratamiento7.
La paciente fue ingresada en nuestro hospital para la administración de blinatumomab presentando al ingreso buen estado general, sin anomalías en el hemograma (hemoglobina 13,9 g/dL, leucocitos 10.000/mm3 (63,4% neutrófilos) y plaquetas 299.000/mm3), y asintomática. La perfusión se inició a dosis de 9 µg/día, con periodo de escalada, según ficha técnica5. A los nueve días de iniciar el tratamiento, con dosis de 28 µg/día, se detuvo la infusión ante sospecha de pancreatitis aguda por elevación de las enzimas pancreáticas (amilasa: 214 U/L; lipasa: 477 U/L) y dolor epigástrico intenso. A las 48h, tras recuperar valores normales, se reanudó la perfusión a la dosis de inicio según las recomendaciones descritas en ficha técnica. El día 19 del ciclo se volvió a suspender la infusión por dolor abdominal pero esta vez sin alteraciones en las enzimas pancreáticas. Catorce horas después se reinició el tratamiento a dosis de 9 µg/día y finalmente, se completó el tratamiento sin incidencias. La dosis acumulada de este primer ciclo fue de 399 µg, suponiendo tan solo el 61,3% de la dosis prevista. Las dos reacciones adversas fueron notificadas al Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano. El segundo ciclo se inició a los 14 días de finalizar el primero, según la dosis de ficha técnica. Este ciclo fue muy bien tolerado por la paciente sin presentar ninguna complicación o toxicidad (figura 1).
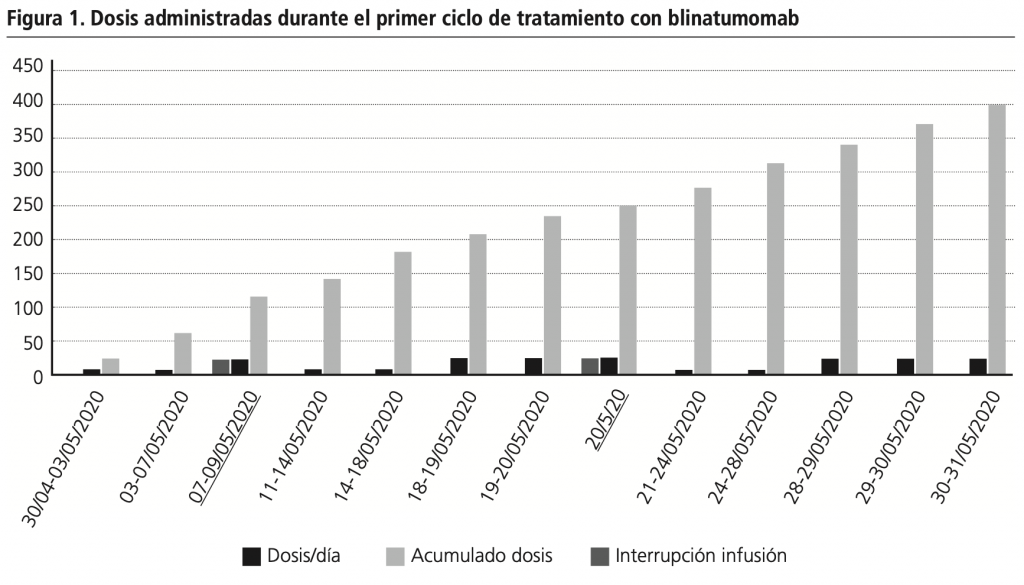
Al finalizar los dos ciclos se realizó el estudio medular pre-trasplante confirmándose EMR negativa (0,006% de blastos en médula ósea), a pesar de no haber recibido a dosis plenas el primer ciclo de tratamiento. El 24 de julio 2020 se realizó alo-TPH, en condiciones óptimas, sin complicaciones relevantes. En la última reevaluación de control, a los dieciséis meses del alo-TPH, la paciente se mantiene en respuesta completa con EMR negativa y quimerismo completo.
DISCUSIÓN
Blinatumomab ha demostrado ser efectivo como terapia puente para el alo-TPH en pacientes con LLA-RR. En dos ensayos clínicos fase 2 se evidenció remisión completa en el 36% y el 33% de los pacientes con LLA-RR tratados con blinatumomab, siendo sometidos a alo-TPH el 44% y el 33% de los respondedores, respectivamente6,10. En un estudio fase 3 multicéntrico se demostró que los pacientes con esta patología tratados con blinatumomab tenían mayor supervivencia global en comparación con la quimioterapia convencional (7,7 vs 4 meses). Las tasas de remisión también fueron mayores blinatumomab, ya que en este grupo el 34% de los pacientes alcanzaron remisión completa respecto al 16% del grupo tratado con quimioterapia5.
La literatura publicada sobre la aparición de pancreatitis en pacientes tratados con blinatumomab es escasa, pero sí está muy descrita la toxicidad neurológica. En el ensayo fase 3 anteriormente mencionado un paciente (n=267; 0,4%) desarrolló pancreatitis aguda tras recibir blinatumomab5. Además, no hay casos publicados post-comercialización de pancreatitis después de la exposición a este fármaco.
Con el presente caso se ha querido mostrar que blinatumomab es efectivo como terapia puente al alo-TPH en una paciente con LLA-RR en la que, por motivos de toxicidad pancreática y gastrointestinal, no se pudieron administrar los dos ciclos de tratamiento a dosis plenas, según ficha técnica. En la bibliografía revisada no se encontró referencia a resultados de eficacia en pacientes en los que hubiera que reducir tanto la dosis. La paciente consiguió llegar al trasplante en condiciones óptimas, con EMR negativa, y éste fue exitoso. Aun así, son necesarios más estudios con mayor tamaño muestral para garantizar la efectividad y seguridad de blinatumumab a largo plazo.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Paul S, Kantarjian H, Jabbour EJ. Adult Acute Lymphoblastic Leukemia. Mayo Clin Proc. 2016;91(11):1645-66.
2. Benjamin JE, Stein AS. The role of blinatumomab in patients with relapsed/refractory acute lymphoblastic leukemia. Ther Adv Hematol. 2016;7(3):142-56.
3. Wolach O, Stone RM. Blinatumomab for the treatment of Philadelphia chromosome-negative, precursor B-cell acute lymphoblastic leukemia. Clin Cancer Res. 2015;21(19):4262-9.
4. Gökbuget N, Dombret H, Bonifacio M, Reichle A, Graux C, Faul C, et al. Blinatumomab for minimal residual disease in adults with B-cell precursor acute lymphoblastic leukemia. Blood. 2018;131(14):1522-31.
5. Kantarjian H, Stein A, Gökbuget N, Fielding AK, Schuh AC, Ribera J-M, et al. Blinatumomab versus Chemotherapy for Advanced Acute Lymphoblastic Leukemia. N Engl J Med. 2017;376(9):836-47.
6. Topp MS, Gökbuget N, Stein AS, Zugmaier G, O’Brien S, Bargou RC, et al. Safety and activity of blinatumomab for adult patients with relapsed or refractory B-precursor acute lymphoblastic leukaemia: A multicentre, single-arm, phase 2 study. Lancet Oncol. 2015;16(1):57-66.
7. Agencia Española de Medicamentos y Productos Sanitarios. Comunicación dirigida a Profesionales Sanitarios ▼BLINCYTO ® (blinatumomab): Riesgo de Pancreatitis; 2016 [consultado 21 de junio 2021]. Disponible en: https://sinaem.agemed.es/CartasFarmacovigilanciaDoc/2016/DHPC-blicyto-28102016.pdf.
8. Vakharia P, Nardone B, Budris W, Hoshizaki K, Frankfurt O, West DP. Blinatumomab and pancreatitis: an analysis of FAERS, EudraVigilance, and a large urban U.S. patient population data. Leuk Lymphoma. 2018;59(7):1759-61.
9. European Medicines Agency (EMA) [Internet]. EudraVigilance European database of suspected drug reaction reports. Available from: http://www.adrreports.eu/en/index.html.
10. Martinelli G, Boissel N, Chevallier P, Ottmann O, Gökbuget N, Topp MS, et al. Complete Hematologic and Molecular Response in Adult Patients With Relapsed/Refractory Philadelphia Chromosome-Positive B-Precursor Acute Lymphoblastic Leukemia Following Treatment With Blinatumomab: Results From a Phase II, Single-Arm, Multicenter Study. J Clin Oncol. 2017 Jun 1;35(16):1795-1802.
____
