Fernández-Bravo Rodrigo J, Flor García A, Martin Niño I, Barreda Hernández D
Servicio de Farmacia. Hospital Virgen de la Luz. Cuenca (España)
Fecha de recepción: 23/01/2022 – Fecha de aceptación: 25/02/2022
Correspondencia: Jaime Fernández-Bravo Rodrigo – Hospital Virgen de la Luz Cuenca (Servicio de Farmacia) – Hermandad Donantes de Sangre, s/n – 16001 Cuenca (España)
jaimefernandezbravorodrigo@gmail.com
____
Resumen
Se presentan dos casos de sospecha de síndrome hemofagocítico secundario en pacientes con leucemia linfocítica crónica, tratados con ibrutinib, síndrome que puede ser letal y que tiene lugar por una activación inmune excesiva. En el presente artículo se describe el desarrollo del síndrome, su diagnóstico, el tratamiento y su desenlace, acorde a las guías y protocolos de diagnóstico, actuación y tratamiento. Es destacable por el hecho de ser una reacción adversa rara de la que no se conoce muy bien la causa, multifactorial, de diferente inicio y evolución, como ocurre en los dos casos que se presentan, no recogida en ficha técnica. Se sitúan los casos junto a un pequeño número de casos también publicados.
Palabras clave: Ibrutinib, síndrome hemofagocítico, leucemia linfocitica crónica, farmacovigilancia, reacción adversa.
Haemophagocytic syndrome in patient with chronic lymphocytic leukaemia treated with ibrutinib. Two cases report
Summary
We presented two cases of suspected secondary haemophagocytic syndrome in patients with chronic lymphocytic leukaemia treated with ibrutinib, syndrome that could be letal and that occurs due to excessive immune activation. This article describes the evolution, diagnosis, treatment, and denouement, according to protocols and guidelines for diagnosis and therapeutic decision-making. It is noteworthy, because is a rare adverse event, not present in product monograph, whose cause is not weel known, multifactorial, with different onset and evolution, as in the two cases presented. The cases are placed next to a small number of publicated cases.
Key words: Ibrutinib, haemophagocytic syndrome, chronic lymphocytic leukaemia, pharmacovigilance, adverse reaction.
____
INTRODUCCIÓN
El síndrome hemofagocítico (SHF), condición que pone en peligro la vida, se origina a partir de una descontrolada activación inmune resultando en inflamación excesiva, con tasas de mortalidad elevadas debido al retraso en el diagnóstico e incluso después de proporcionar tratamiento. El SHF secundario o adquirido, puede ocurrir a cualquier edad, pudiendo ser desencadenado por varios factores, desordenes autoinmunes, reumatológicos, neoplasias, factores idiopáticos o infecciones, siendo la infección viral el factor global más habitual1,2.
Ibrutinib, incluye entre sus indicaciones, el tratamiento de pacientes adultos con leucemia linfocítica crónica (LLC), tratados o no previamente.
Se han descrito varios casos de SHF en pacientes tratados con ibrutinib3-5.
Los principales criterios de diagnóstico son el HLH y Hscore, ambos consolidados para diagnóstico de precisión (ver tabla 1)6.

El tratamiento en adultos, basado en el protocolo HLH-94, con consenso de uso, según las últimas recomendaciones, consiste: etopósido 150 mg/m2, 2 administraciones/semana las dos primeras, y 1 administración/semana hasta la octava. Los ajustes posológicos se realizan en base a función renal. Se suele emplear junto a dexametasona (corticoide de elección), 2-10mg/m2/día las dos primeras semanas y luego en pauta decreciente hasta la octava semana. También se puede emplear ciclosporina 6mg/kg/día en varias dosis, empezando en semana 9, en pacientes muy graves2,7,8.
DESCRIPCIÓN DE LOS CASOS
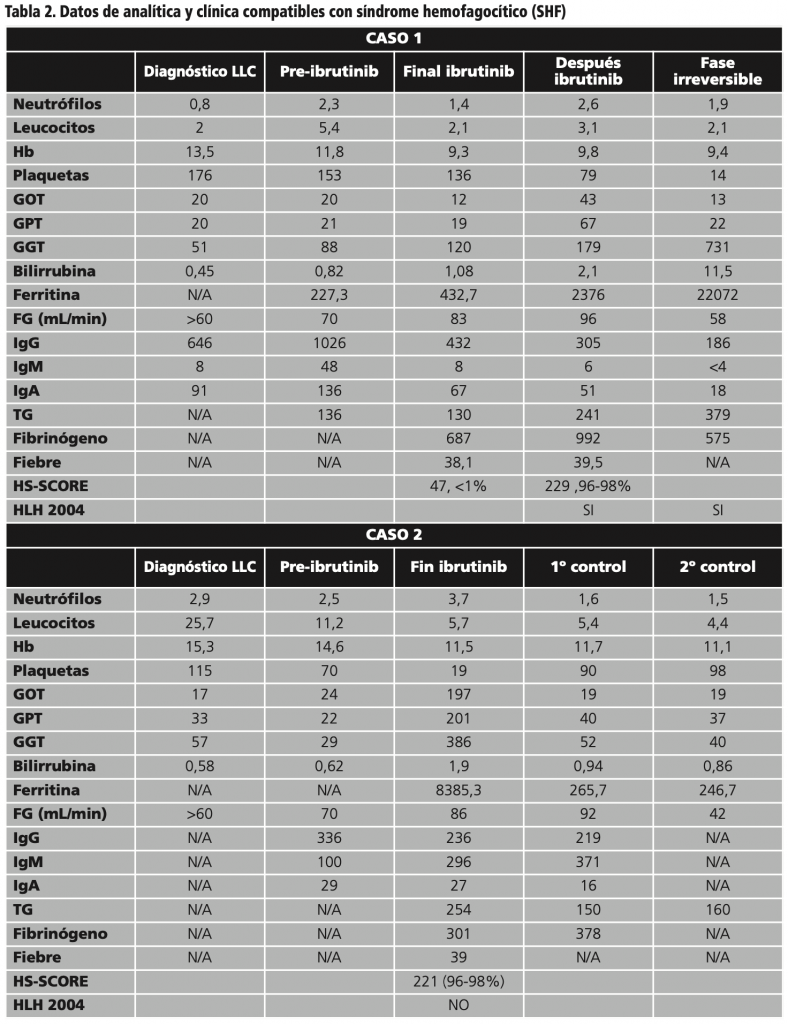
Las evoluciones analíticas pueden observarse en tabla 2.
Caso 1
Varón, 66 años, diagnosticado de LLC-B estadío 4-Rai y C-Binet en 2016 que recibió tratamiento 1ª línea con fludarabina, ciclofosfamida y rituximab (FCR).
A inicios de 2020 presentó progresión, comenzándose con ibrutinib, 420 mg/día, con mejora de síntomas B, pero, a los 3 meses, se evidencia progresión patológica con fiebre intermitente, requiriendo ingreso. Se suspendió ibrutinib, iniciándose tratamiento con rituximab, ciclofosfamida, vincristina y prednisona (R-CVP). Habiendo trascurrido 3 meses del inicio de ibrutinib, y 1 ciclo R-CVP se analizó médula ósea observándose hemofagocitosis, con analítica y clínica compatible con SHF (véase tablas1 y 2). Se inició tratamiento según protocolo HLH-94: etopósido (105 mg/m2 ajustado a función renal), dexametasona 10 mg/m2/día durante 2 semanas.
Tras un mes, presentó varios ingresos por encefalopatía hepática, pancitopenias, neutropenia febril y mal estado general, muy posiblemente secundarias al SHF. Posteriormente, ingresó de nuevo por fiebre, y mal estado general con múltiples complicaciones. Se inició ciclosporina 100 mg/12horas, recibiendo 16ª dosis de etopósido, y manteniendo dexametasona. Las dosis se fueron aumentando progresivamente, alcanzándose: 20 mg/dia dexametasona 112,5 mg/m2 etopósido, 150 mg/12h ciclosporina. En este estadío, anatomía patológica en biopsia de hígado avala diagnóstico de SHF.
Durante este ingreso el paciente entró en fase irreversible, tras 5 años desde diagnóstico, causó exitus.
Caso 2
Varón, 45 años, diagnosticado en 2013 de LLC-B, estadío 2-Rai (no mutada). Recibió 6 ciclos FCR en 2017.
Dos años después, tras progresión, inicia ibrutinib, 420 mg/día. Tras 18 meses ingresa por neutropenia febril de 39º, sin claro foco, tiritona y sudoración profusa de 4 días de evolución, esplenomegalia y analítica compatibles con SHF (véase tablas1 y 2). Se suspende ibrutinib e inicia tratamiento con dexametasona 10 mg/m2/día, observándose clara mejora clínica y analítica, por lo que se decide no iniciar tratamiento con etopósido. Tras 6 días, recibe alta con seguimiento estrecho. En posteriores revisiones el paciente refiere insomnio y astenia principalmente.
Meses después, presenta continua mejora del estado general, aunque con persistencia de insomnio, suspendiéndose dexametasona definitivamente.
Actualmente continua estable con vigilancia estrecha.
Ambos casos se han notificado al Centro de Farmacovigilancia correspondiente.
DISCUSIÓN
Es importante tener en cuenta que pacientes con ibrutinib podrían desarrollar un SHF secundario.
En el primer caso, el desarrollo del daño hepático provocado por el SHF condicionó su evolución. Un diagnóstico precoz, junto una suspensión temprana del ibrutinib, podría haber prevenido la evolución tórpida del paciente. El factor etario pudo contribuir al retraso en el diagnóstico y su desenlace.
En el segundo caso, se observó clara mejoría tras suspensión del ibrutinib e inicio de tratamiento con dexametasona. Destacar que hiperferritinemias muy elevadas se han observado con más sensibilidad en el diagnóstico de SHF, a pesar de no cumplir criterios HLH-2004, no pudiendo ser descartado un SHF, diagnóstico dificultoso, certero y único, sobre todo en ausencia de anormalidades genéticas2,6,8.
Los criterios diagnósticos HS-SCORE, SA-HS, y HLH-2004, aplicados en nuestros pacientes, avalan el diagnóstico. Establecer la asociación con ibrutinib completamente es difícil, no obstante, hay indicios clínicos que apuntan a ello, y por tanto deben ser tenidos en cuenta.
A diferencia de otros casos publicados3-5, el caso 2 tardó más tiempo en desarrollar el SHF secundario desde el inicio con ibrutinib. Pudiendo ser plausible una variabilidad en el desarrollo del SHF secundario a ibrutinib debido a las características del mismo. No obstante, al ser un pequeño número de casos, no permite establecerlo con claridad.
Cavallari et al.5 publicaron un caso de SHF secundario a los 7 días de inicio de ibrutinib en un paciente con LLC refractario y reactivación por virus de Epstein Barr (EBV) documentada. Al igual que Ambider et al.4, pero sin EBV. Ambos casos recibieron quimioterapia previa. Presentaron debut más rápido (7 días frente 72 del Caso 1), propiciado por el EBV5 e inmunosupresión por quimioterapia previa reciente4,5, no presente en el nuestro.
Hay casos publicados presentando debut de 1-2 semanas en pacientes de 54-77 años4,5,6, un caso de 63 años tuvo lugar 6 meses después4. Tiempo muy inferior frente a los 18 meses del Caso 2. Sin embargo, nuestro paciente tenía 45 años, diagnosticado 7 años previo. El factor etario ha podido contribuir a su tardía manifestación y reversibilidad tras suspensión de ibrutinib y tratamiento del SHF.
Un posible mecanismo, que explicara la contribución del ibrutinib, es su unión irreversible a las tirosina-quinasa de Bruton, contribuyendo a la desgranulación en las células Natural Killer, defecto funcional crucial en la patogénesis del SHF2,9.
La clínica del SHF manifiesta la importancia de su detección y actuación precoz para evitar daños irreversibles.
La presencia de varios casos notificados de SHF con ibrunitib hace necesario tener en cuenta esta posibilidad, y vigilar signos y síntomas que nos puedan permitir su rápido diagnóstico y tratamiento. Para un posicionamiento claro de la relación entre ibrutinib y el SHF es necesario un mayor tamaño muestral que lo establezca.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Bhatt NS, Oshrine B, A Talano. J.Hemophagocytic lymphohistiocytosis in adults.Leuk. Lymphoma. 2019Jan; 60(1): 9-28.
2. Ramos-Casals M, Brito-Zerón P, López-Guillermo A, Khamashta MA, Bosch X. Adult haemophagocytic syndrome. Lancet. 2014 Apr 26;383(9927):1503-1516.
3. Poole A, Girard N, Clayton F, Tantravahi SK. Rapid onset of hemophagocytic lymphohistiocytosis in a patient with refractory chronic lymphocytic leukemia treated with ibrutinib. Leuk Lymphoma. 2017May; 58 (5):1258-1261.
4. Ambinder AJ, Hambley B, Shanbhag S, Merrill SA. Ibrutinib-associated hemophagocytic lymphohistiocytosis: A case series from Johns Hopkins. Am J Hematol. 2019Nov; 94(11):E296-E299.
5. Cavallari M, Ciccone M, Falzoni S, Cavazzini F, Formigaro L, Di Virgilio F, et al.“Hemophagocytic Lymphohistiocytosis after EBV reactivation and ibrutinib treatment in relapsed/refractory Chronic Lymphocytic Leukemia”. Leuk Res Rep. 2017Jan; 7(C):11-13.
6. Knaak C, Nyvlt P, Schuster FS Spies C, Heeren P, Schenk T, et al.Hemophagocytic lymphohistiocytosis in critically ill patients: diagnostic reliability of HLH-2004 criteria and Hscore. Crit Care. 2020 May; 24(1):1-9.
7. Treatment and prognosis of hemophagocytic lymphohistiocytosis. Kenneth L McClain . UpToDate. Disponible en: https://www.uptodate.com/contents/treatment-and-prognosis-of-HYPERLINK «https://www.uptodate.com/contents/ treatment-and-prognosis-of-hemophagocytic-lymphohistiocytosis?source=history_widget»hemophagocytic-lymphohistiocytosis?source=history_widget Última actualización: 11 mayo 2020. Consultado en 29 septiembre 2021.
8. La Rosée P, Horne A, Hines M, von Bahr Greenwood T, Machowicz R, Berliner N, Birndt S, et al. Recommendations for the management of hemophagocytic lymphohistiocytosis in adults. Blood. 2019 Jun 6;133(23):2465-2477.
9. Kohrt HE, Sagiv-Barfi I, Rafiq S, Herman SE, Butchar JP, Cheney C, et al. Ibrutinib antagonizes rituximab-dependent NK cell-mediated cytotoxicity. Blood. 2014 Mar 20;123(12):1957-60.
____
