Fecha de recepción: 18/03/2018 – Fecha de aceptación: 04/06/2018
Lázaro López E, Rodríguez Ferreras A, Zapico García I, Velasco Roces L
UGC Farmacia. Hospital Universitario Central de Asturias. Oviedo. Asturias (España)
____
Correspondencia:
Eva Lázaro López w Avda. Roma, s/n w 33011 Oviedo. Asturias (España)
lazarolopezeva@gmail.com
____
Señor Director:
La terapia celular abre un nuevo horizonte en tratamientos diagnósticos y terapéuticos dirigidos a diversas enfermedades, basándose en el uso de células madre adultas y otros tipos de células y tejidos. Constituye una nueva estrategia terapéutica que presenta un amplio abanico de líneas celulares distintas, elaboradas en gran variedad de centros distintos y cuya solicitud se gestiona por el farmacéutico de hospital. Estamos pues ante un nuevo contexto en el que la biología molecular y la farmacología interactúan constituyendo una nueva área de conocimiento donde los farmacéuticos de hospital debemos participar activamente, comportando un reto importante para nosotros.
Tal y como queda recogido en el artículo 47 del capítulo 5 del RD Real Decreto Legislativo 1/2015 de 24 de julio, son considerados como medicamentos tanto la terapia génica como la terapia celular somática. Al igual que sucede con otros medicamentos tales como las fórmulas magistrales o los radiofármacos, los medicamentos de terapia avanzada de fabricación no industrial deben disponer de un procedimiento específico de autorización que se adapte a sus especiales características de producción. En este sentido, el Real Decreto 477/20141, de 13 de junio es el que regula la autorización de medicamentos de terapia avanzada de fabricación no industrial. Sin embargo, y a pesar de que la terapia avanzada es considerada medicamento desde la Ley de Garantías de 20062, ha sido en los últimos años y a raíz del RD 1015/2009 de disponibilidad de medicamentos en situaciones especiales, cuando los farmacéuticos de hospital a través de la tramitación de los Usos Compasivos de este tipo de terapia hemos entrado a formar parte de esta nueva era.
Se revisó la situación actual de la terapia celular así como analizar el uso y efectividad de estos medicamentos en nuestro Hospital durante un período de tres años. Para ello buscamos los medicamentos de terapia avanzada disponibles y cuya adquisición se realiza a través de la aplicación de medicamentos en “Situaciones Especiales” de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) (RD 1015/2009). Tras la búsqueda obtuvimos todos los tipos de células mesénquimales (CME) de médula ósea y piel utilizados en nuestro Hospital. Hay disponibles una gran cantidad de medicamentos de terapia celular, elaborados en hasta 17 centros distintos (Institutos, Fundaciones…) todos ellos a precio cero (en la Tabla 1 se describen las diferentes estirpes celulares y los tipos de piel así como los proveedores). Por otro lado, hemos observado que existen unas directrices de la AEMPS3 sobre la nomenclatura de las sustancias activas de los medicamentos en investigación de terapia avanzada que contengan células.
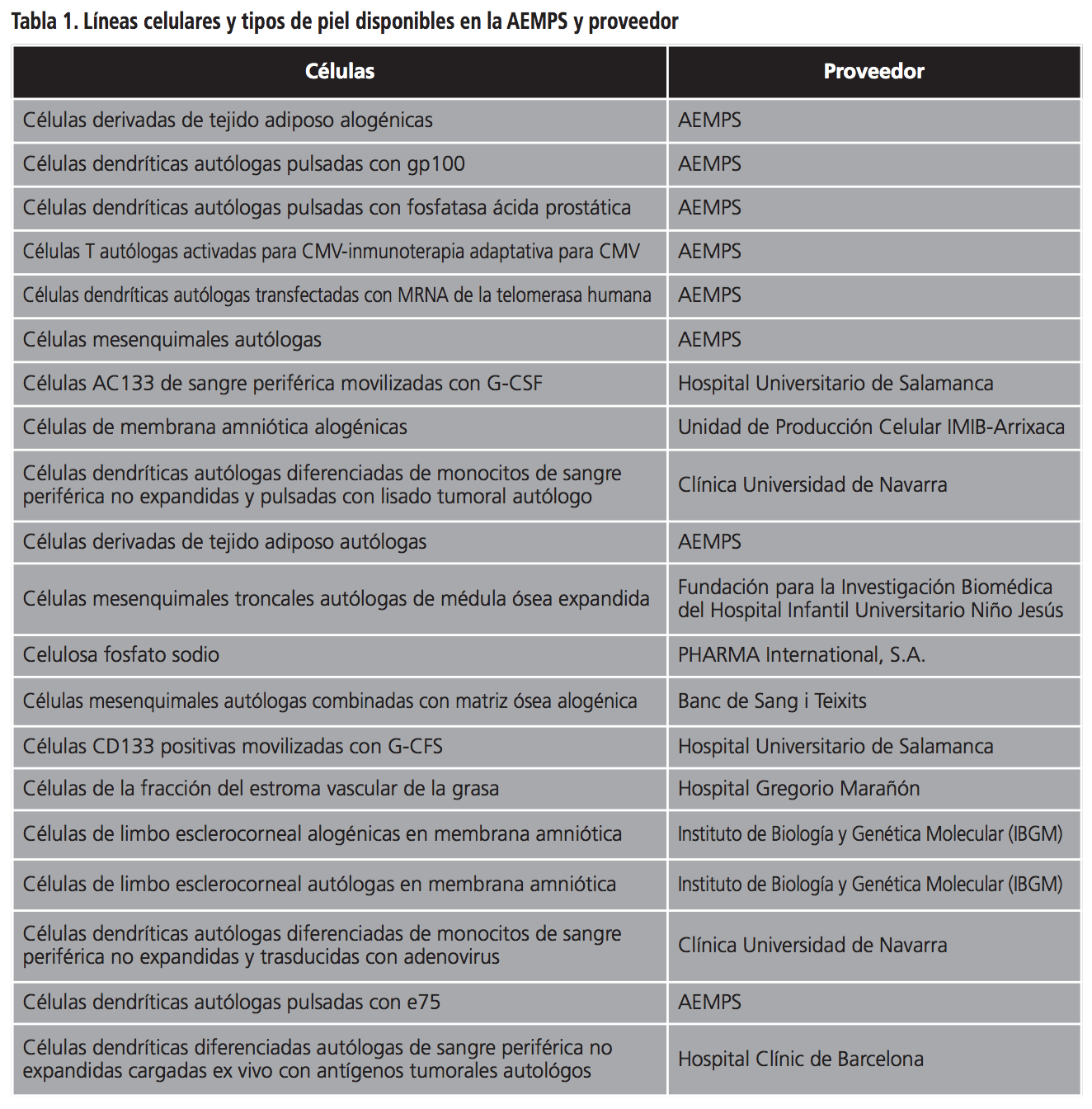
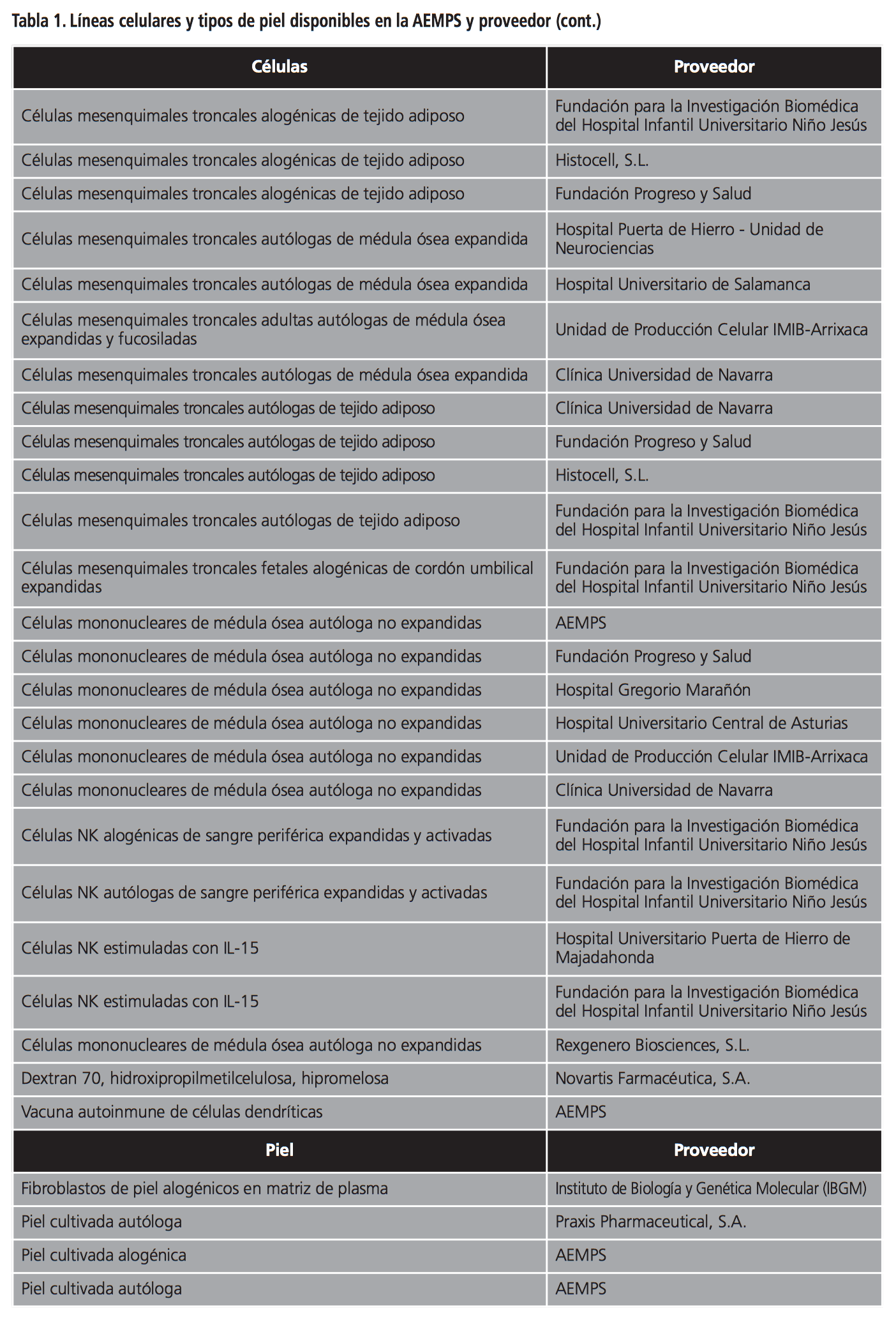
En nuestro Hospital, en los últimos años se han realizado solicitudes de tratamientos de terapia celular para ocho pacientes por los servicios de Hematología, Cirugía Maxilofacial y Cirugía Pediátrica. En todos los casos, las células solicitadas fueron CME.
En los pacientes hematológicos (n=5) la indicación solicitada fue el tratamiento de la enfermedad del injerto contra el huésped (EICH) refractaria a tratamientos convencionales4. Todos los pacientes habían recibido dosis altas de corticoides e inmunosupresores, así como otros tratamientos fuera de ficha técnica (etanercept, rituximab, infliximab, imatinib y talidomida). De estos cinco pacientes, 3 eran mujeres, uno hombre y el otro un niño, la mediana de edad fue de 35,8 años (8-57). En todos los casos fueron infundidas CME de médula ósea. Además, el paciente pediátrico de 8 años de edad, con diagnóstico de leucemia linfoblástica B, presentaba un tumor en el cuero cabelludo que precisó extirpación quirúrgica y posterior injerto de piel cultivada5, que tras dos intervenciones mejora favorablemente. En el momento actual dos de los pacientes con EICH han sido éxitus, otro ha obtenido una recuperación progresiva de cifras hemoperiféricas con independencia trasfusional al alta y, el niño obtuvo una mejoría clínica de las lesiones cutáneas aunque han vuelto a aparecer.
A los pacientes con osteonecrosis mandibular se les inyectó en la cirugía un concentrado de CME junto con plasma rico en plaquetas. Se trataba de pacientes adultos, dos de ellos mujeres. El origen de la osteonecrosis en las mujeres fue el uso de bifosfonatos orales, mientras que en el hombre fue la radioterapia recibida como tratamiento a un cáncer. Tras la intervención quirúrgica, en los tres pacientes se observó una disminución significativa del dolor asociado con un beneficio funcional duradero.
Puesto que la terapia celular es considerada medicamento a raíz del RD 1015/2009, el farmacéutico de hospital es el responsable de tramitar la solicitud de dichos tratamientos innovadores, tratándose en el momento actual de una función meramente burocrática y muy alejada de la evaluación crítica y posicionamiento de los fármacos que acostumbramos a llevar a cabo en el día a día en nuestros hospitales.
El mecanismo por el cual las CME desarrollan su acción en el EICH no es bien conocido, aunque se cree que está relacionado con sus propiedades inmunomoduladoras en puntos de control inmunológico6 (por ejemplo la ruta de señalización de la indoleamina-2,3-dioxigenasa y metabolismo del triptófano)7.
En el caso de los pacientes con osteonecrosis mandibular los resultados obtenidos fueron similares a los estudios publicados al respecto8, obteniendo una reducción de exposición de hueso alveolar y cicatrización completa de la lesión a los pocos meses del procedimiento. No obstante sería necesario realizar estudios con mayor tamaño muestral para confirmar estos hallazgos.
Con los casos analizados en nuestro Centro podemos concluir que a pesar de que la terapia celular tiene un futuro prometedor y genera nuevas ventanas de tratamiento, los resultados obtenidos han sido muy modestos, especialmente en los pacientes con EICH.
Todas las solicitudes realizadas de medicamentos de terapia celular han sido para pacientes sin alternativas terapéuticas y su uso se ha realizado con carácter excepcional.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Boletin Oficial del Estado. Real Decreto 477/2014 de 13 de junio, por el que se regula la autorización de medicamentos de terapia avanzada de fabricación no industrial. BOE nº 144 de 14/06/2014.
2. Boletín Oficial del Estado. Ley 29/2006 de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios. BOE nº 178 de 27/07/2006.
3. Agencia Española de Medicamentos y Productos Sanitarios. Directrices de la agencia española de medicamentos y productos sanitarios sobre la nomenclatura de las sustancias activas de los medicamentos en investigación de terapia avanzada que contengan células. [Consultado 03/2018]. Disponible en: https://www.aemps. gob.es/investigacionClinica/medicamentos/docs/directrices-NSA-invest-terapia-celular.pdf.
4. Lee SJ, Vogelsang G, Flowers ME. Chronic Graft-versus-Host Disease. Biol Blood Marrow Transplant. 2003;9(4):215-33.
5. Taboada A, Prieto A, Couto I, Brea B, González E. Carcinoma basocelular invasivo de cuero cabelludo: Caso clínico. Neurocirugía. 2010;21(5):361-410.
6. Dunavin N, Dias A, Li M, McGuirk J. Mesenchymal Stromal Cells: What Is the Mechanismin Acute Graft-Versus-Host Disease? Biomedicines. 2017;5(3): 39.
7. Moffett JR, Namboodiri MA. Tryptophan and the immune response. Immunol Cell Biol. 2003;81(4):247-65.
8. Jáuregui-Kuo Ying G, Millones-Gómez PA. La inmunoterapia a base de células madre en la enfermedad de osteonecrosis de maxilares asociada a bifosfonatos revisión de reporte de casos. In Crescendo. Ciencias de la Salud. 2015;2(2):538-45.
____
Descargar artículo en PDF: Terapia celular y la farmacia hospitalaria: un nuevo reto
