Fobelo Lozano MJ1, Uceda Montañés J2, Serrano Giménez R1
1 UGC de Farmacia
2 UGC de Reumatología
Hospital Universitario de Valme. Sevilla (España)
Fecha de recepción: 19/10/2018 – Fecha de aceptación: 27/12/2018
Correspondencia: Reyes Serrano Giménez – Hospital Nuestra Señora de Valme – Avda. de Bellavista, s/n – 41014 Sevilla (España)
reysergim@gmail.com
____
Resumen
Secukinumab es un anticuerpo monoclonal recombinante, íntegramente humano, selectivo a la interleucina17A, indicado para el tratamiento de psoriasis en placas, artritis psoriásica y espondilitis anquilosante. Las infecciones leves-moderadas de vías respiratorias altas (rinitis/rinofaringitis) están descritas como efectos secundarios frecuentes. En la mayoría de las ocasiones no es necesario suspender el tratamiento. Presentamos un caso, no descrito anteriormente en la literatura, de tos seca no asociada a proceso respiratorio, relacionada con secukinumab que obligó a la suspensión del fármaco. El caso se ha notificado al Centro Andaluz de Farmacovigilancia.
Palabras clave: Secukinumab, tos, reacción adversa a medicamento (RAM), interleucina-17.
Dry cough due to secukinumab with need for treatment suspensión
Summary
Secukinumab is a recombinant monoclonal antibody, entirely human, selective to interleukin17A, indicated for the treatment of plaque psoriasis, psoriatic arthritis and ankylosing spondylitis. Mild-moderate upper respiratory tract infections (rhinitis/rhinopharyngitis) are described as common side effects. In most cases it is not necessary to stop treatment. We present a case, not previously described in the literature, of dry cough not associated with respiratory process, related to secukinumab that forced the suspension of the drug. The case has been reported to the Andalusian Pharmacovigilance Centre.
Key Words: Secukinumab, cough, adverse drug reaction (ADR), interleukin-17.
____
Introducción
Secukinumab es un anticuerpo monoclonal recombinante, íntegramente humano, selectivo a la interleucina17A indicado para el tratamiento de psoriasis en placas, artritis psoriásica y espondilitis anquilosante. Entre los efectos secundarios, las infecciones leves-moderadas de vías respiratorias altas (rinitis/rinofaringitis) son frecuentes. En la mayoría de las ocasiones no es necesario suspender el tratamiento1. Debido a que se trata de un fármaco biológico y de reciente comercialización, presentamos un caso de tos seca no asociada con ningún proceso respiratorio, que llevó a la discontinuación del fármaco y de la que no existen actualmente casos publicados.
DESCRIPCIÓN DEL CASO
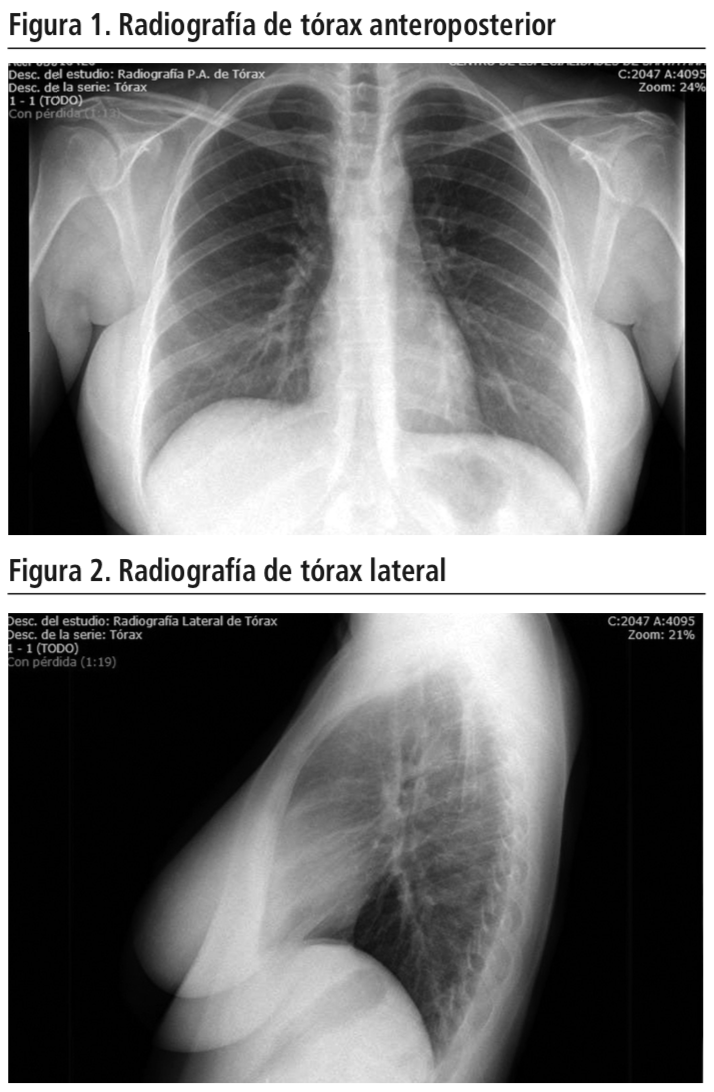
Mujer de 37 años, diagnosticada de espondilitis anquilosante axial y periférica HLA B27 negativo en octubre de 2014. Se inició tratamiento con antiinflamatorios no esteroideos y sulfasalazina desde el momento del diagnóstico, siendo suspendido este tratamiento por ineficacia a los 10 meses. En julio de 2015 inició tratamiento con infliximab intravenoso (5 mg/kg cada 8 semanas) en monoterapia, presentando la paciente un fallo secundario al mismo. Por fallo a infliximab, al año de tratamiento se comenzó secukinumab en pauta habitual para esta indicación. El tratamiento oral concomitante consistía en naproxeno, omeprazol, diazepam y oxicodona/naloxona. Al mes de inicio de tratamiento con secukinumab, la paciente comenzó con un cuadro de tos seca persistente y febrícula. En el estudio de este cuadro clínico se realizó una radiografía de tórax (Figuras 1 y 2), cultivo de esputo, baciloscopia y se repitió el test de Mantoux; todos los resultados obtenidos fueron negativos.
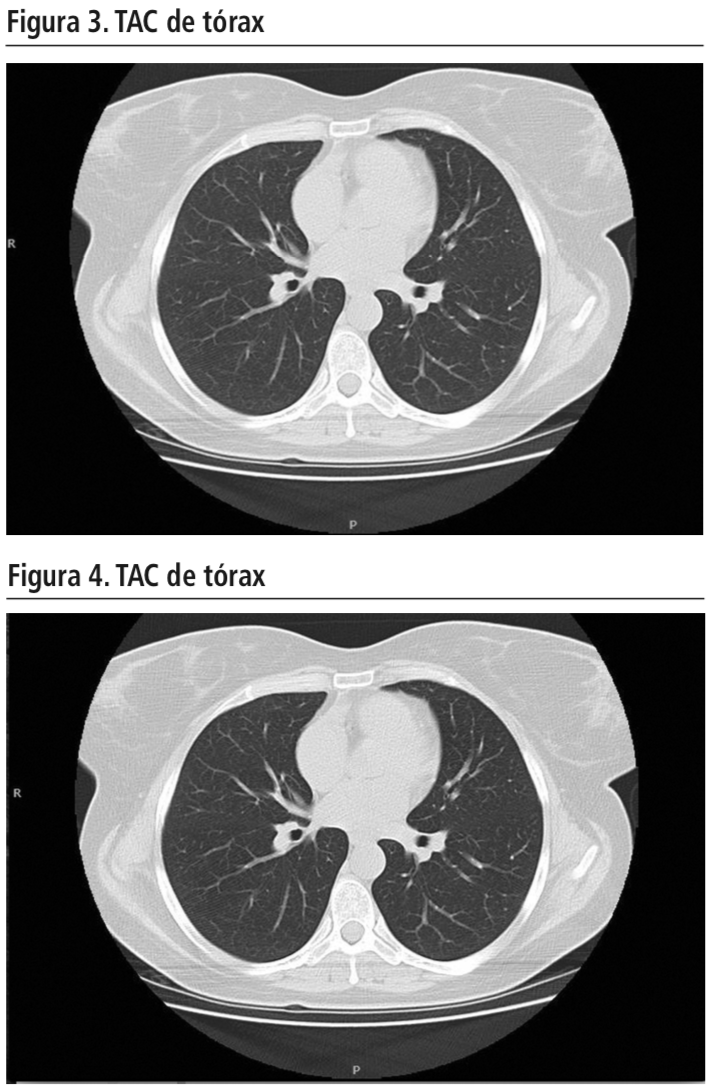
Ante la larga evolución del cuadro clínico se decidió suspender el fármaco biológico, resolviéndose entonces la tos a las pocas semanas. En ese momento la paciente presentaba un alto recuento de articulaciones periféricas inflamadas, por lo que se indicó comenzar tratamiento con leflunomida vía oral 20 mg/24 horas. Ante la falta de respuesta clínica, se reintrodujo secukinumab en enero de 2017. A los cuatro meses, la paciente inició un nuevo cuadro tos seca persistente sin expectoración. En esta ocasión, se realizó una tomografía computarizada (TAC) de tórax (Figuras 3 y 4) donde no se encontró patología pulmonar que justificara el cuadro cliníco.
Posteriormente, la paciente fue derivada a consultas de Neumología para estudio, donde se puso de manifiesto la clara relación cronológica del cuadro clínico con la administración de secukinumab. Se consejó la interrupción tanto de secukinumab como de leflunomida, sin necesidad de ampliar el estudio. A las dos semanas de la suspensión de ambos, se resolvió de forma completa el cuadro de tos persistente.
Al aplicar el algoritmo de Karch Lasagna, la relación de causalidad entre la RAM descrita y secukinumab fue de probable.
DISCUSIÓN
En general, los efectos adversos asociados al tratamiento con secukinumab son comunes a otros tratamientos biológicos e incluyen infecciones, neutropenia y reacciones de hipersensibilidad. Secukinumab incrementa la incidencia de infecciones del tracto respiratorio superior, infecciones mucocutáneas por Candida, infecciones del oído medio e infecciones por virus Herpes simple, aunque los casos suelen ser leves y manejables con los tratamientos habituales, sin necesidad de discontinuar el tratamiento1.
La aparición de tos no asociada a ningún proceso respiratorio, está descrita en la ficha técnica de otros fármacos biológicos utilizados en diferentes patologías inflamatorias reumáticas, digestivas y dermatológicas, como vedolizumab2, adalimumab3 y rituximab4, así como en los estudios PHOENIX 1 y 2 de ustekinumab en tratamiento de psoriasis en placas5,6.
Con respecto a la notificación post-comercialización de cuadro de tos como reacción adversa por estos fármacos biológicos, solamente existen datos para adalimumab7 (un caso de tos grave asociada a un proceso similar a asma) y para etanercept8 (varios casos de tos en pacientes con artritis psoriásica).
Por otra parte, un estudio realizado en 40 pacientes con artritis reumatoide, 20 de ellos en tratamiento con infliximab y 20 sin tratamiento, demostró que el grupo en tratamiento con infliximab manifestó una mayor prevalencia de sensibilización a los alérgenos transmitidos por el aire9.
Secukinumab, al disminuir la concentración de la interleucina17A, aumenta la probabilidad de adquirir infecciones y se ha asociado no solo con la aparición de candidiasis mucocutáneas sino también con una amplia variedad de infecciones por hongos, bacterias e incluso virus10. Sin embargo, podría postularse el cuadro clínico como consecuencia de una hiperreactividad del reflejo tusígeno a raíz de una hipersensibilización a mediadores inflamatorios en las terminaciones nerviosas sensitivas de la vía aérea. No obstante, estas hipótesis deberían ser demostradas en posteriores estudios.
Además, leflunomida tiene descrito en ficha técnica11 la aparición de tos y disnea como síntomas de enfermedad pulmonar intersticial; sin embargo la secuencia temporal, el efecto de retirada y de reexposición apoyan más claramente la relación de causalidad de esta RAM con secukinumab.
Este caso se ha notificado al Centro Andaluz de Farmacovigilancia.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Agencia Española de Medicamentos y Productos Sanitarios. CIMA (Centro de Información de Medicamentos). Ficha técnica de secukinumab [Internet]. España: Agencia Española de Medicamentos y Productos Sanitarios [consultado 14/12/2017]. Disponible en: http://www.ema.europa.eu.
2. Agencia Española de Medicamentos y Productos Sanitarios. CIMA (Centro de Información de Medicamentos). Ficha técnica de vedolizumab [Internet]. España: Agencia Española de Medicamentos y Productos Sanitarios [consultado 14/12/2017]. Disponible en: http://www.ema.europa.eu.
3. Agencia Española de Medicamentos y Productos Sanitarios. CIMA (Centro de Información de Medicamentos). Ficha técnica de adalimumab [Internet]. España: Agencia Española de Medicamentos y Productos Sanitarios [consultado 14/12/2017]. Disponible en: http://www.ema.europa.eu.
4. Agencia Española de Medicamentos y Productos Sanitarios. CIMA (Centro de Información de Medicamentos). Ficha técnica de rituximab [Internet]. España: Agencia Española de Medicamentos y Productos Sanitarios [consultado 14/12/2017]. Disponible en: http://www.ema.europa.eu.
5. Rich P, Bourcier M, Sofen H, Fakharzadeh S, Wasfi Y, Wang Y, Kerkmann U, Ghislain PD, Poulin Y. Ustekinumab improves nail disease in patients with moderate-to-severe psoriasis: results from PHOENIX 1. Br J Dermatol. 2014 Feb;170(2):398-407. DOI: 10.1111/bjd.12632.
6. Langley RG, Lebwohl M, Krueger GG, Szapary PO, Wasfi Y, Chan D, Hsu MC, You Y, Poulin Y, Korman N, Prinz JC, Reich K. Long-term efficacy and safety of ustekinumab, with and without dosing adjustment, in patients with moderate-to-severe psoriasis: results from the PHOENIX 2 study through 5 years of follow-up. Br J Dermatol. 2015;172(5):1371-83. DOI: 10.1111/bjd.13469.
7. Margineanu I, Crişan R, Mihaescu T. Asthma-like symptoms in a patient with rheumatoid arthritis and Adalimumab treatment. Pneumologia. 2015;64(4):28-30.
8. De Vlam K, Boone C. Treatment adherence, efficacy, and safety of etanercept in patients with active psoriatic arthritis and peripheral involvement in Belgium for 66 months (PROVE study). Clin Exp Rheumatol. 2015;33(5):624-31.
9. Machado P, Santos A, Pereira C, Loureiro C, Silva J, Chieira C et al. Increased prevalence of allergic sensitisation in rheumatoid arthritis patients treated with anti-TNFalpha. Joint Bone Spine. 2009 Oct;76(5):508-13. doi: 10.1016/j.jbspin. 2009.01.007
10. Ling Y, Puel A. IL-17 and infections. Actas Dermosifiliogr. 2014;105 Suppl 1:34-40.
11. Agencia Española de Medicamentos y Productos Sanitarios. CIMA (Centro de Información de Medicamentos). Ficha técnica de leflunomida [Internet]. España: Agencia Española de Medicamentos y Productos Sanitarios [consultado 27/12/2017]. Disponible en: http://www.ema.europa.eu.
____
