Fecha de recepción: 26/07/2017 – Fecha de aceptación: 19/12/2017
Marín-Gorricho R1, Alfaro-Olea A1, Casajus-Navasal A1, Serrano-Pérez A1, Nebot-Villacampa MJ2,
Zafra-Morales R2
1 Facultativo Especialista en Farmacia Hospitalaria
2 Residente de Farmacia Hospitalaria
Hospital San Pedro de Logroño. La Rioja (España)
____
Correspondencia:
Raquel Marín Gorricho
Hospital San Pedro de Logroño
(Servicio de Farmacia)
C/ Piqueras, 98
26006 Logroño (La Rioja)
Correo electrónico: raquelmg00@hotmail.com
____
Resumen
Objetivos: Determinar la incidencia y gravedad de los acontecimientos adversos (AA) asociados al tratamiento de primera línea con dobletes de platino en pacientes con cáncer de pulmón no microcítico avanzado en un hospital de tercer nivel. Describir y comparar el perfil toxicológico de los dobletes de platino usados.
Métodos: Estudio observacional prospectivo realizado desde enero a julio de 2016. Se recogieron los AA de cualquier grado en cada ciclo de quimioterapia. Se evaluaron de acuerdo a NCI CTCAE versión 4.03. Se recogieron datos personales, antropométricos y clínicos. Se efectuó un estudio descriptivo de las variables más relevantes y se realizó la prueba de chi cuadrado o prueba exacta de Fisher para valorar el perfil toxicológico de ambos platinos (SPSS® versión 21).
Resultados: Iniciaron el estudio 45 pacientes, 28 con doblete de cisplatino y 17 con carboplatino. Finalizaron el tratamiento 26 pacientes, el resto abandonaron por diferentes motivos. Casi todos ellos presentaron algún AA y el 33,3% (15) sufrieron alguno grave. El número de AA recogido fue de 196. Los pacientes tratados con doblete de cisplatino tuvieron mayor número de AA y mayores alteraciones gastrointestinales, neurotoxicidad y astenia. Sin embargo, los pacientes tratados con carboplatino tuvieron mayor trombopenia y neutropenia
Conclusiones: La incidencia y gravedad de los AA detectados se ajustan a lo descrito en la bibliografía. El perfil de toxicidad observado es diferente. La mayoría de AA son de gravedad moderada y tratables con medidas de soporte y ceden al finalizar el tratamiento.
Palabras clave: Carcinoma de pulmón de células no pequeñas, carboplatino, cisplatino, toxicidad, compuestos de platino.
____
Introducción
El cáncer de pulmón constituye la neoplasia más frecuente en todo el mundo con 1,8 millones de nuevos casos estimados en 2012. Es el cáncer más común en los hombres de todo el mundo con 1,2 millones de casos, el 16,7% del total. Además es la causa más común de muerte debida al cáncer en el mundo, el 19,4% del total1.
Según los datos publicados por la Agencia Internacional para la Investigación en Cáncer (IARC), en 2012 la incidencia de cáncer de pulmón en España fue de 26.715 casos, lo que representa el 16,9% de los tumores entre los varones y el 5,7% entre las mujeres. En 2012 fallecieron en España 21.118 personas por su causa2.
El cáncer de pulmón se puede dividir en dos grandes grupos: carcinoma de pulmón de células pequeñas o microcítico (CPM) que representa el 15-20% de los casos y el carcinoma de pulmón de células no pequeñas o no microcítico (CPNM)3. Entre el 75-80% de los casos diagnosticados de cáncer de pulmón pertenecen al tipo histológico no microcítico y en el momento del diagnóstico más de la mitad de los pacientes presentan enfermedad metastásica no operable o en estadio IV4.
Los dobletes constituidos por las sales de platino en combinación con fármacos de tercera generación (gemcitabina, paclitaxel, vinorelbina, docetaxel, pemetrexed) constituyen los esquemas farmacoterapéuticos más utilizados en el CPNM avanzado en primera línea de tratamiento. Estos dobletes han sido comparados entre sí y los resultados obtenidos indican que su eficacia es equivalente pero ocasionan diferente perfil de toxicidad4,5. Por tanto, la elección del régimen debería basarse en factores como comorbilidades, toxicidad, preferencias del paciente, costes, etc.6,7
En el estudio prospectivo y observacional FRAME8 se concluyó que la elección de un doblete de platino u otro es en base a las características del paciente y de la enfermedad. La quimioterapia basada en cisplatino es actualmente considerada el estándar en el tratamiento de cáncer de pulmón no microcítico avanzado pero debido a su toxicidad muchos médicos no la usan de rutina9. En una revisión Cochrane se concluyó que aunque el uso de regímenes basados en dobletes de cisplatino tuvo tasas de respuesta más altas no hubo diferencias en la supervivencia global entre los agentes de platino10.
Se recomienda administrar cuatro ciclos de tratamiento si existe estabilización, y no debe superar los seis ciclos cuando hay respuesta objetiva, ya que más ciclos no mejoran la supervivencia y, sin embargo, aumentan significativamente la toxicidad11. El mecanismo clave de la actividad de los platinos radica en la formación de enlaces cruzados de ADN y de aductos covalentes de ADN con otros componentes subcelulares12.
Los efectos adversos difieren de manera significativa. Los regímenes basados en cisplatino son asociados con mayor riesgo de náuseas, vómitos, toxicidad renal y neurotoxicidad. Por otro lado, las quimioterapias con carboplatino están asociadas con mayor neutropenia, anemia, trombocitopenia y mielosupresión13,14.
A pesar de que la quimioterapia combinada con platino tiene efectos beneficiosos en cuanto a la supervivencia y el control de los síntomas en personas en tratamiento, también puede producir una serie de efectos adversos no deseables13.
En este trabajo se pretende determinar tanto la incidencia como la gravedad de los acontecimientos adversos asociados al tratamiento con determinados dobletes de platino en pacientes con cáncer de pulmón no microcítico avanzado en un hospital de tercer nivel. Además describir y comparar el perfil toxicológico de los dobletes de platino usados.
MATERIAL Y MÉTODOS
Estudio observacional prospectivo realizado en un hospital de tercer nivel desde enero a julio de 2016.
La población estudiada fueron pacientes con carcinoma de pulmón no microcítico en estadio avanzado que iniciaron tratamiento de primera línea con un doblete de platino durante el periodo de estudio. Se excluyeron todos los pacientes en líneas avanzadas de tratamiento al igual que los que iniciaron esquemas quimioterápicos de platinos en combinación con otros agentes como bevacizumab.
Para valorar la seguridad del tratamiento se registraron todos los acontecimientos adversos (AA), evaluados cada uno de ellos por ciclo en el que se presentaron y por la severidad de acuerdo a los Criterios de Terminología Común para Acontecimientos Adversos del National Cancer Institute (NCI-CTCAE) versión 4.0315. Respecto al momento de manifestación de la toxicidad se clasificó en: toxicidad inmediata, precoz, retardada y tardía.
El análisis de los acontecimientos adversos se centró en los originados durante cada ciclo de tratamiento, es decir, los producidos desde el día 1 de administración de un ciclo de quimioterapia hasta el ciclo siguiente, es decir, en el periodo de tres semanas.
Como la recomendación es administrar entre cuatro y seis ciclos de quimioterapia, se quiso estudiar la toxicidad en todos los pacientes en cuatro ciclos de tratamiento. Los AA agudos se contabilizaron de manera individual en cada ciclo en función de su gravedad debido a que no se estudió el mismo número de pacientes en cada ciclo de tratamiento. Se han realizado análisis por subgrupos estudiando la toxicidad de los dobletes en función de las características clínicas y terapéuticas de los pacientes pero no se han obtenido resultados significativos excepto con la edad, por ello solo se describe este análisis.
Para todos los pacientes incluidos en el estudio se recogieron las siguientes variables: datos personales, antropométricos y clínicos. Estos datos se obtuvieron del programa de historia electrónica Selene-Siemens®, de la aplicación del laboratorio WebLab®, del programa Oncogest® utilizado en el Servicio de Farmacia para la dispensación de citostáticos y de los protocolos quimioterápicos personalizados usados en Hospital de Día.
Para el procesamiento de datos y el análisis estadístico se utilizó el programa SPSS® versión 21. Las características clínicas y demográficas de los pacientes se resumieron por medio de estadística descriptiva utilizando tablas de frecuencia para las variables categóricas y la media y desviación estándar para las variables continuas.
Para valorar el perfil de toxicidad de ambos dobletes de platino se empleó la prueba de chi-cuadrado o en su defecto, la prueba exacta de Fisher. Un valor de p<0,05 fue considerado estadísticamente significativo. Se describió mediante un diagrama de flujo el tamaño muestral del estudio y el número de abandonos junto con el correspondiente motivo.
Los acontecimientos adversos recogidos van a ser notificados al centro de Farmacovigilancia de la comunidad autónoma.
El tratamiento de los datos se realizó conforme a lo dispuesto en la Ley Orgánica 15/1999 de Protección de Datos de Carácter Personal y en el artículo 16.3 de la Ley 41/2002 de autonomía del paciente básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica. Se respetaron los principios éticos para la investigación médica en seres humanos promulgados en la Declaración de Helsinki. El protocolo del estudio recibió la aprobación por parte del Comité Ético de Investigación Clínica.
RESULTADOS
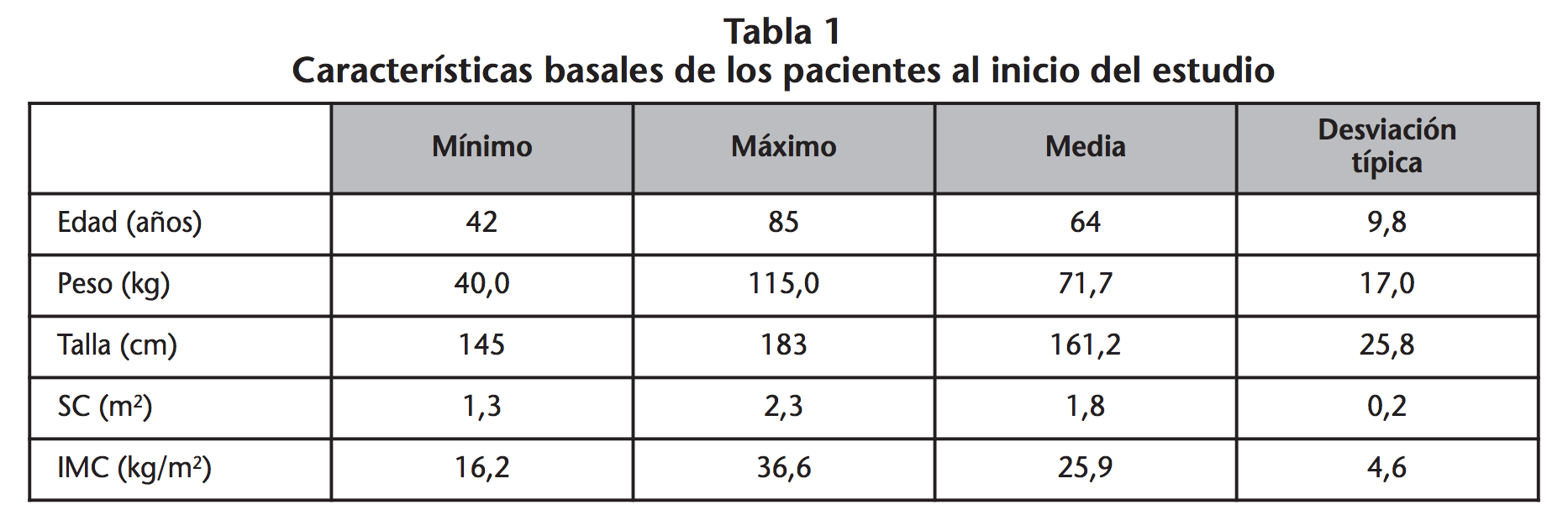
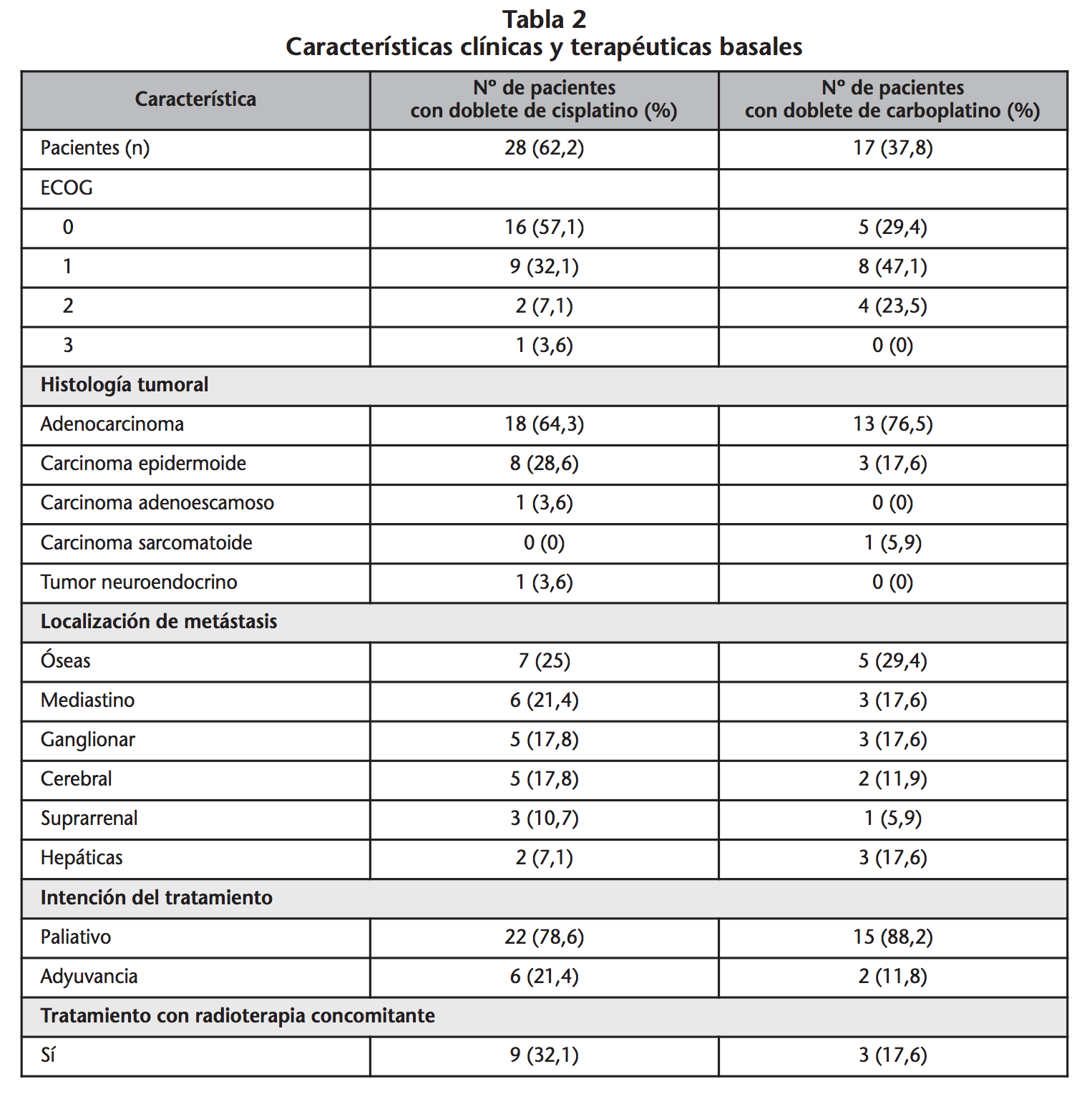
Durante el período de estudio se incluyeron 45 pacientes con CPNM en estadio avanzado que iniciaron tratamiento de primera línea con un doblete de platino. En cuanto a los pacientes estudiados, 32 (71,1%) fueron hombres. En la tabla 1 se muestran las características basales de los pacientes al inicio del estudio. De los pacientes estudiados, 17 (37,8%) fueron tratados con dobletes de carboplatino mientras que 28 (62,2%) recibieron dobletes de cisplatino. Las características clínicas y terapéuticas basales se muestran en la tabla 2.
Se estudiaron los efectos adversos producidos durante la administración de 4 ciclos de quimioterapia cada tres semanas. La toxicidad producida en el primer ciclo se estudió en los 45 pacientes. Durante dos ciclos se pudieron estudiar a 41 pacientes, durante tres ciclos a 32 pacientes. Únicamente pudieron terminar el estudio 26 pacientes. Hubo diferentes motivos de abandono del tratamiento (Figura 1).
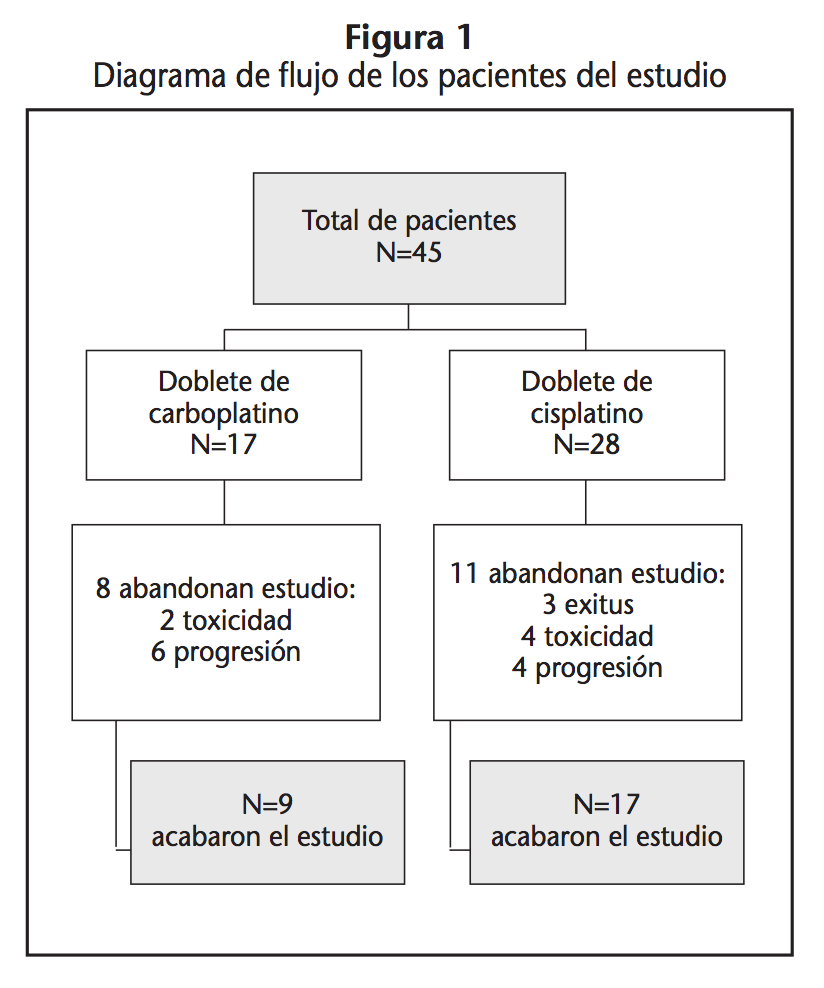
Durante el tratamiento sufrieron modificaciones de algún tipo 24 pacientes (53,3%). Dentro de éstas el 20% fueron retrasos en el día de administración del ciclo, el 26,6% fueron reducción de dosis de tratamiento y el 53,4% restante debido a suspensión de algún ciclo del tratamiento quimioterápico. Además 3 (6,7%) pacientes fallecieron durante el tratamiento.
En cuanto a los AA, casi todos los pacientes del estudio presentaron alguno. De los 17 pacientes tratados con algún doblete de carboplatino 15 (88,2%) sufrieron algún tipo de AA y de los 28 pacientes tratados con doblete de cisplatino 25 (89,3%) sufrieron algún AA. El número de AA recogidos fue de 196, 113 (57,6%) en pacientes con doblete de cisplatino y 83 (42,4%) en pacientes con doblete de carboplatino.
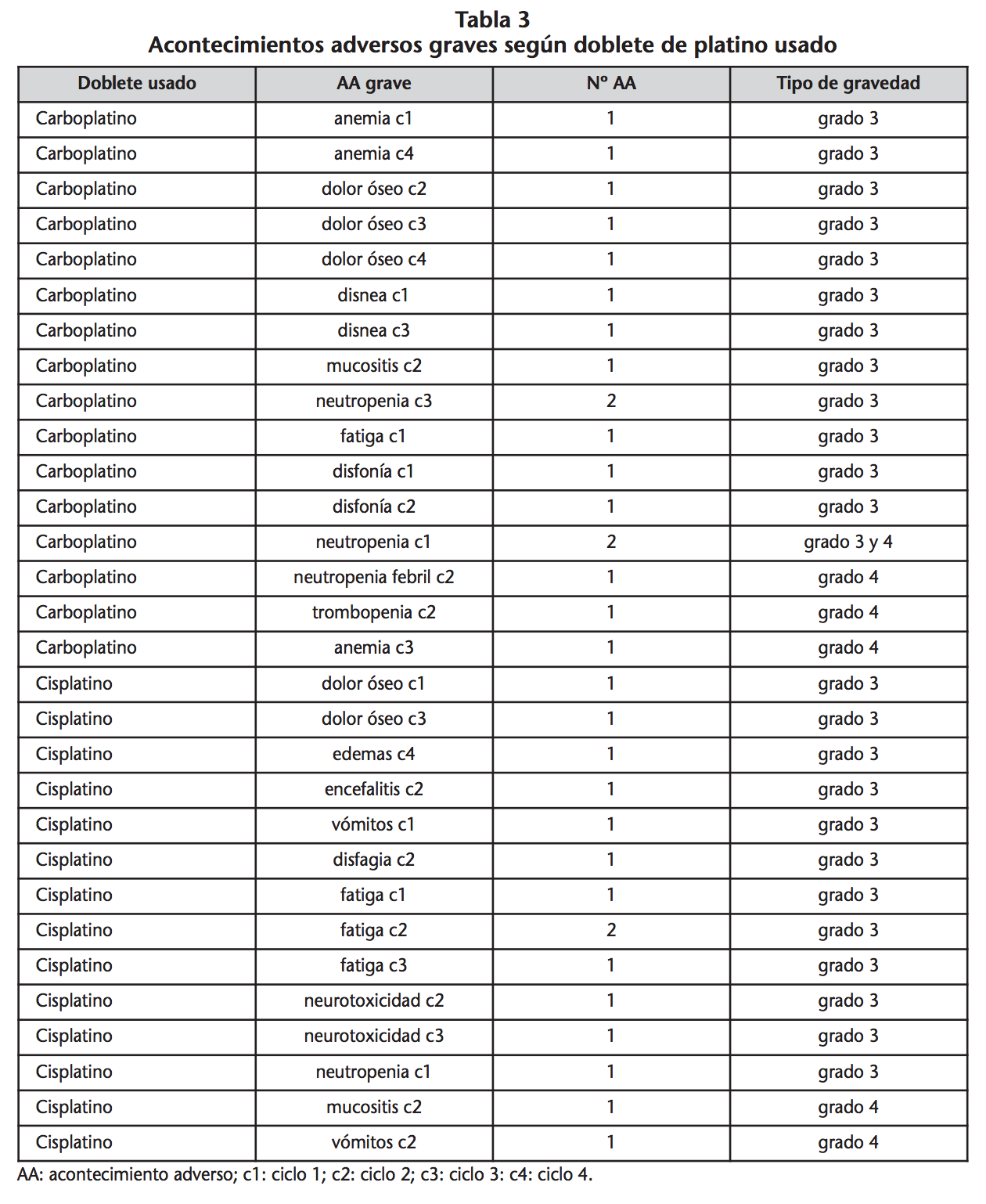
De todos ellos, se dieron 33 AA graves (16,83%) (entendiendo como AA grave aquellos clasificados según el sistema de clasificación NCI CTCAE v 4.03 con grado ≥3). 8 (47,1%) pacientes tratados con doblete de carboplatino y 7 (25%) con dobletes de cisplatino desarrollaron algún AA grave. Por lo tanto el 33,3% (15) de los pacientes del estudio sufrieron algún AA grave.
Los AA más graves, de grado 4, encontrados en el estudio fueron 6. Con dobletes de cisplatino fueron mucositis y vómitos mientras que con los dobletes de carboplatino fueron anemia, trombopenia, neutropenia y neutropenia febril (Tabla 3).
Los AA más frecuentes fueron: anemia 50 episodios (25,5%), astenia 27 (13,7%), disnea 27 (13,7%), dolor óseo 11 (5,6%), trombopenia 11 (5,6%), neutropenia 11 (5,6%) y náuseas 10 (5,1%).
Se obtuvo un perfil de toxicidad (número de AA por ciclo) por paciente estudiado en función del doblete de platino empleado. Se puede observar que los pacientes tratados con doblete de carboplatino presentaron mayor anemia en el ciclo 4 con un resultado estadísticamente significativo (p=0,022). También presentaron mayor trombopenia en el ciclo 1 (p=0,05).
Además los regímenes basados en cisplatino produjeron mayor número de AA de náuseas, vómitos y diarreas en todos los ciclos del tratamiento y también mayor neurotoxicidad no siendo estas diferencias estadísticamente significativas.
El número de pacientes que presentaron AA no fue igual en todos los esquemas quimioterápicos, depende del doblete de platino usado (Tabla 4).
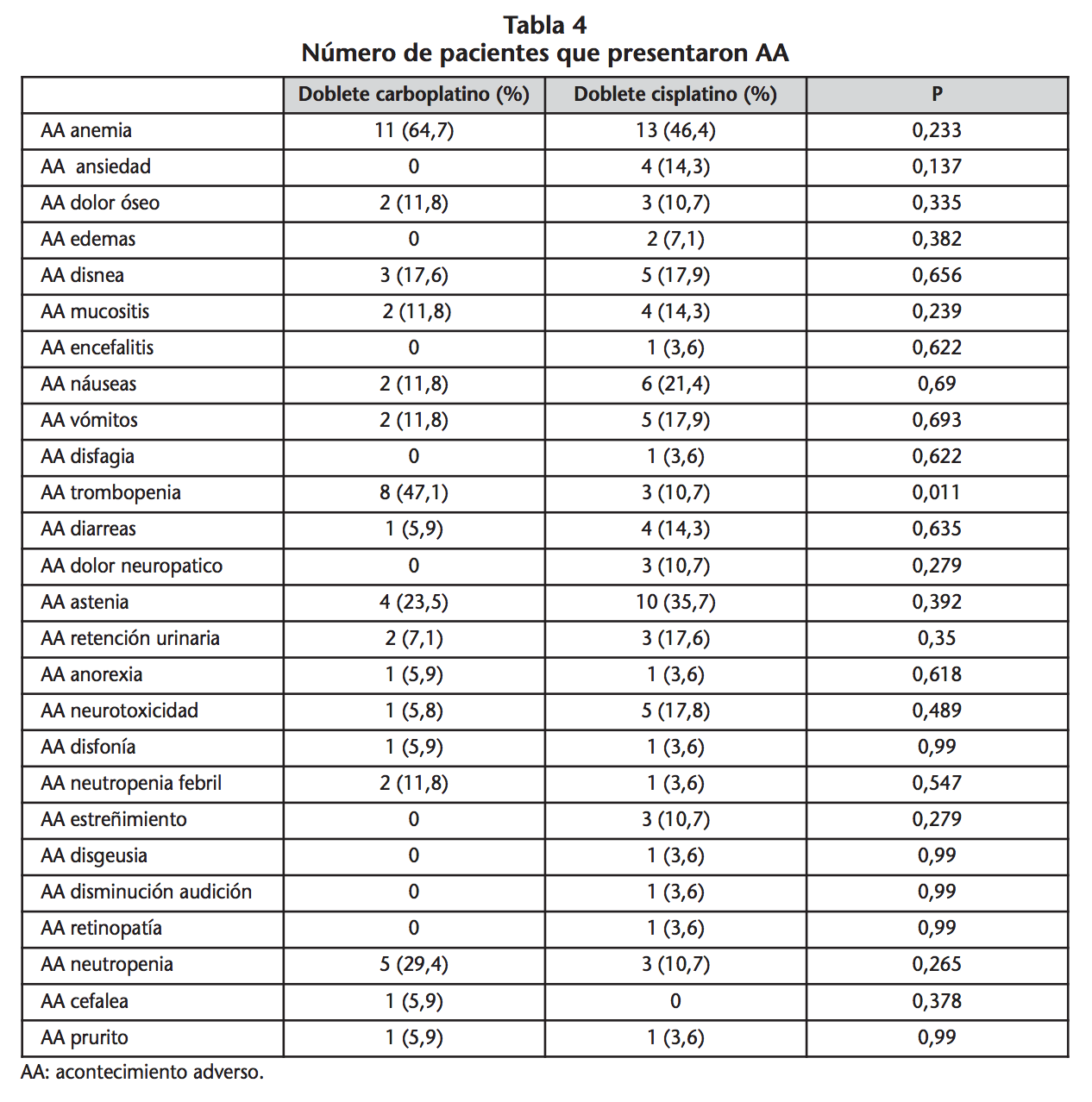
Destacar que ocho pacientes tratados con doblete de carboplatino presentaron trombopenia frente a tres pacientes tratados con doblete de cisplatino siendo esta diferencia estadísticamente significativa (p=0,011).
En cuanto al momento de manifestación de la toxicidad: el 16,13% de los AA se produjeron a las horas/días tras la quimioterapia (toxicidad inmediata), el 63,77% de los AA se produjeron a los días/semanas (toxicidad precoz) y el 20,10% restante a las semanas/meses (toxicidad retardada).
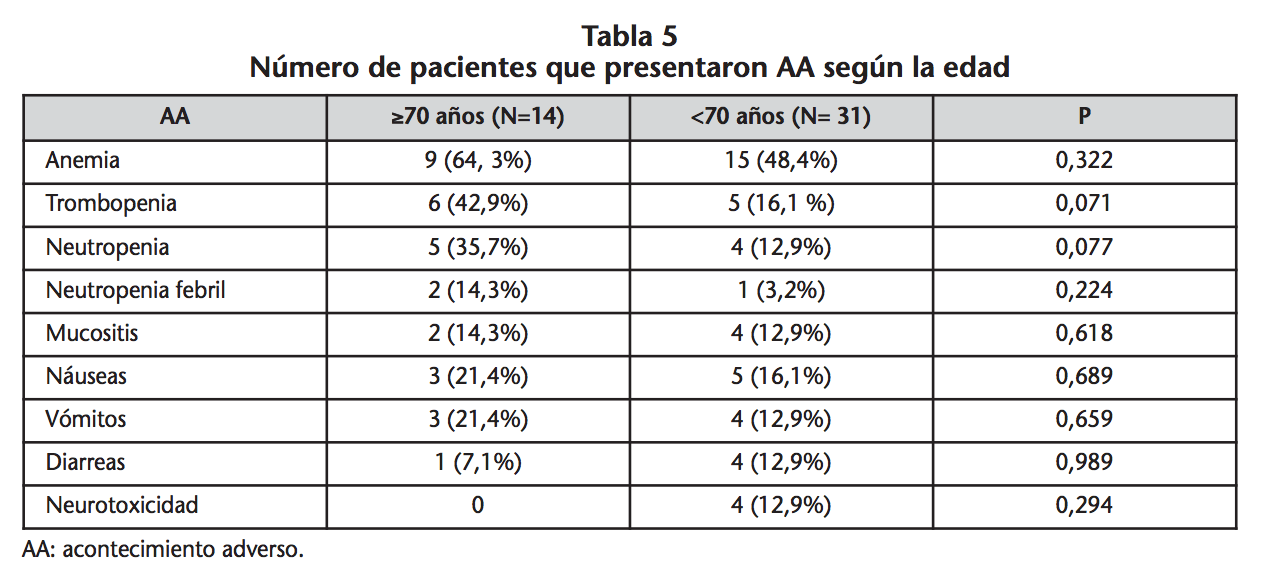
Se realizó un análisis por subgrupos y se valoró la toxicidad más frecuente en el estudio en aquellos pacientes ≥ de 70 años (n=14) o < de 70 años (n=31). De estos 14 pacientes mayores de 70 años, 10 recibieron tratamiento con doblete de carboplatino. Con respecto a la edad de los pacientes y la toxicidad de los AA más destacables, se pueden observar los siguientes resultados (Tabla 5).
DISCUSIÓN
El predominio de varones incluidos en el estudio está en concordancia con la mayor incidencia de CPNM descrita en este sexo2. El tratamiento inicial de los pacientes con CPNM avanzado es paliativo y tanto el carboplatino como el cisplatino pueden ser opciones de tratamiento. Tienen un efecto similar sobre la supervivencia pero un perfil diferente de toxicidad. Por lo tanto la elección del compuesto con platino debe tener en cuenta el perfil esperado de toxicidad y las comorbilidades del paciente.
El estándar actual para el tratamiento de primera línea en pacientes con CPNM inoperable consiste en dobletes de platino con agentes de tercera generación7 (gemcitabina, paclitaxel, vinorelbina, docetaxel, etoposido, pemetrexed), éste último especialmente en pacientes con histología no escamosa16,17.
Como se esperaba en base a la literatura y de la experiencia clínica el perfil de toxicidad de los dos agentes de platino fue diferente18. Terapias basadas en cisplatino fueron asociadas con mayor toxicidad no hematológica y terapias con carboplatino asociadas con mayor mielosupresión como trombopenia y neutropenia. Al igual que en el estudio de Luo J. de 201119 en el cual se estudiaron 1.014 pacientes tratados con CPNM en estadio IIIB y IV, los pacientes del grupo con carboplatino tenían más probabilidades de experimentar trombocitopenia mientras que la quimioterapia basada en cisplatino en el estudio se asoció con más náuseas y vómitos.
Nuestros resultados coinciden con los del metaanálisis CISCA en el que la quimioterapia basada en cisplatino fue asociada con más náuseas, vómitos y nefrotoxicidad, similarmente a Santana-Dávila et al. mientras que no hubo diferencias en la neutropenia20-22.
Casi todos los pacientes del estudio presentaron algún acontecimiento adverso, el número fue mayor en aquellos pacientes tratados con doblete de cisplatino. Este dato coincide con el estudio de Santana-Dávila de 201422 realizado en pacientes que recibieron quimioterapia basada en cisplatino o en carboplatino en el que se concluye que los pacientes tratados con cisplatino tienen mayor morbimortalidad, complicaciones y sufren mayor tasa de hospitalización. En nuestro estudio al igual que en el de Ohe Y. et al. de 200623 todas las toxicidades fueron bien toleradas, la mayoría de grado bajo. En nuestro estudio solo 6 AA fueron de grado 4.
En relación a las reacciones de hipersensibilidad, en nuestro trabajo no se ha encontrado ninguna reacción con ningún doblete de platino. Este dato coincide con la literatura científica en el que las reacciones se han descrito a partir de los seis ciclos de tratamiento y con incidencia baja24. En este estudio los pacientes recibieron cuatro ciclos de tratamiento.
En relación a la histología tumoral, el adenocarcinoma fue el más observado en nuestro estudio (en el 68,9% de los pacientes), coincidiendo así con el tipo histológico más frecuentemente descrito en la bibliografía.
Más del 50% de los pacientes con cáncer de pulmón no microcítico avanzado son diagnosticados en mayores de 70 años de edad. La mortalidad en pacientes más jóvenes está disminuyendo y sigue aumentando entre los ancianos25. La edad media de los pacientes de este estudio es 64±9,8 años y el número de pacientes incluidos mayores de 70 años son 14 (31,1%).
En un estudio retrospectivo26 realizado en 62 pacientes mayores de 70 años con CPNM tratados con dobletes de platino la toxicidad fue moderada, neutropenia de grado 3 y 4 fue el efecto adverso más frecuentemente observado. En el análisis por subgrupos realizado en este estudio, no se mostró ningún resultado estadísticamente significativo a pesar del mayor porcentaje de toxicidad en pacientes con edad ≥ a 70 años.
Es importante realizar estudios de seguridad de cada fármaco quimioterápico para conocer el perfil de toxicidad, ya que muchos de estos efectos secundarios pueden ser predecibles y controlables. Además la mayoría de los pacientes son premedicados o postmedicados para controlar estos efectos y tratarlos precozmente. En este estudio la mayoría de los AA observados no son graves pero pueden mermar la calidad de vida del paciente.
Una de las limitaciones del estudio es que sólo el 57,7% de los pacientes pudieron recibir los 4 ciclos de tratamiento recomendados ya que la administración de más ciclos no está relacionada con mayor supervivencia pero sí con mayor toxicidad11. Por lo tanto, el tamaño muestral fue bajo con la dificultad de obtener resultados estadísticamente significativos.
Otra limitación es que se han comparado diferentes dobletes de platino, por ello al analizar y comparar la toxicidad no podemos asegurar que se deba a cisplatino o a carboplatino puesto que todos van acompañados de otra molécula diferente. También la recogida de datos de acontecimientos adversos se tuvo que limitar exclusivamente a la valoración en la consulta del oncólogo después de cada ciclo de tratamiento por lo que no recogieron aquellos AA olvidados de describir por los pacientes.
CONCLUSIONES
Los dobletes de platino manejados en primera línea pueden causar una amplia gama de reacciones adversas. La mayoría de los pacientes presentaron durante el estudio algún AA, pero la gravedad e incidencia de los mismos no fue superior a la descrita en bibliografía.
A pesar de pertenecer al mismo grupo terapéutico presentan ciertas características diferenciales y diferente seguridad. Es importante conocer el tipo de toxicidad asociada a cada fármaco para así poder elegir el tratamiento más adecuado. Los pacientes en tratamiento con cisplatino presentaron mayores alteraciones gastrointestinales, neurotoxicidad y astenia y los tratados con carboplatino tuvieron mayor trombopenia y neutropenia. Se ha observado que cisplatino se prescribe con más frecuencia a los pacientes más jóvenes y con mejor estado funcional mientras que carboplatino a personas de edad más avanzada.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Bibliografía
1. Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in Globocan 2012. Int J Cancer. 2015;136(5):E359-86.
2. Álvarez FV, Trueba IM, Sanchis JB, López-Rodó LM, Rodríguez SP, de Cos EJ, et al. Recommendations of the Spanish Society of Pneumology and Thoracic Surgery on the diagnosis and treatment of non-small-cell lung cancer. Arch Bronconeumol. 2016;52:2.
3. Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of genetic, clinical and radiologic advances since the 2004 classification. J Thorac Oncol. 2015; 10:1243-60.
4. Gomez Herrero D, Albert Mari A, Merino Sanjuan M, Boquera Ferrer ML, Victor Jimenez Torres N. Toxicity profile and adherence to the pharmacotherapeutic regimen of gemcitabine-carboplatin in non-small cell lung cancer. Farm Hosp. [Internet]. 2011;35(6):298-304.
5. Novello S, Barlesi F, Califano R, Cufer T, Ekman S, Levra MG, et al. Metastatic non-small-cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2016;27(suppl 5):v1-v27.
6. Esteban E, Villanueva N, Fernandez Y, Luque MA, Jimenez P, Jimenez A. Quimioterapia y nuevos fármacos en el carcinoma avanzado de pulmón de células no pequeñas. Gamo. 2005;4(2):29-33.
7. Des Guetz G, Uzzan B, Nicolas P, Valeyre D, Sebbane G, Morere J-F. Comparison of the efficacy and safety of single-agent and doublet chemotherapy in advanced non-small cell lung cancer in the elderly: A meta-analysis. Crit Rev Oncol Hematol. Diciembre de 2012;84(3):340-49.
8. Smit E, Moro-Sibilot D, de Castro Carpeño J, Lesniewski-Kmak K, Aerts J, Villatoro R, et al. Cisplatin and carboplatin-based chemotherapy in the first-line treatment of non-small cell lung cancer: Analysis from the European FRAME study. Lung Cancer. 2016;92:35-40.
9. Hotta K, Matsuo K, Ueoka H, Kiura K, Tabata M, Tanimoto M. Meta-analysis of randomized clinical trials comparing cisplatin to carboplatin in patients with advanced non-small-cell lung. J Clin Oncol. 2004 Oct 1;22(19):3852-9.
10. De Castria TB, da Silva EMK, Gois AFT, Riera R. Cisplatin versus carboplatin in combination with third-generation drugs for advanced non-small cell lung cancer. Cochrane Database Systematic Reviews. 16 de agosto de 2013;(8):CD009256.
11. Rossi A, Chiodini P, Sun J-M, O Brien MER, von Plessen C, Barata F, et al. Six fewer planned cycles of first-line platinum based chemotherapy for non-small-cell lung cancer: a systematic review and meta- analysis of individual patient data. Lancet Oncol. Octubre de 2014; 15(11):1254-62.
12. Ho GY, Woodward N, Coward JIG. Cisplatin versus carboplatin: comparative review of therapeutic management in solid malignancies. Crit Rev Oncol Hematol. Junio de 2016;102:37-46.
13. Trojan A, Burnand B, Giannelli M. Efficacy and side effects of cisplatin- and carboplatin-based doublet chemotherapeutic regimens versus non-platinum-based doublet chemotherapeutic regimens as first line treatment of metastatic non-small cell lung carcinoma: a systematic review of randomized controlled trials. Lung Cancer. 2008;59(1):1-11.
14. Rossi A, Di Maio M, Chiodini P, Rudd RM, Okamoto H, Skarlos DV, et al. Carboplatin- or cisplatin-based chemotherapy in first-line treatment of small-cell lung cancer: The COCIS meta-analysis of individual patient data. J Clin Oncol. 2012;30(14):1692-98.
15. National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE). Department of health and human services; 2010 (v4.03)
16. Lu S, Cheng Y, Zhou C, Wang J, Yang JC-H, Zhang P, et al. Meta-Analysis of First-Line Pemetrexed Plus Platinum Treatment in Compared to Other Platinum-Based Doublet Regimens in Elderly East Asian Patients With Advanced Nonsquamous Non-Small-Cell Lung Cancer. Clin Lung Cancer. 1 de septiembre de 2016;17(5):e103-12.
17. NCCN Clinical Practice Guidelines in Oncology. Non-samll cell lung cancer. Version 3. 2017 http://www. nccn.com (accessed Dec, 2016).
18. Azzoli C G, Temin S. & Giaccone G. 2011 Focused update of 2009 American Society of Clinical Oncology Clinical Practice guideline update on chemotherapy for stage IV non-small-cell lung cancer. J Oncol Pract. 2012;8:63-66.
19. Luo J, Leaw SJ, Xu Y, Zheng D. Comparison of cisplatin- and carboplatin-based third-generation chemotherapy in 1,014 Chinese patients with advanced non-small-cell lung cancer. Med Oncol Northwood Lond Engl. Diciembre de 2011;28(4):1418-24.
20. Ardizzoni A, Boni L, Tiseo M, et al.; CISCA (CISplatin versus CArboplatin) Meta-analysis Group. Cisplatin versus carboplatin based chemotherapy in first-line treatment of advanced non-small-cell lung cancer: an individual patient data meta-analysis. J Natl Cancer Inst. 2007;99:847-57.
21. Tiseo M, Ardizzoni A, Boni L. First- Line Chemotherapy Treatment of Advanced Non-Small-Cell Lung Cancer: Does Cisplatin versus Carboplatin make a difference? J Thorac Oncol. Noviembre de 2014;9(11):e82.
22. Santana-Davila R, Szabo A, Arce-Lara C, Williams CD, Kelley MJ, Whittle J. Cisplatin versus Carboplatin-Based Regimens for the Treatment of Patients with Metastatic Lung Cancer. An Analysis of Veterans Health Administration Data. J Thorac Oncol. 1 de mayo de 2014;9(5):702-9.
23. Ohe Y, Ohashi Y, Kubota K, Tamura T, Nakagawa K, Negoro S, et al. Randomized phase III study of cisplatin plus irinotecan versus carboplatin plus paclitaxel, cisplatin plus gemcitabine, and cisplatin plus vinorelbine for advanced non-small-cell lung cáncer: Four- Arm Cooperative Study in Japan. Ann Oncol. 20 de Noviembre de 2006;18(2):317-23.
24. Cortijo-Cascajares S, Jiménez-Cerezo MJ, Herreros de Tejada A. Revisión de las reacciones de hipersensibilidad a antineoplásicos. Farm Hosp. 2012;36(3):148-58.
25. Pallis AG, Gridelli C, Wedding U, Faivre-Finn C, Veronesi G, Jaklitsch M, et al. Management of elderly patients with NSCLC; updated expert’s opinion paper: EORTC Elderly Task Force, Lung Cancer Group and International Society for Geriatric Oncology. Ann Oncol. 1 de julio de 2014;25(7):1270-83.
26. Piacentini P, Greco F, Mercanti A, Trolese AR, Durante E, Moratello G, et al. Platinum doublets as first-line treatment for elderly patients with advanced non-small cell lung cancer. Tumori. Diciembre de 2013;99(6):650-55.
____
Descargar artículo en PDF: Toxicidad de los dobletes de platinos en el cáncer de pulmón no microcítico avanzado
