Velasco Costa J, Ramírez Roig C, Olmos Jiménez R, Díaz Carrasco MS
Hospital Clínico Universitario Virgen de la Arrixaca. Murcia (España)
____
Rev. OFIL 2016, 26;4:287-293
Fecha de recepción: 15/03/2016 – Fecha de aceptación: 28/05/2016
____
Correspondencia:
Javier Velasco Costa
Hospital Clínico Universitario Virgen de la Arrixaca
Ctra. Madrid-Cartagena, s/n
30120 El Palmar – Murcia
Correo electrónico: doctorvelasco@hotmail.com
____
Resumen
Objetivo: Aunque la adición de cetuximab a radioterapia aumenta la supervivencia, se ha descrito potenciación de toxicidad respecto a radioterapia sola. Los objetivos de este estudio fueron: describir la toxicidad de cetuximab asociado a radioterapia en pacientes con carcinoma epidermoide de cabeza y cuello no metastásico, valorar eficacia y describir factores que influyan en la supervivencia.
Método: Estudio observacional, retrospectivo, de valoración de toxicidad y efectividad de cetuximab asociado a radioterapia en pacientes con cáncer escamoso de cabeza y cuello no metastásico no tributarios a tratamiento con cisplatino por su estado general (ECOG y comorbilidades), entre 2009 y 2015, en un hospital de tercer nivel. Se registraron variables relacionadas con: paciente, enfermedad, tratamiento, toxicidad y efectividad.
Resultados: Se incluyeron 30 pacientes (25 hombres y 5 mujeres) con mediana de edad de 68,5 años, media de 3,6 comorbilidades, estadío IVa predominante e índices medios de Charlson y WUHNCI de 2,8 y 2,0, respectivamente. Recibieron una mediana de 7 ciclos, siendo las toxicidades de grado 3 más frecuentes: linfocitopenia, toxicidad cutánea (radiodermitis y rash acneiforme), oromucositis, astenia y disfagia. Las medianas del intervalo libre de progresión y de supervivencia global (SG) fueron de 14,8 y 19,3 meses, respectivamente; observándose influencia estadísticamente significativa en la SG por parte de las variables: número de ciclos, tipo de respuesta, estadío tumoral y aparición de toxicidad cutánea (rash y radiodermitis).
Conclusión: Los resultados sugieren que en estos pacientes el tratamiento con cetuximab asociado a radioterapia ofrece una respuesta satisfactoria con una toxicidad secundaria aceptable.
Palabras clave: Cetuximab, toxicidad, cáncer de cabeza y cuello.
____
Aportación a la literatura científica
En este trabajo se ha estudiado la toxicidad de cetuximab asociado a radioterapia en pacientes con carcinoma epidermoide de cabeza y cuello no metastásico en el ámbito de la práctica clínica asistencial, valorando la eficacia de esta estrategia terapéutica y describiendo los posibles factores que influyen en la supervivencia, tales como el número de comorbilidades, mediante un enfoque que, aunque es hasta cierto modo habitual en la literatura internacional sobre el tema, se ha utilizado escasamente en nuestro medio. El papel del fármaco aún no está bien establecido respecto al uso de quimioterapia, y al hecho por el que se ha descrito potenciación de toxicidad respecto a la radioterapia sola sobre todo en cuanto a erupción acneiforme y dermatitis grave por radiación.
Introducción
Más del 90% de los cánceres de cabeza y cuello son de la histología de células escamosas y se originan en el labio/cavidad oral, nasofaringe, orofaringe, hipofaringe y la laringe. El cáncer de cabeza y cuello es el sexto cáncer más común en todo el mundo y ha habido un considerable aumento de la incidencia global de carcinoma de células escamosas de cabeza y cuello (CECC) en la última década. En la actualidad, más de 650.000 nuevos casos de CECC se diagnostican cada año en todo el mundo. Sólo en Europa, se estima que hay aproximadamente 143.000 nuevos casos y más de 68.000 muertes debido a la enfermedad cada año1. Se presenta significativamente más en hombres que en mujeres, con una relación que oscila de 2:1 a 4:1. La tasa de incidencia en hombres supera el 20 por 100.000 en las regiones de Francia, Hong Kong, el subcontinente indio, el centro y el este de Europa, España, Italia, Brasil y entre los afro-americanos en los Estados Unidos. Los cánceres de boca y lengua son más comunes en el subcontinente indio, el cáncer nasofaríngeo es más común en Hong Kong, y el de faringe y/o laringe son más comunes en otras poblaciones2.
En total, el 85% de los CECC están relacionados con el consumo de tabaco. El consumo de alcohol frecuente y abundante también aumenta el riesgo de CECC, y esto es particularmente cierto cuando se combina tabaco y alcohol juntos1. Se puede resumir que los factores de riesgo más frecuentemente asociados con el cáncer de cabeza y cuello son el tabaquismo, el consumo de alcohol, la infección por VPH (especialmente para los cánceres de orofaringe) y la infección por el EBV (los cánceres nasofaríngeos en Asia)2.
La elección de la quimioterapia debe ser individualizada según las características del paciente (estado general, objetivos de la terapia). El tratamiento estándar para pacientes con enfermedad localmente avanzada sigue siendo cisplatino (nivel de evidencia 1) y radioterapia (RT) simultánea3,4. También puede ser utilizada la quimioterapia de inducción basada en cisplatino, aunque la inducción no ha demostrado mejora en la supervivencia global. Pero algunos pacientes con comorbilidades y mal estado general no toleran la quimioterapia con cisplatino, y son estos casos los que se pueden beneficiar de la terapia sistémica primaria con cetuximab (nivel de evidencia 1) + RT concurrente5.
Las ventajas clave de la integración de la quimioterapia con la radioterapia son:
– La quimioterapia de inducción antes de la RT puede reducir el volumen del tumor y mejorar la función antes de la quimiorradioterapia concurrente y podría tratar la enfermedad metastásica subclínica a distancia sin demora.
– La administración de la quimioterapia concurrente con RT pueden sensibilizar células tumorales a los efectos de la radiación, y así superar la resistencia a la radiación. La reducción de repoblación entre fracciones de tratamiento por radiación también puede contribuir a los beneficios de la quimioterapia concurrente.
Sin embargo, la adición de quimioterapia a RT puede estar asociada con aumento de la toxicidad, lo que puede limitar el cumplimiento del paciente y retrasar o prevenir la finalización de la terapia local definitiva. Además, el uso de la quimioterapia de inducción, ya sea sola o seguida de quimiorradioterapia concurrente, puede inducir a resistencia cruzada a posterior RT o quimiorradioterapia.
Así, se puede afirmar que en los pacientes diagnosticados de CECC no metastásico las causas de mortalidad se reparten entre la progresión neoplásica, la toxicidad de los tratamientos y otras causas intercurrentes. Mejorar el control de la enfermedad y disminuir la toxicidad ha sido el objetivo en el desarrollo de los tratamientos multimodales3,6-8. Por este motivo, las causas competitivas de mortalidad pueden aumentar. Además, la comorbilidad existente en el momento del diagnóstico es frecuente en los pacientes con CECC y está en relación con las causas competitivas de mortalidad.
Con la intención de evaluar la comorbilidad de un modo global y objetivo se han desarrollado varios índices relacionados con la supervivencia como son el Charlson Comorbidity Index (CCI)9 para la población general o el Washington University Head and Neck Comorbidity Index (WUHNCI)10 para los pacientes con cáncer de cabeza y cuello.
El cetuximab es un anticuerpo monoclonal quimérico IgG1 que se une con alta afinidad al EGFR compitiendo con el ligando endógeno. Los estudios preclínicos con este fármaco demostraron que es capaz de producir una detención del ciclo celular en G1 y aumentar la radiosensibilidad11. En el carcinoma localmente avanzado parece tener una eficacia igual o similar a la de la quimioirradiación con cisplatino12.
Se ha demostrado que la pauta más adecuada es administrar una primera dosis de cetuximab de 400 mg/m2 seguida de 250 mg/m2 semanal y que este tratamiento no solo es muy bien tolerado sino que ofrece una elevada tasa de respuestas objetivas13; mostrando claramente superioridad la combinación con RT frente a RT sola tanto a 3 como a 5 años. Además, para los pacientes tratados con cetuximab, la supervivencia global fue significativamente mejor en aquellos que experimentaron una erupción acneiforme de al menos grado 2 en comparación con los que no sufrieron ningún sarpullido o presentaron erupción cutánea de grado 1. Como era de esperar, la erupción acneiforme se produjo en 87% de los pacientes tratados con la combinación14. Así, en el ensayo de Bonnery cols. (2006) se conseguían resultados de supervivencia muy superiores a las alternativas (ver Tabla 1).
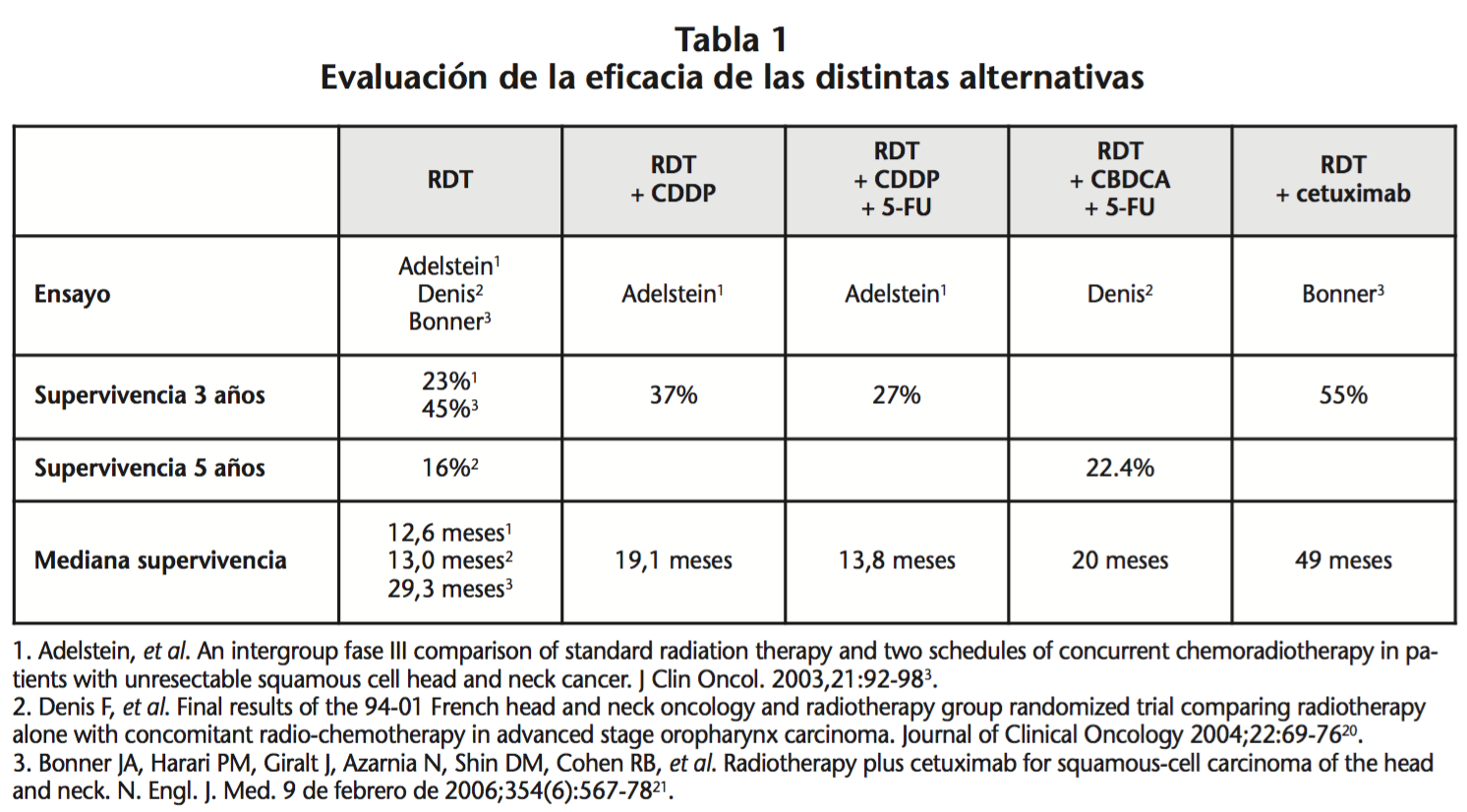
Posteriormente se ha informado de un gran número de casos de dermatitis grave por radiación como necrosis de la piel y algunos autores han observado incluso un aumento de diez veces la dermatitis de grado 3 o 4 con esta combinación en comparación con la radioterapia sola (27-39).
En este contexto de un fármaco cuyo papel no está totalmente establecido en pacientes con numerosas comorbilidades y con el que se ha descrito toxicidad significativa respecto a la RT sola, se plantea el presente estudio, que tiene como objetivos:
1. Describir la toxicidad asociada a cetuximab, combinado con RT, en pacientes con cáncer de cabeza y cuello no metastásico, en el ámbito de la práctica clínica asistencial.
2. Valorar la efectividad de la estrategia terapéutica en estos pacientes.
3. Describir posibles factores que influyan en la supervivencia.
Métodos
Estudio observacional retrospectivo de valoración de toxicidad y efectividad en la utilización de cetuximab asociado a RT en el tratamiento del cáncer de cabeza y cuello no metastásico.
La población de estudio fueron pacientes diagnosticados de cáncer de cabeza y cuello no metastásico tratados con cetuximab asociado a RT, no subsidiarios de tratamiento con cisplatino por su estado general (ECOG y comorbilidades).El período de estudio fue de 2008 a 2014, en un Hospital Clínico Universitario de tercer nivel que realiza más de 20.000 preparaciones oncohematológicas anuales. Se recogieron los datos necesarios para el seguimiento clínico y farmacoterapéutico del programa informático Farhos Oncología y de las historias clínicas del hospital.
Las variables recogidas para el estudio fueron:
– Del paciente: variables antropométricas, sexo, edad, parámetros analíticos, hábitos de consumo de tabaco y alcohol, ECOG y comorbilidades según el Charlson Comorbidity Index (CCI)9 para población general o el Washington University Head and Neck Comorbidity Index (WUHNCI)10 para los pacientes con cáncer de cabeza y cuello.
– De la enfermedad: localización del tumor, estadío, histología, si es un tumor primario o una recaída.
– Del tratamiento: número de ciclos, retrasos en el tratamiento y motivo de éstos, técnica radioterápica usada y dosis.
– Toxicidad: se valoró de acuerdo con los criterios de toxicidad de la radioterapia elaborados por la RTOG (Radiation Therapy Oncology Group) y la EORTC (European Organization for Research and Treatment of Cancer) que son los más utilizados en la práctica clínica en Oncología Radioterápica15.
– Efectividad: tipo de respuesta según criterios RECIST16, supervivencia global y supervivencia libre de progresión o recaída.
Los datos obtenidos se codificaron en bases de datos y se utilizaron para su tratamiento estadístico los siguientes programas:
1. Paquete informático Microsoft Office: en concreto se utilizó Microsoft Excel® para la creación de la base de datos con los datos recopilados de cada individuo.
2. Programa estadístico SPSS 20.0 (SPSS Inc. Chicago, IL, USA): mediante este programa se realizó el análisis de las distintas variables continuas y cualitativas codificadas en la base de datos, para la obtención de conclusiones del estudio realizado.
El análisis descriptivo fue hecho con medidas de frecuencia, el intervalo libre de progresión y la supervivencia global por el método de Kaplan-Meier y los factores relacionados con éstas mediante análisis univariado (log Rank test) y multivariado (regresión de Cox).El coeficiente de correlación entre las escalas índice de Charlson y WUHNCI se calculó con el test de Spearman. El grado de significación de los tests se situó en p≤0,05.
Resultados
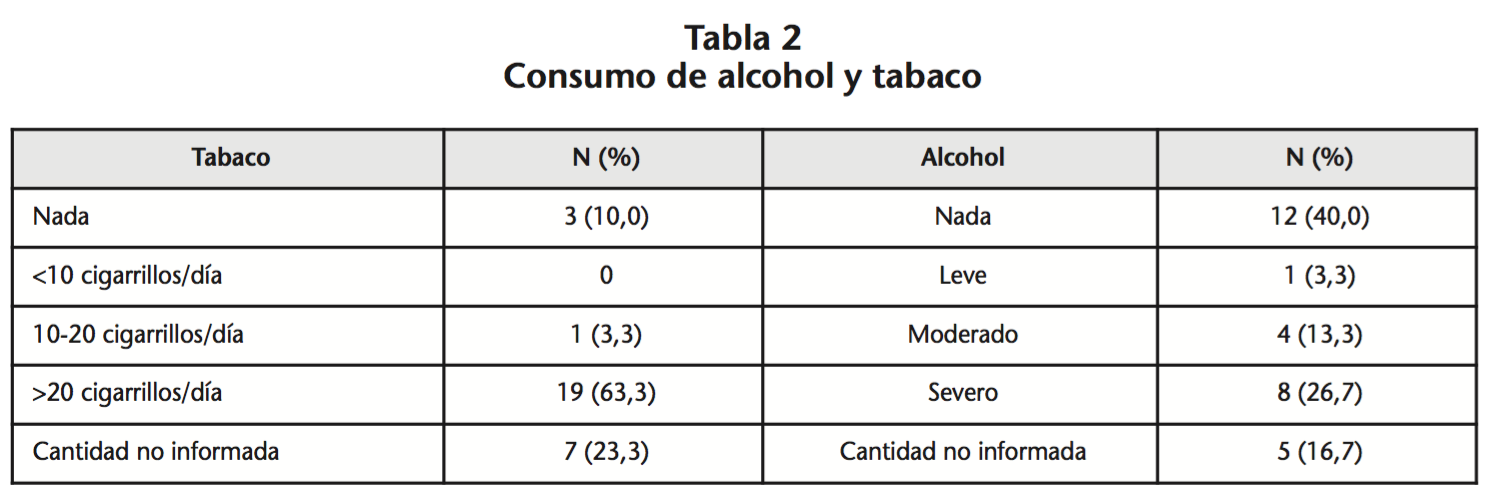
Durante el periodo de estudio, cumplieron los criterios de inclusión un total de 30 pacientes (25 hombres y 5 mujeres) con una mediana de edad de 68,5 años (rango 50-84). El 63,3% presentaba historia tabáquica de más de 20 cigarrillos/día y el 26,7% reconocieron ser bebedores severos (Tabla 2).
La mayoría presentaba cánceres moderadamente diferenciados y con estadío IVa (56,7%) al inicio del tratamiento. Respecto al estadío del tumor, el 53,3% eran T4 y el 40% presentaba un estadío ganglionar N0. Las localizaciones más frecuentes fueron la cavidad oral (30%), la laringe (30%) y la orofaringe (23,3%).
El número medio de comorbilidades que presentó la población de estudio fue de 3,6, con el 33,3% de los individuos con 5 o más comorbilidades. Entre las comorbilidades más frecuentes destacan la DM-II, HTA, DLP e insuficiencia cardíaca.
El valor medio para el índice de Charlson fue de 2,8 siendo en el 31% de individuos mayor o igual a 4. En cuanto al índice WUHNCI, el valor medio fue de 2,0 presentando el 30,8% de la población un índice mayor o igual a 3. El coeficiente de correlación Rho de Spearman entre ambos índices es de 0,76 (p<0,001), lo cual indica una alta correlación lineal entre ambos índices.
En cuanto al tratamiento radioterápico, se administró RT radical a dosis total ≥70 Gy (con fraccionamiento convencional de 1,8-2,0 Gy/sesión cinco veces por semana) al 88,5% de los pacientes, entre 60-69 Gy al 7,7% y <60 Gy al resto.
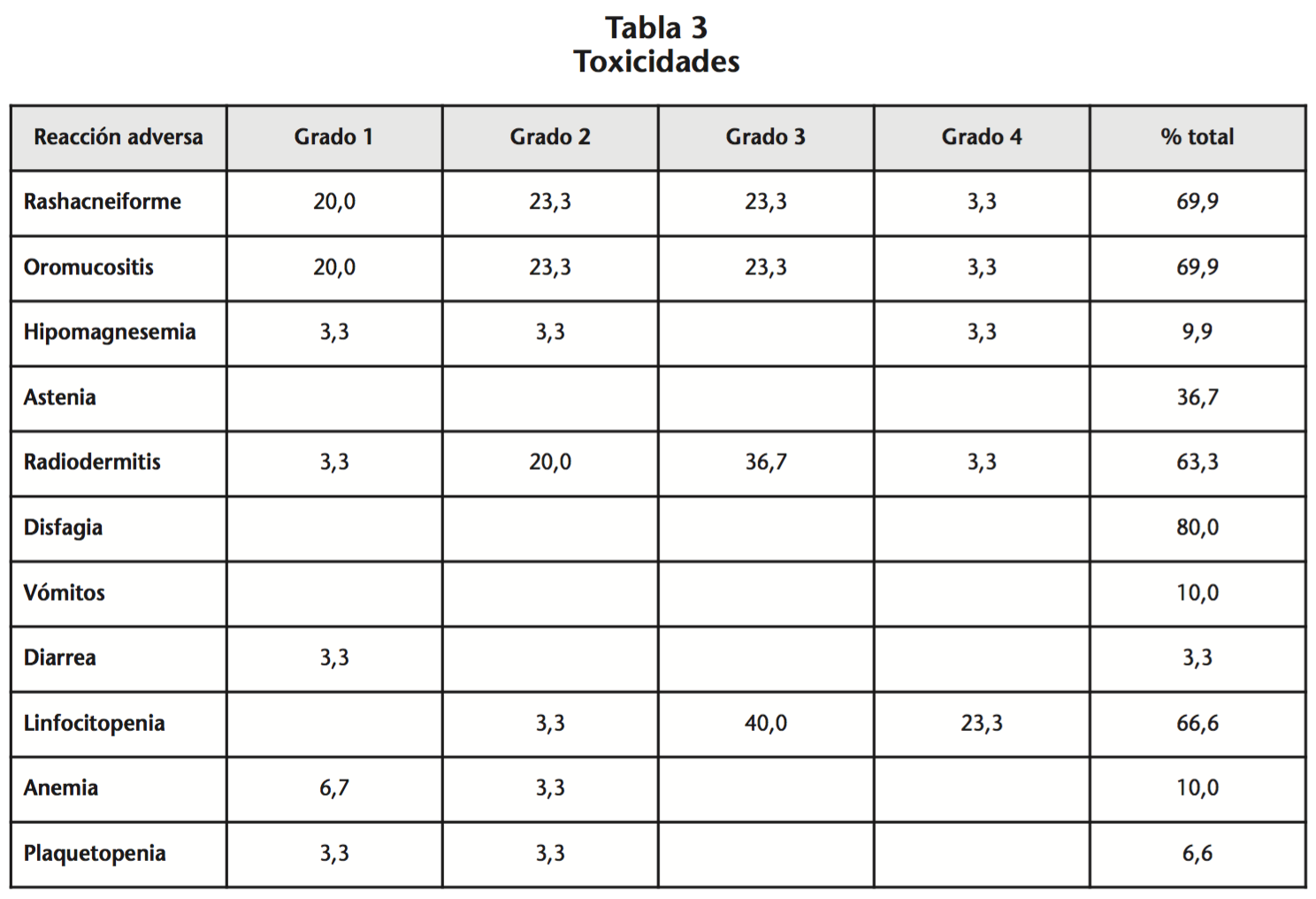
Los pacientes recibieron una mediana de 7 ciclos de cetuximab con aceptable tolerancia, siendo las toxicidades G3 más frecuentes la linfocitopenia (40,0%) y las toxicidades cutáneas, ya sea la radiodermitis (36,7%) o bien el rashacneiforme o la oromucositis (ambas con el 23,3%). El 36,7% de los individuos presentó astenia y el 80% disfagia (Tabla 3). Las toxicidades para las que no se describieron los grados aparecen solamente como porcentaje total.
En 8 de los casos (26,7%) fue necesario aplazar el tratamiento y 5 requirieron su suspensión (16,7%), siendo en la mayoría de los casos el motivo fundamental del aplazamiento o suspensión del tratamiento la toxicidad inaceptable.
En 18 pacientes se alcanzó una respuesta completa (60,0%) y en 8 una respuesta parcial/estabilización de la enfermedad (26,7%).
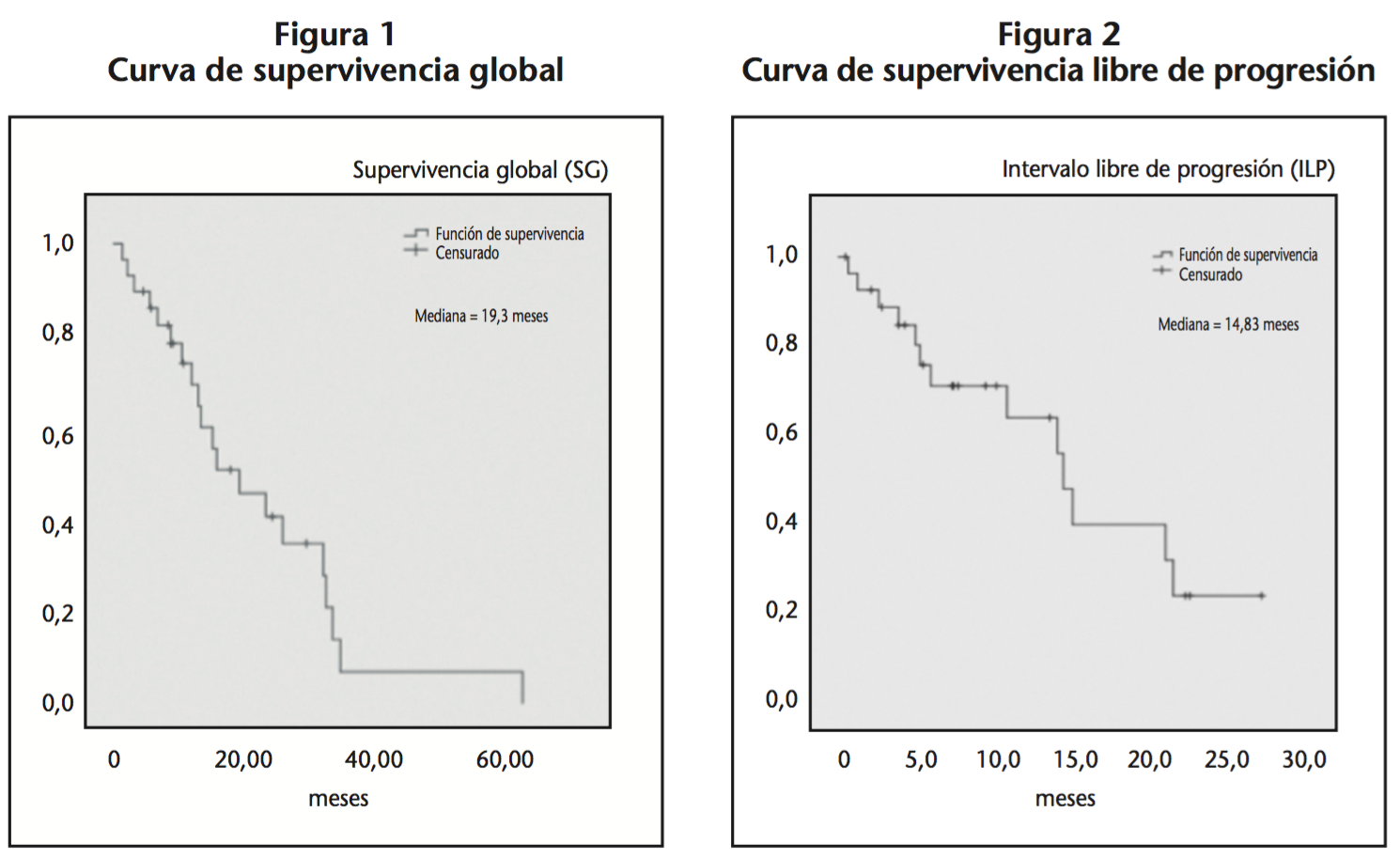
La mediana del intervalo libre de recaída o progresión (ILP) fue de 14,8 meses y la mediana de supervivencia global (SG) de 19,3 meses. Así, se obtuvieron las correspondientes curvas de supervivencia global y libre de progresión (Figuras 1 y 2, respectivamente).
No se encontraron diferencias estadísticamente significativas en la SG respecto al número de comorbilidades, valores medios de los índices de Charlson (IC) y WUHNCI, aplazamiento/suspensión, consumo de alcohol, tabaco, ECOG, grado de diferenciación tumoral, estadío ganglionar y localización. Sin embargo, sí se objetivó una influencia en la SG de las variables nº de ciclos (p=0,018), tipo de respuesta (p=0,001) y estadío tumoral (p=0,019), así como de la aparición de toxicidad cutánea en forma de rash (p=0,019) y radiodermitis (p=0,039). Para el ILP no se encontró influencia significativa de ninguna de las variables.
En el estudio multivariante de la SG ajustado por hábito tabáquico y enólico, índice de Charlson (dividido en menor o mayor/igual a 4 puntos) y estadío tumoral T (dividido en menor o igual a 4), se encontraron diferencias significativas en las variables estadío T (p=0,02; RR=6,5) e índice de Charlson (p=0,022; RR=6,9) cuando éste se categoriza dicotómicamente en pacientes con poca (IC <4) y con alta (IC ≥4) comorbilidad y, por tanto, probabilidad de muerte a un año.
Discusión
Los pacientes incluidos en este estudio fueron predominantemente hombres (25 de 30), lo cual está en consonancia con el hecho de que el CECC es más frecuente entre los hombres (relación que oscila de 2:1 a 4:1) como ya se comentó en la introducción. Esta relación también se refleja en estudios similares como el de Acevedo-Henao y cols. (31 de 36), Bonner y cols. (171 de 211), Denis y cols. (99 de 109), Selzer y cols. (38 de 50) o Cooper y cols. (177 de 206). La media de edad de nuestra muestra de pacientes fue de 68 años, lo cual es superior a la encontrada en estudios similares como el de Acevedo-Henao y cols. (59 años), Bonner y cols. (56 años), Cooper y cols. (56 años) o Selzer y cols. (63 años), pero similar a la encontrada en otros estudios como el de Pryor y cols. (68 años).
El 73,3% de nuestros sujetos presentó un estadío T3 o T4 al momento del diagnóstico, lo cual concuerda con los estudios de Acevedo-Henao y cols. (80%), Bonner y cols. (69%).
Respecto al estado general de los pacientes, en los estudios similares publicados se describe su estado general mediante el índice de Karnofsky, siendo éste normalmente mayor al 80%, como en el estudio llevado a cabo por Acevedo-Henao y cols. (100% de la muestra) o en el estudio de Bonner (90% de los pacientes). Nuestros pacientes presentaron una media de 3,6 comorbilidades, con medias de 2,8 y 2,0 para los índices de Charlson y WUHNCI, respectivamente, debido a lo cual se decidió el uso de cetuximab en vez de la terapia con cisplatino, que ha demostrado ser más tóxica17,18.
En lo referente a la toxicidad (y siempre para dosis de radioterapia similares entre los distintos estudios comparados), en nuestra muestra de pacientes el rash cutáneo se produjo en el 69,9% de los pacientes, lo cual refleja la alta incidencia de este efecto adverso. Resultados similares incluso mayores han sido descritos por otros autores: 80% en el estudio de Acevedo-Henao y cols., 87% en el estudio de Bonner y cols. La mucositis grado 3-4 se produjo en el 26,6% de nuestros pacientes, cifra que está muy por debajo de la encontrada por otros autores como Bonner y cols. (56%), Pryor y cols. (77%), Okano y cols. (73%) o Selzer y cols. (51%), e incluso cuando el tratamiento es solamente radioterapia como por ejemplo el 52% en el estudio de Bonner. Sin embargo, la radiodermitis grado 3-4 apareció en el 40,0% de los pacientes, lo cual contrasta por estar muy por encima del 23% encontrado por Bonner o por Lawrence y cols., el 34% de Studer y cols., el 27% de Okano y cols. o el 30% de Selzer y cols.; aunque otros autores la han descrito incluso en el 49% de los pacientes19. Estos resultados ponen de manifiesto el incremento de los efectos adversos comunes asociados con la radioterapia, pudiéndose deber el alto porcentaje de radiodermitis grado 3-4 encontrado en nuestro estudio a la mayor edad media y elevado número de comorbilidades de nuestra muestra de pacientes.
La mediana de supervivencia global en nuestro estudio fue de 19,3 meses, lo cual está muy por debajo de la cifra de supervivencia de 49 meses encontrada en el ensayo de Bonner5, posiblemente debido a diferencias entre los pacientes incluidos en ambos estudios, fundamentalmente en lo relativo a la mayor edad media así como al elevado número de comorbilidades que presenta nuestra población, hecho que se refleja en la influencia negativa estadísticamente significativa encontrada en nuestro estudio entre la supervivencia global y el índice de Charlson de comorbilidades. Además, la supervivencia global fue significativamente mejor en aquellos individuos que experimentaron radiodermitis y/o erupción acneiforme en comparación con los que no sufrieron ningún sarpullido, lo cual sí coincide plenamente con los resultados obtenidos en el gran estudio de Bonner5 en el que mejoró la supervivencia global en aquellos sujetos que experimentaron rashacneiforme de al menos grado 2.
El análisis de los resultados presentados en este trabajo conjuntamente con la revisión de las publicaciones científicas nos ha permitido llegar a las siguientes conclusiones:
1. En pacientes con cáncer de cabeza y cuello no subsidiarios de tratamiento con platinos por su estado general (ECOG y comorbilidades), el tratamiento con cetuximab asociado a radioterapia ofrece una tasa satisfactoria de respuesta con una toxicidad secundaria tolerable.
2. Las toxicidades G3 más frecuentes fueron la linfocitopenia, astenia, disfagia, oromucositis y las toxicidades cutáneas radiodermitis y rash acneiforme, estas dos últimas se han relacionado con una influencia positiva en la SG.
3. Los datos de supervivencia confirman la eficacia del tratamiento con cetuximab+radioterapia en pacientes con tumores de cabeza y cuello.
4. La comorbilidad, evaluada mediante el estadío tumoral T junto con el índice de Charlson, impacta de forma significativa en la supervivencia global.
A pesar de las limitaciones de nuestro estudio, al ser retrospectivo, no comparativo y con un tamaño muestral pequeño, nuestros resultados sugieren que cetuximab es una opción terapéutica importante, una herramienta valiosa en el tratamiento del carcinoma escamoso de cabeza y cuello. Pero se necesitan futuras investigaciones para maximizar la eficacia de este anticuerpo monoclonal en pacientes con múltiples comorbilidades y para identificar a la subpoblación de pacientes que experimenta esa marcada toxicidad cutánea y realmente se beneficia de su uso en términos de supervivencia global y que se podría beneficiar de un tratamiento más prolongado.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Bibliografía
1. Cardemil M F. Epidemiología del carcinoma escamoso de cabeza y cuello. Revista chilena de cirugía. diciembre de 2014;66(6):614-20.
2. Sankaranarayanan R, Masuyer E, Swaminathan R, Ferlay J, Whelan S. Head and neck cancer: a global perspective on epidemiology and prognosis. Anticancer Res. diciembre de 1998;18(6B):4779-86.
3. Adelstein DJ, Li Y, Adams GL, Wagner HJ, Kish JA, Ensley JF, et al. An intergroup phase III comparison of standard radiation therapy and two schedules of concurrent chemoradiotherapy in patients with unresectable squamous cell head and neck cancer. J Clin Oncol. 1 de enero de 2003;21(1):92-8.
4. Forastiere AA, Zhang Q, Weber RS, Maor MH, Goepfert H, Pajak TF, et al. Long-Term Results of RTOG 91-11: A Comparison of Three Nonsurgical Treatment Strategies to Preserve the Larynx in Patients With Locally Advanced Larynx Cancer. J Clin Oncol. 1 de marzo de 2013;31(7):845-52.
5. Bonner JA, Harari PM, Giralt J, Cohen RB, Jones CU, Sur RK, et al. Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer: 5-year survival data from a phase 3 randomised trial, and relation between cetuximab-induced rash and survival. Lancet Oncol. enero de 2010;11(1):21-8.
6. Forastiere AA, Goepfert H, Maor M, Pajak TF, Weber R, Morrison W, et al. Concurrent chemotherapy and radiotherapy for organ preservation in advanced laryngeal cancer. N Engl J Med. 27 de noviembre de 2003;349(22):2091-8.
7. Cooper JS, Pajak TF, Forastiere AA, Jacobs J, Campbell BH, Saxman SB, et al. Postoperative concurrent radiotherapy and chemotherapy for high-risk squamous-cell carcinoma of the head and neck. N Engl J Med. 6 de mayo de 2004;350(19):1937-44.
8. Bernier J, Domenge C, Ozsahin M, Matuszewska K, Lefèbvre J-L, Greiner RH, et al. Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer. N Engl J Med. 6 de mayo de 2004;350(19):1945-52.
9. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis. 1987;40(5):373-83.
10. Piccirillo JF, Lacy PD, Basu A, Spitznagel EL. Development of a new head and neck cancer-specific comorbidity index. Arch Otolaryngol Head Neck Surg. octubre de 2002;128(10):1172-9.
11. Zhang N, Erjala K, Kulmala J, Qiu X, Sundvall M, Elenius K, et al. Concurrent cetuximab, cisplatin, and radiation for squamous cell carcinoma of the head and neck in vitro. Radiother Oncol. septiembre de 2009;92(3):388-92.
12. Levy AR, Johnston KM, Sambrook J, Donato B, Penrod JR, Corral M, et al. Indirect comparison of the efficacy of cetuximab and cisplatin in squamous cell carcinoma of the head and neck. Curr Med Res Opin. diciembre de 2011;27(12):2253-9.
13. Robert F, Ezekiel MP, Spencer SA, Meredith RF, Bonner JA, Khazaeli MB, et al. Phase I study of anti–epidermal growth factor receptor antibody cetuximab in combination with radiation therapy in patients with advanced head and neck cancer. J Clin Oncol. 1 de julio de 2001;19(13):3234-43.
14. Bonner JA, Harari PM, Giralt J, Azarnia N, Shin DM, Cohen RB, et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med. 9 de febrero de 2006;354(6):567-78.
15. Trotti A, Byhardt R, Stetz J, Gwede C, Corn B, Fu K, et al. Common toxicity criteria: version 2.0. an improved reference for grading the acute effects of cancer treatment: impact on radiotherapy. International Journal of Radiation Oncology*Biology*Physics. 1 de abril de 2000;47(1):13-47.
16. Sohaib A. RECIST rules. Cancer Imaging. 28 de septiembre de 2012;12:345-6.
17. Walsh L, Gillham C, Dunne M, Fraser I, Hollywood D, Armstrong J, et al. Toxicity of cetuximab versus cisplatin concurrent with radiotherapy in locally advanced head and neck squamous cell cancer (LAHNSCC). Radiother Oncol. enero de 2011;98(1):38-41.
18. Studer G, Brown M, Salgueiro EB, Schmückle H, Romancuk N, Winkler G, et al. Grade 3/4 dermatitis in head and neck cancer patients treated with concurrent cetuximab and IMRT. Int J Radiat Oncol Biol Phys. 1 de septiembre de 2011;81(1):110-7.
19. Giro C, Berger B, Bölke E, Ciernik IF, Duprez F, Locati L, et al. High rate of severe radiation dermatitis during radiation therapy with concurrent cetuximab in head and neck cancer: results of a survey in EORTC institutes. Radiother Oncol. febrero de 2009;90(2):166-71.
20. Denis F, Garaud P, Bardet E, Alfonsi M, Sire C, Germain T, et al. Final results of the 94-01 French Head and Neck Oncology and Radiotherapy Group randomized trial comparing radiotherapy alone with concomitant radiochemotherapy in advanced-stage oropharynx carcinoma. J Clin Oncol. 1 de enero de 2004;22(1):69-76.
21. Bonner JA, Harari PM, Giralt J, Azarnia N, Shin DM, Cohen RB, et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med. 9 de febrero de 2006;354(6):567-78.
____
Descargar artículo en PDF: Toxicidad y eficacia de cetuximab asociado a radioterapia en cáncer de cabeza y cuello no metastático
