Talens Bolós A1, Candela Boix MR1, Bujaldón Querejeta N1, Cercós Lletí AC2
1 Hospital General de Elda Virgen de la Salud. Elda. Alicante (España)
2 Hospital Universitario Dr. Peset. Valencia (España)
Fecha de recepción: 08/02/2021 – Fecha de aceptación: 09/03/2021
Correspondencia: Amparo Talens Bolós – Hospital General de Elda Virgen de la Salud (Servicio de Farmacia) – Carretera Elda-Sax, s/n – 03600 Elda, Alicante (España)
talens_amp@gva.es
____
RESUMEN
Introducción: Los inhibidores del checkpoint inmunológico (ICIs) han conseguido buenos resultados en salud, pero pueden presentar eventos adversos inmunorelacionados (EAir), en ocasiones, graves y poco predecibles.
Objetivo principal: Identificar los EAir asociados al uso de pembrolizumab y conocer su incidencia, características y tratamiento, en nuestro centro.
Material y métodos: Estudio observacional y retrospectivo que incluye pacientes con cáncer oncohematológico tratados con pembrolizumab, excluyendo los que participaron en ensayos clínicos. Se recogen variables sociodemográficas, clínicas, y las relacionadas con el tratamiento, incluyendo EAir. El tratamiento estadístico se realizó mediante el paquete estadístico STATA/IC 12.1.
Resultados: Se incluyeron 31 pacientes, 81% varones, con una mediana de edad de 67 años (rango 26-88), siendo los diagnósticos mayoritarios: cáncer de pulmón (55%) y melanoma (16%). 81% de los pacientes presentaban estadio IV y el 71%, PDL-1 positivo. La mediana de duración fue de 3,4 meses (rango 0,7-26). El 77% de los pacientes experimentaron EAir y las más frecuentes fueron: astenia, linfopenia e hipotiroidismo. Respecto a la gravedad, el 91% fueron leves o moderadas y en el 9% grado 3. Las reacciones adversas más graves fueron encefalitis, nefritis, anemia grado 3, liquen plano y polineuropatía motora desmielinizante. 11 de los pacientes suspendieron pembrolizumab, de los cuales el 36% fue de forma definitiva.
Conclusión: La mayoría de los EAir que aparecen son leves, aunque los casos graves observados y el tiempo de aparición variable hacen que sea importante realizar una monitorización continua de la toxicidad de estos fármacos durante tratamiento, incluso después de suspenderlo.
Palabras clave: Pembrolizumab, inmunoterapia, efectos secundarios.
Inmune-related toxicity with pembrolizumab in health care practice
SUMMARY
Background: Immune checkpoint inhibitors (ICIs) have achieved good health outcomes but it presents immunorelated adverse events (AEsir), sometimes serious and not very predictable.
Main objective: To identify the immune-mediated adverse effects (irAE) associated with the use of pembrolizumab and to know its incidence, characteristics and treatment in our center.
Material and methods: Observational and retrospective study including oncohematological cancer patients treated with pembrolizumab, excluding those who participated in clinical trials. Sociodemographic, clinical, and treatment-related variables were collected, including EAir. Statistical treatment was performed using the STATA/IC 12.1 statistical package.
Results: 31 patients, 81% male, with a median age of 67 years (range 26-88), the main diagnoses being lung cancer (55%) and melanoma (16%). Eighty-one percent of the patients had stage IV and PDL-1 positive in 71%. The median duration was 3.4 months (range 0.7-26). Seventy-seven percent of patients experienced AEir and the most frequent were: asthenia, lymphopenia and hypothyroidism. Regarding severity, 91% were mild or moderate and 9% were grade 3. The most serious adverse reactions were encephalitis, nephritis, grade 3 anemia, lichen planus and demyelinating motor polyneuropathy. Eleven of the patients discontinued pembrolizumab, 36% of whom discontinued permanently.
Conclusions: Most of the AEs that appeared were mild, although the severe cases observed and the variable time of onset make it important to continuously monitor the toxicity of these drugs during treatment, even after discontinuation.
Key words: Pembrolizumab, immunotherapy, adverse effects.
____
INTRODUCCIÓN
En la actualidad, la inmunoterapia ha permitido mejorar el pronóstico en pacientes con neoplasia maligna avanzada, recurrente y metastásica. La inmunoterapia se dirige a los receptores de linfocitos o sus ligandos con el fin de mejorar la actividad antitumoral endógena1. La muerte celular programada 1 (PD-1), el ligando 1 de muerte celular programada (PD-L1) o el linfocito T citotóxico asociado antígeno 4 (CTLA-4) son puntos de control inmunitario esenciales para prevenir la activación excesiva del sistema inmunitario y mantener homeostasis inmunológica2-4. Se han desarrollado anticuerpos que inhiben estos puntos de control inmunitarios con el objetivo de estimular la actividad inmunitaria propia del organismo que se denominan inhibidores del checkpoint inmunológico (ICIs) con indicaciones aprobadas, de los cuales disponemos datos que demuestran superioridad frente a la quimioterapia estándar en términos de supervivencia y de seguridad5-9.
Sin embargo, la inmunoterapia no está exenta de efectos secundarios, conocidos como eventos adversos relacionados con el sistema inmune o inmunorelacionados (EAir). La incidencia de estos EAir oscila entre el 30% y el 40%10,11 y parece ser que no se produce un aumento de la incidencia acumulada de estos en tratamientos prolongados12. Suelen ser más leves que los producidos por la quimioterapia convencional, pero poco predecibles y pueden afectar a cualquier órgano derivado del mecanismo de acción de estos fármacos. Los más frecuentes se asocian al tracto gastrointestinal (diarrea, colitis, gastritis), glándulas endocrinas (hipotiroidismo, hipertiroidismo, hipofisitis), la piel (erupción maculopapular, vitíligo) y el hígado (hepatitis). También puede verse afectado el sistema nervioso central (meningitis aséptica, síndrome de Guillain-Barré, neuropatía periférica), el sistema pulmonar (neumonitis, derrame pleural), el riñón (nefritis intersticial, glomerulonefritis), páncreas (pancreatitis), la médula ósea (pancitopenia, neutropenia, trombocitopenia, anemia hemolítica), los ojos (uveítis, conjuntivitis, coroiditis), el sistema cardiovascular y el musculoesquelético13.
La frecuencia de las muertes producidas por antiPD1/antiPDL1 se estima en 0,3% al 1,3% y la causa más frecuente es la neumonitis14.
Los factores de riesgo para el desarrollo de toxicidad inmunomediada son: tipo de tumor y su localización (mayores incidencias de neumonitis en cáncer de pulmón no microcítico), factores relacionados con el tratamiento (tipo de ICI y dosis) y factores relacionados con el paciente (enfermedad autoinmune previa, infecciones recientes, patologías crónicas, microbiota, utilización de antiinflamatorios, entre otros). La identificación de aquellos pacientes con mayor riesgo de sufrir EAir se considera la estrategia más eficiente para su detección precoz y rápido tratamiento15,16.
Varios estudios plantean si el desarrollo de EAir podría ser un reflejo de la respuesta antitumoral y también suponer un beneficio en la supervivencia de los pacientes que las experimentan. Los mismos mecanismos inmunológicos responsables de los efectos terapéuticos, es decir, el bloqueo de los mecanismos inhibitorios que suprimen el sistema inmunitario y, por tanto, lo activan, lo serían de las reacciones inmunomediadas. Lo que sugiere que un inicio temprano de EAir podría ser predictivo de una mejor respuesta al tratamiento con los ICIs17-21.
Con esta hipótesis, se plantea realizar un estudio con el objetivo de identificar los EAir asociados al uso de pembrolizumab y conocer su incidencia, características y tratamiento, así como analizar si existe relación entre la aparición de EAir y eficacia clínica del tratamiento.
MATERIAL Y MÉTODOS
Estudio post-autorización, observacional y retrospectivo realizado en un hospital general y universitario de un departamento de salud de la Comunidad Valenciana en España.
El estudio incluyó pacientes onco-hematológicos mayores de 18 años, tratados con pembrolizumab desde el 25 de febrero de 2016 hasta el 31 de julio 2020.
Se excluyeron los pacientes que iniciaron el tratamiento y no se les había realizado revisión médica tras la primera dosis y aquellos pacientes incluidos en ensayos clínicos.
Los datos se obtuvieron a partir de la historia clínica electrónica (Orion Clinic) y el histórico de prescripciones de los tratamientos oncológicos (Programa de prescripción electrónica Farmis-Oncofarm®).
Las variables recogidas fueron las siguientes:
– Variables sociodemográficas y clínicas: edad, sexo, presencia de enfermedades autoinmunes y su tratamiento, diagnóstico del tumor, estadio al inicio del tratamiento, escala calidad de vida ECOG (Eastern Cooperative Oncology Group) al inicio del tratamiento, presencia de metastasis, PDL-1, y otros fármacos asociados.
– Variables relativas al tratamiento: número de línea de tratamiento, fecha inicio y fin del tratamiento, duración del tratamiento (meses) y motivo de suspensión.
– Variables relacionadas con las reacciones adversas inmunomediadas: presencia de EAIr, número de reacciones adversas, tipo de toxicidad, lugar de manejo (domiciliario, consulta, urgencias), requerimiento de ingreso hospitalario, resultado (daño temporal, hospitalización, cuidados intensivos, muerte), gravedad según los criterios comunes de terminología para eventos adversos (CTCAE) Versión 5.0, continuación o suspensión del tratamiento, manejo farmacoterapéutico de los EAIr y tiempo en aparecer la reacción adversa (semanas).
– Variables de resultado: SLP (supervivencia libre de progresión) y SG (supervivencia global).
Análisis estadístico
El tratamiento estadístico de los datos se realizó mediante el paquete estadístico STATA/IC 12.1. Para el análisis de las variables cuantitativas se calculó la media, desviación típica, intervalos de confianza al 95% (IC95%), mediana, mínimo y máximo. En el caso de las variables cualitativas se calcularon distribuciones de frecuencias y porcentajes. La comparación de las características por grupos se realizó con el test T-student (muestras independientes en variables cuantitativas y variable independiente numérica y asuma normalidad) o el test de la U de Mann-Whitney (cuando no se cumple la condición previa) y el test de la χ2 o prueba exacta de Fisher (variables cualitativas). La variable de eficacia primaria se evaluó por la medida de efecto absoluta y riesgo relativo (Intervalos de Confianza (IC) 95%). Las secundarias con el coeficiente de correlación de Pearson.
Para el análisis de la SLP y de la SG se utilizaron métodos no paramétricos (método Kaplan Meier, mediana, IC95%). La comparación de las curvas de supervivencia se realizó con la prueba logrank.
El proyecto de investigación «Efectos adversos inmunomediados en la práctica asistencial con los inhibidores del punto de control inmunológico» (Código: IRAE) obtuvo el dictamen favorable del Comité Ético de la Investigación con Medicamentos del centro el 14 de abril de 2020.
RESULTADOS
Se incluyeron 31 pacientes tratados con pembrolizumab durante el periodo de estudio. En la tabla 1 se muestran las características demográficas y clínicas de la población estudiada, así como la distribución de los pacientes en función de la aparición o ausencia de EAIr.
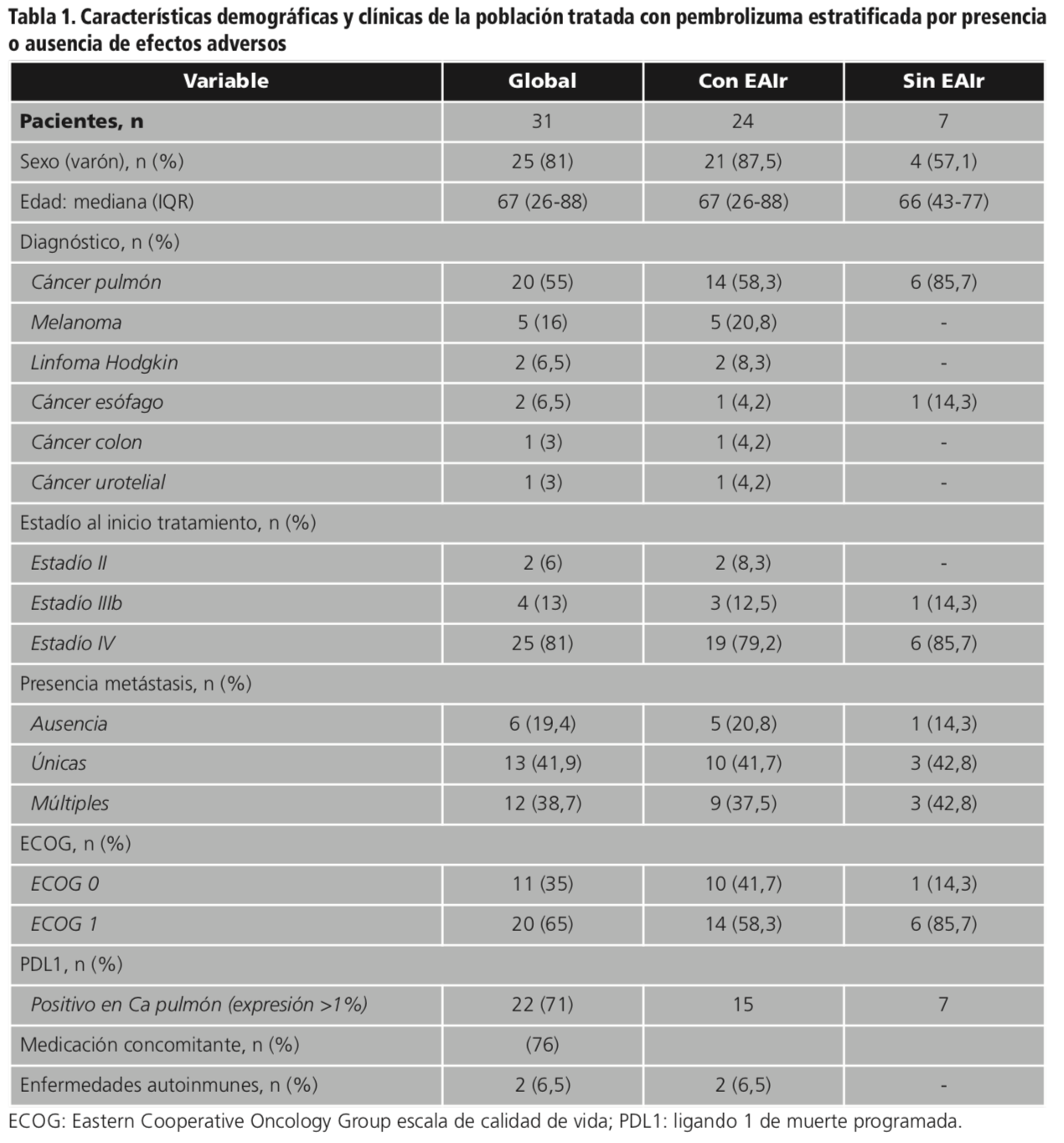
En los pacientes con metástasis múltiples, las localizaciones más habituales fueron las hepáticas, cerebrales y óseas. El 71% de los pacientes tenían el biomarcador PDL-1 positivo (expresión mayor al 1%), todos ellos con diagnóstico de cáncer de pulmón no microcítico, mientras que en los pacientes diagnosticados de melanoma, linfoma, colon y vejiga no se disponía de este dato.
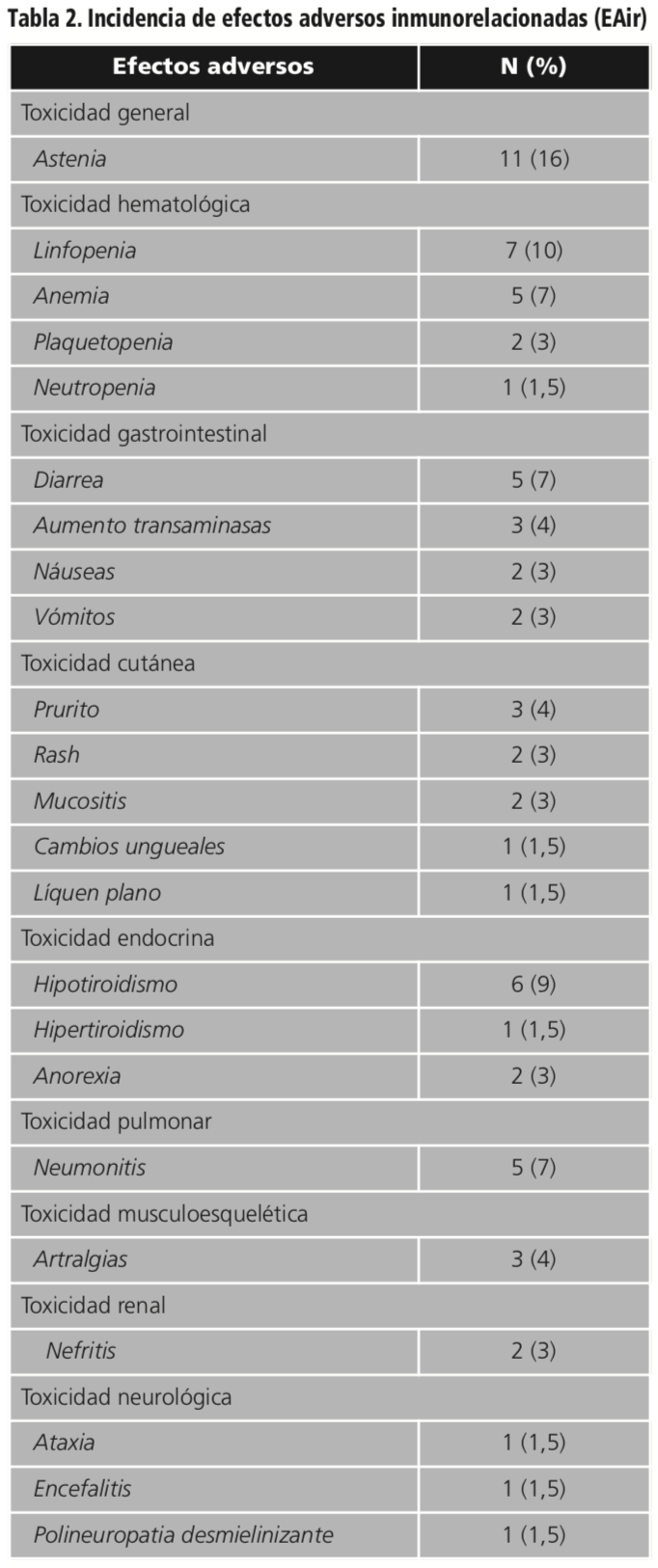
El 77% (n=24) de los pacientes experimentaron EAIr, con una media de 3±1,5 reacciones adversas por paciente, de los cuales el 70% presentaron más de un EAir. Hay que destacar que el 83% de los pacientes con metástasis cerebrales presentaban EAir.
Respecto a la gravedad, el 91% (n=63) fueron leves o moderadas (grado 1-2) y el 9% (n=6) grado 3, que afectaron al 13% de los pacientes. Las reacciones adversas más graves afectaron a 1 paciente con cáncer de esófago que presentó una ataxia grave inmunomediada y a 3 pacientes con cáncer de pulmón que presentaron encefalitis más nefritis, anemia grado 3 y liquen plano oral y cutáneo más polineuropatia motora desmielinizante, respectivamente. No hubo ninguna muerte debida a un efecto secundario relacionado con pembrolizumab.
Se suspendió pembrolizumab por toxicidad en 11 pacientes (35%), de forma temporal hasta resolución del evento en el 64% de los pacientes y definitiva en el 13%. En la tabla 2 se detallan las reacciones adversas en los pacientes del estudio distribuidas por el tipo de afectación.
Los EAIr que requirieron suspensión de tratamiento fueron: artralgia, neumonitis, ataxia, encefalitis, nefritis, anemia, liquen plano, mucositis, polineuropatía, neutropenia, astenia e hipertiroidismo. En general, las reacciones leves se resolvieron con tratamiento sintomático, mientras que en las de grado 3 fue necesario la administración de corticoides por vía oral y/o intravenosa. En el 29% de los pacientes fue necesario prescribir tratamiento antibiótico junto con pembrolizumab.
La mediana de aparición de los principales eventos adversos se situó en 21 semanas (intervalo 1-117 semanas).
El tiempo transcurrido entre el primer paciente tratado con pembrolizumab y la fecha de cierre del estudio ha sido de 54,6 meses. La mediana de duración de tratamiento fue de 3,4 meses (intervalo 0,7-26 meses), correspondiendo las mayores duraciones a los casos de melanoma y cáncer de pulmón en primera línea. Al finalizar el seguimiento del estudio, el 23% de los pacientes continuaban en tratamiento con pembrolizumab; los principales motivos de su suspensión fueron: progresión (52%), toxicidad (13%), descanso terapéutico (6,5%) y programación de trasplante medula en pacientes con linfoma (6,5%).
Se analizó la relación entre la eficacia y la aparición de EAir en los casos de melanoma y cáncer de pulmón. Todos los pacientes diagnosticados de melanoma (n=5) presentaron EAIr y 4 de ellos presentaron respuesta inicial al tratamiento. La mediana de SLP fue de 17 meses (1,5-54), destacando que dos de los pacientes presentan las SLP más altas del estudio con 54 meses y 43 meses, respectivamente, correspondiendo a su vez con los casos con mayor incidencia de efectos secundarios (6 EAir por paciente).
En los pacientes con cáncer de pulmón microcítico la mediana de duración del tratamiento con pembrolizumab fue de 3,3 meses (0,7-15,5) y el 70% presentaron EAir. Los pacientes que no presentaron ningún tipo de respuesta no tuvieron ningún efecto adverso, mientras que todos los pacientes que presentaron EAir hicieron algún tipo de respuesta inicial a pembrolizumab, encontrándose una asociación estadísticamente significativa (p<0,05). La mediana de SLP fue de 4 meses (IC95% 1,6-9,8) en el total de pacientes diagnosticados de cáncer de pulmón, no obstante, en el grupo que presentó algún EAir durante el tratamiento la SLP fue de 7,8 meses (IC95% 2,6-11,4) frente a 1,5 meses (IC95% 0,7-2,8) en el grupo con ausencia de EAir. Al comparar las SLP de ambos grupos mediante la prueba de Mantel-Haenszel (logrank) se observó que la SLP del grupo con EAir fue superior que la del grupo que no presentó efectos secundarios (x2=11,2; p<0,001), con una razón de tasas o Hazard Ratio (HR) de 6,96 (IC95%: 1,9-25,6), p<0,005.
Respecto a la SG, la mediana fue de 8,1 meses (IC95% 2,8-12,3) en los pacientes con cáncer de pulmón. Los pacientes que desarrollaron EAir durante el tratamiento tuvieron una SG de 11,35 meses (IC95% 7,5-17,3), mientras que en el grupo de pacientes que no tuvieron EAir fue de 2,1 meses (IC95% 0,7-4,4), HR: 11,2 (IC95%: 2,1-60,8), p<0,005. La prueba de Mantel-Haenszel (logrank) mostró resultados de SG en el grupo con EAir superiores al grupo sin efectos secundarios (x2=11,71; p<0,001).
Al final del seguimiento, el 23% (n=7) de los pacientes continuaban en tratamiento, el 6% (n=2) se encontraban en descanso terapéutico y 71% (n=22) habían finalizado la inmunoterapia. El 39% (n=12) de los pacientes fueron exitus.
DISCUSIÓN Y CONCLUSIONES
En nuestra serie están representadas la mayoría de las indicaciones de pembrolizumab aprobadas por la EMA y AEMPS y en 3 casos se utilizó fuera de indicación, dos pacientes diagnosticados de cáncer de esófago y uno de cáncer de colon con inestabilidad de microsatélites. Estas últimas son indicaciones aprobadas por la FDA.
La incidencia de EAIr observada (77%), es comparable con los resultados de los ensayos pivotales de pembrolizumab en sus principales indicaciones de pulmón22,23 y melanoma24, así como en el estudio publicado por Xu et al.25 en el que reportan una incidencia de 75,1%. Sin embargo, otros estudios reportan cifras de EAIr de cualquier grado superiores, alrededor del 90%10.
Respecto al perfil de toxicidad inmunomediada observado, es la hematológica (22%), gastrointestinal (17%), dermatológica (13%), junto con el sistema endocrino (13%), las toxicidades más frecuentes, lo que es acorde con lo descrito en diferentes revisiones26,27.
La incidencia de efectos adversos graves (grado 3-5) fue inferior a la reportada en los ensayos pivotales, siendo los EAir neurológicos los más graves.
El tiempo de aparición de los eventos adversos fue muy variable, sin encontrar correlación con los datos descritos en la bibliografía27, lo cual redunda en la necesidad de llevar a cabo una monitorización continua durante y después de la suspensión del fármaco.
Diversos estudios18,19 demostraron que existía una asociación entre la aparición de EAir cutáneos, como vitíligo y rash, con mejores resultados de SG en pacientes con melanoma. Estos resultados se confirmaron posteriormente en el trabajo de Okada et al.28. En nuestra muestra, el 80% de los pacientes con melanoma tuvieron buena respuesta a pembrolizumab con largos periodos de tratamiento y, además, presentaron diversas reacciones adversas, entre ellas cutáneas. Sin embargo, sería necesario un tamaño muestral superior para obtener conclusiones. La asociación entre eventos adversos inmunomediados y efectividad del tratamiento en pacientes con CPNM ha sido analizada en distintos estudios21,29,30. Además en los pacientes del estudio, al comparar las SLP y SG de los pacientes con y sin EAir, los resultados fueron superiores en el grupo de los pacientes que presentaron efectos secundarios; resultados prácticamente idénticos a los descritos en el trabajo de Ricciuti et al.20, quienes observan que el subgrupo de pacientes que sufrieron dos o más reacciones adversas fue el que consiguió los mejores resultados de supervivencia.
Fujii et al.11 apuntan que la gravedad de los eventos adversos relacionados con el sistema inmune podría ser también usado como medida de la probabilidad de una respuesta antitumoral. En dicho trabajo, aquellos pacientes que desarrollaron durante su tratamiento reacciones adversas de grado ≥3 presentaron una mayor SLP y SG frente al grupo que no tuvo reacciones de grado ≥3. En nuestro estudio no es posible analizar esta asociación, ya que, solo 4 pacientes presentaron efectos adversos grado 3.
La principal limitación del estudio es el tamaño y la heterogeneidad de la muestra que no nos permite hacer inferencia de los resultados. Además, destacamos la falta de datos en las historias clínicas de los pacientes, especialmente el grado de los efectos encontrados y el diagnóstico diferencial frente a otras causas. No obstante, el hecho de no interrumpir el tratamiento, ni instaurar tratamiento específico para el EAir, nos hace presumir que fueron leves. Dentro del sesgo de información, en ocasiones no se pregunta expresamente al paciente por todas y cada una de las reacciones plausibles, pasando por alto reacciones adversas leves o moderadas que sí podrían estar asociadas al tratamiento, por lo que intuimos que la toxicidad inmunorelacionada puede estar infraestimada.
En conclusión, el tiempo de aparición de los EAir es muy variable por lo que es importante realizar una monitorización continua de la toxicidad de estos fármacos durante tratamiento, incluso después de suspenderlo. Aunque la mayoría de los EAir que aparecen son leves, es imprescindible un rápido reconocimiento de estos efectos y un manejo adecuado dentro de los equipos interdisciplinares, de acuerdo con las principales guías de manejo y tratamiento, con el objetivo de mejorar la calidad de vida de los pacientes, evitar interrupciones innecesarias de la inmunoterapia y conseguir los mejores resultados de efectividad en la práctica clínica.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
____
BIBLIOGRAFÍA
1. Berraondo P y cols. Principios básicos de la inmunoterapia: situación actual y futuro. En: Farreras Rozman. Medicina Interna XVIII Edición. Elsevier 2016.
2. Postow MA, Sidlow R, Hellmann MD. Immune-Related Adverse Events Associated with Immune Checkpoint Blockade. N Engl J Med. 2018;378(2):158-168.
3. Sun X, Roudi R, Dai T, et al. Immune-related adverse events associated with programmed cell death protein-1 and programmed cell death ligand 1 inhibitors for non-small cell lung cancer: a PRISMA systematic review and meta-analysis. BMC Cancer. 2019;19:558. doi: 10.1186/s12885-019-5701-6.
4. Bertrand A., Kostine, M., Barnetche, T., Truchetet, M. E. &Schaeverbeke, T. Immune related adverse events associated with anti-CTLA-4 antibodies: systematic review and meta-analysis. BMC Med 2015;13,211-214.
5. Agencia Españ̃ola de Medicamentos y Productos Sanitarios. Informe de posicionamiento Terapé́utico de nivolumab (Opdivo®) en el tratamiento de cá́ncer de pulmó́n no microcítico de histología no escamosa [página web]. Madrid: Agencia Españ̃ola de Medicamentos y Productos Sanitarios; 2016 [Consultado 12 de febrero de 2020]. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-nivolumab-Opdivo-cancer-pulmon-NMHNE.pdf?x17133.
6. Agencia Españ̃ola de Medicamentos y Productos Sanitarios. Informe de Posicionamiento Terapé́utico de Pembrolizumab (Keytruda®) en combinación con quimioterapia en el tratamiento de cáncer de pulmón no microcítico no escamoso en primera línea [página web]. Madrid: Agencia Española de Medicamentos y Productos Sanitarios; 20218 [Consultado 12 de febrero de 2020]. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-pembrolizumab-Keytruda-quimioterapia-CPNM.pdf?x17133.
7. Agencia Españ̃ola de Medicamentos y Productos Sanitarios. Informe de Posicionamiento Terapé́utico de atezolizumab (Tecentriq®) en el tratamiento de carcinoma urotelial [página web]. Madrid: Agencia Españ̃ola de Medicamentos y Productos Sanitarios; 2020 [Consultado 12 de febrero de 2020]. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/ docs/IPT-atezolizumab-Tecentriq-carcinoma-urotelial.pdf?x17133N.
8. Agencia Españ̃ola de Medicamentos y Productos Sanitarios. Informe de Posicionamiento Terapé́utico de ipilimumab (Yervoy®) [página web]. Madrid: Agencia Españ̃ola de Medicamentos y Productos Sanitarios; 2015 [Consultado 12 de febrero de 2020]. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-ipilimumab-yervoy.pdf?x17133.
9. Alsaab HO, Sau S, Alzhrani R, Tatiparti K, Bhise K, Kashaw SK, et al. PD-1 and PD-L1 Checkpoint Signaling Inhibition for Cancer Immunotherapy: Mechanism, Combinations, and Clinical Outcome. Front Pharmacol. 2017 Aug 23;8(AUG):561.
10. Puzanov I, Diab A, Abdallah K, Bingham CO, Brogdon C, Dadu R, et al. Managing toxicities associated with immune checkpoint inhibitors: Consensus recommendations from the Society for Immunotherapy of Cancer (SITC) Toxicity Management Working Group. J Immunother Cancer. 2017 Nov 21;5(1):95.
11. Fujii T, Colen RR, Bilen MA, Hess KR, Hajjar J, Suarez-Almazor ME, et al. Incidence of immune-related adverse events and its association with treatment outcomes: the MD Anderson Cancer Center experience. Invest New Drugs. 2018 Aug 1;36(4):638-46.
12. Topalian S, et al. Survival Durable Tumor Remission, and Long-Term Safety in Patients with advanced melanoma receiving Nivolumab. Journal of Clinical Oncology. 2014 32:10,1020-1030.
13. Michot JM, Bigenwald C, Champiat S, Collins M, Carbonnel F, Postel-Vinay S, et al. Immune-related adverse events with immune checkpoint blockade: A comprehensive review. Eur J Cancer. 2016;54(2016):139-48.
14. Wang DY, Salem JE, Cohen J V., Chandra S, Menzer C, Ye F, et al. Fatal Toxic Effects Associated With Immune Checkpoint Inhibitors: A Systematic Review and Meta-analysis. JAMA Oncol. 2018 Dec 1;4(12):1721-8.
15. Champiat S, Lambotte O. Management of immune checkpoint blockade dysimmune toxicities: a collaborative position paper. Ann Oncol. 2016;27 (4):559-74.
16. NCCN Practice Guidelines in Oncology. Management of inmunotherapy-related toxicities. Version 1.2020 December 16, 2019. NCCN.org.
17. Teraoka S, Fujimoto D, Morimoto T, Kawachi H, Ito M, Sato Y, et al. Early Immune-Related Adverse Events and Association with Outcome in Advanced Non-Small Cell Lung Cancer Patients Treated with Nivolumab: A Prospective Cohort Study. J ThoracOncol. 2017 Dec 1;12(12):1798-805.
18. Freeman-Keller M, Kim Y, Cronin H, Richards A, Gibney G, Weber JS. Nivolumab in resected and unresectable metastatic melanoma: Characteristics of immune-related adverse events and association with outcomes. Clin Cancer Res. 2016 Feb 15;22(4):886-94.
19. Hua C, Boussemart L, Mateus C, Routier E, Boutros C, Cazenave H, et al. Association of vitiligo with tumor response in patients with metastatic melanoma treated with pembrolizumab. JAMA Dermatol. 2016 Jan 1;152(1): 45-51.
20. Ricciuti B, Genova C, De Giglio A, Bassanelli M, Dal Bello MG, Metro G, et al. Impact of immune-related adverse events on survival in patients with advanced non-small cell lung cancer treated with nivolumab: long-term outcomes from a multi-institutional analysis. J Cancer Res Clin Oncol. 2019 Feb 13;145 (2):479-85.
21. Haratani K, Hayashi H, Chiba Y, Kudo K, Yonesaka K, Kato R, et al. Association of immune-related adverse events with nivolumab efficacy in non-small cell lung cancer. JAMA Oncol. 2018 Mar 1;4(3):374-8.
22. Herbst R, Baas P, Kim D et al. Pembrolizumab versus docetaxel for previously treated, PD-L1 positive, advanced non smallcell lung cancer (KEYNOTE 010) a randomized controlled trial. Lancet 2016; 387:1540-50.
23. Reck M, Rodriguez-Abreu D, Robinson A et al. Pembrolizumab versus chemotherapy for PD-L1 positive non small cell lung cancer. N Engl J Med. 2016; 375:1823-33.
24. Robert C, Ribas A, Schachter J et al. Pembrolizumab versus ipilimumab in advanced melanoma (KEYNOTE 006): post-hoc 5 year from as open-label, multicentre, randomized, controlled, phase 3 study. The Lancet Oncology. 2019; 20: 1239-51.
25. Xu Cheng, Chen Yu-Pei, Du Xiao-Jing, Liu Jin-Qi, Huang Cheng Long, Chen Lei et al. Comparative safety of immune checkpoint inhibitors in cancer: systematic review and network meta-analysis BMJ 2018; 363: doi: 10.1136/bmj. k4226.
26. Khoja L, Day D, Wei-Wu Chen T, et al. Tumour- and class-specifi c patterns of immune-related adverse events of immune checkpoint inhibitors: a systematic review. Ann Oncol. 2017;28(10):2377-2385.
27. Cercós A. Efectos adversos relacionados con la inmunoterapia en oncología. Bol farmacovigil Comunitat Valenciana 2019;X(91);16-26.
28. Okada N, Kawazoe H, Takechi K, Matsudate Y, Utsunomiya R, Zamami Y, et al. Association Between Immune-Related Adverse Events and Clinical Efficacy in Patients with Melanoma Treated With Nivolumab: A Multicenter Retrospective Study. Clin Ther. 2019;41(1):59-67.
29. Grangeon M, Tomasini P, Chaleat S, Jeanson A, Souquet-Bressand M, Khobta N, et al. Association Between Immune-related Adverse Events and Efficacy of Immune Checkpoint Inhibitors in Non-small-cell Lung Cancer. Clin Lung Cancer. 2019;20(3):201-7.
30. Sato K, Akamatsu H, Murakami E, Sasaki S, Kanai K, Hayata A, et al. Correlation between immune-related adverse events and efficacy in non-small cell lung cancer treated with nivolumab. Lung Cancer. 2018 Jan 1;115:71-4.
____