Arrieta Loitegui M, Caro Teller JM, Rosas Espinoza C, Canales Siguero MD, Ferrari Piquero JM
Hospital Universitario 12 de Octubre. Madrid (España)
Fecha de recepción: 12/09/2018 – Fecha de aceptación: 22/10/2018
Correspondencia
María Arrieta Loitegui – Hospital Universitario 12 de Octubre -Avda. de Córdoba, s/n – 28041 Madrid (España)
maria.arrieta@salud.madrid.org
____
Resumen
Objetivos: Una de las principales reacciones adversas asociadas a daptomicina es la toxicidad muscular. Ésta se puede ver incrementada si se asocia a otros fármacos miotóxicos, como son las estatinas.
El objetivo del estudio es analizar la incidencia de toxicidad muscular asociada al uso concomitante de daptomicina y estatinas y evaluar su relevancia clínica.
Métodos: Se realizó un estudio retrospectivo observacional de dos años de duración (enero de 2015 a diciembre de 2016). Se incluyeron 62 pacientes hospitalizados que habían sido tratados concomitantemente durante cinco días o más con daptomicina y atorvastatina o simvastatina. La toxicidad muscular se determinó en base a las determinaciones de creatin kinasa (CK) antes del inicio de antibioterapia con daptomicina y durante la misma y a la presencia de síntomas musculoesqueléticos.
Resultados: 8 pacientes (13%) experimentaron un aumento en CK por encima del valor superior normal, 6 de ellos fueron leves y 2 moderados. En un paciente (1,6%) el aumento de la CK fue motivo de cambio de antibioterapia. En dos casos (3,2%) aparecieron dolores musculares.
Conclusiones: La administración conjunta de daptomicina y estatinas es habitual en la práctica clínica. En nuestra experiencia no detectamos efectos adversos musculares graves relacionados con dicha asociación.
Palabras clave: Daptomicina, inhibidores de la hidroximetilglutaril-CoA reductasa, sistema musculoesquelético, toxicidad.
____
Musculoskeletal toxicity in patients treated with daptomycin and statins: interaction relevance
Summary
Objectives: Daptomycin and statin interaction is characterized as grade D in several bibliographies. However, there are few studies published about the clinical relevance of the concomitant use of both drugs. The aim of this study is to evaluate the musculoskeletal toxicity associated with the combination of daptomycin and statins.
Methods: A retrospective observational study was carried out from January 2015 to December 2016. 62 patients who had received daptomycin and atorvastatin or simvastatin during at least 5 days were included. To evaluate the musculoskeletal toxicity, musculoskeletal symptoms and creatin kinase (CK) before and during the antibiotic treatment were recorded.
Results: CK levels increased above the upper normal limit (171 UI) in 8 patients (13%). Those increases were considered as slight in 6 cases and as moderate in 2 of them. CK increase was the reason for changing antibiotherapy in one patient (1.6%). Two patients reported muscular pain (3.2%).
Conclusions: Administration of daptomycin and statin is usual in real clinical practice. We did not find severe musculoskeletal toxicity associated with the use of both drugs.
Key Words: Daptomycin, hydroximethylglutaryl-CoA reductase inhibitors, musculoskeletal system, toxicity.
____
Introducción
Daptomicina es un antibiótico lipopéptido cíclico que actúa uniéndose a las membranas bacterianas en presencia de calcio, inhibiendo la síntesis de DNA, RNA y proteínas. Esto produce la muerte de la célula bacteriana con una lisis celular insignificante. Daptomicina está indicada para el tratamiento de infecciones complicadas de piel y partes blandas (IPPBc), endocarditis infecciosa de lado derecho (EID) y bacteriemia secundaria a las dos infecciones anteriores. Únicamente es activa frente a bacterias Gram positivas, incluyendo Staphylococcus aureus meticilin resistente. Se administra por vía intravenosa cada 24 horas, por lo que se utiliza para el manejo de la infecciones tanto en pacientes hospitalizados como ambulatorios. La duración del tratamiento depende de la gravedad, microorganismo causante y tipo de infección. Las dosis recomendadas para adultos con función renal normal según ficha técnica son 4 mg/kg para IPPBc y 6 mg/kg para bacteriemia y EID1. Sin embargo, las guías IDSA recomiendan una posología alternativa de hasta 10 mg/kg en bacteriemia o endocarditis complicadas2.
Una de las reacciones adversas asociadas a daptomicina es la toxicidad musculoesquelética, que puede verse incrementada si se administra conjuntamente con agentes miotóxicos, como las estatinas. Se recomienda suspender la terapia con estatinas mientras dure el tratamiento antibiótico con daptomicina y, en caso de no poder suspenderse, monitorizar más estrechamente la creatin kinasa (CK)1. La miotoxicidad de la daptomicina se ha visto además incrementada en pacientes con insuficiencia renal (aclaramiento de creatinina menor a 80 mL/min). Por ello, en pacientes con insuficiencia renal se recomienda un ajuste posológico para disminuir posibles toxicidades y monitorización de la función renal, los niveles de CK y la respuesta al tratamiento. El ajuste posológico está indicado en pacientes con un aclaramiento inferior a 30 mL/min, y consiste en aumentar el intervalo posológico a 48 horas1.
En 2017, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) emitió una alerta de seguridad en la que se recomendaba evitar el tratamiento concomitante de fármacos asociados a riesgo de miopatía mientras durase el tratamiento con daptomicina3. En todos los pacientes que inicien tratamiento con este antibiótico deben monitorizarse los niveles de CK al inicio y al menos una vez por semana. Asimismo, en aquellos pacientes con mayor riesgo de presentar efectos adversos musculoesqueléticos (aclaramiento renal menor a 80 mL/min o tratamiento con fármacos miotóxicos) debería realizarse con mayor frecuencia la monitorización de niveles de CK.
El objetivo de este estudio es conocer la incidencia de miotoxicidad en pacientes con asociación de daptomicina y estatinas y evaluar la adecuación del manejo clínico a las recomendaciones en cuanto a seguridad publicadas por la AEMPS.
Material y métodos
Se llevó a cabo un estudio retrospectivo observacional del periodo entre enero de 2015 y diciembre de 2016. En él se incluyeron los pacientes ingresados en un hospital del grupo 5 de la Clasificación de hospitales Cluster4 tratados concomitantemente con daptomicina y simvastatina o atorvastatina (estatinas incluidas en guía farmacoterapéutica) durante un mínimo de 5 días y que tuvieran al menos una determinación de CK basal y al menos otra durante la administración conjunta de ambos fármacos.
Se recogieron las variables demográficas: sexo, edad y peso; clínicas: dosis de daptomicina y de estatina, indicación del antibiótico, microorganismo causante en caso de conocerse, duración del tratamiento y aclaramiento de creatinina; y relativas a la toxicidad muscular: presencia de síntomas musculares y niveles de CK. El aumento de la CK se clasificó según la actualización de 2014 National Lipid Association Statin Muscle Safety Task Force como leve cuando estaba entre el límite superior normal (LSN) (171 UI) y 10 veces el LSN, como moderada si estaba entre 10 y 50 veces el LSN y como grave a partir de 50 veces el LSN5.
Las variables demográficas y clínicas se recogieron con el programa de historia y prescripción electrónica integradas.
El filtrado glomerular se calculó mediante la fórmula de CKD-EPI.
El análisis estadístico se llevó a cabo con Microsoft Excel.
Resultados
Se analizaron 352 prescripciones de daptomicina concomitantes con simvastatina o atorvastatina, de las cuales el 17,6% cumplían los criterios de inclusión (n=62). El 71% eran hombres (n=44) y la edad media fue de 72,92±13,28 años. El 67,7% de los pacientes estaban en tratamiento con atorvastatina (n=42). Las características de la población pueden observarse en la Tabla 1. Se registró una media de 3,041-3 peticiones de CK por paciente durante el tratamiento conjunto de ambos fármacos.
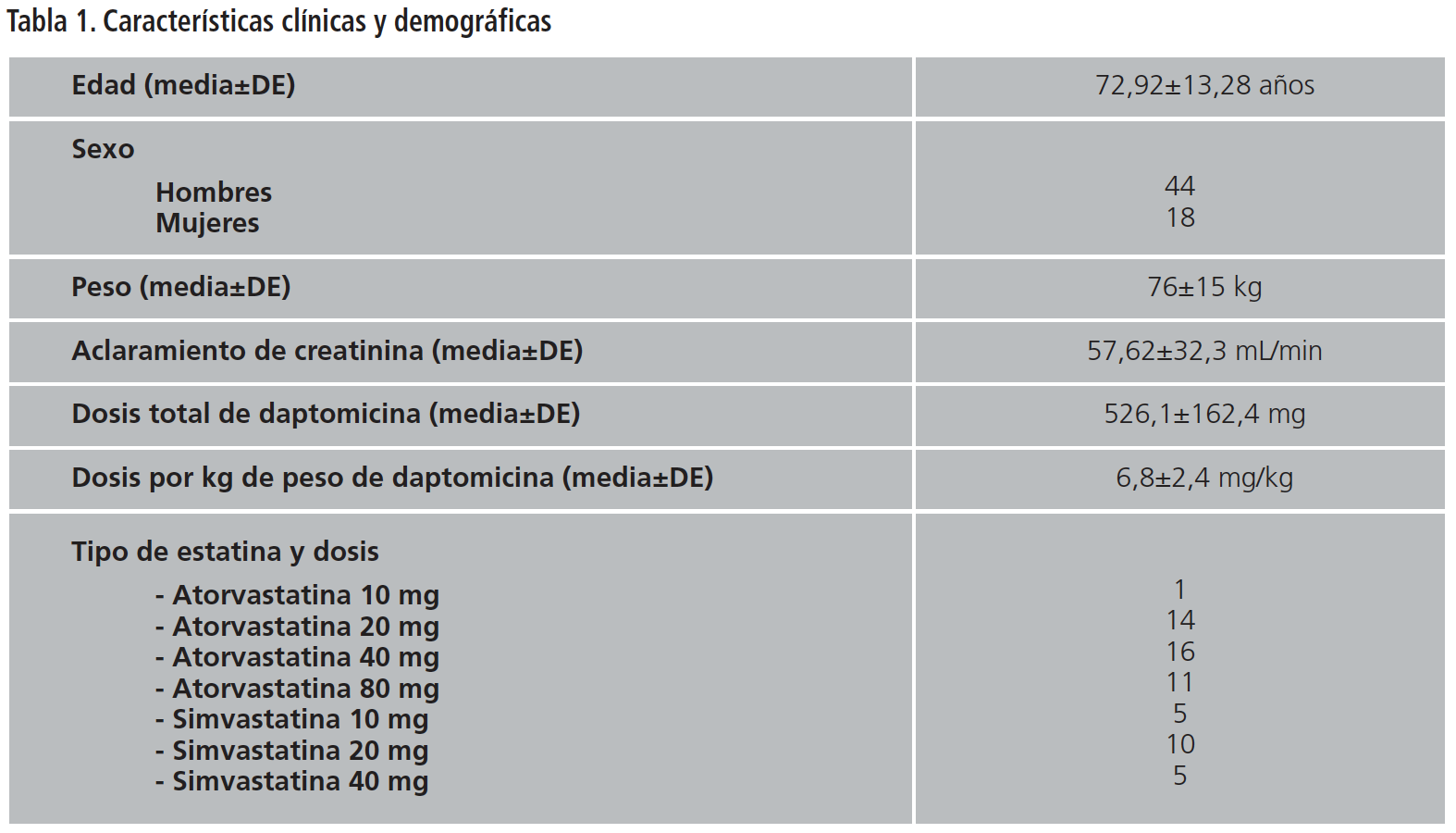
El 29% de las prescripciones de daptomicina se pautaron para el tratamiento de infecciones de piel y partes blandas (n=18), el 13% para endocarditis (n=8) y el 58% para tratar bacteriemia (n=36). En 2 casos las bacteriemias tuvieron origen cardiológico, en 11 piel y partes blandas, 14 se asociaron al uso de catéter y 9 fueron de origen desconocido.
Daptomicina se utilizó de manera empírica en el 45% de los pacientes (n=28), para cubrir cocos gram positivos en bacteriemia en el 9,6% (n=6), en el 11,3% para tratar infecciones por Staphylococcus coagulasa negativo oxacilin resistente (n=7), en el 21% por Staphylococcus aureus (n=13), en el 9,6% por Staphylococcus epidermidis (n=6) y en el 1,6% por S. capitis (n=1) y S. hominis (n=1).
La dosis media de daptomicina por kg de peso en el tratamiento de bacteriemia fue de 7,3±2,15 mg, de 8,2±2,9 mg en endocarditis y de 5,51±2,25 mg en IPPBc.
La duración media del tratamiento concomitante según la indicación fue de 11,45±8,41 días en bacteriemia, de 10,95±6,05 días en piel y de 24,71±12,9 días en endocarditis.
En el 17,7% de los pacientes (n=11) se registraron niveles de CK por encima del valor superior normal en algún momento del tratamiento conjunto (día medio de medición 7,87±4,22). Los datos demográficos y clínicos de estos pacientes pueden observarse en las Tablas 2 y 3. Cuatro de ellos presentaban valores de CK basales elevados, triplicándose dicho valor en uno de ellos tras iniciar el tratamiento con daptomicina. Los siete pacientes restantes tenían unos valores basales de CK dentro de la normalidad: cuatro de ellos presentaban un aclaramiento renal inferior a 80 mL/min y tres estaban en tratamiento con atorvastatina a altas dosis (40-80 mg). La dosis media de daptomicina que recibieron fue de 7,8±2,1 mg/kg. Los pacientes que presentaban un aclaramiento renal inferior a 30 ml/min tenían pautado el intervalo posológico recomendado. El número de veces que aumentó la CK sobre el VSN en estos siete pacientes fue de 3,18±8,54.
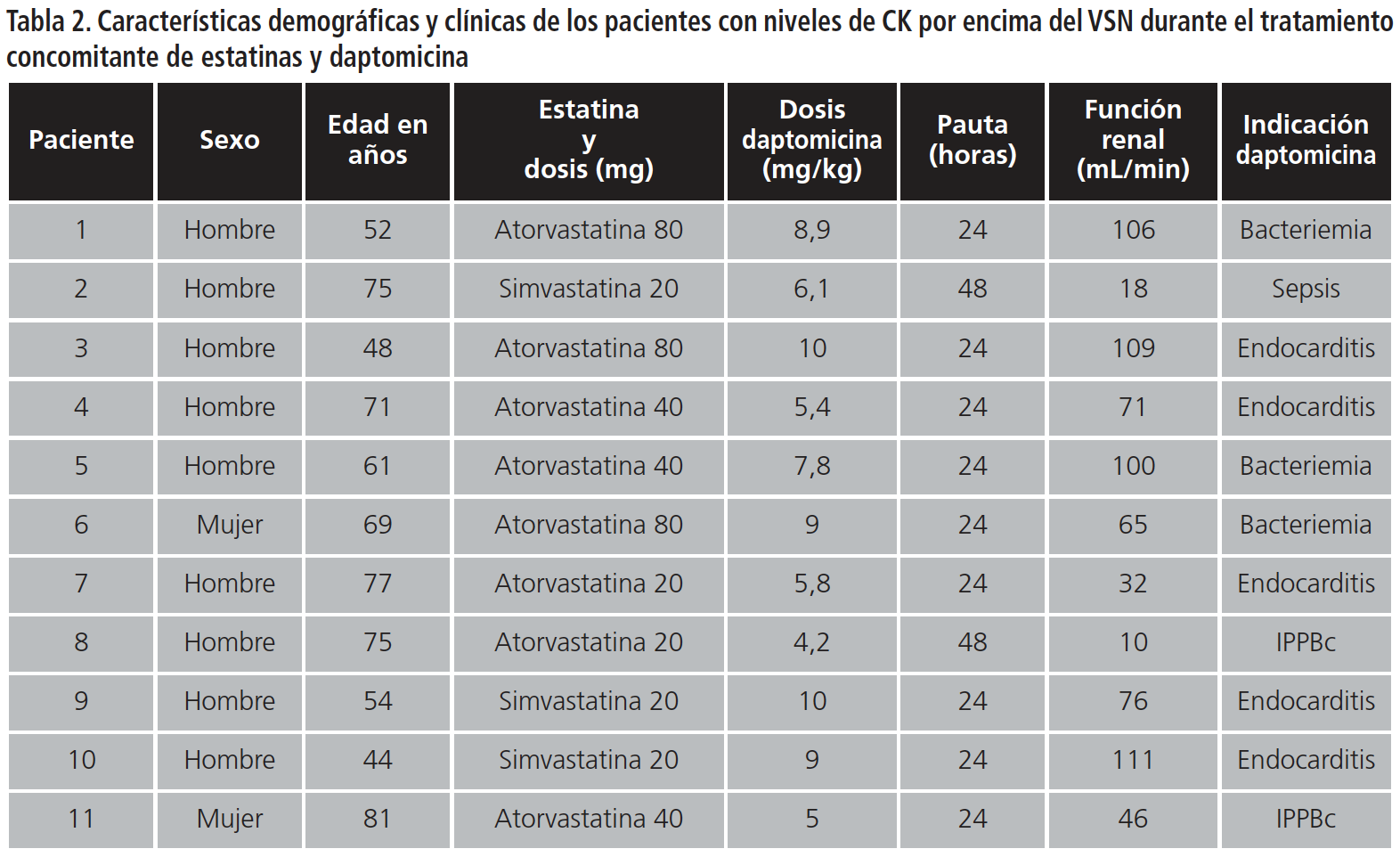
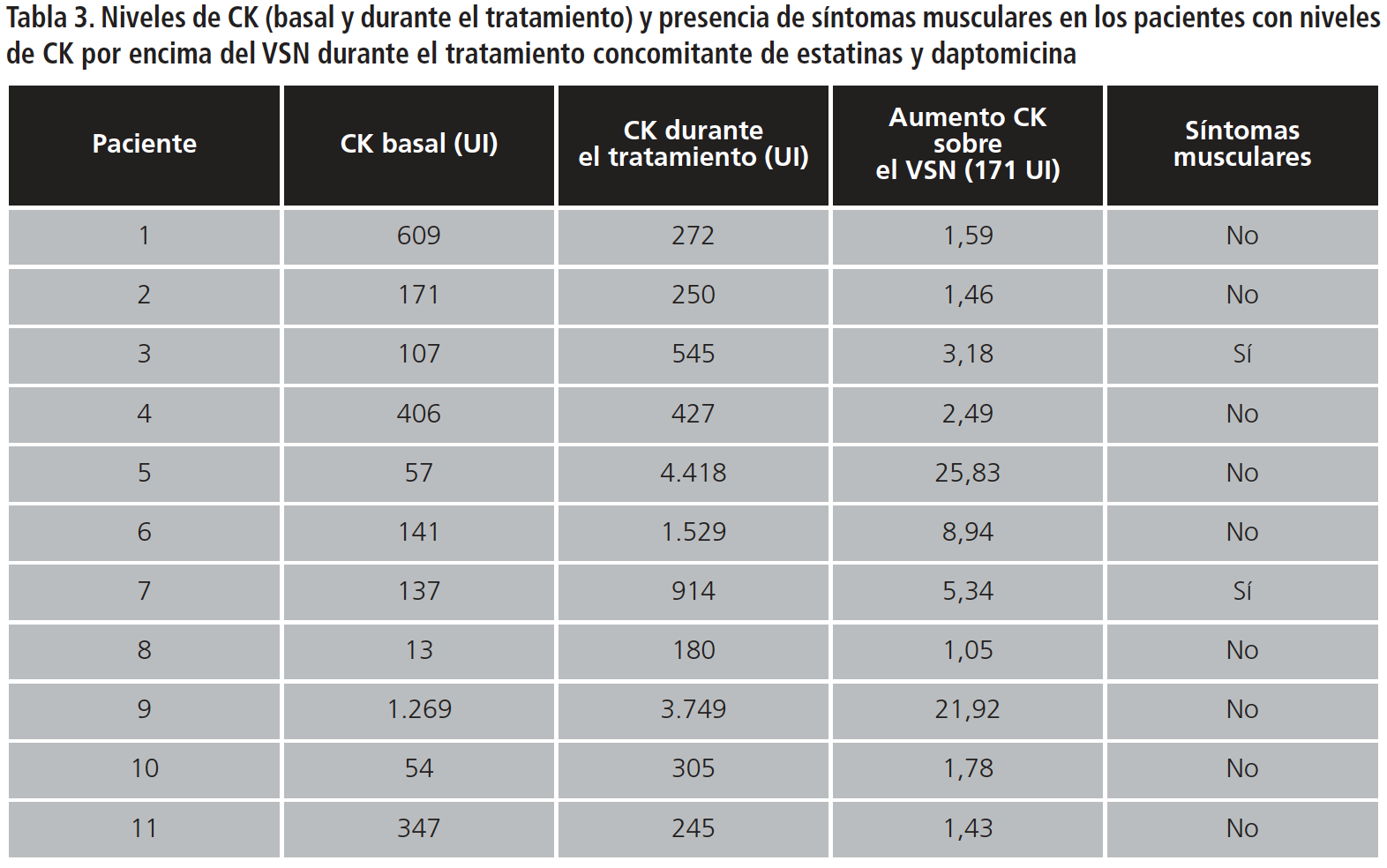
En un caso el aumento de CK fue superior a 10 veces el VSN. Este paciente recibía una dosis de 7,8 mg/kg de daptomicina, atorvastatina de 40 mg y presentaba un aclaramiento renal superior a 80 mL/min. Sin embargo, el paciente no presentó sintomatología muscular.
En dos pacientes el aumento de CK estuvo entre 5 y 10 veces el VSN. La medida de CK durante el tratamiento en uno de ellos fue tomada tras una cirugía cardíaca, y a pesar de que el paciente refirió molestias en miembros inferiores tras producirse un aumento en la dosis de daptomicina de 6 a 10 mg/kg, la terapia pudo ser continuada sin complicaciones. En el otro paciente (que recibía una dosis de daptomicina de 9 mg/kg, atorvastatina de 80 mg y presentaba un aclaramiento renal de 65 mL/min), este aumento de CK motivó el desescalado de antibioterapia (aumento de 8,94 veces por encima del VSN).
Los 4 aumentos restantes fueron inferiores a 5 veces el VSN. Uno de ellos fue sometido a cirugía cardíaca y también presentó molestias musculares.
Discusión
Los datos publicados previamente sobre la seguridad de la coadministración de daptomicina y estatinas son limitados, y muestran una baja aparición de efectos adversos musculoesqueléticos6-9. Así, en el estudio llevado a cabo por McConnell, el 5,7% (n=3) de los 53 pacientes incluidos que recibían la combinación de fármacos sufrió un aumento de CK durante la administración de daptomicina, definida como un aumento de 5 veces el LSN6. En el dirigido por Bland et al., en el que se incluyeron 49 pacientes en tratamiento con daptomicina y estatinas, el 10,2% (n=5) de los mismos experimentaron un aumento de CK basal superior a 1.000 UI/l, y tres suspendieron la terapia por toxicidad muscular, en un caso debido a rabdomiolisis7. En el estudio de Parra-Ruiz et al., en el 8% de los 36 pacientes en tratamiento concomitante se observó un aumento de los niveles de CK de entre 2,5 y 5 veces el LSN8. De los 52 pacientes que recibieron daptomicina y estatinas en el estudio de Golightly et al., ninguno experimentó síntomas de toxicidad muscular. De los 43 que disponían de medidas de CK, el 9% (n=4) experimentó un aumento menor a 5 veces el valor del LSN, aunque dos de ellos ya tenían niveles de CK basales elevados9. En ninguno de estos estudios se observaron diferencias estadísticamente significativas entre los grupos control, que recibían o sólo daptomicina6-8 o sólo estatinas9, y el grupo de estudio, que recibía estatinas y daptomicina.
Berg et al. llevaron a cabo un estudio en el que se comparaba el aumento de la CK en pacientes con daptomicina, con daptomicina y estatinas, y pacientes en terapia crónica con estatinas a los que se les retiraban al iniciar tratamiento con daptomicina10. Se incluyeron un total de 498 pacientes, de los cuales 63 tomaron concomitantemente daptomicina y estatinas y 384 únicamente daptomicina. 40 pacientes obtuvieron un valor de CK elevado durante el tratamiento. Se observó que el riesgo de obtener valores elevados de CK era el doble en el grupo que recibía estatinas además de daptomicina. Sin embargo, los resultados tampoco fueron estadísticamente significativos.
En nuestra población, a pesar de registrarse en 11 pacientes niveles de CK elevados durante el tratamiento, es difícil determinar si estos aumentos se deben principalmente a la asociación de los dos fármacos. En 4 pacientes la CK ya estaba aumentada antes de iniciar la daptomicina. De los 7 pacientes restantes, 4 presentaron elevaciones de la CK por debajo de 5 veces el VSN y en uno de ellos el aumento estaba relacionado en el tiempo con una cirugía cardíaca. Los dos cambios de tratamiento antibiótico se produjeron en pacientes que no presentaban síntomas de toxicidad muscular. En uno de ellos la razón por la que se produjo este cambio fue el aumento de 9 veces el VSN de la CK; sin embargo en el otro caso se debió a un desescalado tras la obtención del antibiograma.
Por todo ello, podemos concluir que en nuestra población la incidencia de toxicidad muscular en térmicos de elevación de la CK que motivó cambio de la antibioterapia fue anecdótica (1,6%, n=1), a pesar de la ausencia de síntomas musculoesqueléticos. Ninguna de las toxicidades descritas puede considerarse grave y no se reportó ningún caso de rabdomiolisis. Asimismo, la incidencia de miotoxicidad asociada al uso concomitante de daptomicina y estatinas en nuestro estudio parece ser concordante con la descrita por otros estudios previos6-10.
Sin embargo, la Agencia Española de Medicamentos y Productos Sanitarios ha emitido recientemente una alerta para mantener una mayor precaución en pacientes que estén recibiendo ambos tratamientos, aunque no contraindica su coprescripción3. A pesar de las recomendaciones, la monitorización de la CK en pacientes tratados con daptomicina y estatinas no se realiza de manera habitual en la práctica clínica. De todas las prescripciones concomitantes de daptomicina y estatinas detectadas, en tan solo el 17,6% se habían determinado los niveles de CK antes de iniciar el tratamiento y durante el mismo, y en casi la mitad de ellos sólo se pidió un único nivel. Esto puede deberse a la gravedad de la situación del paciente cuando decide pautarse este antibiótico, a la baja incidencia de toxicidad muscular relevante descrita en la literatura sobre esta asociación, y a la experiencia adquirida por parte del clínico en la práctica real. Además, han sido recientemente publicados estudios en los que se muestra una disminución de la mortalidad en los pacientes con bacteriemia que continúan recibiendo estatinas11. Se ha asociado esta reducción a un efecto antiinflamatorio de las mismas, lo que refuerza el mantenimiento del tratamiento concomitante.
La principal limitación de nuestro estudio es su carácter retrospectivo, ya que pacientes no han podido ser incluidos debido a la falta de mediciones de CK basales y/o durante el tratamiento. Sería necesario realizar estudios prospectivos con una mayor población de pacientes y un mayor control clínico para detectar si la toxicidad muscular de la daptomicina se ve potenciada al ser coadministrada con estatinas, tal como se alerta en las recomendaciones de la AEMPS.
Conclusiones
En nuestro centro, la prescripción conjunta de estatinas y daptomicina es habitual pese a las alertas de seguridad publicadas. En nuestra población de estudio la incidencia de toxicidad muscular asociada a la introducción de daptomicina en pacientes tratados con estatinas es baja, y no se observan efectos adversos musculares graves relacionados con dicho tratamiento concomitante.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Bibliografía
1. Agencia Española de Medicamentos y Productos Sanitarios. Ficha Técnica Cubicin® [Internet]. [citado 11 de noviembre de 2017]. Disponible en: https://www.aemps.gob.es.
2. Baddour LM, Wilson WR, Bayer AS, Fowler VG Jr, Tleyjeh IM, Rybak MJ, et al; on behalf of the American Heart Association Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on Cardiovascular Disease in the Young, Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and Stroke Council. Infective endocarditis in adults: diagnosis, antimicrobial therapy, and management of complications: a scientific statement for healthcare professionals from the American Heart Association. Circulation. 2015;132:1435-1486.
3. Agencia Española de Medicamentos y Productos Sanitarios. Cubicin® (daptomicina). Información de seguridad para profesionales sanitarios [Internet]. [citado 11 de noviembre 2017]. Disponible en https://www.aemps.gob.es.
4. Departamento de Métodos Cuantitativos en Economía y Gestión de la Universidad de Las Palmas. Clasificación de hospitales públicos españoles mediante el uso del análisis de conglomerados [Internet]. [citado 6 de septiembre 2018]. Disponible en http://www.mscbs.gob.es/estadEstudios/estadisticas/docs/NormaGRD2008/CLASIFICACIONHOSPITALESCLUSTER.pdf.
5. Rosenson RS, Baker SK, Jacobson TA, Kopecky SL, Parker BA. An assessment by the Statin Muscle Safety Task Force: 2014 update. J Clin Lipidol. 2014;8(3 Suppl):S58-71.
6. McConnell HL, Perris ET, Lowry C, Lodise T, Patel N. Effect of Concomitant 3-Hydroxy 3-Methyl-Glutaryl-CoA Reductase Inhibitor Therapy on Creatine Phosphokinase Levels and Mortality Among Patients Receiving Daptomycin: Retrospective Cohort Study. Infect Dis Ther. 2014;3(2):225-33.
7. Bland CM, Bookstaver PB, Lu ZK, Dunn BL, Rumley KF, Southeastern Research Group Endeavor (SERGE-45). Musculoskeletal safety outcomes of patients receiving daptomycin with HMG-CoA reductase inhibitors. Antimicrob Agents Chemother. 2014;58(10):5726-31.
8. Parra-Ruiz J, Dueñas-Gutiérrez C, Tomás-Jiménez C, Linares-Palomino JP, Garrido Gomez J, Hernández-Quero J. Safety analysis of high dose (>6 mg/kg/day) daptomycin in patients with concomitant statin therapy. Eur J Clin Microbiol Infect Dis Off Publ Eur Soc Clin Microbiol. 2012;31(8):1771-4.
9. Golightly LK, Barber GR, Barron MA, Page RL. Statins and daptomycin: safety assessment of concurrent use and evaluation of drug interaction liability. Drug Metabol Drug Interact. 2013;28(1):49-58.
10. Berg ML, Estes LL, Dierkhising RA, Curran B, Enzler MJ. Evaluation of impact of statin use on development of CPK elevation during daptomycin therapy. Ann Pharmacother. 2014 Mar;48(3):320-7.
11. Shrestha P, Poudel D, Pathak R, Ghimire S, Dhital R, Aryal M, et al. Effect of statins on the mortality of bacteremic patients: A systematic review and meta-analysis of clinical trials. North Am J Med Sci. 2016;8(6):250.
____
