Martín Rizo L, Arnáiz Díez S, Domínguez Cantero M, Fernández Lisón LC
Complejo Hospitarario Universitario de Cáceres y Hospital Universitario Puerto Real (España)
Fecha de recepción: 07/07/2018 – Fecha de aceptación: 14/08/2018
Correspondencia
Lara Martín Rizo – Avda. Pablo Naranjo, s/n – 10003 Cáceres (España)
Lara.martinrizo@gmail.com
____
Resumen
La tricoleucemia es un trastorno crónico linfoproliferativo de células B que representa el 2% de todas las leucemias. Se presenta como una enfermedad indolente en la que muchos de los pacientes permanecen asintomáticos sin necesidad de recibir tratamiento. La aparición de citopenias mantenidas, síndrome constitucional, esplenomegalia o infecciones recurrentes son síntomas avanzados de la tricoleucemia que indican la necesidad de iniciar tratamiento con terapias farmacológicas. El tratamiento de elección en primera línea se realiza con análogos de purinas como cladribina o pentostatina. Con estos análogos se obtienen altas tasas de remisión completa y largos períodos libres de enfermedad, pero son frecuentes las recaídas. Presentamos el caso de una mujer de 64 años, refractaria a múltiples líneas de tratamiento. Se trató con vemurafenib e ibrutinib mediante uso off-label como últimas alternativas ante la falta de respuesta con terapias estándar. Ambos fármacos aportan un nuevo abordaje de la tricoleucemia mediante nuevas dianas terapéuticas.
Palabras clave: Tricoleucemia, vemurafenib, ibrutinib.
____
Hairy-cell leukemia treatment with new therapies based on target drugs
Summary
Hairy-cell leukemia (HCL) is a B-cell chronic lymphoproliferative disorder characterised by splenomegaly, pancytopaenia and bone marrow involvement with fibrosis. HCL represents 2% of adult leukaemia. Treatment is not indicated in asymptomatic patients.
Treatment should be initiated in patients with symptomatic disease manifested by progressive symptomatic splenomegaly, cytopenias or severe infections. Purine analogues (cladribine and pentostatin) induce durable complete responses. However disease relapses and a progressively worse response to purine analogues, which can also cause cumulative myelotoxic effets and inmune suppression.
We describe a case of a patient with HCL refractory to standard therapies who need off-label treatment with vemurafenib and ibrutinib. Vemurafenib and ibrutinib seems to represent a future alternative treatment in relapsed/refractory HCL.
Key Words: Hairy-cell leukemia, vemurafenib, ibrutinib.
____
Introducción
La tricoleucemia es un trastorno crónico linfoproliferativo de células B que representa el 2% de todas las leucemias. Patología de origen desconocido, se caracteriza por esplenomegalia, expresión leucémica, anemia normocítica y monocitopenias.
Citológicamente, en un 90% de los casos, se observan células con prolongaciones citoplasmáticas conocidas como células peludas a través de frotis de sangre periférica1.
Se presenta como una enfermedad indolente y muchos de los pacientes permanecen asintomáticos sin necesidad de recibir tratamiento. Sólo se indica tratamiento si aparecen citopenias mantenidas u otra sintomatología como síndrome constitucional, esplenomegalia o infecciones recurrentes2.
Según las guías ESMO (European Society for Medical Oncology) de 2015, cladribina o pentostatina son la primera línea de tratamiento3. Ambos fármacos presentan altas tasas de remisión completa y largos períodos libres de enfermedad, pero son frecuentes las recaídas. En estos casos se puede retratar con análogos de purina asociándolos al anticuerpo monoclonal rituximab o recurriendo a otras líneas de tratamiento como interferón o bendamustina, ésta última utilizada como uso off-label.
La progresión de la enfermedad se constata con una disminución del 25% de los parámetros analíticos (hemoglobina, plaquetas y neutrófilos) respecto a la basal, un aumento del 25% de la organomegalia valorada por tomografía computarizada y la observación de tricoleucitos en sangre periférica4.
La tricoleucemia sigue siendo una enfermedad incurable y las terapias recurrentes se asocian a una importante toxicidad acumulada. De aquí la necesidad de investigar nuevos biomarcadores con la finalidad de establecer nuevas líneas de tratamiento como la mutación en el protooncogén BRaf (BRAF) V600E, la expresión de CD22 en la superficie de las células pilosas o la expresión de la tirosina kinasa de Bruton (BTK)5.
Descripción del caso
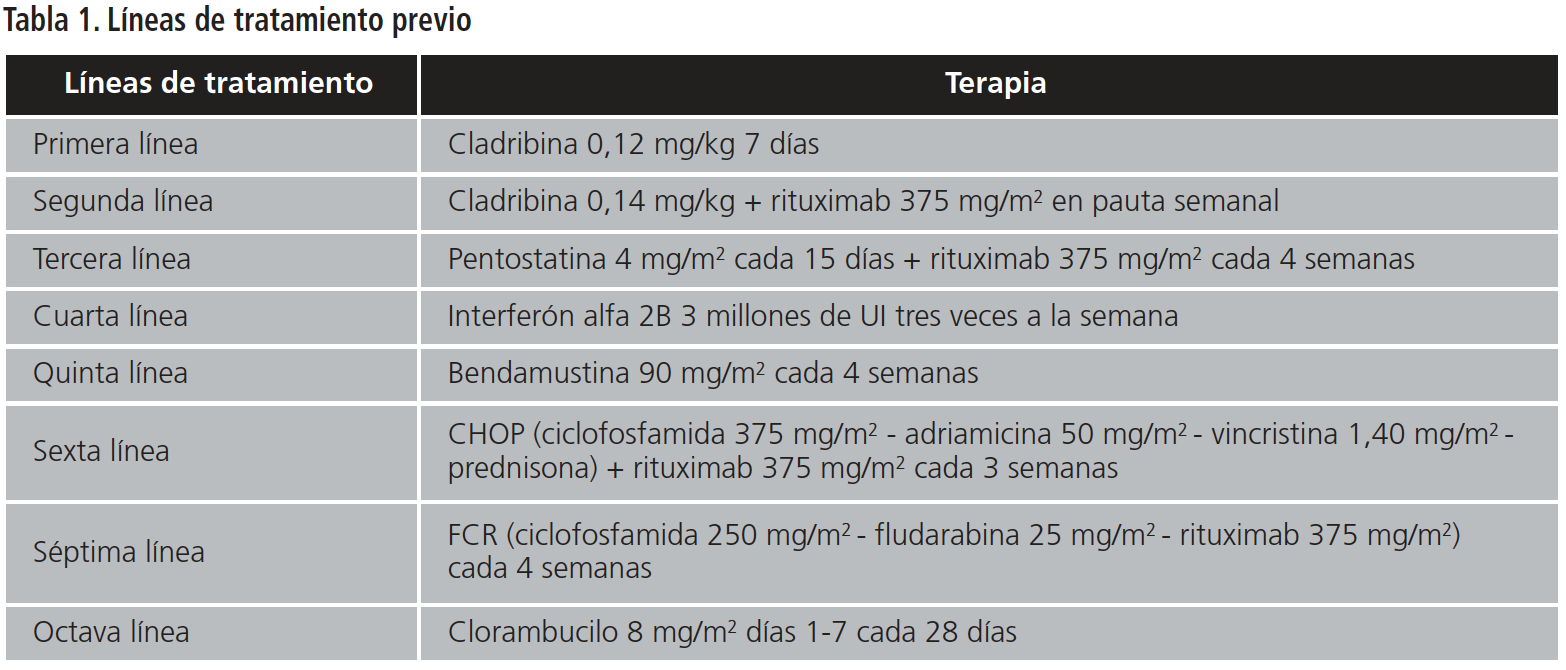
Mujer de 64 años no fumadora, dislipémica, no hipertensa ni diabética. Esplenectomizada. Diagnosticada de tricoleucemia en 1985. Ingresó en noviembre de 2015 por progresión de su enfermedad con crecimiento de adenopatías y dolor intenso. Hasta el momento había recibido ocho líneas de tratamiento (Tabla 1).
Ante la refractariedad a líneas previas, se indicó tratamiento como uso off-label con vemurafenib, inhibidor de la serina-treonina quinasa BRAF. Comenzó tratamiento a dosis completas con 960 mg (4 comprimidos) cada 12 horas. Al inicio del tratamiento se observó un aumento de linfocitos y leucocitos, alcanzando su valor máximo durante la primera semana y disminuyendo progresivamente hasta alcanzar cifras normales (Tabla 2).
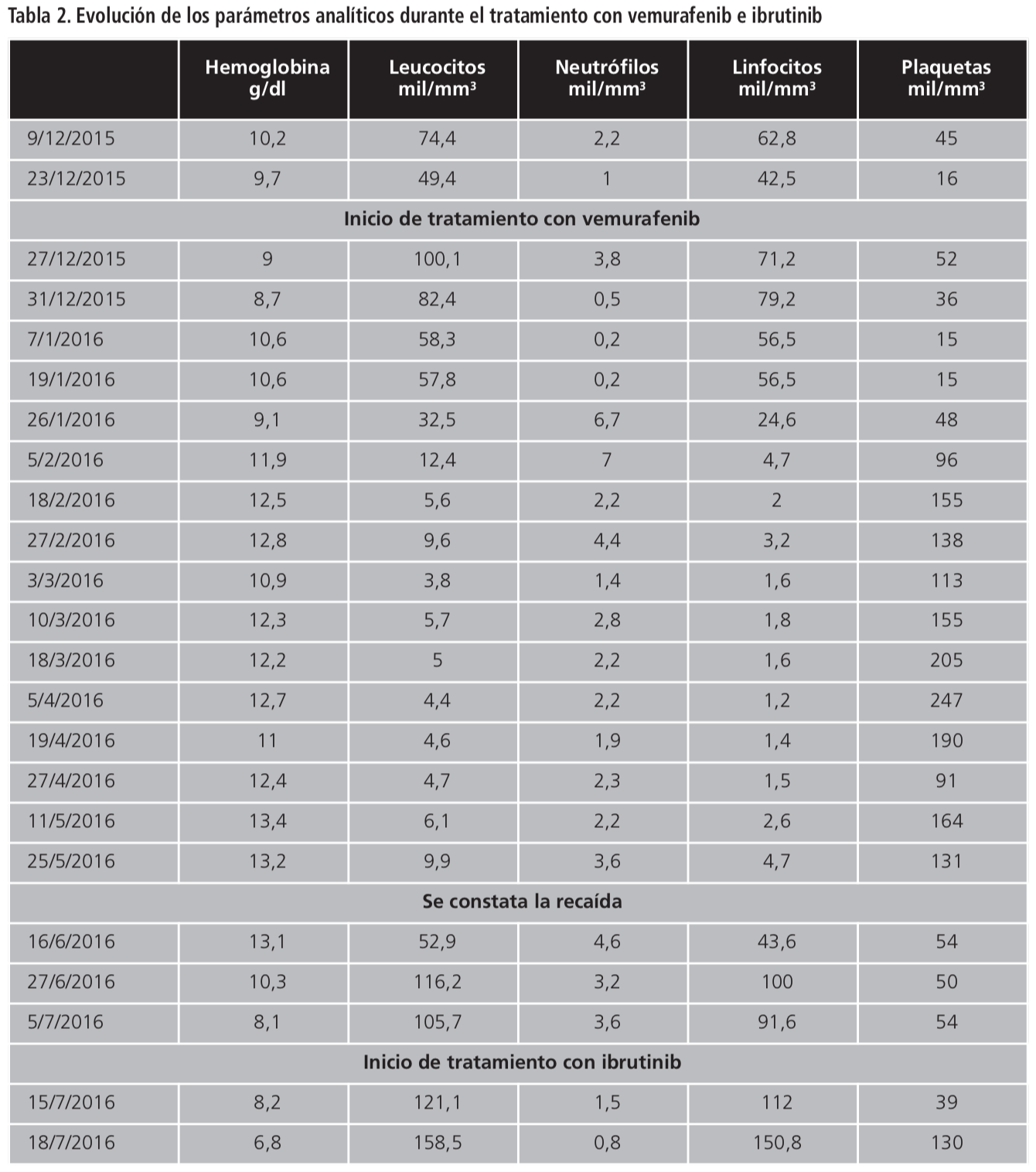
Tras nueve semanas de tratamiento presentó parámetros analíticos normales, el frotis de sangre periférica presentó una disminución del 6% de linfocitos de aspecto velloso, respecto a control, y adenopatías prácticamente imperceptibles; todo ello indicativo de respuesta al tratamiento. Sin embargo, la paciente presentó rash cutáneo extenso en el 33% de la superficie corporal localizado en ambos brazos, tórax y espalda; fatiga y exacerbación de sus dolores articulares de base que limitaban su vida diaria. A causa del extenso rash, se siguieron las recomendaciones incluidas en la ficha técnica del medicamento6: suspender vemurafenib una semana y reintroducir a dosis menores (480 mg cada 12 horas). Después de 14 semanas de tratamiento, no se observaron tricoleucitos en sangre periférica pero la biopsia de médula todavía indicaba infiltración por síndrome linfoproliferativo de tipo tricoleucemia. Finalmente, tras 18 semanas de tratamiento, se retiró vemurafenib en base a la estabilización de la enfermedad.
A los dos meses de finalizar el tratamiento, la paciente acudió a Urgencias por reagudización de su enfermedad de base (Tabla 2). Debido a la mala evolución se solicitó ibrutinib, inhibidor de BTK, como uso off-labbel y, hasta aprobación, se trató con 100 mg diarios de ciclofosfamida oral. Ingresó para control de síntomas hasta disponibilidad del fármaco. Se comenzó tratamiento con ibrutinib a dosis de 420 mg (3 comprimidos) una vez al día, siendo necesario cesar al tercer día por elevación de la bilirrubina a expensas de la directa con transaminasas normales, imputable a una toxicidad farmacológica. La elevación de la bilirrubina total y directa llegó a alcanzar valores diez veces por encima del valor analítico superior normal. La sospecha de reacción adversa fue notificada al centro de farmacovigilancia.
La paciente entró en deterioro progresivo clínico-analítico con requerimientos transfusionales diarios, sedación y finalmente éxitus en julio de 2016.
Discusión
El tratamiento actual de la tricoleucemia va dirigido a fármacos diana en pacientes resistentes a las terapias estándar, recogido en las guías de 20185. Vemurafenib, inhibidor de la serina-treonina quinasa BRAF, ha sido experimentado en ensayos clínicos fase II obteniendo 42% de respuestas completas con una media de tratamiento de 12 meses7. Ibrutinib, estudiado por su relación entre BTK y la activación del receptor BCR de los linfocitos B en la proliferación de las células peludas, se encuentra en fases preliminares habiendo demostrado eficacia en estudios in vitro8.
En la práctica clínica la utilización de estos fármacos es incipiente y sujeta a usos off-label. Desde el Servicio de Farmacia, a través de las comisiones, se evalúa su uso de forma individualizada y se elaboran informes por patología y paciente. La participación activa de los farmacéuticos supone un reto a la hora de adaptar cada situación a criterios de eficacia, coste y seguridad. En nuestro caso, vemurafenib se valoró positivamente por los buenos resultados fase II obtenidos y la situación de la paciente. Ibrutinib en cambio, supuso mayor controversia por la evidencia disponible y la situación clínica de la paciente.
Nuestro caso supone el único de tricoleucemia ampliamente tratada, agotándose todas las opciones terapéuticas previas. Nuestra paciente obtuvo buena respuesta tras el tratamiento de vemurafenib, aunque no se alcanzaron los resultados de los ensayos clínicos por la evolución de la enfermedad y las numerosas líneas de tratamiento previas. Como último recurso ante la recaída se utilizó ibrutinib, cuyo efecto no es valorable por el corto período de tratamiento.
Destacar el inicio de vemurafenib, tras recaída analítica de la paciente, sin la determinación de la mutación BRAF y la pauta de ibrutinib con un deterioro generalizado de la paciente.
Podemos concluir que el uso de los nuevos fármacos diana pueden resultar beneficiosos en la tricoleucemia refractaria al tratamiento estándar pero recurriendo a ellos en estados menos avanzados de la enfermedad y con un buen estado general del paciente.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Bibliografía
1. Anna Merino. Diagnóstico diferencial de las células linfoides atípicas en sangre periférica. Ed Cont Lab Clín. 2012-2013;16:20-40.
2. Thompson P, Ravandi F. How I manage patients with hairy cell leukaemia. British Journal of Haematology. 2017;177(4):543-446.
3. Robak T, Matutes E, Catovsky D, Zinzani PL, Guske C. Hairy cell leukaemia: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Annals of Oncology. 2015;26(5):100-107.
4. Grever M, Abdel-Wahab O, Andritsos L, Banerji V, Barrientos J, Blachly J, et al. Consensus Guidelines for the Diagnosis and Management of Patients with Classic Hairy Cell Leukemia. Blood. 2016;129(5):553-560.
5. Troussard X, Cornet E. Hairy cell leukemia 2018: Update on diagnosis, risk-stratification, and treatment. American Journal of Hematology. 2017;92(12): 1382-1390.
6. Ficha técnica Vemurafenib. Consultada 26 de junio de 2018. https://ec.europa.eu/health/documents/community-register/2012/20120217116713/ anx_116713_es.pdf.
7. Tiaci E, Park J.H., De Carolis L, Chung S.S, Brocoli A, Scott S, et al. Targeting mutant BRAF in relapsed or refractory hairy-cell leukemia. New England Journal of Medicine. 2015;373(18):1733-1747.
8. Sarvaria A, Topp Z, Saven A. Current therapy and new directions in the treatment of hairy cell leukemia. JAMA Oncology. 2016;2(1):123-129.
____
