Moreno-raMos C1, Gil-sierra MD1,2, BriCeño-CasaDo MP3
1 Servicio de Farmacia Hospitalaria, Hospital Universitario Puerto Real, Cádiz, España.
2 Departamento de Farmacología, Universidad de Sevilla, Facultad de Farmacia, Sevilla, España.
3 Servicio de Farmacia Hospitalaria, Hospital Universitario de Jerez de la Frontera, Jerez de la Frontera, España.
Fecha de recepción: 29/10/2022 – Fecha de aceptación: 21/11/2022
Correspondencia: María del Pilar Briceño Casado – Servicio de Farmacia Hospitalaria, Hospital Universitario de Jerez de la Frontera. Ronda de Circunvalación s/n, 11407, Jerez de la Frontera, Cádiz, España.
pilarbricenocasado@gmail.com
____
RESUMEN:
Objetivo: La hidradenitis supurativa (HS) es un proceso inflamatorio crónico que afecta a la piel. El objetivo de nuestro estudio fue analizar datos de ustekinumab en pacientes diagnosticados de HS con grado moderado a grave que habían recibido agentes anti factor de necrosis tumoral (anti-TNF). Métodos: Se desarrolló un estudio descriptivo retrospectivo de pacientes diagnosticados de HS en tratamiento con ustekinumab desde mayo de 2021 hasta junio 2022. Como variable de efectividad se empleó la mejoría en la estadificación de la escala Hurley a los 6 meses de tratamiento con ustekinumab. Se recogieron las reacciones adversas al fármaco para valorar la seguridad. Resultados: Se describieron 7 casos. Un 80% de los pacientes de nuestro estudio alcanzaron una disminución respecto al valor inicial en la escala Hurley. Un paciente presentó una reacción adversa autolimitada al fármaco. Conclusiones: El uso de ustekinumab ha reportado datos de efectividad y seguridad aceptables para el tratamiento de la HS en nuestros pacientes refractarios a anti-TNF.
PALABRAS CLAVE: Ustekinumab, hidradenitis supurativa, escala Hurley.
Use of ustekinumab in patients with moderate-severe hidradenitis suppurativa: real clinical practice data
SUMMARY:
Objetive: Hidradenitis suppurativa (HS) is a chronic inflammatory process that affects the skin. The objective of our study was to analyze data on ustekinumab in patients diagnosed with moderate to severe HS who had received anti tumor necrosis factor (anti-TNF) agents. Methods: A retrospective descriptive study of patients diagnosed of HS treated with ustekinumab from May 2021 to June 2022 was developed. The improvement in Hurley scale staging at 6 months of treatment with ustekinumab was used as effectiveness endpoint. Adverse reactions to the drug were collected to assess safety. Results: There were 7 cases. A decrease from the initial value on the Hurley scale was achieved by 80% of the patients in our study. One patient had a self-limited adverse reaction to the drug. Conclusion: The use of ustekinumab reported acceptable effectiveness and safety data for the treatment of HS in our patients refractory to anti-TNF.
KEYWORDS: Ustekinumab, hidradenitis suppurativa, Hurley scale.
____
Introducción
La hidradenitis supurativa (HS) es una enfermedad inflamatoria crónica de la piel, que puede presentase tras la pubertad. Las regiones con mayor afectación son la axilar, inguinal y anogenital. Esta patología se caracteriza por la aparición de nódulos inflamatorios, comedones abiertos y tractos sinusales, así como la presencia de cicatrices. Actualmente, el mecanismo de la patogénesis de la enfermedad es incierto. Las teorías iniciales situaban a las glándulas apocrinas como elementos principales de la afectación. Sin embargo, ahora la mayoría de autores coincide en el papel del folículo como el eje central de la patología1. De este modo, la oclusión folicular constituye el evento responsable de la aparición de las lesiones. Debido al dolor y la ubicación de las lesiones, la calidad de vida de los pacientes se encuentra afectada negativamente, produciendo malestar psicológico. Algunos factores como el tabaco o la obesidad se han relacionado con una mayor predisposición a padecer esta patología2. Se estima que la prevalencia de la HS se sitúa en torno a un 0,4% en Europa occidental, Escandinavia, Estados Unidos y Australia3. Respecto al tratamiento, se hace uso de una terapia combinada con el objetivo de reducir la carga de la enfermedad cuando se alcanza un grado de afectación moderado-severo. Las terapias biológicas, como adalimumab o infliximab, parecen aportar beneficios en el tratamiento de la HS4,5. A pesar de ello, algunos pacientes muestran refractariedad a los agentes anti factor de necrosis tumoral (anti-TNF). La existencia de ensayos con otros fármacos biológicos ‒como ustekinumab‒ en esta patología es aún escasa. Por ello, resulta importante generar evidencia sobre el uso de ustekinumab en HS. El objetivo de este estudio es describir la respuesta a ustekinumab en pacientes diagnosticados de HS con grado moderado-grave.
Material y métodos
Se realizó un estudio descriptivo retrospectivo de pacientes diagnosticados de HS en tratamiento con ustekinumab desde mayo de 2021 hasta junio 2022. A partir de la historia clínica digital, se obtuvieron los siguientes datos: sexo, edad, tratamiento previo (incluyendo terapia biológica), tipo de pérdida de respuesta al fármaco biológico previo (fallo primario o secundario), duración del tratamiento con ustekinumab, y pauta posológica empleada. Como variable de efectividad se usó la mejoría en la estadificación de la escala Hurley6 a los 6 meses de tratamiento con respecto al estado basal en pacientes valorables. Se definieron pacientes valorables como aquellos de los que se dispuso de una valoración clínica por el facultativo prescriptor a los 6 meses de tratamiento. La escala Hurley estratifica a los pacientes en tres estadios según la presencia de abscesos y tractos fistulosos o de cicatrización. El estadio Hurley I comprende la formación de abscesos aislados o múltiples, sin presencia de fístulas o cicatrices. El estadio Hurley II engloba la formación de abscesos recurrentes, una o múltiples lesiones ampliamente separadas con formación de tractos fistulosos. El estadio Hurley III consiste en la formación de múltiples abscesos y fístulas interconectadas, además de la presencia de cicatrices. Asimismo, se recogieron las reacciones adversas observadas para valorar la seguridad de ustekinumab. Los resultados de efectividad y seguridad de los pacientes fueron descritos tanto de forma individual como global.
Resultados
Durante el período de tiempo del estudio, 7 pacientes recibieron ustekinumab con una pauta posológica de 90 mg cada 3 meses. En la tabla 1 se exponen resumidamente los datos demográficos de los pacientes, tratamientos previos, tipo de pérdida de respuesta al tratamiento biológico previo, estadificación de Hurley basal y tras 6 meses de tratamiento con ustekinumab, además de reacciones adversas asociadas al fármaco.
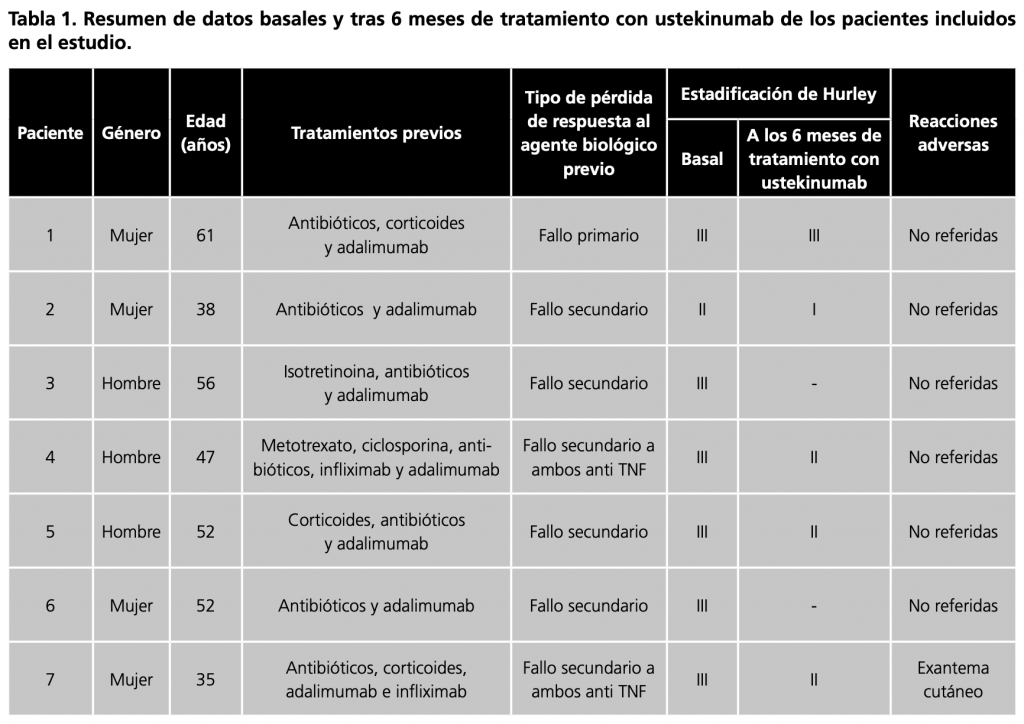
Datos individuales
Paciente 1: mujer de 61 años tratada previamente con antibióticos, corticoides y adalimumab con fallo primario, que presentaba un estadio Hurley III previo al uso de ustekinumab. La paciente no presentó respuesta a ustekinumab tras 6 meses de tratamiento.
Paciente 2: mujer de 38 años que había recibido antibióticos y adalimumab, al que presentó un fallo secundario. Presentaba inicialmente una escala Hurley II. Tras 6 meses de tratamiento con ustekinumab, la paciente presentó escala Hurley I.
Paciente 3: varón de 56 años previamente tratado con isotretinoina, antibióticos y adalimumab con fallo secundario. Presentó escala Hurley III basal. No fue posible una valoración a los 6 meses por pérdida de seguimiento.
Paciente 4: hombre de 47 años tratado con metotrexato, ciclosporina, antibióticos, infliximab y adalimumab con fallo secundario. Se registró una escala Hurley III inicial. Tras 6 meses recibiendo ustekinumab, el paciente alcanzó una escala Hurley II.
Paciente 5: hombre de 52 años que había recibido corticoides, antibióticos y adalimumab, al que presentó fallo secundario. Este paciente presentó escala Hurley III basal. Tras tratamiento con ustekinumab en los 6 primeros meses, se observó una escala Hurley II.
Paciente 6: mujer de 52 años tratada con antibióticos y adalimumab, presentando fallo secundario. Se registró una escala Hurley III basal. No fue posible realizar una valoración a los 6 meses por interrupción del tratamiento a causa de una intervención quirúrgica. Posteriormente el tratamiento con ustekinumab se reinició.
Paciente 7: mujer de 35 años que estuvo en tratamiento con antibióticos, corticoides, adalimumab e infliximab, a los que presentó fallo secundario posteriormente. Se registró escala Hurley III inicial. En la primera administración del fármaco, la paciente presentó una reacción adversa con aparición de exantema cutáneo. Tras 6 meses de tratamiento con ustekinumab, la paciente presentó una escala Hurley II.
Datos globales
Un 80% de los pacientes valorables de nuestro estudio alcanzaron una disminución en la escala Hurley a los 6 meses de tratamiento con ustekinumab. Respecto a la seguridad, se puede apreciar que sólo un paciente (14,3% del global de pacientes) presentó una reacción adversa autolimitada. En el resto de casos descritos no se observaron eventos adversos.
Discusión
Actualmente no es posible encontrar en la literatura ensayos clínicos aleatorizados sobre el uso de ustekinumab en HS. Sólo algunos casos han sido descritos7. Nuestro estudio aporta datos de efectividad de ustekinumab que pueden enriquecer a la literatura disponible sobre pacientes que previamente habían mostrado fracaso terapéutico (fallo primario o secundario) a un agente anti-TNF. La escala Hurley es una escala de medida muy utilizada para la valoración de la afectación de HS, debido a la sencillez de su aplicación. Sin embargo, esta herramienta mantiene algunas limitaciones al tratarse de una escala cualitativa en la que no se evalúan el número de zonas afectadas ni el número de lesiones8. En cuanto al perfil de seguridad, los eventos adversos de ustekinumab son conocidos ya que este principio activo es empleado en otras patologías como las enfermedades inflamatorias intestinales9, en las que presenta datos de seguridad en mayores poblaciones de pacientes. En nuestro caso, solo un paciente presentó una reacción cutánea que se resolvió sin incidencias.
Las limitaciones de nuestro estudio incluyen un escaso número de pacientes, pérdida de seguimiento en algún paciente, un corto período de seguimiento y la ausencia de un grupo control. Asimismo, estas limitaciones son similares a las halladas en la escasa bibliografía disponible.
La HS genera un alto impacto en la calidad de vida de los pacientes a nivel social, laboral y personal. Un estudio multicéntrico desarrollado por la European Society for Dermatology and Psychiatry (ESDaP)10 en 13 países europeos que valoró la influencia de enfermedades dermatológicas sobre la calidad de vida en pacientes, situó la HS como la patología que causa un mayor impacto negativo. El dolor, el prurito, la baja autoestima, las disfunciones sexuales, la calidad del sueño y las consecuencias sobre la salud mental son síntomas crónicos o resultados de una enfermedad no controlada causante de un fuerte impacto en la vida diaria de los pacientes. Alrededor de un 20% de los pacientes diagnosticados de HS sufren otra enfermedad inmunomediada concomitante11. En estos casos puede ser esencial encontrar una terapia biológica con eficacia en ambas. Algunos de los pacientes descritos en nuestro estudio habían sido diagnosticados de enfermedad de Crohn, además de HS. Ustekinumab podría emplearse para tratar ambas patologías de base autoinmune, aumentando así la eficiencia terapéutica.
El mayor conocimiento de la patogénesis implicada ha supuesto la introducción de terapias biológicas para el tratamiento de la HS. Además de la implicación del factor de necrosis tumoral, la cascada generada a través de las vías inflamatorias de diferentes familias de interleucinas (IL) como la IL-112, IL-1213, IL-1714 o IL-2313 también ha adquirido un papel relevante. Hasta el momento, en la literatura se han descrito varios casos de HS refractaria en los que se han empleado diferentes agentes biológicos en condiciones off-label. Respecto a las terapias basadas en inhibidores de IL-17, como secukinumab15, encontramos varios casos publicados sobre su uso como tratamiento en la HS tras un fracaso terapéutico a un agente anti-TNF previo. En esa misma línea se encuentran los inhibidores de IL-23 como guselkumab, con algunos casos clínicos disponibles16. Asimismo, en pacientes que han experimentado una pérdida de respuesta a un tratamiento previo de anti-TNF se ha valorado el empleo de otra terapia del mismo grupo farmacológico, como golimumab17.
Recientemente, ha sido publicado un ensayo clínico con bimekizumab (inhibidor de la IL-17)18. Se trata de un ensayo aleatorizado de fase 2, doble ciego, que incluyó una población de 88 pacientes no tratados previamente con agentes anti-TNF o fármacos anti-IL-17. Los resultados obtenidos fueron superiores respecto a placebo, sin embargo, son necesarios otros estudios que confirmen un beneficio frente a otras alternativas terapéuticas activas. En otro ensayo clínico fase 2 y abierto que evaluó con bermekimab19 (inhibidor de la IL-1α) se asignaron 42 pacientes a dos cohortes según exposición previa a un anti-TNF o no. El periodo de seguimiento fue de 12 semanas, observándose una reducción de las lesiones del 46% y 60% para pacientes pre-tratados o naïve, respectivamente. Se encuentra en desarrollo un ensayo clínico fase 2, aleatorizado y doble ciego sobre bermekimab20 con 144 pacientes (se incluyeron pacientes expuestos previamente a tratamiento biológico y naïve). Hasta la fecha no hay resultados publicados de dicho estudio. Otros fármacos inhibidores de la IL-1, como anakinra12 o canakinumab21, también se mencionan en la literatura como posibles alternativas farmacológicas frente a la HS. La eficacia de anakinra se evaluó frente a placebo en un ensayo clínico aleatorizado y doble ciego, con 20 pacientes no expuestos previamente a anti-TNF. Respecto a los resultados, un 78% de los pacientes que recibieron anakinra alcanzaron una disminución del 50% de la actividad de la enfermedad, frente al 30% en el grupo control. En el caso de canakinumab, solo se dispone de dos casos clínicos publicados en pacientes refractarios a terapias con anti-TNF.
Conclusiones
En nuestro estudio, la mayoría de los pacientes valorables presentaron una disminución de, al menos, un grado en la escala Hurley tras 6 meses de tratamiento con ustekinumab. De esta manera, se ha podido alcanzar un mayor control de la patología en nuestra cohorte. Asimismo, la toxicidad del tratamiento ha sido aceptable. Ustekinumab podría ser tenido en cuenta como una opción farmacológica en el tratamiento de la HS refractaria a agentes anti-TNF, a falta de ensayos clínicos que aporten un mayor grado de evidencia.
Conflictos de intereses: Gil-Sierra MD participó en un advisory board de Janssen Pharmaceutica. El resto de los autores no posee conflictos de interés.
BIBLIOGRAFÍA
1. Van der Zee HH, Laman JD, Boer J, Prens EP. Hidradenitis suppurativa: viewpoint on clinical phenotyping, pathogenesis and novel treatments. Exp Dermatol. 2012; 10:735-9. DOI: 10.1111/j.1600-0625.2012.01552.x.
2. Revuz, JE, Canoui-Poitrine F, Wolkenstein P, Viallette C, Gabison G, Pouget F et al. Prevalence and factors associated with hidradenitis suppurativa: results from two case-control studies. J Am Acad Dermatol. 2008; 59 (4): 596–601. DOI: 10.1016/j.jaad.2008.06.020.
3. A, Nassim D, O´Brien E, Gulliver W, Nikolakis G, Zouboulis CC. Prevalence of hidradenitis suppurativa: a systematic review and meta-regression analysis. JAMA Dermatol. 2021; 157:924-31. DOI: 10.1001/jamadermatol.2021.1677.
4. Kimball AB, Okun MM, Williams DA, Gottlieb AB, Papp A, Zoubolis CC et al. Two phase 3 trials of adalimumab for hidradenitis suppurativa. N Engl J Med. 2016; 375(5):422. DOI: 10.1056/NEJMoa1504370.
5. Grant A, González T, Montgomery MO, Cardenas V, Kerdel FA. Infliximab therapy for patients with moderate to severe hidradenitis suppurativa: a randomized, double-blind, placebo-controlled crossover trial. J Am Acad Dermatol. 2010;62(2):205. DOI: 10.1016/j.jaad.2009.06.050.
6. García-Martínez FJ, Pascual JC, López-Martín I, Pereyra-Rodríguez JJ, Martorell Calatayud A, Salgado-Boquete L et al. Actualización en hidrosadenitis supurativa en Atención Primaria. Semergen. 2017; 43(1):34-42. DOI: 10.1016/j.semerg.2015.12.005.
7. Takeda K, Kikuchi K, Kanazawa Y, Yamasaki K, Aiba S. Ustekinumab treatment for hidradenitis suppurativa. J Dermatol. 2019: 46(12):1215-18. DOI: 10.1111/1346-8138.15122.
8. Martorell A, García-Martínez F.J, Jiménez-Gallo D, Pascual JC, Pereyra-Rodriguez J, Salgado L et al. Actualización en hidradenitis supurativa (I): epidemiología, aspectos clínicos y definición de severidad de la enfermedad. Actas Dermosifiliogr. 2015;106(9):703-15. DOI: 10.1016/j.ad.2015.06.004.
9. Feagan BG, Sandborn WJ, Gasink C, Jacobstein D, Lang Y, Friedman JR, et al. Ustekinumab as induction and maintenance therapy for Crohn’s disease. N Engl J Med. 2016; 375(20):1946. DOI: 10.1056/NEJMoa1602773.
10. Dalgard FJ, Svensson Å, Halvorsen JA, Gieler U, Schut C, Tomas-Aragones L et al. Itch and mental health in dermatological patients across Europe: a cross-sectional study in 13 countries. J Invest Dermatol. 2020; 140(3):568-73. DOI: 10.1016/j.jid.2019.05.034.
11. Martorell A, Molina-Leyva A. Guía para el farmacéutico hospitalario sobre hidradenitis supurativa. Sociedad Española de Farmacia Hospitalaria. 2021. [Consultado en octubre de 2022]. Disponible en: https://www.sefh.es/bibliotecavirtual/hidra20/20210215_GUIAFHHIDRADENITISSUPURATIVA.pdf?ts=20210219132018
12. Aarts P, Dudink K, Vossen A, van Straalen KR, Ardon CB, Prens, EP et al. Clinical implementation of biologics and small molecules in the treatment of hidradenitis suppurativa. Drugs. 2021; 81(12):1397-410. DOI: 10.1007/s40265-021-01566-2.
13. Maarouf M, Clark AK, Lee DE, Shi VY. Targeted treatments for hidradenitis suppurativa: a review of the current literature and ongoing clinical trials. J Dermatolog Treat. 2018; 29(5):441-9. DOI: 10.1080/09546634.2017.1395806.
14. Fletcher JM, Moran B, Petrasca A, Smith CM. IL-17 in inflammatory skin diseases psoriasis and hidradenitis suppurativa. ClinExp Immunol. 2020; 201(2):121-34. DOI:10.1111/cei.13449.
15. Wu K. K, Dao H. Off-label dermatologic uses of IL-17 inhibitors. J Dermatolog Treat. 2022;33(1):41-7. DOI: 10.1080/09546634.2020.1737638.
16. Casseres RG, Kahn JS, Her M. J, Rosmarin D. Guselkumab in the treatment of hidradenitis suppurativa: A retrospective chart review. J Am Acad Dermatol. 2019;81(1), 265-7. DOI: 10.1016/j.jaad.2018.12.017.
17. Melendez-Gonzalez, M. del M, Hamad, J, Sayed, C. Golimumab for the treatment of hidradenitis suppurativa in patients with previous TNF-α treatment failure. J Invest Dermatol. 2021;141(12):2975-9. DOI: 10.1016/j.jid.2021.04.026.
18. Glatt S, Jemec GBE, Forman S, Sayed C, Schmieder G, Weisman J et al. Efficacy and safety of bimekizumab in moderate to severe hidradenitis suppurativa: a phase 2, double-blind, placebo-controlled randomized clinical trial. JAMA Dermatol. 2021; 157(11): 1279-88. DOI: 10.1001/jamadermatol.2021.2905.
19. Gottlieb A, Natsis NE, Kerdel F, Forman S, Gonzalez E, Jimenez G, et al. A phase II open-label study of bermekimab in patients with hidradenitis suppurativa shows resolution of inflammatory lesions and pain. J Invest Dermatol. 2020;140(8):1538-45.e2. DOI: 10.1016/j.jid.2019.10.024.
20. A study to evaluate the efficacy, safety and tolerability of bermekimab in patients with hidradenitis suppurativa. NCT04019041. [Consultado en octubre de 2022]. Disponible en: https://clinicaltrials.gov/ct2/show/NCT04019041?term=bermekimab&cond=Hidradenitis&draw=2&rank=3.
21. Houriet C, Seyed Jafari SM, Thomi R, Schlapbach C, Borradori L, Yawalkar N et al. Canakinumab for severe hidradenitis suppurativa: preliminary experience in 2 cases. JAMA Dermatol. 2017; 153(11): 1195-7. DOI: 10.1001/jamadermatol.2017.2392.
