Rev. OFIL 2017, 27;3:235-240
Fecha de recepción: 08/11/2016 – Fecha de aceptación: 03/02/2017
Parro MA1, López S2, Sánchez M1, Chinea A2, Pueyo C1, Bermejo T1
1 Servicio de Farmacia
2 Servicio de Hematología
Hospital Universitario Ramón y Cajal. Madrid (España)
____
Correspondencia:
Mª Angeles Parro Martin
C/San Dacio, 15 – 5º Izda.
28034 Madrid
Correo electrónico: mariadelosange.parro@salud.madrid.org
____
Resumen
Objetivo: Evaluar la eficacia y seguridad de la utilización de foscarnet para el tratamiento de la infección por CMV en pacientes trasplantados de médula ósea.
Método: Estudio observacional retrospectivo, en el que se incluyeron todos los pacientes que recibieron foscarnet como tratamiento de la viremia por CMV durante un año. Se recogieron variables demográficas, diagnósticas, terapéuticas, y analíticas. La eficacia se evaluó mediante la negativización del virus en sangre y la resolución del cuadro de viremia. Se evaluó la toxicidad hematológica, renal, hepática, metabólica y neurológica en base a los Common Terminology Criteria for Adverse Events (CTCAE) Versión 4.
Resultados: Se evaluaron 12 pacientes con una edad media de 45 años. Los pacientes habían sido trasplantados mayoritariamente por leucemia mieloide aguda y leucemia linfoide aguda. 8 pacientes recibían tratamiento previo para la viremia por CMV con ganciclovir intravenoso, y 4 pacientes con valganciclovir o aciclovir oral. El 16,6% de pacientes no negativizaron el virus, el resto negativizó con una media de 18,5 días. El 41,7% presentaron toxicidad renal, el 58,4% toxicidad hepática, el 41,7% sufrió un empeoramiento de la toxicidad hematológica y todos presentaron toxicidad metabólica.
Conclusiones: El foscarnet ha demostrado ser eficaz en el tratamiento de la infección por CMV en pacientes trasplantados de medula ósea. La toxicidad producida por el fármaco es menor de la esperada, sobre todo a nivel renal y hematológico.
Palabras clave: Foscarnet, citomegalovirus, trasplante de médula ósea, seguridad, eficacia.
____
Introducción
La infección por Citomegalovirus (CMV) es una de las principales complicaciones infecciosas tras un trasplante de médula ósea1. Se define infección por CMV como la detección del virus en sangre. La infección primaria consistiría en la transmisión del virus a un individuo previamente seronegativo, ya sea por contagio, por soporte transfusional o por los progenitores hematopoyéticos. La seroprevalencia varía en distintos entornos según los países y el nivel socioeconómico, pudiendo oscilar entre un 40-100%. En España en torno al 70% de la población es seropositiva2. Por otro lado, se define enfermedad por CMV a la infección de un órgano que conlleva manifestaciones clínicas, o bien cuando existe demostración histológica, siendo lo más habitual la afectación gastrointestinal, la aparición de neumonía, encefalitis, retinitis, hepatitis y cistitis por CMV2. La enfermedad por CMV es una causa de mortalidad elevada en los pacientes trasplantados, aunque ha disminuido en las últimas décadas, debido al empleo de estrategias de tratamiento anticipado en las que se inicia tratamiento antiviral una vez que el CMV es detectado en sangre2.
El CMV pertenece a la familia Herpersviridae, junto con el virus Epstein-Barr, herpes simplex, varicela-zoster y herpes virus tipo 6, 7 y 83. Se trata de un virus que está presente aproximadamente en la mitad de los adultos en países desarrollados4. Para la mayoría de las personas la infección por CMV no presenta síntomas importantes. Sin embargo, en los pacientes inmunodeprimidos puede ocasionar una enfermedad grave que puede llegar a causar la muerte5.
El ganciclovir es un antiviral indicado en la profilaxis y tratamiento de la enfermedad por CMV en el paciente trasplantado. Su principal efecto adverso es la toxicidad hematológica, que puede ser de extrema gravedad en el paciente inmunodeprimido6.
El foscarnet constituye la alternativa terapéutica. Es un agente antiviral perteneciente a la misma familia, pero sin la toxicidad hematológica previamente descrita del ganciclovir. Los efectos adversos frecuentes de foscarnet son alteraciones a nivel de la función renal, alteraciones hidroelectrolíticas y mala tolerabilidad, hechos por lo que su empleo es habitualmente restringido7. Durante las últimas décadas el ganciclovir ha sido el agente comúnmente utilizado en el tratamiento anticipado de la enfermedad por CMV en los pacientes trasplantados, mientras que foscarnet se indicaba para casos de resistencia o ineficacia de ganciclovir8.
En nuestro centro se evidenció un aumento en la utilización de foscarnet como tratamiento de la infección por CMV en pacientes trasplantados de médula ósea, ligado probablemente a la mayor actividad en trasplante alogénico.
El objetivo de este estudio es evaluar la eficacia y seguridad de la utilización de foscarnet para el tratamiento de la infección por CMV en pacientes trasplantados de médula ósea.
Material y métodos
Se realizó un estudio observacional retrospectivo. Se incluyeron todos los pacientes trasplantados de médula ósea que iniciaron tratamiento con foscarnet sódico intravenoso en un Hospital General Universitario durante un año (febrero 2014 a febrero 2015). Para la identificación de los pacientes y recogida de datos se utilizaron los módulos OncoWin® y PrescriWin® de la aplicación informática HospiWin®, bases de datos de analíticas (Gipi®), de microbiología (MicroSystem®) y de informes clínicos (Cajal®), así como la historia clínica en formato papel.
Se recogieron las siguientes variables: demográficas (edad y sexo), diagnósticas (patología y tipo de trasplante), terapéuticas (enfermedad por CMV documentada, tratamiento anterior, indicación de uso, dosis y duración de tratamiento con foscarnet, tipo de inmunosupresión inicial y tratamiento de continuación) y analíticas (antigenemia, fecha de positivización y negativización del CMV, toxicidad renal, neurológica, hematológica y metabólica).
La pauta empleada de foscarnet para el tratamiento de la infección por CMV fue 90 mg/kg cada 12 horas durante 14 días, seguidas de un mantenimiento de 90 mg/kg cada 24 horas durante otros 14 días. Se realizaron ajustes de dosis por deterioro de la función renal de acuerdo a las recomendaciones de la ficha técnica7.
En el momento del estudio el empleo de foscarnet estaba protocolizado en nuestro centro para el tratamiento de segunda línea de pacientes de alto riesgo, definidos como aquellos que presentaban citopenias en grado variable.
La eficacia se evaluó mediante la negativización del virus en sangre y la resolución del cuadro de viremia. Se consideró que el virus era negativo cuando el número de copias en sangre era ≤400 copias/ml, determinado por PCR. Se consideró resuelto el cuadro de viremia con la consecución de dos medidas por debajo de 400 copias/ml.
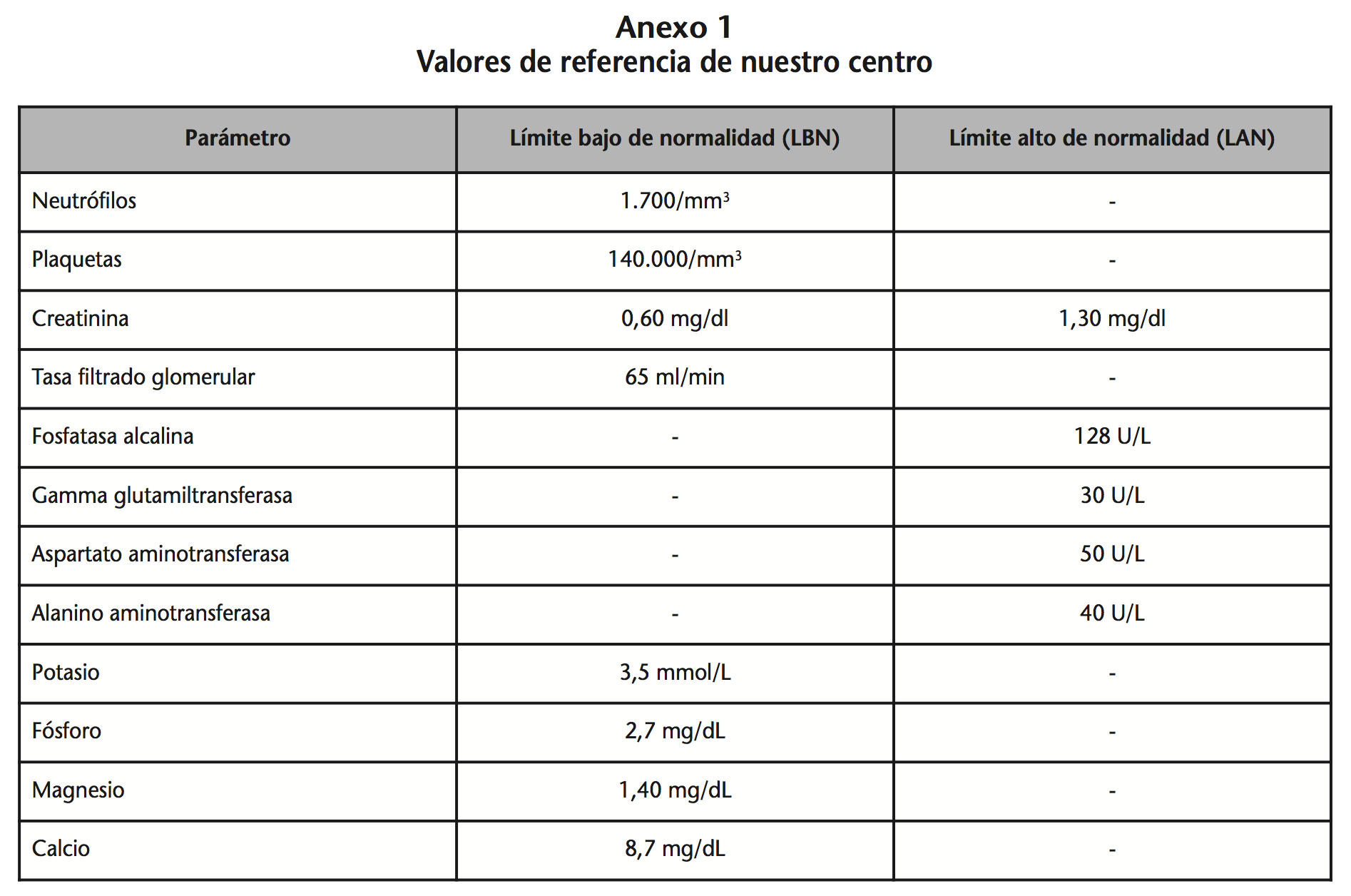
En el análisis de seguridad se analizaron específicamente las siguientes toxicidades: hematológica, renal, hepática, metabólica y neurológica. Los datos se recogieron de la historia clínica y de la base de datos de analíticas (Gipi®). Los grados de toxicidad se clasificaron en base a los Common Terminology Criteria for Adverse Events (CTCAE) Versión 4.09.
La toxicidad hematológica se definió como presencia de neutropenia y trombocitopenia, clasificándola en cuatro grados, según se recogen en la tabla 1. Los pacientes incluidos podían presentar citopenias de forma variable, por el uso previo de ganciclovir o por la propia infección por CMV, por lo que en este caso se analizó si el empleo de foscarnet produjo progresión en el grado de citopenias o no.
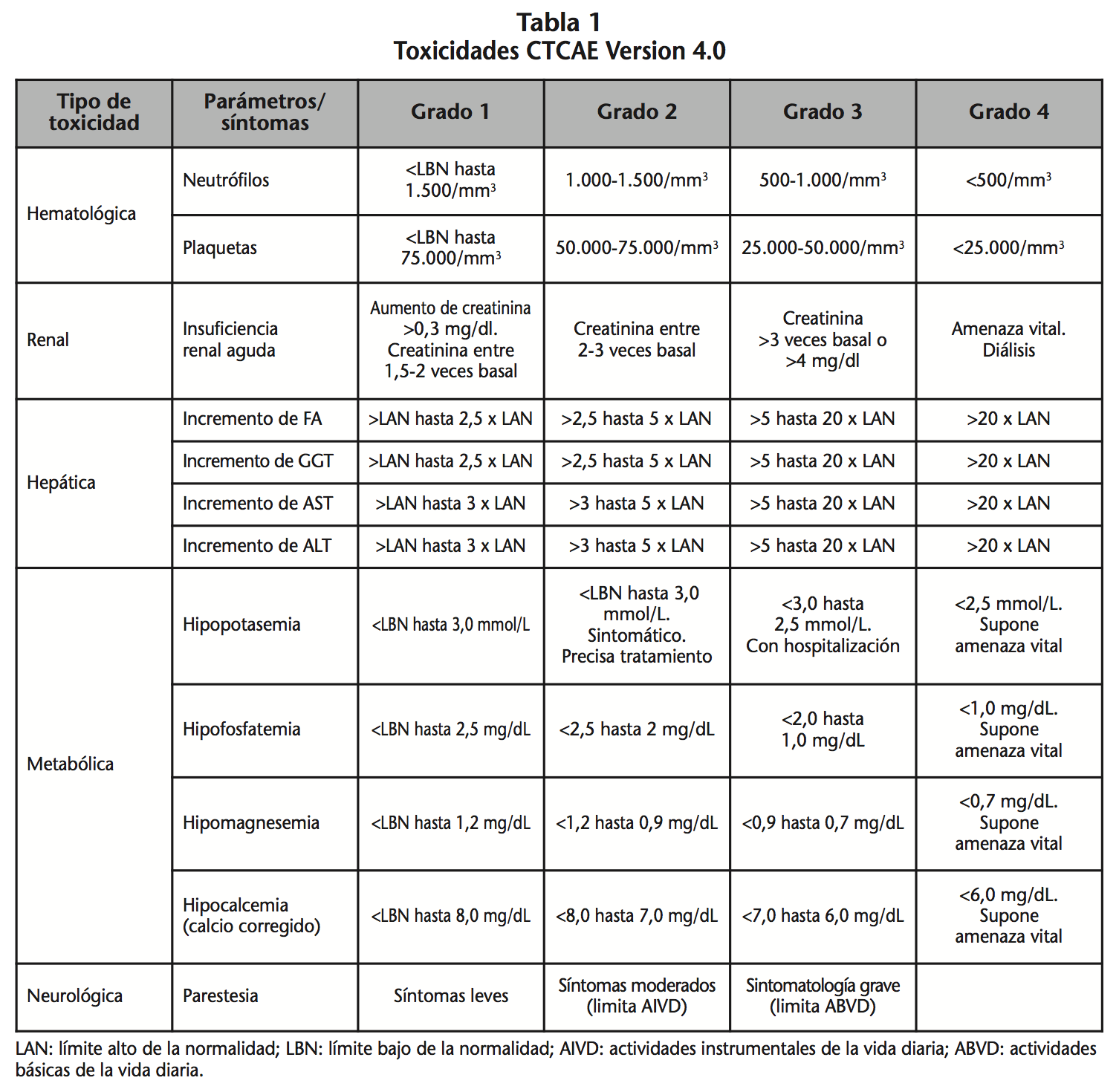
En cuanto a la toxicidad renal, se definió como insuficiencia renal aguda el aumento de la cifra de creatinina respecto al valor basal antes del tratamiento con foscarnet, clasificándose en 4 grados (Tabla 1). Se valoró si se produjo descenso de la tasa de filtrado glomerular por debajo del rango de normalidad, así como la presencia de tubulopatía. También se evaluó si se produjo asociación entre fallo renal y repercusión hidroelectrolítica.
La toxicidad hepática se analizó en función de varios parámetros analíticos, incluyendo valores enzimáticos de fosfatasa alcalina (FA), gamma glutamiltranspeptidasa (GGT), aspartato aminotransferasa (AST) y alanino aminotranferasa (ALT), considerando toxicidad según lo recogido en la tabla 1.
La toxicidad metabólica se evalúo según las alteraciones hidroelectrolíticas: valores séricos de potasio, fósforo, magnesio y calcio (Tabla 1)10.
La toxicidad neurológica se definió como aparición de parestesias. Se valoró además la repercusión del tratamiento sobre actividades instrumentales de la vida diaria (AIVD), como usar el teléfono, manejo de dinero y de utensilios (valorado dentro de ámbito de hospitalización), así como en las actividades básicas de la vida diaria (ABVD), como el autocuidado, aseo, vestirse o tomar medicación.
El análisis estadístico fue realizado con el programa STATA® Versión 12.0, según el test exacto de Fisher.
Los límites analíticos de normalidad empleados fueron los definidos en nuestro centro (Anexo 1).
Resultados
Se incluyó a 12 pacientes, de los cuales 7 fueron hombres (58,3%). La edad media fue de 45 años, con un rango de edad comprendido entre 24 y 65 años.
Las indicaciones de trasplante fueron: leucemia mieloide aguda (LMA) 33,3%, leucemia linfoide aguda (LLA) 33,3%, mieloma múltiple (MM) 8,3%, síndrome mielodisplásico (SMD) 8,3%, linfoma de Hodking (LH) 8,3% y mielofibrosis 8,3%.
En el 66,6% de los casos, donante y receptor eran seropositivos para CMV. En los 4 pacientes restantes (33,33%) unicamente era seropositivo el donante.
El 91,6% de los trasplantes fueron de progenitores hematopoyéticos provenientes de médula ósea/sangre periférica, mientras que uno de ellos fue dual (progenitores hematopoyéticos de un donante parcialmente idéntico y cordón umbilical), para disminuir así el prolongado periodo de aplasia que se observa tras un trasplante de sangre de cordón umbilical11. 8 trasplantes (66,6%) procedían de donante emparentado (DE) y 4 (33,33%) de donante no emparentado (DNE).
El 16,6% de los pacientes incluidos presentaban enfermedad por CMV de tipo intestinal y ocular, mientras que el 83,3% restante presentaba solo infección documentada en sangre. En cuanto a los tratamientos previos, el 66,7% de pacientes recibieron ganciclovir intravenoso, 25% aciclovir oral y 8,3% valganciclovir oral. Todos los pacientes habían recibido tratamiento corticoideo sistémico en las semanas previas.
Los motivos de cambio de tratamiento a foscarnet fueron pancitopenias severas inducidas por ganciclovir (66,7%) e ineficacia de valganciclovir oral (8,3%). El resto de pacientes estaba en tratamiento profiláctico con aciclovir oral y empezó tratamiento directamente con foscarnet.
El 66,7% de los pacientes recibieron las dosis protocolizadas de foscarnet, mientras que en el resto se realizó ajuste según función renal. La duración de la inducción osciló en un rango entre 8-27 días y el mantenimiento entre 4-35 días. La dosis media administrada en los pacientes con ajuste de dosis fue de 90 mg/kg cada 24 horas.
En cuanto a los resultados de eficacia, 10 pacientes (83,3%) negativizaron la viremia. Los 2 pacientes restantes (16,6%), aunque no negativizaron el virus en sangre ninguno presentó enfermedad por CMV. El 75% de los pacientes tratados previamente con ganciclovir negativizaron el virus en sangre así como el 100% de pacientes tratados con valganciclovir oral o que recibían aciclovir profiláctico. No existen diferencias de eficacia estadísticamente significativas en función del tratamiento previo con ganciclovir ((-0,55-0,50) IC95).
La media de tiempo hasta la negativización fue de 18,5±7,2 días (7-29 días). Tras la negativización del virus se suspendió foscarnet en todos los casos, continuando profilaxis oral de CMV con aciclovir un 60% de los pacientes y realizando tratamiento prolongado de mantenimiento con valganciclovir el 40% restante.
En cuanto a los resultados de seguridad, el 40% de los pacientes presentaron toxicidad grado 3-4. El 41,7% de los pacientes presentaron toxicidad renal, de los cuales un 8% fue grado 3 y un 8% grado 4 (Tabla 2). El 33,3% de los pacientes presentaron toxicidad hepática de grado 3 (Tabla 3). Todos los pacientes presentaron toxicidad metabólica, destacando la de grado 3: 58% hipopotasemia, 50% hipofosfatemia, 16% hipomagnesemia y 8% hipocalcemia. El 25% de los pacientes presentó hipofosfatemia grado 4 (Tabla 4). No se detectó toxicidad neurológica en ninguno de los pacientes.
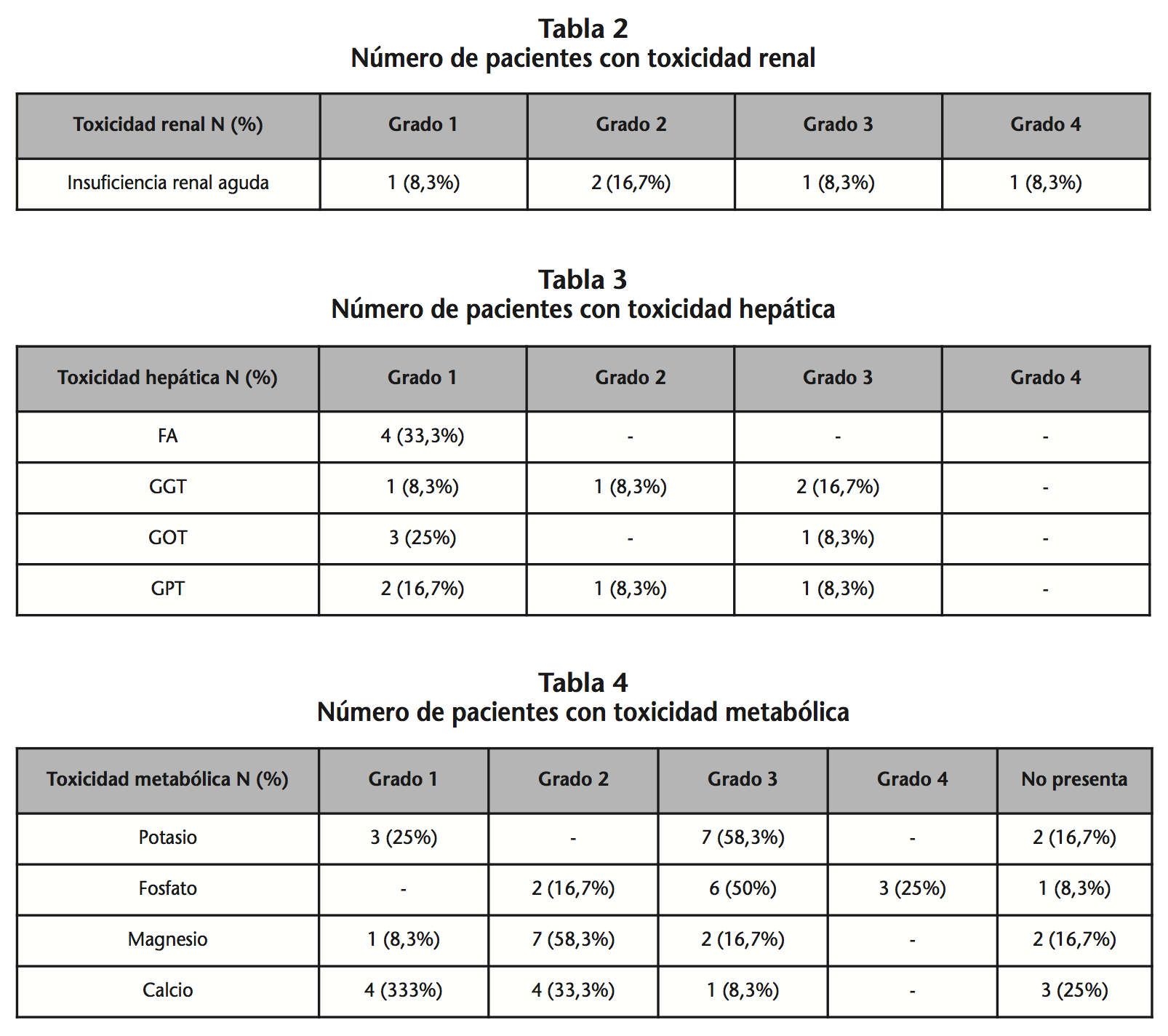
Un 83,3% de los pacientes presentaban neutropenia antes de iniciar tratamiento con foscarnet, siendo un 30% grado 3 y 50% grado 4. Durante el tratamiento con foscarnet, un paciente con límites normales de neutrófilos progresó a neutropenia grado 1 y otro paciente progresó de grado 2 a grado 4. En el 83,3% restante, la neutropenia no empeoró y se resolvió durante el tratamiento. 8 pacientes recibieron G-CSF (factores estimulantes de colonias de granulocitos) según la situación clínica y para acortar el periodo de neutropenia.
Todos los pacientes presentaban trombopenia previa al tratamiento con foscarnet, siendo para los grados 3 y 4 del 41%. En un 16,6% de los pacientes la trombopenia progresó a grado 4.
Discusión
El manejo de la infección por citomegalovirus en el período posterior al trasplante de médula ósea es una situación de riesgo debido a la inmunosupresión y la toxicidad de los tratamientos.
La utilización de foscarnet como tratamiento de la infección y enfermedad por CMV en pacientes trasplantados de médula ósea se plantea como una alternativa a la utilización de ganciclovir debido al elevado riesgo de pancitopenias graves producidas por este, lo que puede empeorar la situación basal del paciente.
Dado que existen diferentes pautas a utilizar de foscarnet, en nuestro centro las dosis de foscarnet protocolizadas son 90 mg/kg cada 12 horas en inducción y 90 mg/kg cada 24 horas en mantenimiento. Con estas dosis altas se intenta acortar el tiempo de alta replicación del virus y evitar el desarrollo de enfermedad sobre un órgano específico. En este sentido se observó que un tercio de los pacientes necesitaron ajuste de dosis por toxicidad renal. En un estudio similar de Asakura et al.12 no se consideraba realizar ajustes de dosis según función renal mientras que, por otro lado, la dosis inicial era variable dependiendo del tratamiento previo con ganciclovir. Así mismo Takami et al.13 realizó ajuste según función renal mientras que los pacientes con aclaramiento de creatinina menor de 40 ml/min fueron excluidos.
En el 83,3% de los pacientes la respuesta fue eficaz al negativizarse el CMV en sangre. Este resultado se encuentra entre los obtenidos por Asakura et al.12 y por Takami et al.13, del 80% y 90% de respuesta respectivamente. El 66,6% de los pacientes habían sido tratados previamente con ganciclovir, dato semejante al de Asakura et al.12, que concluyeron que la eficacia era mayor en pacientes sin tratamiento previo con ganciclovir, pese a no detectar diferencias estadísticamente significativas. Estos autores estiman que la diferencia podría ser debida al estado inmunológico y a la toma de esteroides de los pacientes tratados con ganciclovir (peor que en el grupo no tratado). En nuestro estudio tampoco se han encontrado diferencias estadísticamente significativas entre el grupo previamente tratado con ganciclovir y el tratado con aciclovir o valganciclovir.
Los datos de nuestro estudio señalaron una toxicidad renal grado 3 en un 8% de los pacientes y grado 4 en otro 8% de pacientes. Mientras que Asakura et al.12 encontraron un 2,8% de pacientes con toxicidad renal grado 3 y un 0,6% con grado 4. Esta disparidad podría deberse al protocolo de altas dosis utilizadas en nuestro centro y a las medidas tomadas como la hidratación intensa etc. Takami et al.13 realizaron ajuste de dosis en un 10% de los pacientes, sin especificar grados de toxicidad. Las toxicidades electrolíticas más destacadas fueron hipopotasemia e hipofosfatemia, ambas grado 3. Asakura et al.12 observan alteraciones electrolíticas grado 3 en un 8,4% de los pacientes pero no reflejan a que electrolitos afecta, por tanto en nuestro centro hay una mayor frecuencia, aspecto que también podría estar relacionado con las dosis utilizadas. También Takami et al.13 encontraron hipopotasemia e hipocalcemia en el 70% de los pacientes.
En general el empleo de foscarnet no empeoró el grado previo de neutropenia y trombopenia, y por tanto podríamos sugerir que presenta mejor perfil de seguridad hematológica que ganciclovir. En cuanto a la toxicidad renal, uno de los motivos por los que el uso de foscarnet se encontraba habitualmente restringido, el 58,3% de los pacientes de este estudio no presenta ningún grado de toxicidad, lo que se puede considerar como un perfil de seguridad renal aceptable.
La principal limitación del estudio es que se trata de un grupo reducido de pacientes. El tratamiento del CMV con foscarnet se reserva a pacientes no respondedores a otros tratamientos o con neutropenia severa, por ello nuestra muestra de pacientes es reducida. Sería interesante ampliar la muestra a pacientes con mejor estado basal, lo que aportaría más datos y la posibilidad de establecer una comparativa según el estado basal del paciente. Por otro lado, se trata de un estudio observacional retrospectivo, por lo que presenta las limitaciones inherentes de este tipo de estudios.
Como fortaleza podemos señalar la falta de estudios recientes similares en el ámbito de la atención farmacéutica al paciente hematológico. Nuestros datos provienen de la práctica clínica habitual y han sido revisados y analizados en colaboración con especialistas en hematología. Con este estudio, proporcionamos datos válidos para establecer un protocolo de consenso de utilización del fármaco en este tipo de pacientes.
En conclusión, foscarnet es eficaz en el tratamiento de la infección y enfermedad por CMV en pacientes trasplantados de medula ósea. Su perfil de seguridad es aceptable en este tipo de pacientes, por lo que se podría considerar que es un fármaco seguro. Por ello resulta una alternativa adecuada al tratamiento con ganciclovir en este tipo de pacientes. Se deberían realizar estudios para consensuar y protocolizar las pautas de tratamiento, acordes a las características previas del paciente.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Bibliografía
1. Ariza-Heredia Ella J, Nesher L, Chemaly Roy F. Cytomegalovirus diseases after hematopoietic stem celltransplantation: A mini-review. Cancer Letters. 2014;342(1):1-8.
2. Carreras E, Rovira M, Martinez C. (2010). Manual de trasplante hematopoyetico. 4ªedición. Editorial Antares.
3. Martín Peinador Y., Grupo de Patología Infecciosa AEPap. (2014). Aproximación diagnóstica a la infección por citomegalovirus. Obtenida el 30 de septiembre de 2015, de https://aepap.org/grupos/grupo-de- patologia-infecciosa/contenido/documentos-del-gpi.
4. Martín Peinador Y, Grupo de Patología Infecciosa AEPap. (2014) Prevención de la infección por Citomegalovirus (CMV) en la población. Obtenida el 30 de septiembre de 2015, de https://aepap.org/grupos/ grupo-de-patologia-infecciosa/contenido/documentos-del-gpi.
5. Jacobsen T, Sifontis N. Drug interactions and toxicities associated with the antiviral management of cytomegalovirus infection. Am J Health-Syst Pharm. 2010,67(17):1417-25.
6.Centro de Información online de Medicamentos de la AEMPS-CIMA. (2013). Ficha técnica de Ganciclovir. Obtenida el 5 de febrero de 2016, de http://www. aemps.gob.es/cima/dochtml/ft/58266/FichaTecnica_58266.html.
7. Centro de Información online de Medicamentos de la AEMPS-CIMA. (2014). Ficha técnica de Foscavir. Obtenida el 5 de febrero de 2016, de http://www. aemps.gob.es/cima/pdfs/es/ft/59712/FT 59712.pdf.
8. Bacigalupo A, Boyd A, Slipper J, Curtis J, Clissold S. Foscarnet in the management of cytomegalovirus infections in hematopoietic stem cell transplant patients. Expert Rev. Anti Infect Ther. 2012;10(11):1249-1264.
9. U.S. Department of health and human services. (2010). Common Terminology Criteria for Adverse Events (CTCAE), Versión 4.0. Obtenida el 30 de septiembre de 2015 de http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf.
10. Marzal-Alfaro MB, Manrique-Rodríguez S, Alcaraz Romero A, García San Prudencio M, Fernández-Llamazares CM. Infección sistémica por citomegalovirus: influencia del tratamiento con foscarnet en los niveles plasmáticos de calcio y magnesio. An Pediatr. (Barc) 2014;82(1):70-74.
11. Organización nacional de trasplante. (2012). Plan Nacional de Donación de Médula Ósea. Versión aprobada por la comisión de Trasplantes. Obtenida el 30 de septiembre de 2015 de http://www.ont.es/infesp/DocumentosDeConsenso/Plan%20Nacional%20M%C3%A9dula%20%C3%93sea.pdf.
12. Asakura M, Ikegame K, Yoshihara S, Taniguchi S, Mori T, Etoh T, et al. Use of foscarnet for cytomegalovirus infection after allogeneic hematopoietic stem cell transplantation from a related donor. Int J Hematol. 2010;92(1):351-359.
13. Takami A, Mochizuki K, Ito S, Sugimori C, Yamashita T, Asakura H, et al. Safety and Efficacy of Foscarnet for Preemptive Therapy Against Cytomegalovirus Reactivation After Unrelated Cord Blood Transplantation. Transplantation Proceedings. 2007;39(1):237-239.
____
Descargar artículo en PDF: Uso de foscarnet sódico en pacientes trasplantados de médula ósea con infección por CMV
