Hernández-Terciado C1, Calvo-Salvador M1, Delgado-Téllez-de-Cepeda L1, Ramos-Martínez A2, Sánchez-Guerrero A1
1 Servicio de Farmacia Hospitalaria. Hospital Universitario Puerta de Hierro. Majadahonda (España)
2 Servicio de Medicina Interna. Unidad de Enfermedades Infecciosas. Hospital Universitario Puerta de Hierro. Majadahonda (España)
Fecha de recepción: 23/12/2021 – Fecha de aceptación: 20/01/2022
Correspondencia: Carlos Hernández Terciado – Hospital Universitario Puerta de Hierro de Majadahonda (Servicio de Farmacia Hospitalaria) – C/Manuel de Falla, 1 – 28222 Majadahonda, (España)
chterciado@salud.madrid.org
_____
Resumen
Objetivo: Evaluar la utilización en la práctica clínica de cuatro antibióticos de amplio espectro o innovadores: ceftolozano/tazobactam, ceftazidima/avibactam, ceftarolina y dalbavancina.
Métodos: Estudio retrospectivo en que se han recogido datos de los pacientes que han recibido dichos antibióticos entre julio de 2018 y junio de 2019 en un hospital terciario. Se recogen las condiciones de uso y los resultados en efectividad a los 30 días para dalbavancina, y para el resto de antimicrobianos a los 3-5 días del inicio, a los 14 y a los 30 días para determinar mortalidad.
Resultados: Se recogieron datos de 51 pacientes, con una mediana de edad de 63 años. La infección más comúnmente tratada fue neumonía (41,2%). Tres pacientes (5,9%) recibieron la terapia en estudio como primera línea y 43 (84,3%) recibieron antibióticos concomitantes. En el 66,7% de las infecciones se había aislado previamente un microorganismo sensible. En el 19,6% de los casos el cultivo fue negativo. En el grupo dalbavancina, el 75% de los pacientes se curaron a los 30 días. En el resto de antimicrobianos, el tratamiento resultó efectivo a los 3-5 días en el 65,1%. El 51,2% se curaron a los 14 días y un 30,2% fallecieron a los 30 días.
Conclusiones: Los resultados de efectividad resultan comparables a estudios publicados con diseños similares. Se detecta la importancia de fomentar un uso adecuado de los antibióticos, como tratamientos dirigidos o empíricos en casos de riesgo de resistencias, priorizando su desescalada. Es esencial la implantación de equipos multidisciplinares PROA.
Palabras clave: Agentes antibacterianos, resistencia a los antibióticos, programas de optimización de uso de antimicrobianos, estudio de utilización de medicamentos, ceftolozano/tazobactam, ceftazidima/ avibactam, ceftarolina fosamil, dalbavancina.
Use of restricted antibiotics in clinical practice: ceftolozane/tazobactam, ceftazidime/avibactam, ceftaroline and dalbavancin
Summary
Objective: To evaluate the use in clinical practice of four recently marketed antibiotics: ceftolozane/tazobactam, ceftazidime/avibactam, ceftaroline, and dalbavancin.
Methods: Retrospective study in which data have been collected from patients who have received these antibiotics between July 2018 and June 2019, in a third-level hospital. The conditions of use and the results in clinical efficacy measured in three periods have been studied: 3-5 days after the start of treatment, 14 days and 30 days to determine mortality.
Results: Data were collected from a total of 51 patients, with a median age of 63 years. The most commonly treated infection was pneumonia (41.2%). Three patients (5.9%) received study therapy as the first line of treatment and 43 (84.3%) received concomitant antibiotics. In 66.7% of the infections, a sensitive microorganism to the antibiotic under study had been previously isolated. In 19.6% of the cases, the culture was negative. In the dalbavancin group, 75% of the pacients cured at day 30. In the other groups, the treatment was effective at 3-5 days in 65.1% of the cases. 51.2% experienced clinical cure at 14 days and 30.2% died at 30 days.
Conclusions: The effectiveness results are comparable to published studies with similar designs. The importance of promoting an adequate use of antibiotics is detected, as directed or empirical treatments in cases of risk of resistance, prioritizing their de-escalation. The implementation of multidisciplinary PROA teams is essential.
Key words: Anti-bacterial agents, drug resistance, bacterial, antimicrobial stewardship, drug utilization review, ceftolozane, tazobactam drug combination, avibactam, ceftazidime drug combination, ceftaroline fosamil, dalbavancin.
____
Introducción
La resistencia a los antibióticos se define como la capacidad de los microorganismos de seguir proliferando en presencia de antimicrobianos. En los últimos años se han ido incrementando estas resistencias, constituyendo en la actualidad una de las mayores amenazas para la salud mundial1. Se ha demostrado que este hecho aumenta la morbimortalidad de los pacientes e incrementa de forma notable el coste sanitario2. Tanto es así, que se estima que en el año 2050 puedan atribuirse hasta 10 millones de muertes a las resistencias a antibióticos, superando los fallecimientos por cáncer3. Los antibióticos presentan además un efecto ecológico, afectando no solo al paciente tratado, sino también al resto de personas de una comunidad1.
Uno de los factores de riesgo para la aparición de resistencias a los antibióticos es la utilización excesiva de antimicrobianos, especialmente de aquéllos de amplio espectro4.
Se han ido implementando diferentes medidas para favorecer la utilización correcta de los antibióticos, reservando aquéllos de más amplio espectro y más innovadores para tratar infecciones causadas por bacterias resistentes. Dentro de estas medidas se encuentran los Programas de Optimización de uso de los Antimicrobianos (PROA), enfocados en mejorar los resultados clínicos de los pacientes minimizando los efectos secundarios, reduciendo la aparición de resistencias y garantizando la utilización de tratamientos coste-efectivos5.
En los últimos años se han desarrollado algunos antibióticos de amplio espectro o con características innovadoras: ceftolozano/tazobactam (C/T), ceftazidima/avibactam (C/A), ceftarolina (CTR) y dalbavancina (DBV).
C/T y C/A son combinaciones de cefalosporina e inhibidor de beta-lactamasa. Tazobactam es capaz de inhibir numerosas beta-lactamasas de espectro extendido (BLEE) de clase molecular A, incluyendo las enzimas CTX-M, SHV y TEM6, siendo una alternativa importante ante la sospecha de infecciones por enterobacterias productoras de BLEEs o cepas multirresistentes. Avibactam tiene la capacidad de inhibir las beta-lactamasas de clase A y C de Ambler y algunas enzimas de la clase D, incluyendo BLEE, carbapenemasas KPC y OXA-48 y cefalosporinasas de clase C (AmpC)7. Ambos constituyen una opción terapéutica importante para el tratamiento de infecciones causadas por bacterias Gram-negativas multirresistentes, especialmente Pseudomonas multirresistente, y para pacientes con limitadas opciones terapéuticas. Están indicados para el tratamiento de infección intraabdominal complicada, infección complicada del tracto urinario (incluyendo pielonefritis) y neumonía intrahospitalaria (incluyendo neumonía asociada a ventilación mecánica). Adicionalmente, C/A está indicada para bacteriemia asociada a cualquiera de las anteriores, así como para el tratamiento de infecciones por microorganismos aerobios Gram-negativos en pacientes con opciones terapéuticas limitadas8-12.
CTR es una cefalosporina de quinta generación de amplio espectro, activa frente a bacterias Gram-positivas y Gram-negativas, incluyendo Staphylococcus aureus resistente a meticilina (SARM). Ha sido aprobada para el tratamiento de infecciones de la piel y tejidos blandos de la piel y de la neumonía adquirida en la comunidad13-17, constituyendo una buena alternativa en infecciones con alta sospecha de SARM.
Por último, DBV es un antibiótico lipoglicopeptídico activo frente a bacterias Gram-positivas indicado para el tratamiento de infecciones bacterianas agudas de la piel y de los tejidos blandos de la piel, y presenta la ventaja de poder ser administrada en dosis única o en dos dosis con una semana de separación entre ambas gracias a su larga semivida18,19.
El objetivo de este estudio es evaluar la utilización en la práctica clínica de estos cuatro antibióticos innovadores (C/T, C/A, CTR y DBV), revisando la indicación a tratar y su efectividad clínica.
Métodos
Diseño del estudio
Se trata de un estudio observacional y retrospectivo en un hospital de tercer nivel. Se estudiaron las condiciones de uso en la práctica clínica y los resultados en efectividad de los antibióticos C/T, C/A, CTR y DBV.
Se incluyeron en el estudio todos los pacientes que recibieron al menos una dosis de C/T, C/A, CTR o DBV en el periodo de tiempo comprendido entre julio de 2018 y junio de 2019, ambos incluidos. Este estudio fue autorizado por el Comité Ético de Investigación con Medicamentos de nuestro hospital a fecha de 13 de enero de 2020.
Para evaluar las condiciones de utilización de dichos antibióticos se recogieron las siguientes variables: datos demográficos, tipo de infección, aislamiento de patógenos en cultivos microbiológicos, antibiograma, terapia antibiótica previa y concomitante, duración del tratamiento y efectividad clínica. Los datos se obtuvieron a través del programa de farmacia (Farmatools®), así como de prescripción e historia clínica (Selene®) y del módulo de resultados microbiológicos (Servolab®).
Se realizó un análisis descriptivo expresando las variables categóricas como frecuencia y porcentaje, y las continuas como mediana y rango intercuartílico (RIC).
Definiciones
Para los grupos C/T, C/A y CTR se evaluó la efectividad del tratamiento antimicrobiano en tres periodos de seguimiento: seguimiento precoz (a los 3-5 días del inicio de la terapia), seguimiento a los 14 días de la última dosis de antibiótico y seguimiento tardío a los 30 días del fin de tratamiento para determinar mortalidad.
No se evaluó la efectividad precoz ni a los 14 días en los pacientes tratados con DBV por su elevada semivida y por ser administrada cada 1-2 semanas. La efectividad clínica en este grupo de pacientes se evaluó a los 30 días de la finalización del tratamiento.
Se ha definido efectividad o curación clínica como aquella situación en que se resuelven por completo los síntomas y signos de la enfermedad, o que mejoran de manera notable sin la necesidad de tratamiento antimicrobiano adicional. Se ha determinado el escenario de fracaso clínico cuando los síntomas o signos de la enfermedad se mantienen durante el periodo de seguimiento, cuando se requiere la utilización de otro antimicrobiano o cuando se produce la muerte del paciente por cualquier causa.
Resultados
Tras el periodo mencionado de 12 meses se han recogido datos de un total de 51 pacientes, con la siguiente distribución: 16 tratados con C/T (31,4%), 12 con C/A (23,5%), 15 con CTR (29,4%) y 8 con DBV (15,7%).
El rango de edad de los pacientes fue de 28 a 85 años (mediana de 63 años, RIC 54,5-69 años). El 62,7% de los pacientes eran varones. La mayoría de los pacientes se encontraban ingresados en la Unidad de Cuidados Intensivos (56,9%).
Infecciones
Veintiún pacientes (41,2%) recibieron el antibiótico en estudio para tratar una neumonía. Dentro de los grupos C/T, C/A y CTR esta patología fue la mayoritaria, ya que estuvo presente en el 37,5%, 33,3% y 73,3% de los casos, respectivamente. DBV se utilizó con más frecuencia para el tratamiento de endocarditis (50%).
Treinta y cuatro pacientes (66,7%) recibieron la antibioterapia para el tratamiento de una infección indicada en ficha técnica (FT): 75% para C/T, 67% para C/A, 73% para CTR y 37,5% para el grupo DBV. Dentro de los usos fuera de la indicación autorizada destaca el tratamiento de osteomielitis (3 con C/T y 1 con CTR) y endocarditis (4 con DBV, 3 con CTR y 1 con C/A).
De los 51 pacientes, 3 recibieron la antibioterapia en estudio como primera línea de tratamiento (5,9%). Todos los pacientes tratados con C/A y DBV recibieron antimicrobianos en líneas anteriores. El 15,7% de los pacientes (n=8) recibieron el antibiótico en estudio como monoterapia, de los cuales la mitad pertenecen al grupo DBV.
El antibiótico más comúnmente asociado a C/T y a C/A fue linezolid (46,7% y 41,7%, respectivamente). 6 pacientes del grupo CTR recibieron también levofloxacino (46,2%). La mitad de los pacientes con antibioterapia concomitante a DBV recibieron rifampicina.
La duración del tratamiento con C/T fue de entre 2 y 32 días (mediana 10 días, RIC 4-15 días). Con C/A los pacientes fueron tratados entre 4 y 84 días (mediana 14, RIC 4-9). La duración del tratamiento con CTR fue de 2-38 días (mediana 6, RIC 4-13), y con DBV de 1-266 días (mediana 10,5, RIC 5-14). Un paciente en diálisis recibió un total de 26 dosis de DBV para tratar una endocarditis complicada por Staphylococcus epidermidis sobre válvula protésica.
Microorganismos
El 66,7% de los pacientes recibieron el tratamiento para una infección por microorganismos sensibles in vitro, como Pseudomonas aeruginosa tratada con C/T o Staphylococcus aureus con CTR o DBV. La sensibilidad fue confirmada por antibiograma en 8 pacientes (22,9% de los aislamientos). Un paciente con fibrosis quística colonizado por Pseudomonas aeruginosa fue tratado con C/T de manera profiláctica antes de un trasplante pulmonar. En el resto de pacientes los cultivos resultaron negativos (19,6%), se aislaron microorganismos con dudosa sensibilidad o se trataba de infecciones polimicrobianas.
Trece pacientes del grupo C/T (81,2%) lo recibieron para tratar infecciones por bacterias sensibles in vitro. De éstos, 11 estaban infectados con Pseudomonas aeruginosa (68,7% del grupo C/T). En 2 ocasiones (12,5%), C/T se utilizó para el tratamiento de un microorganismo resistente (Enterococcus spp. C/T fue desescalado a un antibiótico de menor espectro en el 33% de los casos, gracias a los resultados de los antibiogramas o a la mejoría clínica de los pacientes.
C/A se utilizó en 5 pacientes para tratar microorganismos sensibles (41,7% del grupo). La infección por Klebsiella pneumoniae fue la más frecuente (n=3, 25% del grupo C/A). En 2 pacientes (16,7%) el patógeno era resistente (Enterococcus spp.), mientras que en otros 2 pacientes se produjeron infecciones mixtas. En el 33,3% de los pacientes el tratamiento con C/A pudo desescalarse a antibióticos de menor espectro.
En 7 pacientes del grupo CTR (46,7%) no se aisló ningún microorganismo antes de su inicio. Los 8 patógenos que sí se aislaron eran sensibles. Seis personas sufrían una infección por Staphylococcus spp. (40% del grupo CTR), tratándose en 2 de los casos de Staphylococcus aureus sensible a meticilina (SASM).
En todos los pacientes del grupo DBV se habían aislado microorganismos sensibles. El patógeno más habitual fue Enterococcus spp. (62,5%). En 6 pacientes (75%) se utilizó DBV para dar altas precoces con respecto a una terapia antimicrobiana intravenosa convencional.
En la tabla 1 se recogen, según los grupos de tratamiento, las infecciones a tratar y los microorganismos causantes.
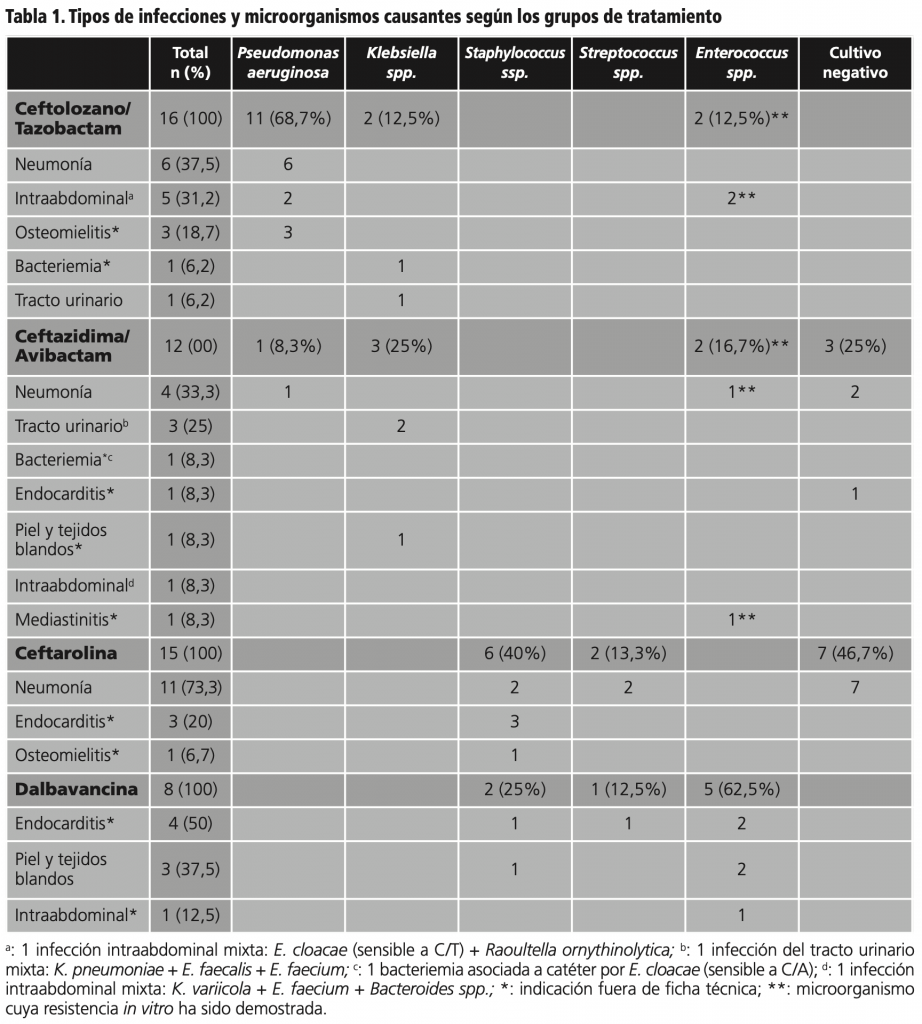
Efectividad clínica
La efectividad a los 30 días en el grupo DBV la experimentaron 6 de los 8 pacientes (75%). Para el resto de antimicrobianos, el tratamiento fue efectivo de manera precoz en 28 de los 43 pacientes (65,1%). A los 14 días, 22 pacientes experimentaron curación clínica (51,2%) y 13 pacientes fallecieron a los 30 días de finalizar el tratamiento (30,2%).
El desglose por grupos se muestra en la figura 1.
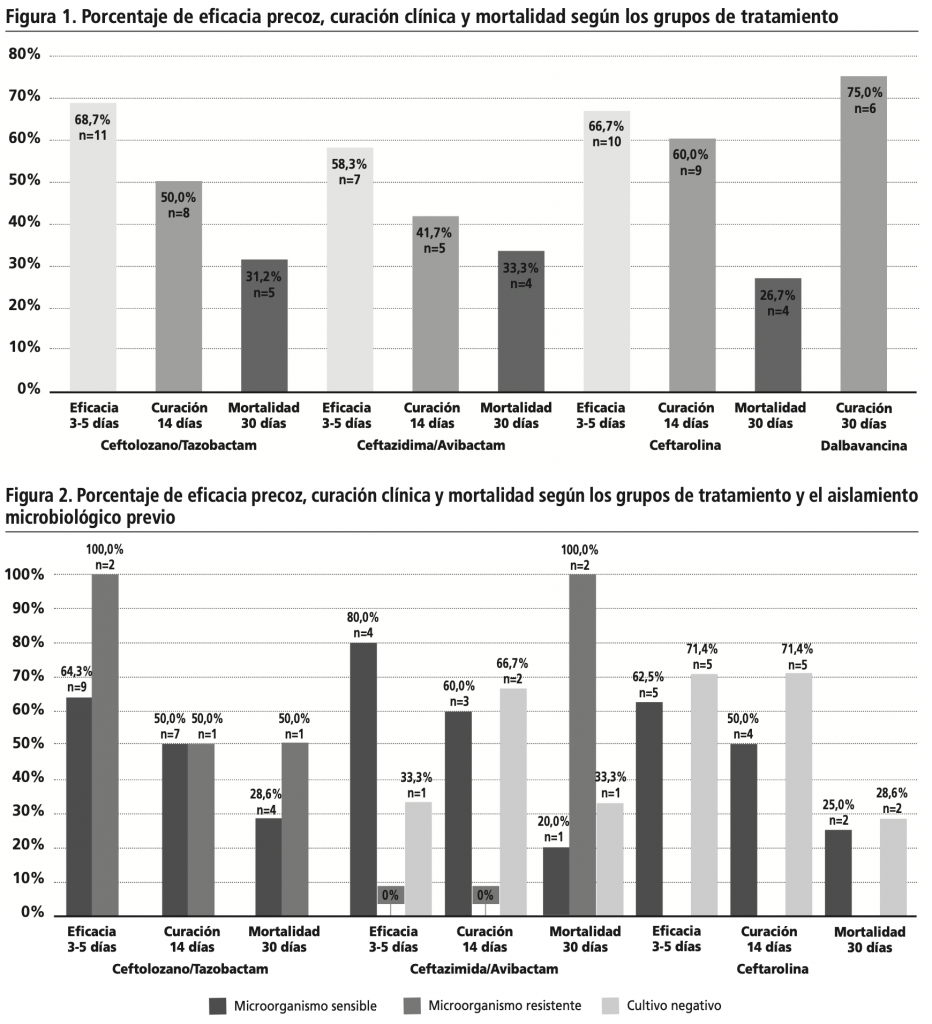
El resultado de efectividad precoz en los pacientes con microorganismos sensibles fue del 66,7%. En aquéllos sin aislamiento previo fue del 60%, mientras que en los que se aislaron microorganismos resistentes in vitro se resolvió la infección en el 50%.
En cuanto a la mortalidad a los 30 días, fue menor en los pacientes con cultivo sensible (25,9%) que en los pacientes con cultivo negativo (30%), y que en los pacientes con cultivos resistentes (75%).
El desglose según aislamiento microbiológico y grupos de tratamiento se recoge en la figura 2.
Discusión
Las indicaciones que figuran en la ficha técnica de muchos antibióticos no reflejan sus condiciones de uso habituales, debido probablemente a que la actualización de los documentos regulatorios es más lenta que las necesidades terapéuticas reales. En nuestro estudio, en un tercio de los casos se utilizaron los fármacos para tratar infecciones no autorizadas según ficha técnica. Los usos fuera de indicación más frecuentes fueron el tratamiento de osteomielitis con C/T (el 18% de los casos) y las endocarditis tratadas con CTR y DBV, que han supuesto el 20% y el 50% de los casos, respectivamente.
C/T es un buen agente para el tratamiento de infecciones por cepas de Pseudomonas aeruginosa resistentes, al igual que colistina y aminoglucósidos20. En nuestro estudio ha sido utilizado mayoritariamente para tratar dicho patógeno (68,7%), al igual que en otros estudios publicados en vida real, donde se utilizó para el tratamiento de Pseudomonas aeruginosa en el 88,8% de los pacientes21.
Los datos de efectividad reportados en el presente estudio (68,7% de efectividad precoz y 50,0% a los 14 días) se asemejan a los datos publicados en estudios multicéntricos con características similares. En un estudio francés, publicado por Castan et al., se objetiva una ratio de curación del 61,1%21, mientras que, en otro trabajo, en que se evalúa la efectividad de C/T para tratar Pseudomonas aeruginosa en indicaciones fuera de ficha técnica, la curación alcanza el 76,2%22.
C/A es un fármaco con efectividad demostrada frente a patógenos resistentes a carbapenems y a otros betalactámicos23, siendo por ello una buena alternativa terapéutica en los pacientes con pocas opciones de tratamiento. En nuestro caso se ha utilizado de forma empírica en un 67%, si bien todos los pacientes habían recibido un tratamiento antibiótico previo y se pudo desescalar a un antibiótico de menor espectro en un tercio de los casos.
Los resultados de nuestro estudio (58,3% de efectividad precoz y 41,7% a los 14 días, con mortalidad del 33,3%) son comparables a la mayoría de publicaciones en vida real, en los que la ratio de efectividad clínica varía entre el 45% y el 100% y la mortalidad a los 30 días entre el 0% y 63%24.
En nuestro trabajo el tratamiento de infecciones con implicación de Enterococcus spp. no ha resultado efectivo. Este hecho puede explicarse por la resistencia in vitro a C/T y C/A, o bien por la complejidad de los pacientes.
Staphylococcus aureus es uno de los patógenos más comúnmente aislados, y causa infecciones tanto en el medio hospitalario como comunitario25. Resulta de gran importancia reservar antibióticos eficaces para tratar infecciones por este microorganismo. CTR ha demostrado ser efectivo para el tratamiento de infecciones por SARM, incluso de aquellas cepas resistentes a vancomicina, daptomicina o linezolid26. En nuestro estudio, para tratar infecciones por bacterias Gram-positivas (generalmente Staphylococcus spp.), el 71% de los pacientes recibieron CTR después de vancomicina, daptomicina o linezolid. En un 13% de los casos totales la cepa aislada fue un estafilococo sensible a meticilina (SASM), justificado por la inefectividad de otros antibióticos dirigidos.
En nuestro estudio se presenta una efectividad precoz del 66,7%, y del 60,0% a los 14 días. En una revisión sistemática en que se evalúa CTR para el tratamiento de neumonía, infección mayoritaria en nuestro trabajo, se publica una efectividad del 81,2%27. En una revisión del uso de CTR fuera de la indicación aprobada, la efectividad clínica se sitúa en el 77%28.
En cuanto al uso de DBV, se confirma como una buena alternativa para el tratamiento de bacterias Gram-positivas, sobre todo en casos en que pueda reducirse la estancia hospitalaria. En nuestro estudio, DBV se utilizó en todos los casos para tratar infecciones por patógenos sensibles, y todos los pacientes habían recibido antimicrobianos previamente.
En el 75% de los casos los pacientes fueron dados de alta tras el tratamiento y objetivaron curación clínica. Los resultados son comparables a estudios en vida real en nuestro entorno, donde se publica una efectividad del 84,1%29, y a revisiones sistemáticas de su utilización fuera de indicación, en que se reporta un 81,1% de efectividad en endocarditis30, infección mayoritaria en nuestro trabajo.
Debemos destacar la importante limitación de este estudio unicéntrico con un número reducido de casos incluidos. Asimismo, el análisis retrospectivo puede motivar la pérdida de datos relevantes. No se ha tenido en cuenta el patrón de resistencias en nuestro centro, lo que puede ser relevante en cuanto al tratamiento empírico, ni tampoco la existencia de variables relacionadas con el pronóstico, no incluidas en el análisis. Se tiene en cuenta también la limitación que supone comparar estudios con diferentes metodologías.
En este estudio se muestra la utilización en vida real de cuatro antibióticos innovadores. Según los datos observados, se detecta la gran importancia de fomentar un uso adecuado de dichos antibióticos, ya sea como tratamientos dirigidos o de manera empírica en casos de alto riesgo de infecciones resistentes, priorizando en este escenario la desescalada cuando sea posible. Por ello, es esencial la implantación de equipos multidisciplinares PROA, que fomenten el buen uso de estos tratamientos, para garantizar la disponibilidad de medicamentos eficaces y la disminución de la aparición de resistencias.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Organización Mundial de la Salud. Resistencia a los antibióticos [Internet]. Centro de prensa. Notas descriptivas. [Publicado 31 jul 2020]. [Consultado 17 Nov 2021]. Disponible en: https://www.who.int/es/news-room/fact-sheets/detail/resistencia-a-los-antibi%C3%B3ticos#:~:text=La%20resistencia %20a%20los%20antibi%C3%B3ticos%20se%20produce%20cuando%20las%20bacterias,vuelven%20resistentes%20a%20los%20antibi%C3%B3ticos.
2. Gulen TA, Guner R, Celikbilek N, Keske S, Tasyaran M. Clinical importance and cost of bacteremia caused by nosocomial multi drug resistant acinetobacter baumannii. Int J Infect Dis. 2015 Sep;38:32-5. doi: 10.1016/j.ijid.2015.06.014.
3. Jim O’Neill. Antimicrobial resistance: tackling a crisis for the Health and wealth of nations. The Review on Antimicrobial resistance chaired by Jim O’Neill. 2014.
4. Palacios-Baena ZR, Giannella M, Manissero D, Rodríguez-Baño J, Viale P, Lopes S, et al. Risk factors for carbapenem-resistant Gram-negative bacterial infections: a systematic review. Clin Microbiol Infect. 2021 Feb;27(2):228-235. doi: 10.1016/j.cmi.2020.10.016.
5. Rodríguez-Baño J, Paño-Pardo JR, Alvarez-Rocha L, Asensio Á, Calbo E, Cercenado E, et al; GEIH-SEIMC; SEFH; SEMPSPH. Programas de optimización de uso de antimicrobianos (PROA) en hospitales españoles: documento de consenso GEIH-SEIMC, SEFH y SEMPSPH. Farm Hosp. 2012 Jan-Feb;36(1):33.e1-30. Spanish. doi: 10.1016/j.farma.2011.10.001.
6. Zerbaxa®. Ficha Técnica del medicamento. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). [Consultado 17 Nov 2021]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1151032001/FT_1151032001.html.
7. Zavicefta®. Ficha Técnica del medicamento. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). [Consultado 17 Nov 2021]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1161109001/FT_1161109001.html.
8. Kollef MH, Nováček M, Kivistik Ü, Réa-Neto Á, Shime N, Martin-Loeches I, et al. Ceftolozane-tazobactam versus meropenem for treatment of nosocomial pneumonia (ASPECT-NP): a randomised, controlled, double-blind, phase 3, non-inferiority trial. Lancet Infect Dis. 2019 Dec;19(12):1299-1311. doi: 10.1016/ S1473-3099(19)30403-7.
9. Solomkin J, Hershberger E, Miller B, Popejoy M, Friedland I, Steenbergen J, et al. Ceftolozane/Tazobactam Plus Metronidazole for Complicated Intra-abdominal Infections in an Era of Multidrug Resistance: Results From a Randomized, Double-Blind, Phase 3 Trial (ASPECT-cIAI). Clin Infect Dis. 2015 May 15;60(10):1462-71. doi: 10.1093/cid/civ097.
10. Wagenlehner FM, Umeh O, Steenbergen J, Yuan G, Darouiche RO. Ceftolozane-tazobactam compared with levofloxacin in the treatment of complicated urinary-tract infections, including pyelonephritis: a randomised, double-blind, phase 3 trial (ASPECT-cUTI). Lancet. 2015 May 16;385(9981):1949-56. doi: 10.1016/S0140-6736(14)62220-0.
11. Mazuski JE, Gasink LB, Armstrong J, Broadhurst H, Stone GG, Rank D, et al. Efficacy and Safety of Ceftazidime-Avibactam Plus Metronidazole Versus Meropenem in the Treatment of Complicated Intra-abdominal Infection: Results From a Randomized, Controlled, Double-Blind, Phase 3 Program. Clin Infect Dis. 2016 Jun 1;62(11):1380-1389. doi: 10.1093/cid/ciw133.
12. Wagenlehner FM, Sobel JD, Newell P, Armstrong J, Huang X, Stone GG, et al. Ceftazidime-avibactam Versus Doripenem for the Treatment of Complicated Urinary Tract Infections, Including Acute Pyelonephritis: RECAPTURE, a Phase 3 Randomized Trial Program. Clin Infect Dis. 2016 Sep 15;63(6):754-762. doi: 10.1093/cid/ciw378.
13. Corey GR, Wilcox MH, Talbot GH, Thye D, Friedland D, Baculik T; CANVAS 1 investigators. CANVAS 1: the first Phase III, randomized, double-blind study evaluating ceftaroline fosamil for the treatment of patients with complicated skin and skin structure infections. J Antimicrob Chemother. 2010 Nov;65 Suppl 4:iv41-51. doi: 10.1093/jac/dkq254.
14. Wilcox MH, Corey GR, Talbot GH, Thye D, Friedland D, Baculik T; CANVAS 2 investigators. CANVAS 2: the second Phase III, randomized, double-blind study evaluating ceftaroline fosamil for the treatment of patients with complicated skin and skin structure infections. J Antimicrob Chemother. 2010 Nov;65 Suppl 4:iv53-iv65. doi: 10.1093/jac/dkq255.
15. File TM Jr, Low DE, Eckburg PB, Talbot GH, Friedland HD, Lee J, et al; FOCUS 1 investigators. FOCUS 1: a randomized, double-blinded, multicentre, Phase III trial of the efficacy and safety of ceftaroline fosamil versus ceftriaxone in community-acquired pneumonia. J Antimicrob Chemother. 2011 Apr;66 Suppl 3:iii19-32. doi: 10.1093/jac/dkr096.
16. Low DE, File TM Jr, Eckburg PB, Talbot GH, David Friedland H, Lee J, et al; FOCUS 2 investigators. FOCUS 2: a randomized, double-blinded, multicentre, Phase III trial of the efficacy and safety of ceftaroline fosamil versus ceftriaxone in community-acquired pneumonia. J Antimicrob Chemother. 2011 Apr;66 Suppl 3:iii33-44. doi: 10.1093/jac/dkr097.
17. Zinforo®. Ficha Técnica del medicamento. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). [Consultado 17 Nov 2021]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/12785001/FT_12785001.html.
18. Boucher HW, Wilcox M, Talbot GH, Puttagunta S, Das AF, Dunne MW. Once-weekly dalbavancin versus daily conventional therapy for skin infection. N Engl J Med. 2014 Jun 5;370(23):2169-79. doi: 10.1056/NEJMoa1310480.
19. Xydalba®. Ficha Técnica del medicamento. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). [Consultado 17 Nov 2021]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/114986001/FT_114986001.html.
20. García-Fernández S, García-Castillo M, Bou G, Calvo J, Cercenado E, Delgado M, et al; SUPERIOR Study Group. Activity of ceftolozane/tazobactam against Pseudomonas aeruginosa and Enterobacterales isolates recovered from intensive care unit patients in Spain: The SUPERIOR multicentre study. Int J Antimicrob Agents. 2019 May;53(5):682-688. doi: 10.1016/j.ijantimicag.2019.02.004.
21. Castan B, Akrich B, Levy-Bachelot L, Amode A, Berthelot A, Mackosso C, et al. Real-world evaluation of ceftolozane/tazobactam therapy and clinical outcomes in France. Infect Dis Now. 2021 Sep;51(6):532-539. doi: 10.1016/j.idnow.2021.05.003.
22. Maraolo AE, Mazzitelli M, Trecarichi EM, Buonomo AR, Torti C, Gentile I. Ceftolozane/tazobactam for difficult-to-treat Pseudomonas aeruginosa infections: A systematic review of its efficacy and safety for off-label indications. Int J Antimicrob Agents. 2020 Mar;55(3):105891. doi: 10.1016/j.ijantimicag.2020.105891.
23. Castanheira M, Mills JC, Costello SE, Jones RN, Sader HS. Ceftazidime-avibactam activity tested against Enterobacteriaceae isolates from U.S. hospitals (2011 to 2013) and characterization of β-lactamase-producing strains. Antimicrob Agents Chemother. 2015;59(6):3509-17. doi: 10.1128/AAC.00163-15.
24. Soriano A, Carmeli Y, Omrani AS, Moore LSP, Tawadrous M, Irani P. Ceftazidime-Avibactam for the Treatment of Serious Gram-Negative Infections with Limited Treatment Options: A Systematic Literature Review. Infect Dis Ther. 2021 Dec;10(4):1989-2034. doi: 10.1007/s40121-021-00507-6.
25. David MZ, Daum RS. Community-associated methicillin-resistant Staphylococcus aureus: epidemiology and clinical consequences of an emerging epidemic. Clin Microbiol Rev. 2010 Jul;23(3):616-87. doi: 10.1128/CMR.00081-09.
26. Sader HS, Flamm RK, Jones RN. Antimicrobial activity of ceftaroline tested against staphylococci with reduced susceptibility to linezolid, daptomycin, or vancomycin from U.S. hospitals, 2008 to 2011. Antimicrob Agents Chemother. 2013 Jul;57(7):3178-81. doi: 10.1128/AAC.00484-13.
27. Sotgiu G, Aliberti S, Gramegna A, Mantero M, Di Pasquale M, Trogu F, et al. Efficacy and effectiveness of Ceftaroline Fosamil in patients with pneumonia: a systematic review and meta-analysis. Respir Res. 2018 Oct 23;19(1):205. doi: 10.1186/s12931-018-0905-x.
28. Pani A, Colombo F, Agnelli F, Frantellizzi V, Baratta F, Pastori D, et al. Off-label use of ceftaroline fosamil: A systematic review. Int J Antimicrob Agents. 2019 Nov;54(5):562-571. doi: 10.1016/j.ijantimicag.2019.06.025.
29. Bouza E, Valerio M, Soriano A, Morata L, Carus EG, Rodríguez-González C, et al; DALBUSE Study Group (Dalbavancina: Estudio de su uso clinico en España). Dalbavancin in the treatment of different gram-positive infections: a real-life experience. Int J Antimicrob Agents. 2018 Apr;51(4):571-577. doi: 10.1016/j.ijantimicag.2017.11.008.
30. Gatti M, Andreoni M, Pea F, Viale P. Real-World Use of Dalbavancin in the Era of Empowerment of Outpatient Antimicrobial Treatment: A Careful Appraisal Beyond Approved Indications Focusing on Unmet Clinical Needs. Drug Des Devel Ther. 2021 Aug 3;15:3349-3378. doi: 10.2147/DDDT.S313756.
____
