Fecha de recepción: 29/06/2017 – Fecha de aceptación: 26/09/2017
Alañón Pardo MM1, Áreas del Águila VL1, Cuadra Díaz JL2, Paulino Huertas M2, Ariza Hernández A2,
Rodríguez Martínez M1
1 Servicio de Farmacia
2 Servicio de Reumatología
Hospital General Universitario de Ciudad Real. Ciudad Real (España)
____
Correspondencia:
María del Mar Alañón Pardo
Calle Real, 133
13380 Aldea del Rey (Ciudad Real)
Correo electrónico: malanonp@sescam.jccm.es
____
Resumen
Objetivos: Analizar la utilización de fármacos antirreumáticos modificadores de la enfermedad (FAME) biológicos (FAME-b) cuando se prescriben en monoterapia en artritis reumatoide (AR) y sus causas, así como su efectividad y seguridad solos o combinados con FAME convencionales (FAME-c); y estimar la adherencia a los FAME-b administrados por vía subcutánea y a sus FAME-c asociados.
Métodos: Estudio transversal en pacientes con AR tratados con FAME-b en abril 2015, utilizados en combinación con FAME-c (terapia combinada [TC]) o sin combinar (monoterapia biológica [MB]). La efectividad se definió como actividad inflamatoria baja (DAS28 ≤3,2) o remisión (DAS28 ≤2,6). La adherencia fue calculada mediante “razón de posesión de medicación” (MPR) y cuestionario autoadministrado (Compliance Questionnaire Rheumatology, CQR-5). Los pacientes se clasificaron como “adherentes” a los FAME-b subcutáneos y/o FAME-c si lo habían sido con ambos métodos de medición (MPR ≥80% y “adherencia alta” según CQR-5).
Resultados: Se incluyeron 85 pacientes (28,2% MB). La principal causa de MB fue “intolerancia/toxicidad a FAME-c” (58,3%). Los pacientes en MB presentaron mayor consumo de opioides que los pacientes en TC (45,8% vs. 16,4%, p=0,005). No hubo diferencias (p>0,05) entre MB y TC en actividad inflamatoria baja (16,7% vs. 20,8%), remisión (45,8% vs. 39,6%), y efectos adversos (12,5% vs. 32,8%). Considerando ambos métodos de medición, la adherencia a FAME-b fue mayor en MB (89,5%) que en TC (77,7%) (p=0,290), 72,2% de pacientes fueron adherentes a FAME-c.
Conclusiones: La MB es una alternativa aceptada a la TC en pacientes con AR, con similar seguridad y efectividad en lo que se refiere al control inflamatorio de la enfermedad. Sin embargo, al menos en nuestra población de estudio, requiere de un soporte de opioides para un correcto control analgésico.
Palabras clave: Artritis reumatoide, terapia biológica, monoterapia, terapia combinada.
____
Introducción
La artritis reumatoide (AR) es la artropatía inflamatoria crónica autoinmune más frecuente, que afecta al 0,5%-1,0% de la población1; caracterizada por una destrucción progresiva de las articulaciones con distintos grados de deformidad e incapacidad funcional.
Los fármacos antirreumáticos modificadores de la enfermedad (FAME) convencionales (FAME-c) son considerados primera línea de tratamiento, principalmente metotrexato. En caso de pérdida de respuesta, se recomienda su combinación con un FAME biológico (FAME-b), como los inhibidores del factor de necrosis tumoral-alfa (anti-TNF-α), los antagonistas de receptores de interleucinas, anticuerpos anti-CD20 y otros inmunomoduladores2-4.
Estudios controlados y aleatorizados en pacientes con AR demostraron que la eficacia del anti-TNF-α es superior cuando se combina con metotrexato respecto a su uso en monoterapia5-9. Del mismo modo, estudios prospectivos y observacionales demostraron que la combinación del anti-TNF-α con metotrexato produce mayor efectividad a largo plazo10,11.
El mecanismo de potenciación del anti-TNF-α cuando se combina con metotrexato está en relación con la acción directa del FAME-c sobre la reducción de la actividad inflamatoria y con la disminución de la formación de anticuerpos anti-TNF-α.
Sin embargo, según recientes estudios observacionales, la monoterapia biológica (MB) es ampliamente utilizada (30-33,6%) en la práctica clínica habitual10-13.
Según Emery et al.13, el 10-77,5% de los pacientes con AR interrumpen el tratamiento con metotrexato por efectos adversos. De ahí que la MB sea una alternativa terapéutica en caso de intolerancia o contraindicación de FAME-c2-4.
Asimismo, la falta de adherencia a los FAME-c en pacientes con AR puede suponer otra posible causa de MB. Según diversos estudios, 20-80% de pacientes con AR no son adherentes al tratamiento con FAME14,15. Diferentes registros electrónicos de prescripción y dispensación de fármacos antirreumáticos han demostrado que el 29% de pacientes con AR no recogen en la farmacia comunitaria el FAME-c prescrito durante los seis meses posteriores al inicio del FAME-b16.
Actualmente, existen cuatro FAME-b aprobados en Europa para su uso en monoterapia: adalimumab, etanercept, certolizumab y tocilizumab13,17. Este último es el que presenta mayor evidencia de su eficacia en monoterapia4.
El objetivo principal de este estudio fue analizar la utilización de MB en pacientes con AR y sus causas. Los objetivos secundarios fueron: analizar la efectividad y seguridad de FAME-b prescritos en MB o TC, y estimar la adherencia a los FAME-b administrados por vía subcutánea y a sus FAME-c asociados.
MATERIAL Y MÉTODOS
Se realizó un estudio transversal de utilización de FAMEs-b para el tratamiento de la AR en un hospital general público universitario con una población adscrita de 263.646 habitantes. Los criterios de inclusión fueron: pacientes ≥18 años diagnosticados de AR y en tratamiento activo en abril de 2015 con FAME-b intravenosos (infliximab, tocilizumab, abatacept, rituximab) ó subcutáneos (etanercept, adalimumab, certolizumab y golimumab). La adherencia al tratamiento fue calculada en el subgrupo de pacientes a los que se dispensaron FAME-b subcutáneos en el Área de Atención Farmacéutica a Pacientes Externos (AAF-PEXT).
Las variables estudiadas fueron: demográficas (sexo, edad), clínicas (evolución AR [“larga”, si ≥10 años], comorbilidades), farmacológicas (FAME, corticoides, analgésicos, duración del tratamiento biológico, número de fármacos por paciente), causas de MB, actividad inflamatoria, efectos adversos (EA), adherencia a FAME-b subcutáneos (en MB o TC) y a sus FAME-c asociados.
Se definieron las siguientes causas de MB: “contraindicación de FAME-c”, “intolerancia/toxicidad a FAME-c”, “suspensión por el reumatólogo por buena evolución clínica del paciente” y “negación del paciente a tomar FAME-c” (bajo conocimiento de su reumatólogo). Se consideraron las contraindicaciones y los efectos adversos descritos en la ficha técnica de cada medicamento en el momento del estudio.
La efectividad se midió mediante el índice de actividad inflamatoria DAS28 (Disease Activity Score in 28 joints): “remisión” (DAS28 ≤2,6), “actividad baja” (DAS28 ≤3,2), “intermedia” (3,2< DAS28 <5,1) y “alta” (DAS28 >5,1) para el uso de FAME-b en MB o en TC. Se consideró efectivo el tratamiento si el valor de DAS28 indicaba baja actividad o remisión. La seguridad fue analizada mediante la valoración de efectos adversos (EA) por el reumatólogo para los FAME en MB y TC.
La adherencia fue estimada mediante dos métodos indirectos: 1) cálculo a partir de los registros electrónicos de dispensación de la “razón de posesión de medicación” (MPR), definida como porcentaje de días cubiertos con medicación dispensada respecto al total de días con medicación prescrita durante los 12 meses previos a su determinación; y 2) cuestionario para enfermedades reumáticas (Compliance Questionnaire Rheumatology, CQR5, adaptado al castellano).
El CQR5 fue autocumplimentado en la entrevista farmacéutica realizada durante la visita de seguimiento en el AAF-PEXT por los pacientes tratados con FAME-b subcutáneos durante ≥12 semanas en el momento de la entrevista. Este cuestionario consta de cinco ítems y cuatro posibles puntuaciones según la escala de Likert: desde “nada de acuerdo” (puntuación 1) hasta “totalmente de acuerdo” (Tabla 1)18. La puntuación obtenida en el CQR-5 fue introducida en la calculadora de adherencia desarrollada por Hughes LD et al.18, la cual clasifica a los pacientes en “adherencia alta” versus “adherencia baja” según un modelo multifactorial.
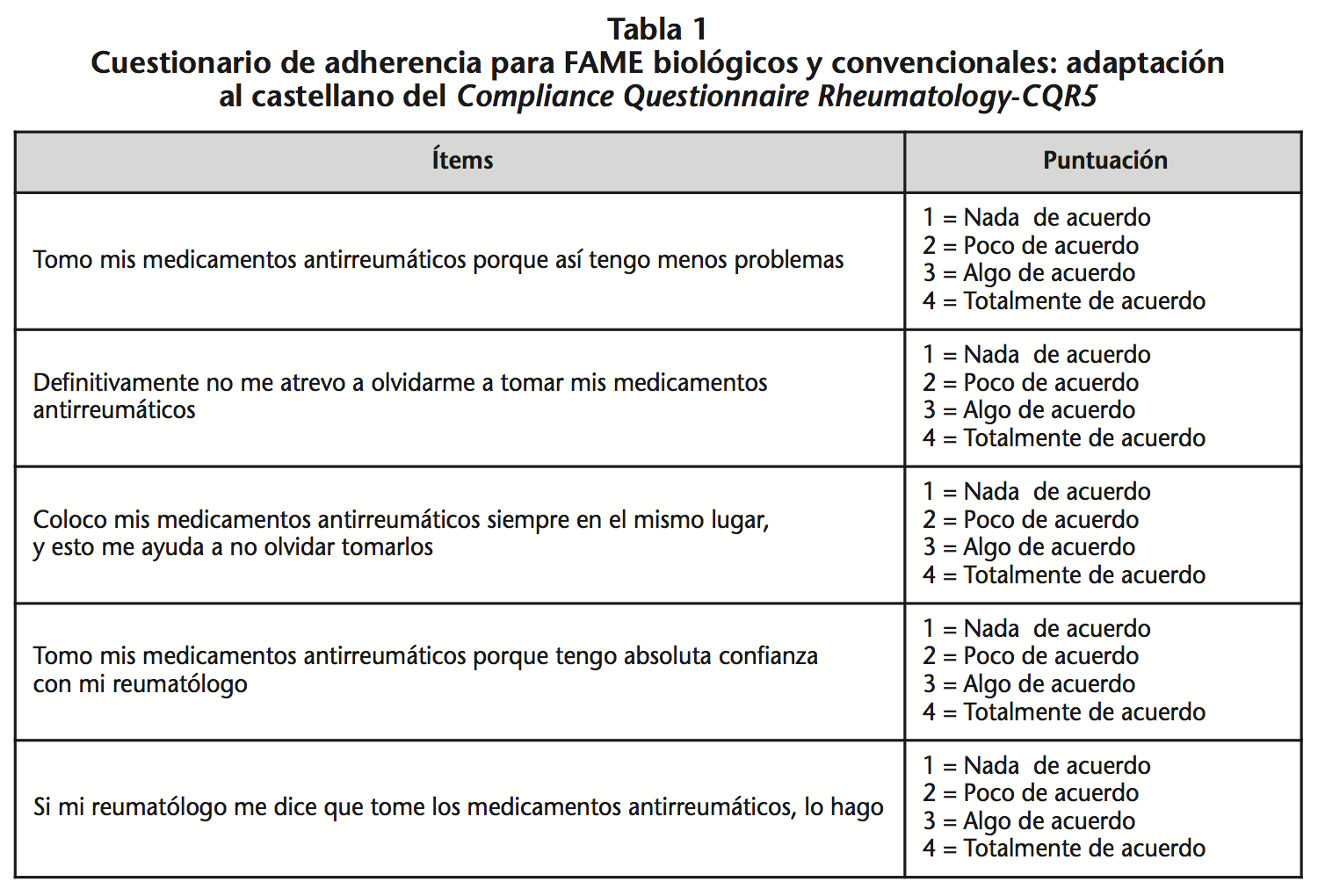
A los pacientes a los que se dispensaron los FAME-b subcutáneos, se les aplicaron ambos métodos de análisis (MPR y CQR-5) para estimar la adherencia al biológico. En aquellos pacientes que tenían prescrito el biológico en TC, se volvieron a aplicar ambos métodos para estimar también la adherencia al FAME-c.
Se consideraron “adherentes” los pacientes con MPR ≥80% y los clasificados como “adherencia alta” según el CQR-5. Se clasificaron como “adherentes” si lo habían sido con ambos métodos. Al contrario, se clasificaron como “no adherentes” si sólo lo fueron con uno de los métodos.
Los datos se obtuvieron de: la historia clínica electrónica (Mambrino®, en atención especializada, y Turriano®, en atención primaria), los programas de preparación de mezclas estériles intravenosas (Farmis-Oncofarm®), dispensación a pacientes externos (Athos-Prisma®) y en farmacias comunitarias mediante receta electrónica (Fierabrás®) y la entrevista farmacéutica.
Análisis estadístico
Para el análisis descriptivo, las variables cuantitativas se expresaron con la media y desviación estándar (DE) y las cualitativas, con frecuencias absolutas y relativas.
Para el análisis bivariante, se utilizó el test c2 de Pearson para comparar proporciones entre grupos ó el test exacto de Fisher en los casos de tablas 2×2 en las que el porcentaje de frecuencias esperadas menores de 5 fue superior al 20%. Para analizar las diferencias entre los valores medios entre dos grupos independientes, se aplicó el test “t” de Student; o bien, U de Mann-Whitney cuando no se cumplía la hipótesis de normalidad. El nivel de significación estadística fue p<0,05. El software utilizado fue IBM-SPSS Statistics v.19.
RESULTADOS
Se incluyeron 85 pacientes (73,2% mujeres) con una media de edad de 53,7 (DE: 12,0) años (Tabla 2). El 64,7% de pacientes presentaba AR de larga evolución y el 74,1%, comorbilidades, mayoritariamente: hipertensión (42,3%), dislipemia (30,6%), depresión (12,9%) y asma/EPOC (12,9%).
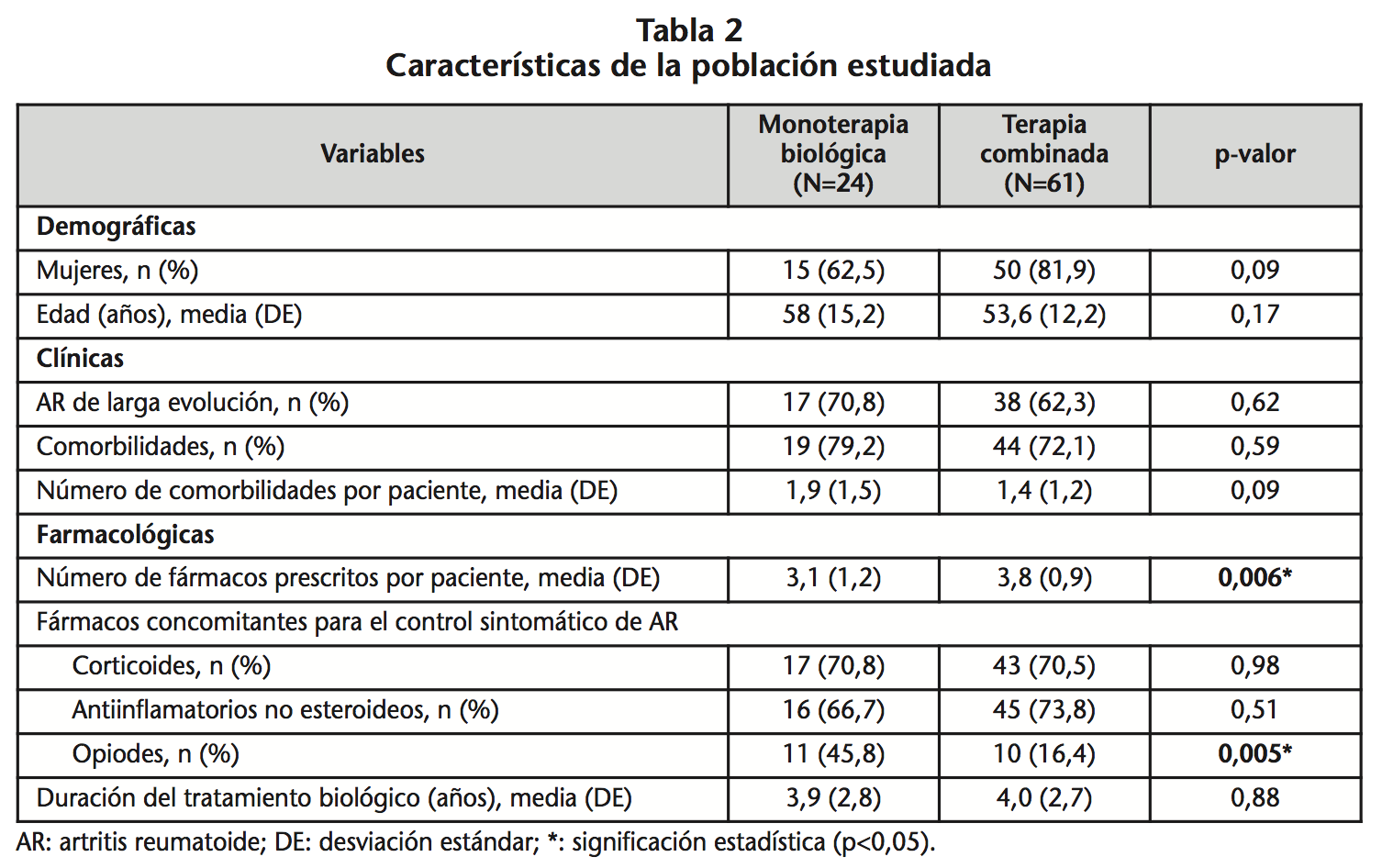
En el momento del estudio, 24 pacientes (28,2%) tenían prescrito el FAME-b en monoterapia y 61 (71,8%) lo tenían prescrito en combinación con FAME-c.
Del total de pacientes que se encontraban en MB (n=24), catorce (58,3%) iniciaron el biológico en TC.
El tratamiento con biológicos como monoterapia presentó una frecuencia similar en los pacientes tratados con un primer agente biológico en relación a los tratados con un segundo (30,4% vs. 29,2%, p=0,836).
Los FAME-b más prescritos en MB fueron: adalimumab (47,1%), etanercept (32,1%) certolizumab (28,6%), y tocilizumab (25,0%). Golimumab y abatacept siempre se prescribieron en combinación con FAME-c (Figura 1).
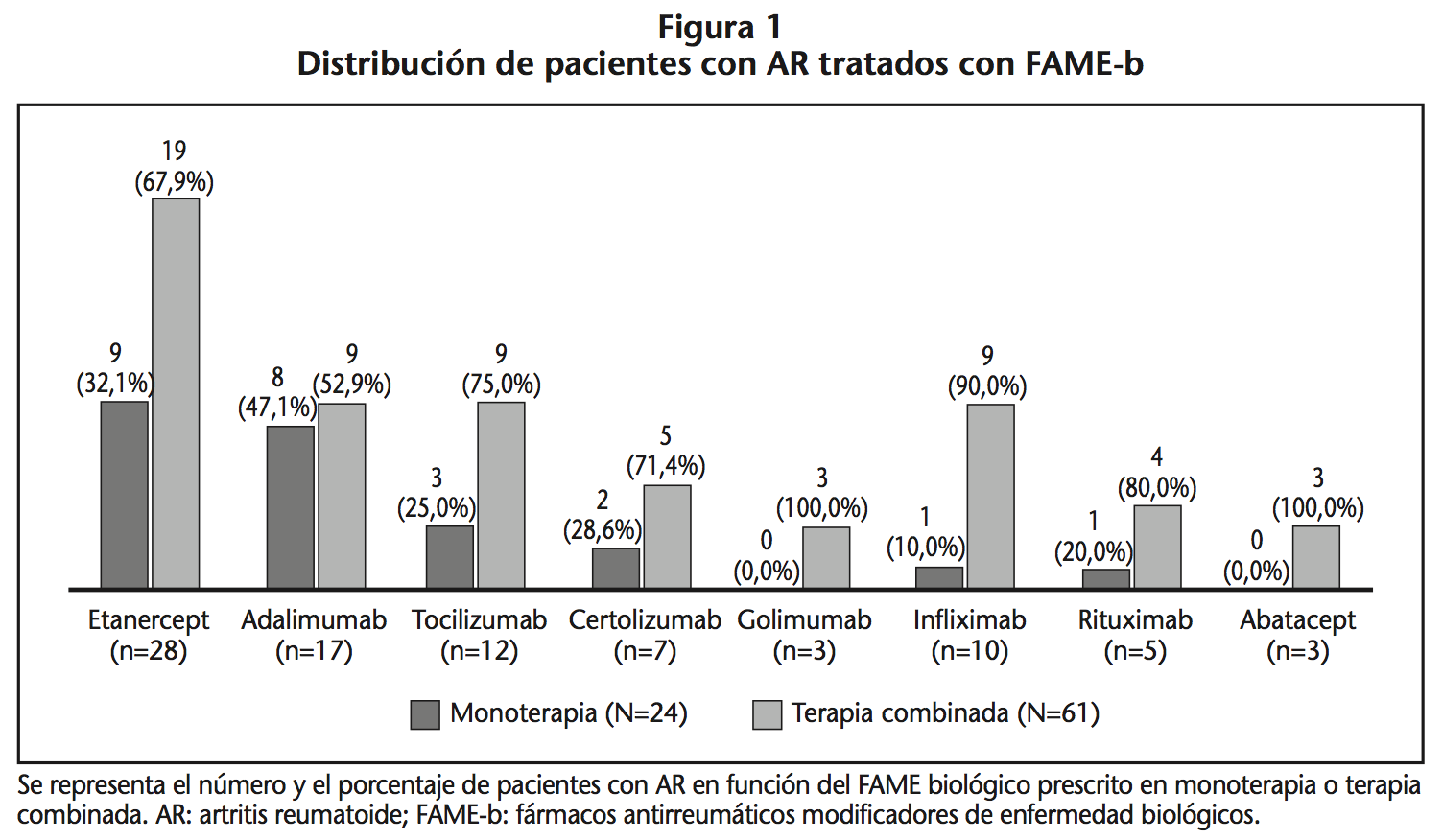
La tabla 3 muestra las causas del uso de FAME-b en monoterapia, siendo la principal la intolerancia a FAME-c por los siguientes toxicidades: hepática (47,4%), digestiva (21,1%), pulmonar (15,8%), angioedema (5,3%), prurito (5,3%) y ulceración cutánea (5,3%). Sólo en una paciente embarazada, la MB estuvo causada por contraindicación a FAME-c.
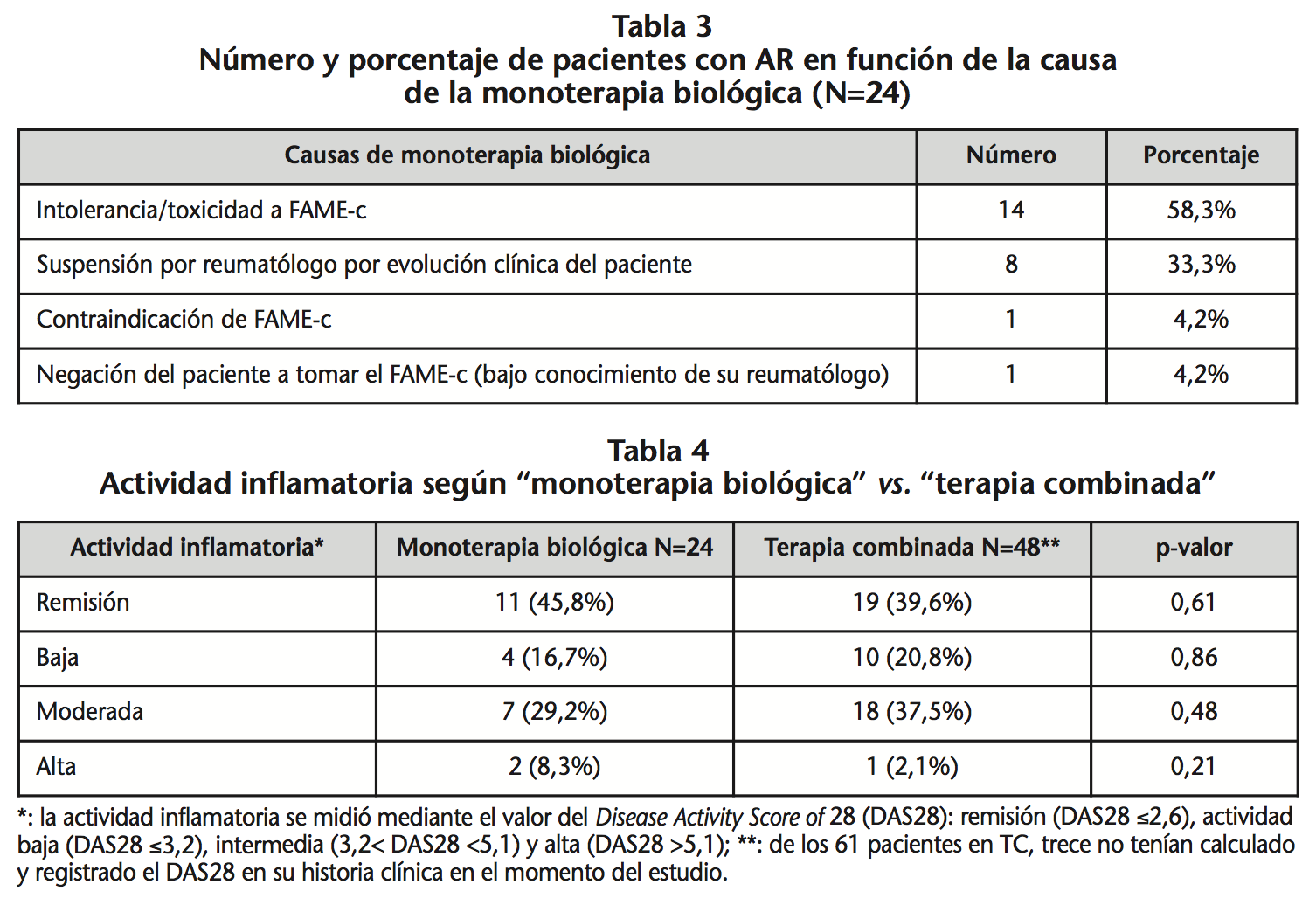
La tabla 4 muestra la efectividad según MB versus TC. En un 62,5% y 60,4% (p=0,864), respectivamente, el tratamiento con FAME-b fue efectivo. Del total de la muestra (n=85), solamente 72 pacientes (24 en MB y 48 en TC) tenían calculado y registrado el DAS28 en su historia clínica en el momento del estudio. En 13 pacientes en TC, solamente se registraron algunos de los parámetros que forman el DAS28, como la velocidad de sedimentación globular (VSG), concentraciones séricas de proteína C reactiva (PCR), factor reumatoide, escala análoga visual (EAV) y número de articulaciones dolorosas y tumefactas; y ≠por tanto estos pacientes fueron excluidos en el análisis de la actividad inflamatoria.
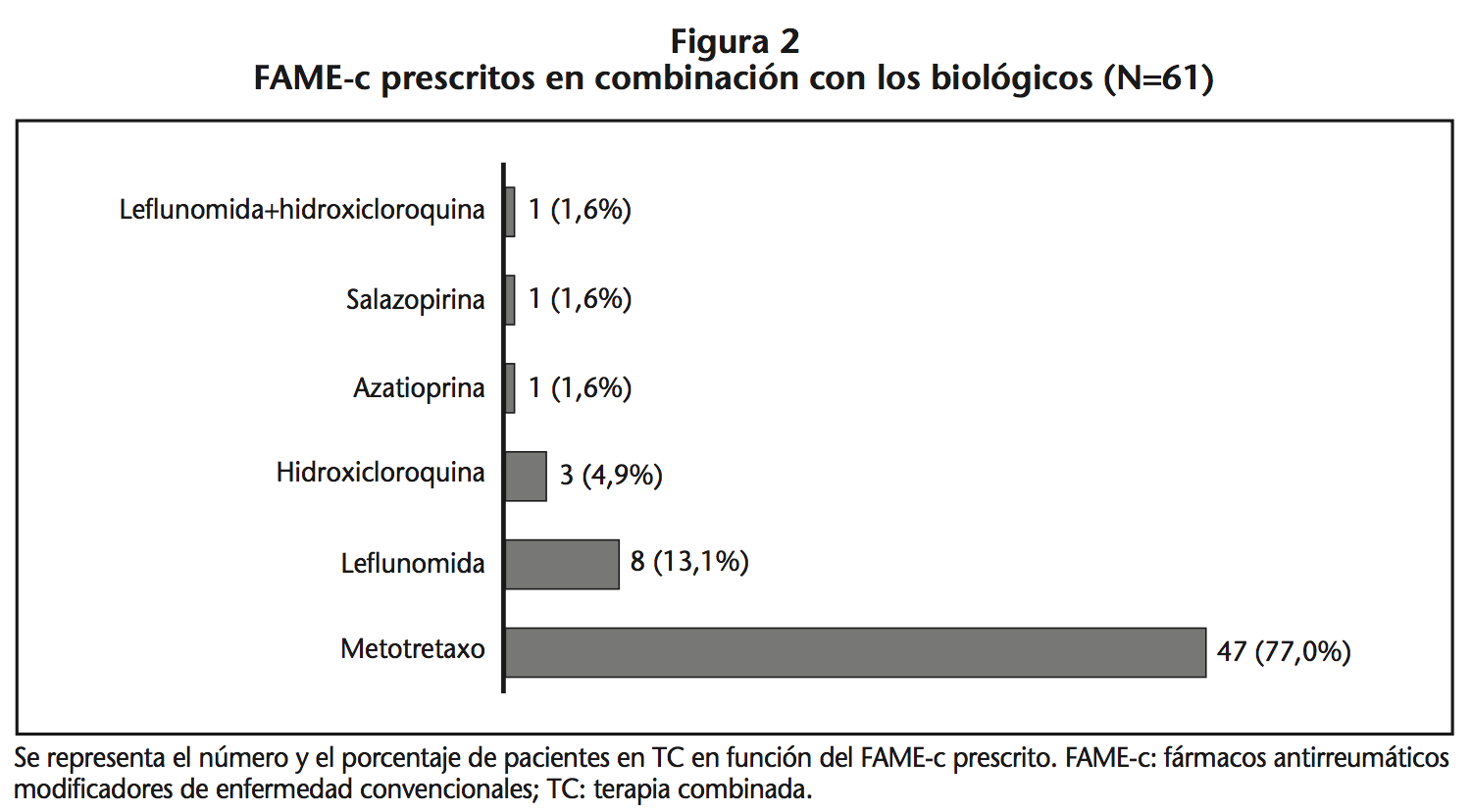
Metotrexato fue el FAME-c más prescrito en combinación con FAME-b (Figura 2).
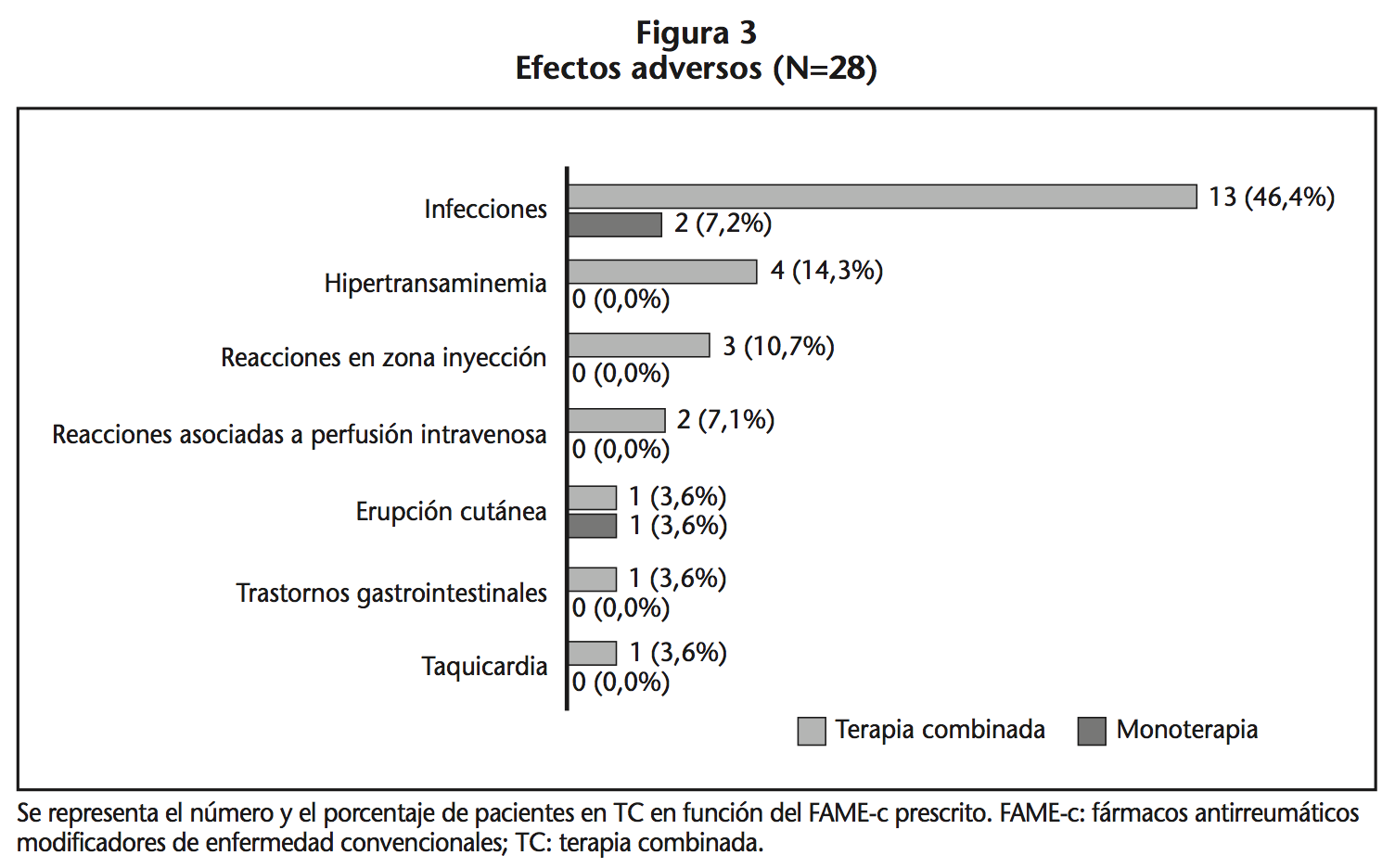
Se registraron 28 EA (Figura 3): 12,5% en MB y 32,8% en TC (p=0,058). Las infecciones, principalmente respiratorias (66,7%) y urinarias (26,7%), fueron las más frecuentes. Los FAME-b implicados fueron: etanercept (39,1%), infliximab (21,7%), adalimumab (17,4%), tocilizumab (8,7%), abatacept (8,7%) y certolizumab (4,4%).
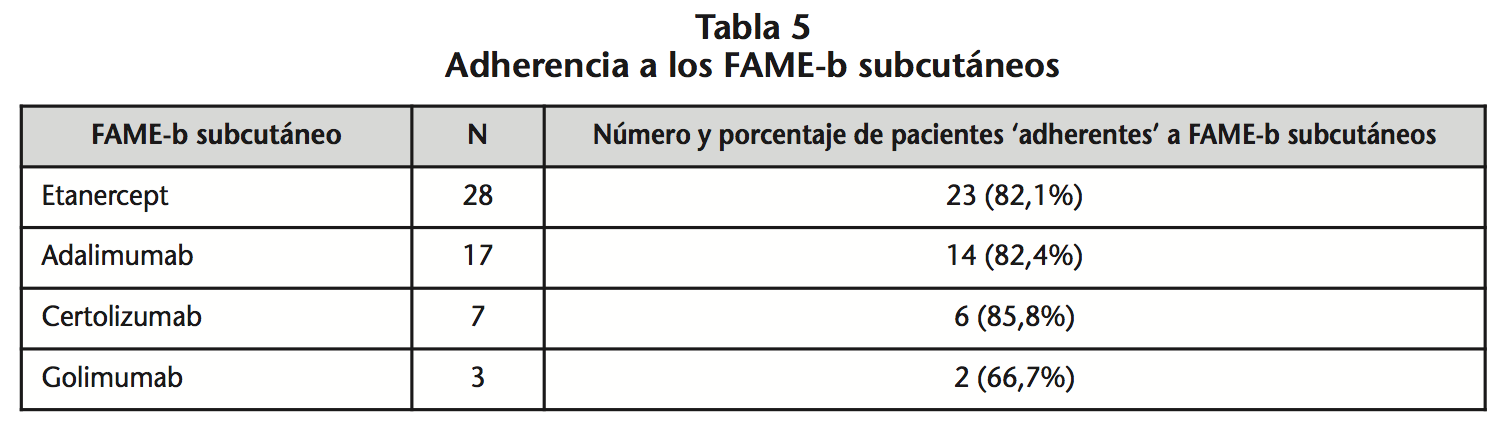
Cincuenta y cinco pacientes fueron tratados con FAME-b subcutáneos (19 en MB y 36 en TC), siendo adherentes un 81,8% (89,5% MB vs. 77,7% TC, p=0,290). La tabla 5 compara el porcentaje de pacientes adherentes en función del tipo de FAME-b.
En TC, el 58,3% de los pacientes fueron adherentes a ambos FAME (28,8% no fueron adherentes a FAME-c).
DISCUSIÓN
Nuestros resultados sostienen que la MB es una práctica habitual en los pacientes con AR, coincidiendo con la frecuencia reportada por otros autores (30-33,6%)10-13.
Los anti-TNF-α se prescribieron en monoterapia con mayor frecuencia que tocilizumab, que debería ser opción preferente en monoterapia según las recomendaciones de las principales sociedades reumatológicas3,4. La monoterapia con tocilizumab ha demostrado una eficacia superior a la monoterapia con adalimumab (estudio ADACTA)19 y a la monoterapia con metotrexato (estudios AMBITION y SATORI)20,21. Asimismo, demostró una eficacia comparable a la TC con tocilizumab y metotrexato (estudio ACT-RAY)22. En cambio, la eficacia de los anti-TNF-α es menor en monoterapia que cuando se combinan con metotrexato2-4. Según revisiones sistemáticas y meta-análisis, la monoterapia con tocilizumab también ha demostrado mayor eficacia que la monoterapia con anti-TNF-α13,17,23-25. El mecanismo de acción diferente de estos últimos podría justificar la necesidad de su combinación con metotrexato para la potenciación del efecto13.
La administración subcutánea de etanercept y adalimumab, que pudiera presentar una mejor adherencia en los pacientes con AR27,29,30, podría haber contribuido a que la monoterapia con estos anti-TNF-α fuera prescrita con mayor frecuencia que la monoterapia con tocilizumab, el cual presenta una mayor evidencia de su eficacia en esta situación y solamente estaba disponible su presentación intravenosa en el momento del estudio.
La intolerancia/toxicidad a los FAME-c fue la principal causa del uso de FAME-b en monoterapia, al igual que en el estudio de Sommerfleck et al.26. En los ensayos clínicos, entre un 5-15% de pacientes con AR interrumpieron el tratamiento con metotrexato debido a la aparición de EA; sin embargo, estudios observacionales mostraron que la frecuencia de interrupción es aún mayor en la práctica real (10-77%)13. Las guías reumatológicas recomiendan el uso de FAME-b en monoterapia para pacientes con intolerancia o contraindicación a FAME-c y, en este caso, consideran tocilizumab como opción preferente2-4. La segunda causa de MB fue la buena evolución clínica valorada por el médico, debido a la actividad inflamatoria baja (DAS28 <2,6) o remisión (DAS28 <2,6) mantenidas. La optimización de dosis del FAME-b es la opción recomendada para pacientes en remisión, mientras que la suspensión del FAME-c es considerada excepcional3,4.
Según nuestros resultados, la MB parece ser efectiva para el control de la actividad inflamatoria, ya que la mayoría de los pacientes en monoterapia se encontraba en remisión (45,8%), coincidiendo con el porcentaje reportado por Jorgensen et al. (41,0%)27. Este resultado puede deberse a la suspensión por el médico del FAME-c por buena evolución. No se encontraron diferencias estadísticamente significativas en la efectividad del tratamiento entre MB y TC. No obstante, los pacientes en MB presentaron mayor consumo de analgésicos opioides, lo que podría indicar recurrencia de la enfermedad4,28.
De acuerdo con las recomendaciones para el tratamiento de la AR, el FAME-c más prescrito en combinación con FAME-b fue metotrexato2-4.
El porcentaje de pacientes adherentes a FAME-b subcutáneos (81,8%) fue mayor que el referenciado en la bibliografía (50,5-83,0%)14,15,29, principalmente cuando se prescribieron en monoterapia (89,5%). En nuestro estudio, el 27,8% de los pacientes en TC no retiraban el FAME-c de la farmacia comunitaria, a pesar de tenerlo prescrito. Esta falta de adherencia a FAME-c podría suponer un mayor porcentaje de pacientes en MB que el calculado.
La monoterapia con FAME-b presenta un perfil de seguridad similar a la TC con FAME-c17,23-25. Sin embargo, en nuestro estudio la MB fue bien tolerada, siendo la frecuencia de RA, fundamentalmente infecciones, mayor en la TC, sin alcanzar significación estadística6.
Una limitación de este estudio es la historia clínica como principal fuente de información; la cual puede no reflejar adecuadamente la realidad de la asistencia sanitaria, existiendo un sesgo de infrarregistro de efectos adversos. En segundo lugar, el cuestionario utilizado para evaluar la adherencia a FAME no había sido validado en castellano previamente en otros estudios. Por último, se necesitarían otros estudios con mayor tamaño muestral para confirmar nuestros resultados.
CONCLUSIONES
La MB es una práctica habitual en los pacientes con AR debido a la buena evolución clínica del paciente y a la intolerancia y baja tasa de adherencia a FAME-c.
Etanercept y adalimumab subcutáneos fueron más prescritos en monoterapia que tocilizumab intravenoso, cuya eficacia ha sido demostrada en esta situación, pudiendo contribuir a ello la diferente vía de administración.
La MB es una alternativa aceptada a la TC en pacientes con AR, ya que presenta una similar seguridad y efectividad en lo que se refiere al control inflamatorio de la enfermedad y en la frecuencia de efectos adversos. Sin embargo, al menos en nuestra población de estudio, requiere de un soporte de opioides para un correcto control analgésico.
La adherencia a los FAME-b subcutáneos en pacientes con AR es elevada, siendo mayor que para los FAME-c.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Bibliografía
1. Glibofsky A. Overview of epidemiology, pathophysiology and diagnosis of rheumatoid arthritis. Am J Manag Care. 2012;18:295-302.
2. Singh JA, Saag KG, Bridges SL Jr, Akl EA, Bannuru RR, Sullivan MC, et al. 2015 American Collegue of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. American Collegue of Rheumatology. Arthritis Rheumatol. 2016;68:1-26.
3. Smolen JS, Landewé R, Bijlsma J, Burmester G, Chatzidionysiou K, Dougados M, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis. 2017; 76:960-977.
4. Sanmartí R, García-Rodríguez S, Álvaro-Gracia JM, Andreu JL, Balsa A, Cáliz R, et al. 2014 update of the Consensus Statement of the Spanish Society of Rheumatology on the use of biological therapies in rheumatoid arthritis. Reumatol Clin. 2015;11:279-294.
5. Maini RN, Breedveld FC, Kalden JR, Smolen JS, Davis D, Macfarlane JD, et al. Therapeutic efficacy of multiple intravenous infusions of anti-tumor necrosis factor alpha monoclonal antibody combined with low-dose weekly methotrexate in rheumatoid arthritis. Arthritis Rheum. 1998;41:1552-63.
6. Breedveld FC, Weisman MH, Kavanaugh AF, Cohen SB, Pavelka K, Van Vollenhoven R, et al. The PREMIER study: a multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous mehotrexate treatment. Arhritis Rheum. 2006;54:26-37.
7. Keystone EC, Genovese MC, Klareskog L, Hsia EC, Hall ST, Miranda PC, et al. Golimumab, a human antibody to tumour necrosis factor alpha given by monthly subcutaneous injections, in active rheumatoid arthritis despite methotrexate therapy: the GO-FORWARD Study. Ann Rheum Dis. 2009;68:789-96.
8. Van Der Heijde D, Klareskog L, Rodriguez-Valverde V, Codreanu C, Bolosiu H, Melo-Gomes J, et al. Comparison of etanercept and methotrexate, alone and combined, in the treatment of rheumatoid arthritis: two-year clinical and radiographic. Results from the TEMPO study, a double-blind, randomized trial. Arthritis Rheum. 2006;54:1063-74.
9. Kameda H, Kanbe K, Sato E, Ueki Y, Saito K, Nagaoka S, et al. Continuation of methotrexate resulted in better clinical and radiographic outcomes than discontinuation upon starting etanercept in patients with rheumatoid arthritis: 52-week results from the JESMR study. J Rheumatol. 2011;38:1585-92.
10. Heiberg MS, Koldingsness W, Mikkelsen K, Rodevand E, Kaufmann C, Mowinckel P, et al. The comparative one-year performance of anti-tumour necrosis factor alpha drugs in patients with rheumatoid arthritis, psoriatic arthritis, and ankylosing spondylitis: results from a longitudinal, observational, multicenter study. Arthritis Rheum. 2008;59:234-40.
11. Soliman MM, Ashcroft DM, Watson KD, Lunt M, Symmons DPM, Hyrich KL. Impact of concomitant use of DMARDs on the persistence with anti-TNF therapies in patients with rheumatoid arthritis: results from the British Society for Rheumatology Biologics Register. Ann Rheum Dis. 2011;70:583-589.
12. Yazici Y, Shi N, John A. Utilization of biologic agents in rheumatoid arthritis in the United States: analysis of prescribing patterns in 16.752 newly diagnosed patients and patients new to biologic therapy. Bull NYU Hosp Jt Dis. 2008;66:77-85.
13. Emery P, Sebba A, Huizinga TWJ. Biologic and oral disease-modifying antirheumatic drug monotherapy in rheumatoid arthritis. Ann Rheum Dis. 2013;72:1897-1904.
14. Pascual-Ramos V, Contreras-Yáñez I, Villa AR, Cabiedes J, Rull-Gabayet M. Medication persistence over 2 years of follow-up in a cohort of early rheumatoid arthritis patients: associated factors and relationship with disease activity and with disability. Arthritis Res Ther. 2009;11. doi: 10.1186/ar2620.
15. Contreras-Yáñez I, Ponce De León S, Cabiedes J, Rull-Gabayet M, Pascual-Ramos V. Inadequate Therapy behaviour is associated to disease flares in patients with rheumatoid arthritis who have achieved remission with disease-modifying antirheumatic drugs. Am J Med Sci. 2010;340:282-290.
16. Choquette D, Thomas O, Arundine M. Lower than expected levels of DMARD acquisition immediately pre and post biologic initiation in rheumatoid arthritis patients. Arthritis Rheum. 2012;64:S783.
17. Detert J, Klaus P. Biologic monotherapy in the treatment of rheumatoid arthritis. Biologics. 2015;9:35-43.
18. Hughes LD, Done J, Young A. A 5 item version of the Compliance Questionnaire for Rheumatology (CQR5) successfully identifies low adherence to DMARDS. BMC Musculoskeletal Disorders. 2013;14:286-294.
19. Gabay C, Emery P, van Vollenhover R, Dikranian A, Alten R, Pavelka K, et al. Tocilizumab monotherapy versus adalimumab monotherapy for treatment of rheumatoid arthritis (ADACTA): a randomized, double-blind, controlled phase 4 trial. Lancet. 2013;381:1541-50.
20. Jones G, Sebba A, Gu J, Lowenstein MB, Calvo A, Gomez-Reino JJ, et al. Comparison of tocilizumab monotherapy versus methotrexate monotherapy in patients with moderate to severe rheumatoid arthritis: the AMBITION study. Ann Rheum Dis. 2010;69:88-96.
21. Nishimoto N, Miyasaka N, Yamamoto K, Kawai S, Takeuchi t, Azuma J, et al. Study of active controlled tocilizumab monotherapy for rheumatoid arthritis patients with an inadequate response to methotrexate (SATORI): significant reduction in disease activity and serum vascular endotelial growth factor by IL-6 receptor inhibition therapy. Mod Rheumatol. 2009;19:12-19.
22. Dougados M, Kissel K, Conaghan PG, Mola EM, Schett G, Gerli R, et al. Clinical, radiographic and immunogenic effects after 1 year of tocilizumab-based treatment strategies in rheumatoid arthritis: the ACT RAY Study. Ann Rheum Dis. 2014;73:803-809.
23. Jansen JP, Buckley F, Dejonckheere F, Ogale S. Comparative efficacy of biologics as monotherapy and in combination with methotrexate on patient reported outcomes (PROs) in rheumatoid arthritis patients with an inadequate response to conventional DMARDS-a systematic review and network meta-analysis. Health Qual Life Outcomes. 2014;12:102-117. doi: 10.1186/ 1477-7525-12-102.
24. Migliore A, Bizzi E, Egan CG, Bernardi M, Petrella L. Efficacy of biological agents administered as monotherapy in rheumatoid arthritis: a Bayesian mixed-treatment comparison analysis. Ther Clin Risk Manag. 2015;11:1323-35.
25. Gabay C, Hasler P, Kyburz D, So A, Villiger P, Von Kempis J, et al. Biological agents in monotherapy for the treatment of rheumatoid arthritis. Swiss Med Wkly. 2014;10:144-155.
26. Sommerfleck F, Mysler E, Alvarellos A, Arturi A, Asnal C, Babini A, et al. Monoterapia biológica en pacientes con artritis reumatoidea en Argentina. Rev Arg Reumatol. 2013;24:30-36.
27. Jorgensen TS, Kristensen LE, Christensen R, Bliddal H, Lorenzen T, Hansen MS, et al. Effectiveness and drug adherence of biologic monotherapy in routine care of patients with rheumatoid arthritis: a cohort study of patients registered in the Danish biologics registry. Rheumatology. 2015;54:2156-65.
28. Zamora-Legoff JA, Achenbach SJ, Crowson CS, Krause ML, Davis JM, Matteson EL. Opioid use in patients with rheumatoid arthritis 2005-2014: a population-based comparative study. Clin Rheumatol. 2016;35:1137-1144.
29. Grijalva CG, Chung CP, Arbogast PG, Stein CM, Mitchel EF, Griffin MR. Assessment of adherence to and persistence on disease-modigying antirheumatic drugs (DMARDS) in patients with rheumatoid arthritis. Med Care. 2007:45-S66-76.
30. Desplats M, Pascart T, Jelin G, Norberciak L, Philipe P, Houvenagel E, et al. Are abatacept and tocilizumab intravenous users willing to switch for the subcutaneous route of administration? A questionnaire-based study. Clinical Rheumatology. 2017;36:6:1395-1400.
____
Descargar artículo en PDF: Utilización de fármacos biológicos en artritis reumatoide: monoterapia y terapia combinada
