Fernández Redondo D, Caro Teller JM, Origüen Sabater J, Nieves Sedano M, Ferrari Piquero JM
Servicio de Farmacia. Hospital Universitario 12 de Octubre. Madrid (España)
Fecha de recepción: 21/06/2018 – Fecha de aceptación: 10/08/2018
Correspondencia
Delia Fernández Redondo – Avda. de los Artesanos, 23 – 28760 Tres Cantos, Madrid (España)
deliafdezredondo@gmail.com
____
Resumen
Objetivo: Evaluar la eficacia y seguridad de fidaxomicina en el tratamiento de la infección por Clostridium difficile (ICD) en un hospital de tercer nivel.
Métodos: Estudio retrospectivo de todos los pacientes con diagnóstico de ICD tratados con fidaxomicina en el hospital, desde marzo 2013 a septiembre 2016. Se analizaron variables como curación, recurrencia a los tres meses, comorbilidades, número de episodios previos, inmunosupresión o gravedad. Posteriormente se realizó un análisis de subgrupos.
Resultados: Se incluyeron 37 pacientes, de los cuales, un 54,1% eran mujeres y un 70,3% mayores de 65 años. El 51,3% presentó enfermedad grave o grave-complicada, y 59,4% de los pacientes estaban inmunodeprimidos. En el 73% de los pacientes, fidaxomicina se utilizó para tratar segundas recurrencias o posteriores. El 89,2% presentaba algún tipo de comorbilidad. Se observó respuesta tras tratamiento con fidaxomicina en un 97,3%. El porcentaje de recurrencia a los tres meses de finalizar tratamiento fue del 24,3%, siendo la mayoría (77,8%) pacientes que habían presentado previamente dos o más episodios de ICD. Únicamente dos pacientes mostraron reacciones adversas leves atribuibles al antibiótico. El análisis de subgrupos no mostró una mayor recurrencia para las variables analizadas.
Conclusiones: Fidaxomicina ha demostrado ser un medicamento seguro y bien tolerado, aunque alrededor de un cuarto de los pacientes analizados recurrió tras el tratamiento. Con el fin de obtener resultados más concluyentes sería conveniente realizar estudios posteriores con un tamaño muestral mayor, posiblemente multicéntricos.
Palabras clave: Fidaxomicina, infección por Clostridium difficile, diarrea, recurrencia.
____
Use, efficacy and safety of fidaxomicin in the treatment of Clostridum difficile-associated diarrea
Summary
Objective: To evaluate the efficacy and safety of fidaxomicin in the treatment of Clostridium difficile infection (CDI) in a third level hospital.
Method: A retrospective study was carried out including all patients diagnosed with CDI and treated with fidaxomicin in a Spanish hospital from March 2013 to September 2016. Clinical cure, three-months recurrence, comorbidities, number of prior episodes, immunosuppression or severity variables were analyzed.
Results: Among the 37 patients included in the study, 54.1% were women and 70.3% older than 65 years old. 51.3% had a severe or severe-complicated disease and 59.4% were immunosuppressed. Fidaxomicin was used in 73% of patients to treat second or greater recurrences. 89.2% had any type of comorbidity. 97.3% achieved clinical response to the treatment with fidaxomicin. The percentage of three-months recurrence after finishing the treatment was 24.3%, being the majority (77.8%) patients who had had two or more prior recurrences. Only two patients experienced mild adverse events due to the antibiotic. The subgroup analysis did not show a higher recurrence rate for the variables analyzed.
Conclusions: Fidaxomicin has shown to be a safe and well-tolerated drug even though about a quarter of patients analyzed had recurrence. In order to reach results that are more conclusive, further studies with a larger sample size, perhaps multicenter studies, are necessary.
Key Words: Fidaxomicin, Clostridium difficile infection, diarrhea, recurrence.
____
Introducción
Fidaxomicina es un antibiótico macrocíclico bactericida autorizado para el tratamiento de la infección por Clostridium difficile (ICD) en adultos. Interfiere con la ARN polimerasa inhibiendo la síntesis de ARN, posee actividad frente a la toxina de Clostridium difficile (CD), es muy selectivo frente a la bacteria y dispone de una mínima absorción oral1,2.
La ICD es considerada como la principal causa de diarrea nosocomial en los países desarrollados y va adquiriendo cada vez más relevancia en el ámbito comunitario3. La acción patógena es debida a la producción de toxinas A y/o B por algunas cepas de CD, produciendo desde diarrea leve a íleo y megacolon tóxico. Es más frecuente en pacientes ingresados y de edad avanzada, y está relacionada con factores de riesgo como el uso de antibióticos y antiácidos, inmunosupresión, comorbilidades digestivas, neoplásicas o cardiacas4, además de tener un gran impacto en la morbilidad y mortalidad en ancianos.
En España, la incidencia de ICD es similar a la de otros países europeos, aunque el creciente uso de antibióticos de amplio espectro en el país, favorece el aumento de esta enfermedad.
Una de las principales complicaciones de la ICD es la recurrencia, o aparición de un nuevo caso de ICD dentro de las 4-12 semanas posteriores a un episodio anterior resuelto. Las recurrencias ocurren aproximadamente entre un 15% y un 30% de los casos y pueden ser debidas tanto a un nuevo episodio producido por la misma cepa (recidiva) como a una cepa diferente (reinfección). Por otra parte, tras una primera recurrencia las probabilidades de presentar nuevas recaídas son de un 35-50%5. Generalmente las recaídas ocurren durante el primer mes de tratamiento, aunque pueden observarse hasta transcurridos más de cuatro meses6.
Las guías de la IDSA (Infectious Diseases Society of America)7 en su última revisión de 2017, recomiendan tratamiento con vancomicina a dosis de 125 mg/6 h o fidaxomicina 200 mg/12 h durante 10 días en el primer episodio de ICD. Sólo recomiendan metronidazol 500 mg/8 h vía oral durante 10 días, en lugares donde el acceso de vancomicina o fidaxomicina es limitado y cuando se trate de una ICD no complicada. En casos de ICD grave-complicada el tratamiento de elección es vancomicina 500 mg/6 h vía oral. En primeras recurrencias recomiendan vancomicina en pautas descendentes (o 125 mg/6 h si en el primer episodio se utilizó metronidazol), o fidaxomicina 200 mg/12 h, 10 días. En segundas recurrencias y consecutivas el tratamiento recomendado es el trasplante fecal.
Sin embargo, en España fidaxomicina está autorizada para su financiación por el Sistema Nacional de Salud para segundas recurrencias después del uso de metronidazol y vancomicina.
El objetivo de este estudio fue evaluar la eficacia y seguridad de fidaxomicina en el tratamiento de la ICD en un hospital de tercer nivel.
Material y métodos
El presente trabajo es un estudio observacional retrospectivo de una cohorte de pacientes con ICD tratados con fidaxomicina entre marzo 2013 (fecha de inclusión del antibiótico en la Guía Farmacoterapéutica del hospital) y diciembre de 2016, siendo el periodo de estudio de 45 meses. Se incluyeron un total de 37 pacientes mayores de 18 años con síntomas de ICD (más de tres deposiciones no formadas durante al menos 2 días consecutivos y presencia de toxina A o B en heces) y que recibieron tratamiento con fidaxomicina 200 mg/12 h durante al menos cinco días. Fidaxomicina fue incluida tras aprobación por la Comisión de Farmacia y Terapéutica del hospital, restringiendo su uso a la indicación financiada.
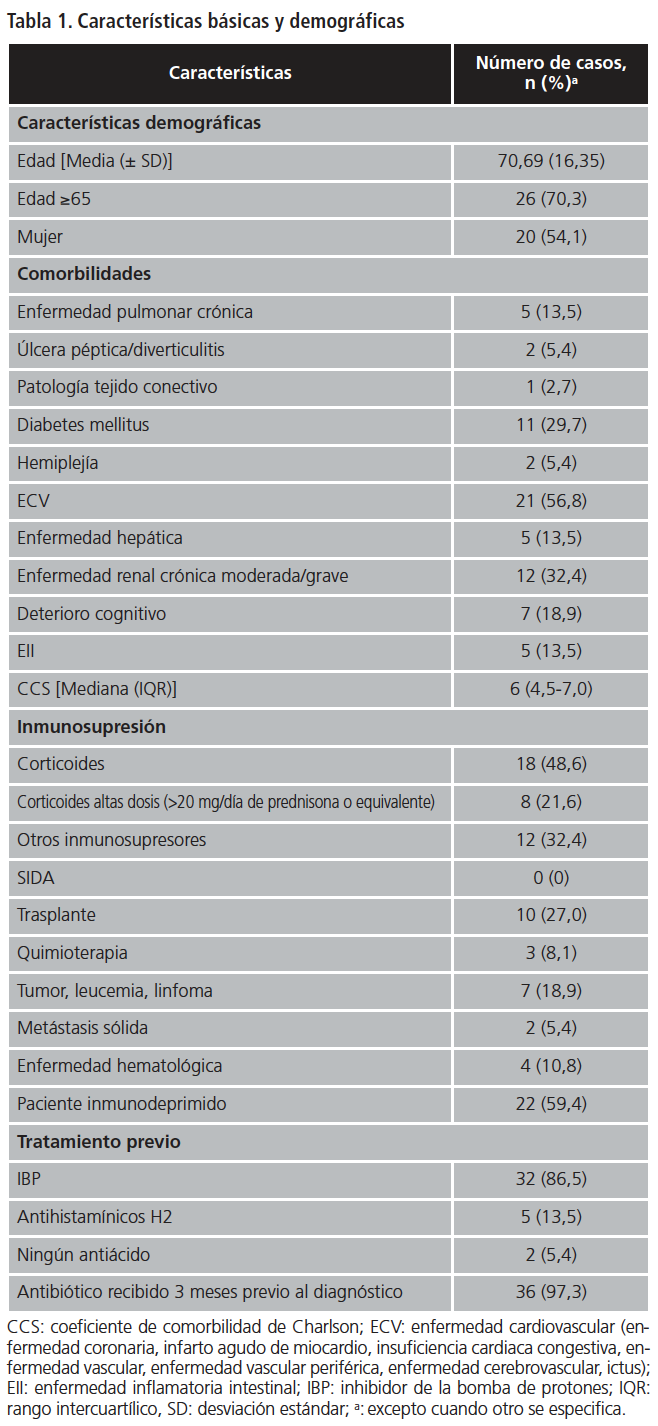
Los datos se recogieron utilizando los programas de prescripción electrónica, historia clínica electrónica y programas informáticos de gestión de medicamentos del hospital. Se recopilaron variables demográficas de edad y sexo, comorbilidades, tratamiento previo (inhibidores de la bomba de protones (IBP)/antihistamínicos H2 (antiH2) en las cuatro semanas previas, antibiótico recibido tres meses antes del diagnóstico, tratamiento para ICD en episodios previos), pacientes inmunodeprimidos (aquéllos que recibieron medicación inmunosupresora durante las cuatro semanas previas al diagnóstico o presentaban alguna característica descrita en el apartado de “inmunosupresión” de la Tabla 1, características clínicas de los episodios, gravedad de la infección y duración del tratamiento con fidaxomicina.
La variable principal para evaluar la eficacia del tratamiento con fidaxomicina fue la curación, definida como resolución de la diarrea (≤3 deposiciones no formadas durante dos días consecutivos) tras finalizar el tratamiento con el antibiótico sin la necesidad de medicación adicional y sin reaparición de la enfermedad en los tres meses posteriores.
Las variables secundarias de eficacia y seguridad fueron resolución de la diarrea, recurrencia a los tres meses, tiempo hasta la recurrencia, mortalidad relacionada o no con ICD, tolerancia y reacciones adversas como náuseas, vómitos, cefalea y/o dolor abdominal. La recurrencia de la ICD, fue definida como la reaparición de clínica de infección y presencia de toxina en heces durante los tres meses siguientes tras finalizar el tratamiento con fidaxomicina.
La ICD se definió mediante la presencia de diarrea (más de tres deposiciones no formadas durante al menos dos días consecutivos) asociada a la presencia de la toxina de la bacteria (A o B) en heces mediante técnica de enzimoinmunoanálisis (C. DiffQuikChek Complete®), que detecta simultáneamente el antígeno del glutamato deshidrogenasa (GDH) y las toxinas A y B. En caso de resultado positivo para GDH pero negativo para toxina, se realiza una técnica de PCR (Xpert® C. difficile) para confirmar la presencia o ausencia de la toxina en heces.
Se determinó el coeficiente de comorbilidad de Charlson (CCS) teniendo en cuenta las siguientes patologías: enfermedad cardiovascular, demencia, enfermedad pulmonar crónica, enfermedad del tejido conectivo, úlcera péptica, enfermedad hepática moderada/grave, diabetes mellitus (DM), SIDA, hemiplejía, enfermedad renal moderada-grave, tumor, leucemia o linfoma y metástasis. CCS ≥5 fue considerado como comorbilidad grave8. Se contabilizaron también los pacientes con enfermedad inflamatoria intestinal (enfermedad de Crohn o colitis ulcerosa).
La gravedad de la enfermedad se determinó de acuerdo a la guía de la SHEA-IDSA-2010 (Society for Healthcare Epidemiology of America e Infectious Diseases Society of America):
• Leve-moderada: presencia de diarrea sin síntomas sistémicos, leucocitosis o fallo renal significativo.
• Grave: existencia de al menos uno de los siguientes: fiebre (>38°C), leucocitosis ≥15.000 células/mm3 o fallo renal agudo (aumento de creatinina en sangre >50% sobre el nivel basal).
• Grave-complicada: enfermedad grave acompañada de condiciones amenazantes para la vida tales como admisión en Unidad de Cuidados Intensivos (UCI), shock séptico, íleo o aparición de megacolon. El shock séptico es un tipo de sepsis en la que los pacientes requieren de la administración de vasopresores para mantener una presión arterial media de 65 mm Hg o más y presentan cifras de lactato mayores de 2 mmol/l (>18 mg/dl) en ausencia de hipovolemia9.
El análisis estadístico se llevó a cabo utilizando el software estadístico SAS System® versión 9.4. Para describir las características de la cohorte, se determinaron frecuencias absolutas y relativas para las variables discretas, y para las variables continuas se calculó la media y desviación estándar o mediana y rangos intercuartílicos, cuando los datos no seguían una distribución normal. Para realizar el análisis univariante, las variables categóricas se compararon utilizando Chi cuadrado o el test de Fisher cuando correspondía.
Resultados
Del total de los pacientes, 54,1% eran mujeres y 70,3% mayores de 65 años. Todos los pacientes presentaron diagnóstico de ICD confirmado mediante la presencia de toxina en heces. Las variables demográficas y clínicas de los 37 pacientes analizados se muestran en la Tabla 1. El 89,2% de los pacientes presentaba algún tipo de comorbilidad, siendo las más frecuentes la enfermedad cardiovascular (56,8%), enfermedad renal crónica moderada-grave (32,4%) y DM (29,7%). La mediana del CCS fue de 6 (IQR 4,5-7,0). El 59,4% de los pacientes estaban inmunodeprimidos.
Únicamente dos pacientes no habían recibido tratamiento con IBP o antiH2 durante las cuatro semanas previas al episodio de ICD. El episodio fue leve en uno de estos pacientes y grave en el otro. Ninguno de los dos presentó recurrencias tras tratamiento con fidaxomicina.
En la Tabla 2 se representan las características relacionadas con el episodio de ICD actual y previos, y la gravedad del episodio actual del estudio. La mediana de duración de fidaxomicina fue de 9 días (IQR 9-10) a una dosis de 200 mg/12 h. Fidaxomicina se utilizó para tratar las recurrencias tras al menos un episodio previo tratado con vancomicina y/o metronidazol, excepto en dos pacientes (5,4%) en los que el antibiótico se empleó para tratar un primer episodio, tras aprobación por la Dirección Médica del hospital al tratarse de pacientes especialmente frágiles con una ICD grave-complicada. Ninguno de ellos presentó recurrencia posterior. En el 21,6% de los pacientes, fidaxomicina se utilizó para tratar una primera recurrencia, en el 54% una segunda, y en el 18,9% una tercera y consecutivas, presentando recurrencia posterior tras el tratamiento el 25%, 20% y 43% respectivamente. Nueve pacientes recibieron tratamiento concomitante con vancomicina y/o metronidazol.
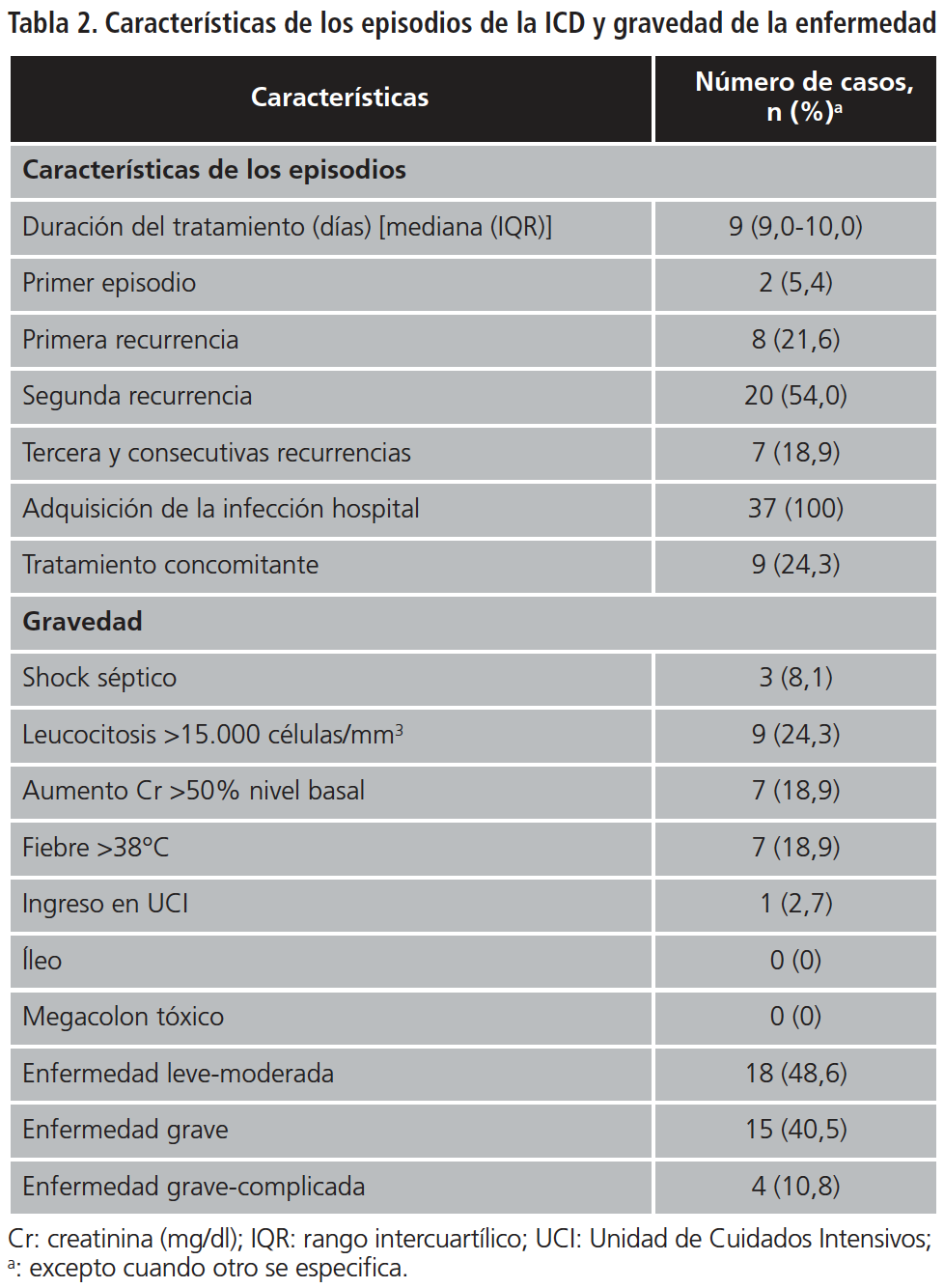
Todos los pacientes excepto uno habían recibido tratamiento antibiótico en los tres meses previos al diagnóstico.
En todos los pacientes la infección fue nosocomial.
Respecto a la gravedad de la enfermedad, 18 pacientes presentaron enfermedad leve-moderada, 15 grave y cuatro grave-complicada.
El 97,3% de los pacientes resolvió el episodio de diarrea durante el tratamiento con fidaxomicina, con una mediana de nueve días (IQR 5,5-18) hasta la resolución (Tabla 3). Únicamente un paciente no logró la curación inicial tras 12 días de tratamiento, por lo que posteriormente se le cambió el antibiótico a vancomicina.
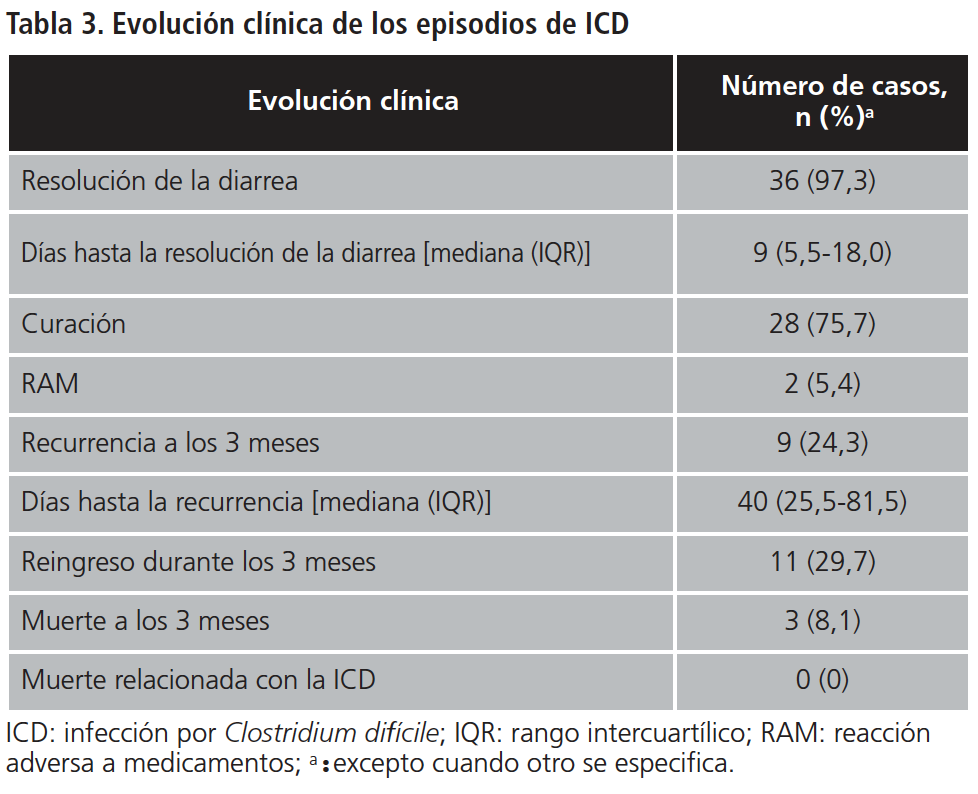
Veintiocho pacientes (75,7%) lograron la curación de la enfermedad. Los nueve restantes recurrieron durante los tres meses de finalizar el tratamiento, con una mediana de 40 días hasta la aparición de una nueva diarrea (IQR 25,5-81,5). De éstos, dos habían presentado únicamente un episodio previo y siete habían recurrido anteriormente una o dos veces.
Por otra parte, durante los tres meses posteriores a la finalización del tratamiento con fidaxomicina, 11 pacientes reingresaron en el hospital, cuatro de ellos a consecuencia de una recurrencia de ICD. Otros dos recurrieron durante la estancia hospitalaria, de los cuales uno falleció. Además hubo otras dos muertes de pacientes que no habían reingresado durante los tres meses. Ninguna de las muertes ocurridas en el estudio se puede asociar a la ICD.
El medicamento fue bien tolerado, únicamente dos pacientes de los 37 presentaron reacciones adversas leves (dolor abdominal leve).
En cuanto a los factores que pueden estar relacionados con un aumento del riesgo de recurrencia, en la Tabla 4 se muestran los resultados de curación frente a recurrencia de determinados subgrupos de población. Para el análisis estadístico, no se tuvieron en cuenta las variables de tratamiento antibiótico previo ni el uso de antiácidos, ya que la práctica totalidad de los pacientes habían sido tratados con estos medicamentos.
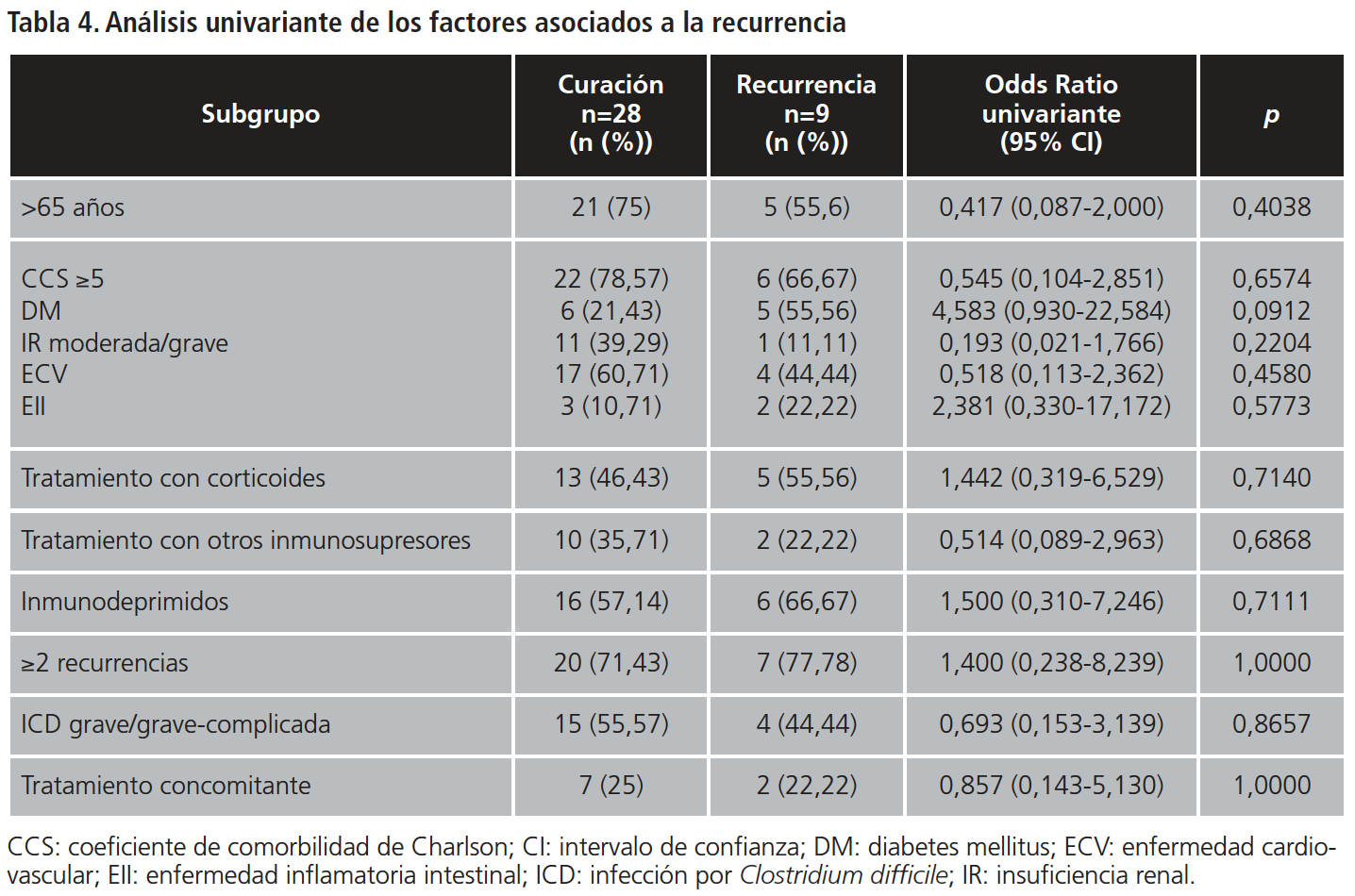
Al no ser los resultados obtenidos del análisis univariante estadísticamente significativos (p>0,05) no se realizó análisis multivariante de las variables.
Discusión
La eficacia de fidaxomicina en términos de resolución de la infección fue muy elevada (97,3%), en concordancia con la bibliografía disponible10-16,18.
La recurrencia obtenida en este estudio (24,3%) ha sido algo mayor que en los trabajos de Fehér et al.10, Spiceland et al.11, Pichenot et al.12 y Eiland et al.13, cuyos resultados fueron de 16,7%, 15%, 19% y 10,3% respectivamente. Este hecho puede ser debido en parte a que, en este trabajo, se ha considerado como recurrencia la reaparición de los síntomas de ICD en un periodo de estudio de 12 semanas tras finalizar el tratamiento con fidaxomicina, mientras que en algunos de estos estudios el periodo fue menor, de 4, 8 y 10 semanas10-12. Si se limitara el periodo de seguimiento a 8 semanas, el porcentaje de recurrencia descendería a 18,9%, similar a los estudios publicados. Sin embargo, en el estudio de Eiland et al.13, donde el tiempo considerado hasta la recurrencia es también de 12 semanas, la tasa de recurrencia es notablemente más baja (10,3%).
Comparando con los ensayos clínicos de fase III realizados14,15, éstos muestran un porcentaje de recurrencia en torno al 15%, inferior al del presente estudio. Esto puede deberse a que los pacientes incluidos en los ensayos clínicos, únicamente habían presentado uno o ningún episodio previo, mientras que en este estudio el 73% de los pacientes presentaron dos o más episodios previos. Como se ha mencionado previamente, las probabilidades de recurrir aumentan con el número de recurrencias previas, siendo considerablemente más bajo en personas que nunca han recaído. De hecho, en otro estudio donde se analiza el subgrupo de pacientes del ensayo clínico que habían presentado un episodio previo de ICD, la recurrencia fue mayor (19,7%)16. Por otro lado, el tiempo considerado hasta recurrencia fue menor en los ensayos clínicos (cuatro semanas).
De los 27 pacientes que en este estudio han presentado dos o más episodios previos, únicamente siete (26%), presentaron una nueva recurrencia tras tratamiento con fidaxomicina. Este porcentaje no se considera muy elevado ya que en este tipo de población, de acuerdo con la bibliografía, la probabilidad de recurrencia es de 35-50%5; aunque cabe destacar que el 77,8% de los pacientes que recurrieron habían presentado dos o más episodios previos. Por el contrario, los pacientes que no habían presentado episodios previos de ICD no recurrieron tras el tratamiento con el antibiótico.
Según la CADTH-2011 (Vancomycin or metronidazole for treatment of Clostridium difficile infection: Clinical and economicanalyses) y Kelly17, algunos de los factores de riesgo que se asocian de forma independiente a un aumento del riesgo de recurrencia son: edad superior a 65 años, enfermedad subyacente grave, empleo de antiácidos o inmunosupresión. En el presente estudio, el 70,3% eran mayores de 65 años, la mayoría de los pacientes analizados se encontraban en tratamiento con antiácidos (94,6%) y/o presentaban alguna comorbilidad grave: de los 9 pacientes que recurrieron, 6 presentaron un CCS ≥5, 5 tenían DM, 6 eran pacientes inmunodeprimidos, y 7 presentaron ≥2 episodios previos.
Por otra parte, una de las limitaciones del estudio, debido en gran parte a las condiciones de la financiación, es el tamaño muestral. En el periodo de estudio evaluado, 37 pacientes cumplieron los criterios de inclusión, lo que puede ser una muestra insuficiente para detectar diferencias significativas entre las variables. En la revisión de la bibliografía publicada, en aquellos estudios donde sí encuentran asociación entre ciertas variables como el número de episodios previos de ICD12, cardiopatía, fallo renal agudo, grado de comorbilidad y la aparición de recurrencia, la muestra era superior a 70 pacientes10,11. Por otro lado, en el estudio de Pichenot et al.12, no se encuentran diferencias estadísticamente significativas entre los grupos de población de edad de más de 65 años y gravedad de la ICD. El estudio de Vargo et al.18, con un tamaño de muestra similar al presente estudio (44 pacientes) y un 13,6% de recurrencia, no obtiene diferencias significativas entre los subgrupos de pacientes que recurrieron. En otros estudios como el de Eiland et al.13, únicamente realizan un estudio descriptivo sin llevar a cabo un análisis univariante entre subgrupos.
En cuanto a la tolerancia y seguridad, fidaxomicina ha mostrado tener muy pocas reacciones adversas siendo estas leves, al igual que en los estudios y los ensayos clínicos previamente citados mostrando ser un medicamento seguro y bien tolerado en nuestra población.
Conclusiones
En el presente estudio, el tratamiento con fidaxomicina ha mostrado ser eficaz ya que casi la totalidad de los pacientes resolvieron el episodio de diarrea, más de tres cuartos lograron la curación y menos del 25% presentaron una ICD posterior en una muestra en la que la mayoría de los pacientes tenía un elevado riesgo de recurrencia. Más de la mitad de los pacientes que recurrieron habían presentado previamente dos o más episodios, tal y como era de esperar ya que el riesgo de recurrencia aumenta con el número de episodios previos. Las reacciones adversas, que únicamente padecieron dos pacientes, fueron leves, pudiéndose afirmar que se trata además de un medicamento seguro y bien tolerado.
Dado que fidaxomicina no es en la actualidad un antibiótico de primera elección, su casuística de utilización continúa siendo reducida, siendo necesarios estudios multicéntricos de mayor tamaño muestral para la obtención de resultados más concluyentes.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Bibliografía
1. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Centro de Información online de Medicamentos. Madrid: AEMPS; sin fecha [citado 7 de enero de 2018]. Información del medicamento. Dificlir 200 mg, fidaxomicina. Disponible en: https://www.aemps.gob.es/cima/publico/home.html.
2. European Medicines Agency (EMEA). Committee for Medicinal Products for Human Use. London: EMEA; 22 sep 2011 [citado 7 de enero de 2018]. Assessment report. Dificlir 200 mg. Fidaxomicin. Disponible en: http://www.ema.europa.eu/.
3. Freeman J, Bauer MP, Baines SD, Corver J, Fawley WN, Goorhuis, B, et al. The changing epidemiology of Clostridium difficile infections. Clin Microbiol Rev. 2010;23(3):529-49.
4. Cohen SH, Gerding DN, Johnson S, Kelly CP, Loo VG, McDonald LC, et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the Society for Healthcare Epidemiology of America (SHEA) and the Infectious Diseases Society of America (IDSA). Infect Control Hosp Epidemiol. 2010;31(5):431-55.
5. Debast SB, Bauer MP, Kuijper EJ. European Society of Clinical Microbiology and Infectious Diseases: update of the treatment guidance document for Clostridium difficile infection. Clin Microbiol Infect. 2014;20(s2):1-26.
6. Rodríguez-Pardo D, Mirelis B, Navarro F. Infecciones producidas por Clostridium difficile. Enferm Infecc Microbiol Clin. 2013;31(4):254-63.
7. McDonald LC, Gerding DN, Johnson S, Bakken JS, Carroll KC, Coffin SE, et al. Clinical Practice Guidelines for Clostridium difficile Infection in Adults and Children: 2017 Update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis. 2018;66(7):e1-e48.
8. Huang YQ, Gou R., Diao YS, YinQH, Fan WX, Liang YP, et al. Charlson comorbidity index helps predict the risk of mortality for patients with type 2 diabetic nephropathy. J Zhejiang Univ Sci B. 2014;15(1):58-66.
9. Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8): 801-81
10. Fehér C, Rubio EM, Amador PM, García-Campero ADI, Salavert M, Merino E, et al. The efficacy of fidaxomicin in the treatment of Clostridium difficile infection in a real-world clinical setting: a Spanish multi-centre retrospective cohort. Eur J Clin Microbiol Infect Dis. 2017;36(2):295-303.
11. Spiceland CM, Khanna S, Pardi DS. Outcomes with fidaxomicin therapy in Clostridium difficile infection. J Clin Gastroenterol. 2016;52(2):151-4.
12. Pichenot M, Héquette-Ruz R, Le Guern R, Grandbastien B, Charlet C, Wallet F, et al. Fidaxomicin for treatment of Clostridium difficile infection in clinical practice: a prospective cohort study in a French University Hospital. Infection. 2017;45(4):425-31.
13. Eiland III, EH Sawyer AJ, Massie NL. Fidaxomicin use and clinical outcomes for clostridium difficile-associated diarrhea. Infect Dis Clin Pract (Baltim Md). 2015;23(1):32-5.
14. Cornely OA, Crook DW, Esposito R, Poirier A, Somero MS, Weiss K, et al. Fidaxomicin versus vancomycin for infection with Clostridium difficile in Europe, Canada, and the USA: a double-blind, non-inferiority, randomised controlled trial. Lancet Infect Dis. 2012;12(4):281-9.
15. Louie TJ, Miller MA, Mullane KM, Weiss K, Lentnek A, Golan Y, et al.Fidaxomicin versus vancomycin for Clostridium difficile infection. N Engl J Med. 2011;364(5):422-31.
16. Cornely OA, Miller MA, Louie TJ, Crook DW, Gorbach SL. Treatment of first recurrence of Clostridium difficile infection: fidaxomicin versus vancomycin. Clin Infect Dis. 2012;55(suppl_2):S154-S161.
17. Kelly CP. Can we identify patients at high risk of recurrent Clostridium difficile infection? Clin Microbiol Infect. 2012;18(s6):21-7.
18. Vargo CA, Bauer KA, Mangino JE, Johnston JE, Goff DA. An Antimicrobial Stewardship Program’s Real World Experience with Fidaxomicin for Treatment of Clostridium difficile Infection: A Case Series. Pharmacotherapy. 2014;34(9),901-9.
____
