Muñoz Cid CL1, Claramunt García R2, Sánchez Ruiz A3, Marín Pozo JF3
1 Hospital La Serranía de Ronda. Ronda. Málaga (España)
2 Hospital Virgen de Altagracia. Manzanares. Ciudad Real (España)
3 Hospital Universitario de Jaén. Jaén (España)
Fecha de recepción: 01/09/2022 – Fecha de aceptación: 27/09/2022
Correspondencia: Carmen Lucía Muñoz Cid – Fernán Gómez, 36 – 14540 La Rambla. Córdoba (España)
cluc.munoz.sspa@juntadeandalucia.es
____
RESUMEN
Objetivos: Analizar la influencia del ratio neutrofilos/linfocitos (NLR) y la derivada del NLR (dNLR) en la efectividad de la inmunoterapia antiPD-L1 en pacientes con cáncer de pulmón no microcítico (CPNM) que hayan recibido al menos una línea previa de tratamiento en la práctica habitual.
Métodos: Estudio observacional retrospectivo en pacientes con CPNM tratados en 2º línea o posteriores con inmunoterapia anti PD-1 y anti PDL-1 desde septiembre de 2016 hasta enero de 2020 en un hospital de tercer nivel. Las variables interesadas se recogieron en una base de datos Excel. Las variables de efectividad fueron supervivencia libre de progresión (SLP) y supervivencia global (SG) en función de NLR y dNLR.
Resultados: Se incluyeron 79 pacientes. Se apreció que los pacientes con CPNM y una dNLR basal <3 tuvieron mayor supervivencia libre de progresión y mayor supervivencia global, por tanto, presentan mejor pronóstico que los que tienen una dNLR ≥3. También se observó que los pacientes con un NLR <5 presentaban mayor supervivencia libre de progresión y mayor supervivencia global con respecto a los pacientes con un NLR ≥5, aunque estos datos no fueron estadísticamente significativos.
Conclusiones: El valor dNLR tiene un valor pronóstico en nuestra población, no así el NLR, para supervivencia global en pacientes de CPNM tratados con antiPDL-1 tras una terapia previa.
Palabras clave: Pulmón, cáncer, pronóstico, inmunoterapia, supervivencia.
Prognostic value of the neutrophil/lymphocyte ratio in the effectiveness of anti-PDL1 immunotherapy in non-small cytic lung cáncer
SUMMARY
Objectives: To analyse the influence of the Neutrophil/Lymphocyte Ratio (NLR) and that derived from the NLR (dNLR) on the effectiveness of antiPD-L1 immunotherapy in patients with non-small cell lung cancer (NSCLC) who have received at least one previous line of treatment in routine practice.
Methods: Retrospective observational study in patients with NSCLC treated in 2nd line or later with anti-PD-1 and anti-PDL-1 immunotherapy from September 2016 to January 2020 in a tertiary care hospital. The interested variables were collected in an Excel database. The effectiveness variables were progression-free survival (PFS) and overall survival (OS) based on NLR and dNLR.
Results: 79 patients were included. It was observed that patients with NSCLC and a baseline dNLR <3 had higher progression-free survival and overall survival, therefore, they have a better prognosis than those with a dNLR ≥3. It was also observed that patients with an NLR <5 had higher progression-free survival and overall survival compared to patients with an NLR ≥5, although these data were not statistically significant.
Conclusions: The dNLR value has a prognostic value in our population, but not the NLR, for overall survival in NSCLC patients treated with anti-PDL-1 after previous therapy.
Key words: Lung, cancer, prognosis, immunotherapy, survival.
____
INTRODUCCIÓN
El cáncer de pulmón es la principal causa de mortalidad por cáncer a nivel mundial. En España se estima que en 2022 se diagnosticarán 30.948 nuevos casos de cáncer de pulmón siendo el tercer cáncer más frecuente, por detrás de próstata y colorrectal. Este tipo de cáncer, a pesar de ser un tumor muy frecuente, se estima una prevalencia a los 5 años de 5,9%, una prevalencia muy baja debido a su alta mortalidad1.
El cáncer de pulmón no microcítico (CPNM) es el tipo de cáncer de pulmón más frecuente (85%). Este, a su vez, tiene diferentes subtipos histológicos: adenocarcinoma (37-47%), carcinoma de células escamosas (25-32%) y carcinoma de células grandes (10-18%)2. El 57% de los pacientes se diagnostican cuando la enfermedad está avanzada o metastásica, reduciéndose las opciones de tratamiento curativo3.
Debido al gran desarrollo y conocimiento de la biología molecular de estos tumores, se han obtenido nuevas armas terapéuticas contra el CPNM. Entre estas nuevas terapias se encuentra la inmunoterapia, que ha revolucionado las estrategias terapéuticas para abordar este tipo de tumor. Entre la inmunoterapia que se está utilizando en el CPNM están atezolizumab, nivolumab y pembrolizumab4.
La inmunoterapia tiene como diana terapéutica puntos de control del sistema inmune para modular la proliferación de la célula. En concreto, atezolizumab es un anticuerpo monoclonal humanizado tipo IgG1 que se une al ligando PD-L1 bloqueando doblemente los receptores PD1 y B7.15. Nivolumab y pembrolizumab son anticuerpos monoclonales humanizados tipo IgG4 dirigidos frente al receptor de muerte programada 1 (PD-1), bloqueando su interacción con sus ligandos (PD-L1 y PD-L2)6,7.
Todos los pacientes no se benefician de la inmunoterapia, por lo que sería de suma importancia poder identificar qué pacientes tienen más probabilidades de responder a la misma. Esto se podría conseguir si se dispone de biomarcadores predictivos capaces de identificar a estos pacientes con resultados satisfactorios8.
La inflamación sistémica se ha visto que tiene una implicación importante en la tumorigénesis y en la progresión del cáncer sólido. La proporción de neutrófilos a linfocitos (NLR, sus siglas en inglés, neutrophil-to-lymphocyte ratio) es un marcador de inflamación sistémica y ha sido estudiado para diferentes tumores sólidos, incluido el CPNM. Cuando este marcador está elevado en el momento del diagnóstico de la enfermedad, se asocia a una peor supervivencia global (SG) y supervivencia libre de progresión (SLP)9-11.
Otro marcador de la inflamación es la derivada de la proporción de neutrófilos a linfocitos (dNLR, sus siglas en inglés) también utilizado como marcador predictivo de la inmunoterapia en tumores sólidos como el CPNM12.
En la mayoría de los estudios comentados, el valor del corte para NLR es 5 y para dNLR es de 3, pero en ninguno de estos artículos se mencionan la fuente de los valores de corte.
El objetivo de este estudio es analizar la influencia NLR y dNLR en la efectividad de la inmunoterapia antiPD-L1 en pacientes con CPNM que hayan recibido al menos un tratamiento de quimioterapia previo en la práctica habitual.
MÉTODOS
Estudio observacional retrospectivo que incluyó a todos los pacientes con CPNM tratados en 2ª línea o posteriores con inmunoterapia anti PD-1 y anti PDL-1 desde septiembre de 2016 hasta enero de 2020 en un hospital de tercer nivel (una población de 600.000 habitantes).
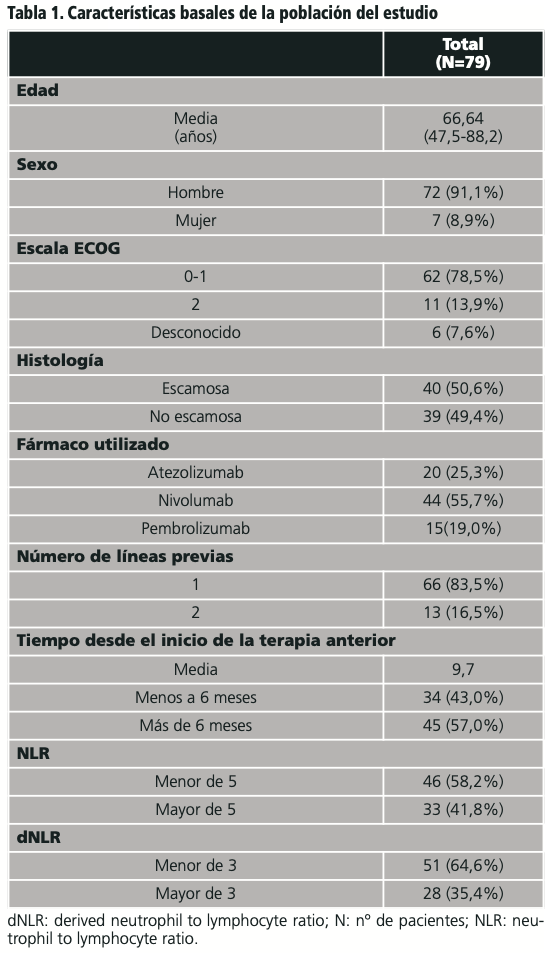
Las variables descriptivas de la población fueron: edad, sexo, fecha de diagnóstico, fecha de progresión, tiempo transcurrido entre el inicio de la terapia previa con platino y la terapia con antiPDL-1 (TiTPt), duración del tratamiento antiPD-L1 (DT), estado basal del paciente según la escala Eastern Cooperative Oncology Group (ECOG), histología del tumor, nº de terapias previas, recuento absoluto de leucocitos (RAB), recuento absoluto de neutrófilos (RAN) y recuento absoluto de linfocitos (RAL).
Las variables del estudio fueron supervivencia global (SG), definida como el tiempo desde el inicio de la terapia con antiPDL-1 y la muerte del paciente y supervivencia libre de progresión (SLP), definida como el tiempo transcurrido entre el inicio de la terapia con antiPDL-1 hasta la progresión de la enfermedad o muerte del paciente. Las variables principales fueron SLP y SG en función de NLR y dNLR. También se calculó la SLP y SG de cada medicamento. Además, se hizo un análisis de los siguientes subgrupos: histología, calidad de vida y tiempo hasta progresión.
El valor de NLR y dNLR se calculó según la siguiente expresión:
– NLR: RAN/RAL, usando como valor de corte NLR=5.
– dNLR: RAN/(RAB-RAL), usando como valor de corte dNLR=3.
Los datos de los pacientes se obtuvieron a través de la historia clínica, historia farmacológica y el programa informático farmacia oncológica. Todos estos datos de los pacientes se introdujeron en una base de datos de Microsoft® Access® de elaboración propia.
El análisis estadístico se realizó con el programa G-Stat2.0; Dep.Biometría GSK. Madrid®. El análisis de supervivencia se elaboró mediante la construcción de curvas de Kaplan-Meier. Para el cálculo del hazard ratio (HR) se utilizó la regresión de Cox. El análisis de subgrupos también se realizó mediante la regresión de Cox.
La pauta de tratamiento que recibieron los pacientes del grupo de atezolizumab fue de 1.200 mg cada 21 días por perfusión intravenosa. La pauta recibida de nivolumab fue de 3mg/kg cada 14 días por perfusión intravenosa y la de pembrolizumab fue de 2 mg/kg cada 21 días por perfusión intravenosa.
RESULTADOS
Pacientes
Con un total de 79 pacientes diagnosticados de CPNM que habían progresado a un tratamiento previo, la media de edad fue de 66 años. Las características basales de los tres grupos de tratamiento se pueden observar en la tabla 1.
Efectividad
El tiempo de seguimiento de este estudio ha sido de 40 meses. Los resultados de efectividad en función del fármaco administrado mostraron una mediana de SLP en pacientes que recibieron nivolumab de 2,9 meses [IC95%: 2,1;3,7], 5,83 meses [IC95%: 0,4;11,2] con atezolizumab y 9,2 meses [IC95%: 0,4;18,0] con pembrolizumab. La mediana de SG en los pacientes tratados con nivolumab fue 4,2 meses [IC95%: 2,5;5,9], 15,7 meses [IC95%: 0,0;33,2] para atezolizumab, y 13,9 meses [IC95%: 4,5;23,3] con pembrolizumab.
La mediana de SLP en pacientes con dNLR <3 fue de 5,36 meses [IC95%: 3,9; 6,7] y en pacientes con un dNLR ≥3 fue de 3,13 meses [IC95%: 1,7; 4,5], con una HR: 0,38 [IC95%: 0,7;2,2], p=0,388. La mediana de SG, en los pacientes con dNLR <3 fue 13,9 meses [IC95%: 5,4; 22,4] y en los pacientes con un dNLR ≥3, 3,6 meses [IC95%: 2,4;4,7] con una HR: 1,81 [IC95%: 1,1;3,2; p=0,04] siendo estos resultados estadísticamente significativos. En SLP, para los pacientes que presentaban un NLR <5, se obtuvo una mediana de 5,36 meses [IC95%: 3,9; 6,8] y, para los pacientes con NLR ≥5, una mediana de 3,13 meses [IC95%: 2,1; 4,1], con una HR: 1,44 [IC95%: 0,84;2,5], p=0,176. Para SG, los pacientes con NLR <5 fue una mediana de 9,10 meses [IC95%: 1,8; 16,4] y en los pacientes con NLR ≥5 se alcanzó una mediana de 4,26 meses [IC95%: 2,8; 5,7], con una HR:1,41 (IC95%: 0,80; 2,51), p=0,231.
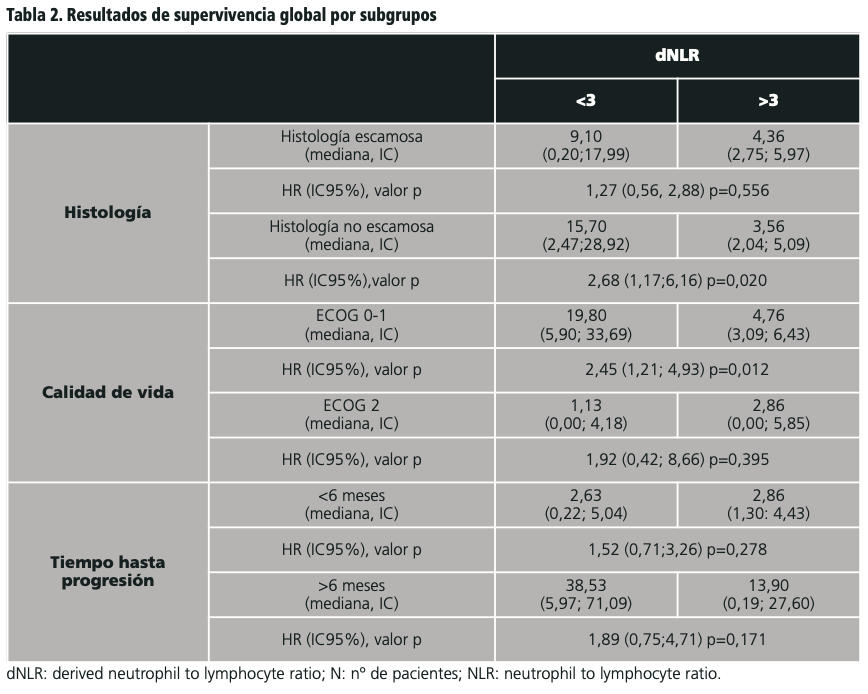
Los resultados de SG en función de dNLR para los subgrupos analizados se muestran en la tabla 2.
DISCUSIÓN
En nuestro estudio se aprecia que los pacientes con CPNM y una dNLR basal <3 tienen mayor supervivencia libre de progresión y mayor supervivencia global, por tanto, presentan mejor pronóstico que los que tienen una dNLR ≥3. También se observó que los pacientes con un NLR <5 presentaban mayor supervivencia libre de progresión y mayor supervivencia global con respecto a los pacientes con NLR ≥5, aunque estos datos no fueron estadísticamente significativos.
En el análisis por subgrupos se apreció que los pacientes con histología no escamosa o con una buena calidad de vida (ECOG 0-1) y con una dNLR <3 se beneficiaban más de la inmunoterapia antiPD-L1 (atezolizumab, nivolumab o pembrolizumab) que los pacientes de estos subgrupos con una dNLR ≥3.
Nuestros resultados son coincidentes con los obtenidos en la búsqueda bibliográfica realizada en varias bases de datos. Entre estos estudios había dos metaanálisis, uno de Jin et al.11 que incluía 23 estudios con 2.063 pacientes con cáncer de pulmón que recibían en cuyos resultados se vio que un NLR elevado se asociaba a una SG y SLP deficiente. En el otro metaanálisis de Zhang et al.13 incluían a 21 estudios con 1.845 pacientes tratados con nivolumab, pembrolizumab y atezolizumab asoció niveles altos del NLR con una SG y SLP deficientes.
En un estudio con 52 pacientes con CPNM tratados con nivolumab se observó que niveles altos de NLR se correspondían con SG y SLP más cortas, es decir presentaban peor pronóstico14.
Hay otro estudio en pacientes con CPNM tratados en primera línea con pembrolizumab15 sugiere que aquellos pacientes con un NLR <5 junto con una expresión PD-L1 o lactacto deshidrogenada (LDH) altas son una buena herramienta pronostica para predecir los pacientes que se podrían beneficiar de pembrolizumab en primera línea.
Un estudio de Mezquita et al.16 concluye que un dNLR basal >3 y LDH por encima de su límite normal superior predice un beneficio deficiente en SG y SLP de la inmunoterapia antiPD-L1 en pacientes con CPNM avanzado.
En el estudio Katayama et al.17 se estudia la importancia de los índices inflamatorios basales en pacientes con CPNM tratados con atezolizumab en segunda línea. Este estudio mostró que niveles altos de NLR basales podrían ser factores pronósticos negativos.
También estudian otros biomarcadores relacionados con la inflamación como son la proporción de linfocitos a monocitos (siglas en inglés, LMR), proporción de plaquetas a linfocitos (PLR) e índice de inflamación del cáncer de pulmón avanzado (ALI)18.
También nuestros resultados coinciden con los del estudio Capone et al.19 en que un NLR o dNLR bajo se asocia a mejor supervivencia, siendo estos unos buenos biomarcadores pronósticos, aunque este estudio se haya hecho en pacientes con melanoma tratados con nivolumab.
No hemos encontrado en la bibliografía estudios que hayan realizado análisis de subgrupos, no pudiendo comparar nuestros resultados.
Tenemos en cuenta que en nuestro estudio tiene varias limitaciones, como que los grupos de pacientes no son uniformes, debido a que la población que recibe nivolumab es casi el 50% de la población y un bajo porcentaje de ellos, era mujeres. En nuestro estudio no se registraron los datos de expresión de PD-L1, pues no siempre estaban disponibles en la práctica clínica habitual del centro para la 2ª línea de tratamiento de todos los pacientes. Sería necesario diseñar estudios de vida real con mayor número de pacientes y/o prospectivos que confirmaran estos resultados.
CONCLUSIONES
El valor dNLR tiene un valor pronóstico en nuestra población, no así el NLR, para supervivencia global en pacientes de CPNM tratados con antiPDL-1 tras terapia con esquemas de platino. Estos resultados son coincidentes con los reflejados por otros autores.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. LAS CIFRAS DEL CANCER EN ESPANA 2022. Sociedad Española de Oncología Médica [Internet]. [citado 4 de abril de 2022]. Disponible en: https://seom.org/images/LAS_CIFRAS_DEL_CANCER_EN_ESPANA_2022.pdf.
2. Non-Small Cell Lung Cancer: Epidemiology, Screening, Diagnosis, and Treatment – ClinicalKey [Internet]. [citado 4 de abril de 2022]. Disponible en: https://www-clinicalkey-es.bvsspa.idm.oclc.org/#!/content/playContent/1-s2.0-S0025619619300709?returnurl=https:%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS0025619619300709%3Fshowall%3Dtrue&referrer=https:%2F%2Fpubmed.ncbi.nlm.nih.gov%2F.
3. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians [Internet]. 2020 [citado 4 de abril de 2022];70(1):7-30. Disponible en: https://onlinelibrary.wiley.com/doi/abs/10.3322/caac.21590.
4. Metastatic Non-Small-Cell Lung Cancer. European Society for Medical Oncology. 2020;71.
5. Ficha técnica de Tecentriq. Agencia Española del Medicamento y Productos Sanitarios. [Internet]. [citado 4 de abril de 2022]. Disponible en: https:// cima.aemps.es/cima/pdfs/ft/1171220001/FT_1171220001.pdf.
6. Ficha técnica de Opdivo. Agencia Española del Medicamento y Productos Sanitarios. [Internet]. [citado 4 de abril de 2022]. Disponible en: https:// cima.aemps.es/cima/pdfs/ft/1151014001/FT_1151014001.pdf.
7. Ficha técnica de Keytruda. Agencia Española del Medicamento y Productos Sanitarios. [Internet]. [citado 4 de abril de 2022]. Disponible en: https:// cima.aemps.es/cima/pdfs/ft/1151024002/FT_1151024002.pdf.
8. Ferrucci PF, Ascierto PA, Pigozzo J, Del Vecchio M, Maio M, Antonini Cappellini GC, et al. Baseline neutrophils and derived neutrophil-to-lymphocyte ratio: prognostic relevance in metastatic melanoma patients receiving ipilimumab. Ann Oncol. abril de 2016;27(4):732-8.
9. Zucker A, Winter A, Lumley D, Karwowski P, Jung MK, Kao J. Prognostic role of baseline neutrophil-to-lymphocyte ratio in metastatic solid tumors. Molecular and Clinical Oncology [Internet]. 1 de octubre de 2020 [citado 15 de febrero de 2021];13(4):1-1. Disponible en: http://www.spandidos-publications.com/ 10.3892/mco.2020.2095/abstract.
10. Diakos CI, Charles KA, McMillan DC, Clarke SJ. Cancer-related inflammation and treatment effectiveness. Lancet Oncol. octubre de 2014;15(11):e493-503.
11. Jin J, Yang L, Liu D, Li W. Association of the neutrophil to lymphocyte ratio and clinical outcomes in patients with lung cancer receiving immunotherapy: a meta-analysis. BMJ Open [Internet]. junio de 2020 [citado 15 de febrero de 2021];10(6):e035031. Disponible en: https://bmjopen.bmj.com/lookup/doi/ 10.1136/bmjopen-2019-035031.
12. Yang T, Hao L, Yang X, Luo C, Wang G, Cai CL, et al. Prognostic value of derived neutrophil-to-lymphocyte ratio (dNLR) in patients with non-small cell lung cancer receiving immune checkpoint inhibitors: a meta-analysis. BMJ Open [Internet]. 1 de septiembre de 2021 [citado 6 de abril de 2022];11(9):e049123. Disponible en: https://bmjopen.bmj.com/content/11/9/e049123.
13. Zhang N, Jiang J, Tang S, Sun G. Predictive value of neutrophil-lymphocyte ratio and platelet-lymphocyte ratio in non-small cell lung cancer patients treated with immune checkpoint inhibitors: A meta-analysis. International Immunopharmacology [Internet]. 1 de agosto de 2020 [citado 6 de mayo de 2021]; 85:106677. Disponible en: https://www.sciencedirect.com/science/article/pii/ S1567576920311401.
14. Diem S, Schmid S, Krapf M, Flatz L, Born D, Jochum W, et al. Neutrophil-to-Lymphocyte ratio (NLR) and Platelet-to-Lymphocyte ratio (PLR) as prognostic markers in patients with non-small cell lung cancer (NSCLC) treated with nivolumab. Lung Cancer [Internet]. 1 de septiembre de 2017 [citado 4 de agosto de 2021];111:176-81. Disponible en: https://www.lungcancerjournal.info/article/S0169-5002(17)30403-8/abstract.
15. Banna GL, Signorelli D, Metro G, Galetta D, De Toma A, Cantale O, et al. Neutrophil-to-lymphocyte ratio in combination with PD-L1 or lactate dehydrogenase as biomarkers for high PD-L1 non-small cell lung cancer treated with first-line pembrolizumab. Transl Lung Cancer Res [Internet]. agosto de 2020 [citado 5 de noviembre de 2021];9(4):1533-42. Disponible en: https://www. ncbi.nlm.nih.gov/pmc/articles/PMC7481583/.
16. Mezquita L, Auclin E, Ferrara R, Audigier-Valette C, Tessonnier L, Charrier M, et al. Baseline-derived neutrophil-to-lymphocyte ratio (dNLR) and lactate dehydrogenase (LDH) to predict the benefit of immune checkpoint inhibitors (ICI) in advanced non-small cell lung cancer (NSCLC) patients. JCO [Internet]. 20 de mayo de 2017 [citado 7 de noviembre de 2021];35(15_suppl):9089-9089. Disponible en: https://ascopubs.org/doi/abs/10.1200/JCO.2017.35.15_ suppl.9089.
17. Katayama Y, Yamada T, Chihara Y, Tanaka S, Tanimura K, Okura N, et al. Significance of inflammatory indexes in atezolizumab monotherapy outcomes in previously treated non-small-cell lung cancer patients. Sci Rep [Internet]. 15 de octubre de 2020 [citado 7 de noviembre de 2021];10(1):17495. Disponible en: https://www.nature.com/articles/s41598-020-74573-0.
18. Mandaliya H, Jones M, Oldmeadow C, Nordman IIC. Prognostic biomarkers in stage IV non-small cell lung cancer (NSCLC): neutrophil to lymphocyte ratio (NLR), lymphocyte to monocyte ratio (LMR), platelet to lymphocyte ratio (PLR) and advanced lung cancer inflammation index (ALI). Translational Lung Cancer Research [Internet]. diciembre de 2019 [citado 4 de agosto de 2021];8(6). Disponible en: https://tlcr.amegroups.com/article/view/34596.
19. Capone M, Giannarelli D, Mallardo D, Madonna G, Festino L, Grimaldi AM, et al. Baseline neutrophil-to-lymphocyte ratio (NLR) and derived NLR could predict overall survival in patients with advanced melanoma treated with nivolumab. J Immunother Cancer [Internet]. 1 de diciembre de 2018 [citado 15 de febrero de 2021];6(1):74. Disponible en: https://jitc.bmj.com/content/6/1/74.
____